电针曲池、足三里穴对缺血再灌注损伤大鼠线粒体Caspase-3途径诱导细胞凋亡的影响
2015-12-21上官豪柳维林陈文列郑薏王鲜林云娇王露露陈立典陶静
上官豪,柳维林,陈文列,郑薏,王鲜,林云娇,王露露,陈立典,陶静
电针曲池、足三里穴对缺血再灌注损伤大鼠线粒体Caspase-3途径诱导细胞凋亡的影响
上官豪1,柳维林1,陈文列2,郑薏1,王鲜1,林云娇1,王露露1,陈立典1,陶静1
目的 观察电针曲池、足三里穴对脑缺血再灌注损伤大鼠缺血周围区皮质神经细胞超微结构和caspase-3、Bcl-2、Bax蛋白表达的影响。方法 36只雄性Sprague-Daw ley大鼠随机分为假手术组、模型组及电针组,每组12只。采用Longa线栓法制作左侧大脑中动脉缺血再灌注损伤模型。电针偏瘫侧曲池、足三里穴30m in。治疗前后分别进行神经行为学评分,采用透射电镜观察神经细胞超微结构,Western blotting法检测caspase-3、Bcl-2及Bax的表达。结果 电针治疗后,电针组大鼠神经行为学评分较模型组降低(P<0.05);电镜下电针组较模型组核染色质均匀,线粒体数量增加;电针组Bcl-2蛋白表达水平明显高于模型组(P<0.01),caspase-3、Bax蛋白表达低于模型组(P<0.05)。结论 电针曲池、足三里穴可通过线粒体-caspase-3途径抑制缺血周围区皮质神经细胞凋亡。
脑缺血再灌注;电针;线粒体;caspase-3;凋亡;大鼠
[本文著录格式] 上官豪,柳维林,陈文列,等.电针曲池、足三里穴对缺血再灌注损伤大鼠线粒体Caspase-3途径诱导细胞凋亡的影响[J].中国康复理论与实践,2015,21(8):900-904.
CITED AS:Shangguan H,Liu WL,Chen WL,et al.Effects of electroacupuncture at Quchi(LI11)and Zusanli(ST36)on neuronalapoptosis induced bym itochondria-caspase-3 pathway in ratswith cerebral ischem ia-reperfusion injury[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(8):900-904.
缺血性脑卒中是临床的常见病、多发病,具有高死亡率、高致残率、高复发率等特点[1]。缺血性脑卒中涉及复杂的病理生理变化,呈现一个时间、空间改变的动态过程,与细胞凋亡关系密切。目前研究已经表明,细胞凋亡与线粒体功能密切相关,而线粒体是细胞凋亡调控中心。线粒体膜电位消失,通透性改变,释放细胞色素C(cytochrome C,CytC),激活caspase-9/caspase-3等分子诱导细胞凋亡[2]。Bcl-2蛋白家族中,抗凋亡蛋白Bcl-2阻碍CytC的释放,抑制凋亡;而另一部分如Bax等促进凋亡。Bcl-2与Bax相互作用共同参与程序性细胞凋亡过程[3-4]。Bcl-2家族基因与Caspase家族共同参与了细胞凋亡中由线粒体介导的内源性途径。抗凋亡Bcl-2家族成员下调或促凋亡成员在线粒体膜上过度表达和移位,导致线粒体通透性增加,激活caspase家族,导致细胞凋亡[5]。caspase-3是多种凋亡途径最主要的下游效应因子之一,是细胞凋亡的关键酶。在脑缺血后程序性细胞死亡过程中,激活的caspase-3通过对DNA修复蛋白、细胞骨架蛋白及其他caspase相关底物蛋白产生裂解的作用,直接参与细胞凋亡的发生,导致脑缺血再灌注损伤。进一步研究发现,在缺血性神经损伤过程中,抑制caspase-3活性可产生明显的神经保护作用[6]。我们前期研究发现电针曲池和足三里3 d能激活PI3k/Akt信号通路,抑制细胞凋亡来发挥对脑缺血再灌注损伤的神经保护功能[7]。本研究拟进一步观察电针曲池、足三里穴是否通过线粒体-caspase-3途径治疗脑缺血再灌注损伤,发挥神经保护作用。
1 材料与方法
1.1 实验动物及分组
雄性Sprague-Daw ley大鼠36只,体质量200~250 g,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪2012-0002)。动物饲养于SPF级动物实验室,模拟标准日夜系统,予以自由饮食及饮水。
将大鼠进行编号,采用随机数字表法将其分为假手术组、模型组及电针组,每组12只。模型组与电针组采用Longa[8]法制备左侧大脑中动脉梗死(m iddle cerebralanery occlusion,MCAO)模型,2 h后进行神经行为学评分[8]。
1.2 主要试剂
Bcl-2、Bax、caspase-3、β-actin一抗及辣根过氧化物酶二抗(Cell Signaling,Beverly,MA,USA)、10%水合氯醛、3%戊二醛-1.5%多聚甲醛、1%锇酸-1.5%亚铁氰化钾。
1.3 制备左侧MCAO模型
术前大鼠禁食,大鼠经10%水合氯醛3m l/kg腹腔注射麻醉,仰卧固定大鼠,颈部皮肤消毒备皮后,沿前正中线切开颈部皮肤,充分暴露左侧颈总动脉、颈内动脉、颈外动脉,用结扎线依次结扎颈总动脉近心端、颈外动脉远心端,用显微血管夹夹闭颈内动脉,在距颈总动脉分叉处约1.0 cm处用显微剪刀剪一切口,将直径为0.2mm的鱼线从切口处缓慢进入颈内动脉,松开血管夹,当鱼线头端到达大脑中动脉起始端处(从颈外动脉与颈内动脉分叉处起计算插入约18~22mm)即可。固定线栓,缝合切口。手术结束后,动物放置于室温环境下苏醒。2 h后缓慢退出鱼线至分叉处。试验过程和动物苏醒期间注意保温。动物苏醒后观察其体态及行为,以判断MCAO模型是否成功。手术后大鼠正常喂食,饮水。
假手术组只分离左侧颈总、颈内、颈外动脉,不予以插线栓。
1.4 电针干预
电针组大鼠在造模后2 h开始进行电针干预。根据《实验针灸学》[9]取大鼠右侧曲池、足三里穴。局部消毒后,用0.5寸毫针(华佗牌30号),直刺2~3 mm,接电针仪(G6805型),电压峰值为6 V,疏密波,频率1~20Hz,以大鼠肢体轻微抖动为度,治疗时间为30m in/次,1次/d,疗程1 d。假手术组及模型组大鼠同一时间以同样方法固定30m in,但不予电针刺激。
1.5 神经行为学评分
所有大鼠在缺血再灌注后2 h及24 h后,进行两次Longa神经功能缺损评分。神经行为学评估方法:无神经功能缺损,0分;提尾时右前肢内收,不能完全伸展,1分;自发行走时向右侧转圈,2分;行走时身体向右侧倾倒,3分;不能自发行走,有意识丧失,4分。0分及4分者予以剔除。
该评估均由一名对本研究不知情的观察者完成。
1.6 透射电镜观察
各组大鼠分别于电针干预1 d后,用10%水合氯醛3m l/kg腹腔麻醉成功后,用4%多聚甲醛经心脏灌流固定,灌流完毕后快速断头取脑,取左侧半球缺血周围区皮质,大小约1×1×1mm,迅速置入预冷的3%戊二醛-1.5%多聚甲醛前固定3 d(4℃),1%锇酸-1.5%亚铁氰化钾后固定2 h,PBS漂洗;酒精-丙酮梯度脱水,环氧树脂618包埋剂包埋。超薄切片80 nm,醋酸铀、柠檬酸铅染色;在H7650型透射电镜80 KV下观察线粒体及细胞核的形态结构,并用SIS 400万像素电镜CCD相机摄影。
1.7 Western blotting检测
取缺血周围区皮质样本约100mg放入匀浆器,加入RIPA裂解液1 m l,于冰上充分研磨后,4℃,12000 r/m in离心5m in,小心吸取上清液。采用BCA法测定各样本蛋白浓度。100℃加热5m in,使蛋白充分变性后,取50μg样品蛋白经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl-polyacrylgradientgelelectrophoresis,SDS-PAGE),转移到聚偏二乙烯(polyvinylidene fluoride,PVDF)膜后,用5%脱脂牛奶室温封闭2 h,分别加入抗caspase-3(1∶1000)、抗Bcl-2(1∶1000)、抗 Bax(1∶1000)及抗β-actin(1∶1000)一抗,4℃孵育过夜,经TBST洗膜后,用辣根过氧化物标记的二抗(1∶5000)室温孵育60m in。将PVDF膜放图像扫描仪上,避光配置显色液并覆盖PVDF膜,反应1m in,成像;应用Image lab软件计算蛋白条带光密度并进行分析处理。
1.8 统计学分析
实验数据采用统计软件SPSS 18.0处理,计量资料均以(±s)表示,多组间的比较采用One-Way ANOVA,方差齐时用LSD方法,不齐时用Games-Howell方法。显著性水平α=0.05。
2 结果
2.1 神经行为学评分
脑缺血再灌注后2 h,与假手术组大鼠相比,模型组及电针组大鼠神经行为学评分均明显升高(P<0.01),但模型组与电针组之间无显著性差异(P>0.05),说明造模成功。缺血再灌注后24 h,电针组神经行为学评分低于模型组(P<0.05)。见表1。

表1 各组大鼠神经行为学评分
2.2 皮质线粒体结构
假手术组大鼠皮层中神经元细胞核呈多种形态,多数扁圆形;核仁清晰可见;线粒体结构、线粒体嵴清晰可见。缺血再灌注后24 h,模型组缺血周围区部分神经元细胞核破裂,大部分神经元核染色质出现边聚,线粒体嵴紊乱,其数量减少;而电针组较模型组核染色质均匀,线粒体数量增加。见图1。
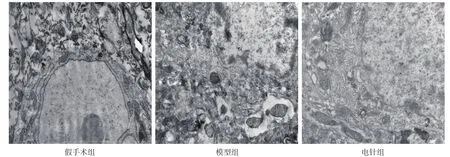
图1 缺血周围区皮层神经元超微结构(透射电镜,25000×)
2.3 皮质caspase-3、Bcl-2、Bax表达
模型组大鼠Bcl-2蛋白表达低于假手术组(P<0.05),而caspase-3、Bax蛋白的表达明显高于假手术组(P<0.01)。电针组Bcl-2蛋白表达水平明显高于模型组(P<0.01),caspase-3、Bax蛋白表达低于模型组(P<0.05)。见图2、表2。

图2 缺血周围区皮质caspase-3、Bcl-2、Bax蛋白表达情况

表2 各组大鼠缺血周围区皮质caspase-3、Bcl-2、Bax蛋白表达比较(/β-actin)
3 讨论
缺血性脑卒中在祖国传统医学中归属于 “中风”范畴,而对中风的记载可追溯至《内经》。中风的基本病机属阴阳失调,气血逆乱。在治疗中风的方法上,《内经》明确指出应以针灸为主。曲池是手阳明大肠经的合穴,足三里是足阳明胃经的合穴,阳明经具有多气多血的特点,针刺曲池、足三里具有调节全身气血的作用。大量临床研究表明,电针曲池、足三里穴能够促进脑卒中后瘫痪肢体功能的恢复,改善其运动功能[10-11]。另有学者对针刺治疗脑卒中的相关文献取穴规律进行研究,发现阳明经穴出现频率较高,其中曲池、足三里穴较为常用[12-13]。本研究发现电针曲池、足三里穴能有效缓解脑缺血再灌注损伤后的神经功能缺损。
目前大量基础研究表明,脑缺血再灌注损伤与细胞凋亡途径有密切联系[14-17]。神经细胞凋亡是脑缺血再灌注损伤后神经元死亡的重要方式之一[18-19]。具体表现为细胞皱缩,出现凋亡小体;核浓缩,染色质凝集。线粒体是脑缺血后神经细胞凋亡的重要途径之一,在各种促细胞凋亡信号作用下,线粒体的形态发生变化,线粒体通透性改变,线粒体基质渗透压升高,内膜肿胀,释放CytC和凋亡诱导因子等,通过激活下游的caspase信号通路最终引起细胞凋亡[20-21]。本研究发现,模型组缺血周围区部分神经元细胞核破裂,大部分神经元核染色质出现边聚,线粒体嵴紊乱,其数量减少;而电针组核染色质较均匀,线粒体数量较模型组增加。提示线粒体凋亡参与脑缺血再灌注损伤后神经元凋亡的调控,给予电针干预后,通过稳定线粒体膜,减少线粒体内部嵴断裂,保护线粒体的形态功能,增加线粒体数量,促进核染色质均匀分布,从而减少细胞凋亡的发生,在线粒体水平上发挥脑保护作用。表明电针作用能减少线粒体损伤,神经细胞的凋亡。
此外,线粒体途径诱导caspase-3和Bcl-2家族引起细胞凋亡的作用受到越来越多的重视。研究表明,Bax可从细胞浆转移到线粒体,增加线粒体膜的通透性,释放Cyt C入细胞浆,激活Caspase-3,引起细胞凋亡[22-24]。有研究发现,脑缺血再灌注损伤大鼠缺血周围区皮质Bcl-2的水平降低,Bax呈高水平表达,活化型caspase-3免疫阳性细胞的数量明显多,电针干预后促进Bcl-2表达,抑制Bax表达,减少活化型caspase-3免疫阳性细胞的数量[25]。本研究从蛋白表达水平发现,电针上调抗凋亡蛋白Bcl-2表达水平,下调促凋亡蛋白Bax及caspase-3的表达水平,抑制神经细胞凋亡,研究结果与其一致。
综上所述,本研究证实电针刺激曲池、足三里穴可改善缺血再灌注损伤大鼠神经行为缺损,产生神经保护作用。其机制可能通过改善线粒体结构,抑制caspase-3的表达,调控Bcl-2、Bax的表达,抑制缺血周围区皮质神经细胞的凋亡,从而缓解脑缺血再灌注损伤。但效应机制还有待于进一步的深入研究。
[1]Kahn JM,Le T,Angus DC,etal.The epidemiology of chronic critical illness in the United States[J].Crit Care Med,2015,43 (2):282-287.
[2]Liang WZ,Chou CT,Hsu SS,et al.The involvement ofm itochondrial apoptotic pathway in eugenol-induced cell death in human glioblastoma cells[J].Toxicol Lett,2015,232(1): 122-132.
[3]SiddiquiWA,Ahad A,Ahsan H.Themystery of BCL2 fam ily: Bcl-2 proteins and apoptosis:an update[J].Arch Toxicol, 2015,89(3):289-317.
[4]Renault TT,Floros KV,Elkholi R,et al.M itochondrial shape governs BAX-inducedmembrane permeabilization and apoptosis[J].MolCell,2015,57(1):69-82.
[5]Zhang L,Xing D,Chen M.Bim(L)displacing Bcl-x(L)promotes Bax translocation during TNF alpha-induced apoptosis[J].Apoptosis,2008,13(7):950-958.
[6]Chelluboina B,K lopfenstein JD,GujratiM,etal.Temporal regulation of apoptotic and anti-apoptotic molecules afterm iddle cerebralartery occlusion followed by reperfusion[J].Mol Neurobiol,2014,49(1):50-65.
[7]Xue X,You Y,Tao J,etal.Electro-acupuncture atpoints of Zusanliand Quchiexertsanti-apoptotic effect through themodulation of PI3K/Akt signaling pathway[J].Neurosci Lett,2014, 558:14-19.
[8]Longa EZ,Weinstein PR,Carlson S,et al.Reversiblemiddle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[9]李忠仁.实验针灸学[M].北京:中国中医药出版社,2007:242.
[10]Zhang GC,Fu WB,Xu NG,et al.Meta analysis of the curative effect of acupuncture on post-stroke depression[J].JTraditChin Med,2012,32(1):6-11.
[11]Cho SY,Kim M,Sun JJ,etal.A comparison of brain activity between healthy subjects and stroke patients on fMRIby acupuncture stimulation[J].Chin J Integr Med,2013,19(4): 269-276.
[12]罗玲,王静,任玉兰,等.古代针灸治疗中风穴位处方配伍规律研究[J].成都中医药大学学报,2010,(4):1-4.
[13]孙英霞,张悦.中风偏瘫采用体针治疗方法集粹[J].中医药学刊,2001,19(1):35.
[14]王晔,刘乃红,王锐,等.大鼠全脑缺血再灌注后海马CA1区神经元凋亡机制的研究[J].中西医结合心脑血管病杂志, 2011,9(7):848-850.
[15]Fang L,Gao H,Zhang W,et al.Resveratrol alleviates nerve injury after cerebral ischemia and reperfusion inm ice by inhibiting inflammation and apoptosis[J].Int JClin Exp Med,2015, 8(3):3219-3226.
[16]Beaulieu JM,Sotnikova TD,Yao WD,et al.Lithium antagonizes dopam ine-dependentbehaviorsmediated by an AKT/glycogen synthase kinase 3 signaling cascade[J].Proc Natl Acad SciU SA,2004,101(14):5099-5104.
[17]Yang Y,Li X,Zhang L,etal.Ginsenoside Rg1 suppressed inflammation and neuron apoptosis by activating PPARγ/HO-1 in hippocampus in ratmodel of cerebral ischem ia-reperfusion injury[J].Int JClin Exp Pathol,2015,8(3):2484-2494.
[18]Dang S,Liu X,Fu P,etal.Neuroprotection by local intra-arterial infusion of erythropoietin after focal cerebral ischem ia in rats[J].NeurolRes,2011,33(5):520-528.
[19]Chudoba P,Kam ińska D,Kościelska-Kasprzak K,etal.Duration of brain death and cold ischemia time,butnotwarm ischem ia time,increases expression of genes associated with apoptosis in transplanted kidneys from deceased donors[J].TransplantProc,2011,43(8):2887-2890.
[20]Kumarswamy R,Seth RK,Dwarakanath BS,etal.M itochondrial regulation of insectcellapoptosis:evidence for permeability transition pore-independent cytochrome-c release in the lepidopteran Sf9 cells[J].Int JBiochem Cell Biol,2009,41(6): 1430-1440.
[21]KawaiC,Pessoto FS,Rodrigues T,etal.pH-sensitive binding of cytochrome c to the innerm itochondrialmembrane.Implications for the participation of the protein in cell respiration and apoptosis[J].Biochem istry,2009,48(35):8335-8342.
[22]Morales-Cruz M,Figueroa CM,González-Robles T,etal.Activation of caspase-dependent apoptosis by intracellular delivery of cytochrome c-based nanoparticles[J].JNanobiotechnology,2014,12:33.
[23]Xue X,Yu JL,Sun DQ,et al.Curcum in induces apoptosis in SGC-7901 gastric adenocarcinoma cells via regulation ofm itochondrial signaling pathways[J].Asian Pac J Cancer Prev, 2014,15(9):3987-3992.
[24]Kulikov AV,Shilov ES,Mufazalov IA,et al.Cytochrome c: the Achilles'heel in apoptosis[J].Cell Mol Life Sci,2012,69 (11):1787-1797.
[25]游咏梅,薛偕华,陶静,等.电针曲池穴及足三里穴对脑缺血再灌注损伤大鼠神经细胞线粒体凋亡途径的影响[J].中华物理医学与康复杂志,2014,36(10):745-750.
Effects of Electroacupuncture at Quchi(LI11)and Zusanli(ST36)on Neuronal Apoptosis Induced by M itochondria-caspase-3Pathway in Ratswith Cerebral Ischem ia-reperfusion Injury
SHANGGUAN Hao1,LIUWei-lin1,CHENWen-lie2,ZHENG Yi1,WANG Xian1,LIN Yun-jiao1,WANG Lu-lu1,CHEN Li-dian1,TAO Jing1
1.College of Rehabilitation Medicine,Fujian University of Traditional Chinese Medicine,Fuzhou,Fujian 350122, China;2.Academy of IntegrativeMedicine,Fujian University of Traditional Chinese Medicine,Fuzhou,Fujian 350122, China
Objective To investigate the effects of electroacupuncture(EA)at Quchi(LI11)and Zusanli(ST36)acupoints on the ultrastructural structure of cortical neurons in peripheral area and the protein expression of caspase-3,Bcl-2,Bax in rats with cerebral ischem ia-reperfusion injury.Methods 36male adult Sprague-Daw ley ratswere random ly divided into sham operation group,model group,and electroacupuncture group,with 12 rats in each group.Themodelgroup and electroacupuncture group were performed with leftmiddle cerebralartery occlusion(MCAO)according to themodified Longa'methods.The electroacupuncture group received electroacupuncture atQuchi(LI11)and Zusanli(ST36)on the paralyzed limb,for 30m inute.The neurobehavioral scoreswere recorded before and after treatment. The ultrastructural structure of corticalneuronswas observed with transmission electronmicroscope(TEM).The protein expression of caspase-3,Bcl-2 and Bax were detected byWestern blotting technique.Results The neurobehavioral scorewas lower in the electroacupuncture group than in the controlgroup(P<0.05).Compared with themodelgroup,the chromatin of neuronswas even relatively,and the number of mitochondria increased.The expression of Bcl-2 was higher and the expression of caspase-3 and Bax was lower in the electroacupuncture group than in themodelgroup(P<0.05).Conclusion Electroacupuncture atQuchi(LI11)and Zusanli(ST36)acupoints can inhibit the neuronsapoptosis in peripheralarea throughm itochondria-caspase-3 pathway.
cerebral ischemia-reperfusion;electroacupuncture;mitochondria;caspase-3;apoptosis;rats
10.3969/j.issn.1006-9771.2015.08.006
R743.3
A
1006-9771(2015)08-0900-05
2015-07-07
2015-07-22)
国家自然科学基金项目(No.81273835;No.81373778)。
1.福建中医药大学康复医学院,福建福州市350122;2.福建中医药大学中西医结合研究院,福建福州市350122。作者简介:上官豪(1990-),男,汉族,福建清流县人,硕士研究生,主要研究方向:脑血管病的临床与康复。通讯作者:陶静(1977-),女,汉族,江苏淮安市人,医学博士,副教授,硕士研究生导师,主要研究方向:脑血管病的临床与康复。E-mail:taojing01@163.com。
