活血化瘀法对急性心肌梗死大鼠CD34、血管内皮生长因子阳性细胞的影响
2015-12-21师伟李晔紫赵海滨杨丹丹姜天元李东方翟瑶瑶
师伟,李晔紫,赵海滨,杨丹丹,姜天元,李东方,翟瑶瑶
·基础研究·
活血化瘀法对急性心肌梗死大鼠CD34、血管内皮生长因子阳性细胞的影响
师伟1,李晔紫2,赵海滨2,杨丹丹2,姜天元2,李东方2,翟瑶瑶2
目的 研究活血化瘀法对大鼠心肌组织微环境中CD34、血管内皮生长因子(VEGF)的影响,探讨其治疗急性心肌梗死的机制。方法 Sprague-Daw ley大鼠32只随机分为假手术组(n=8)、模型组(n=8)、中药+粒细胞集落刺激因子(G-CSF)组(n=8)和G-CSF组(n=8)。各组均于造模3 h后给予相应药物,连续6 d,第7天处死取材。苏木素-伊红(HE)染色观察病理形态,免疫组化染色检测梗死心肌边缘区CD34、VEGF、Ki-67阳性细胞表达。结果 模型组、中药+G-CSF组和G-CSF组CD34、VEGF、Ki-67阳性细胞表达均高于假手术组(P<0.05);中药+G-CSF组、G-CSF组高于模型组(P<0.05);中药+G-CSF组CD34、VEGF阳性表达高于G-CSF组(P<0.05),两组Ki-67阳性细胞表达无显著性差异(P>0.05)。结论 活血化瘀法能够提高CD34和VEGF的表达,其作用优于单独使用G-CSF,可以有效治疗急性心肌梗死。
急性心肌梗死;骨髓干细胞;血管内皮生长因子;微环境;活血化瘀法
[本文著录格式] 师伟,李晔紫,赵海滨,等.活血化瘀法对急性心肌梗死大鼠CD34、血管内皮生长因子阳性细胞的影响[J].中国康复理论与实践,2015,21(8):894-899.
CITED AS:ShiW,LiYZ,Zhao HB,etal.Effectof Activating Blood to Resolve Stagnation on cellsexpressing CD34and vascular endothelialgrow th factor in ratswith acutemyocardial infarction[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(8):894-899.
急性心肌梗死(acutemyocardial infarction,AM I)产生的局部无收缩功能的瘢痕组织是导致心肌重塑、心脏破裂以及心力衰竭等严重并发症的重要因素。研究发现,AM I后动员骨髓干细胞(CD34阳性细胞)定向归巢,并在梗死心肌局部微环境的诱导下,可以达到再生心肌和血管的目的,实现 “无创性”组织再生[1]。微环境对干细胞在心肌内存活、分化起决定性作用[2]。心肌梗死急性期心肌组织微环境突出表现为血管内皮生长因子(vascular endothelial grow th factor, VEGF)、肿瘤坏死因子α和大量炎性细胞浸润等显著增加以及氧化应激反应增加[3]。研究证实,AM I后VEGF分泌增加,能促进内皮细胞分裂增殖、趋化和迁移;还能动员CD34阳性细胞定向归巢及转化[4]。而CD34阳性细胞的旁分泌作用可使其在归巢后分泌一定量的VEGF。在AM I后心肌梗死局部微环境中CD34阳性细胞与VEGF有一定的交互作用[5]。本次实验以CD34、VEGF为靶点对微环境影响AM I的治疗进行初步的探索。
在本课题组 “祛瘀血、生新血”为理论基础的前期研究[6-7]下,把宏观辨证与微观辨证相结合,使用具有活血祛瘀、通脉活络作用的血塞通注射液(主要成分为三七总皂苷)作为中药干预,以目前国际上主要使用的粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)作为心肌梗死后干细胞归巢的有效动员剂[8],探讨活血化瘀法治疗AM I的效应靶点及疗效,为活血化瘀药治疗AM I提供有效的实验依据。
1 材料与方法
1.1 实验动物与分组
健康清洁级雄性Sprague-Daw ley大鼠48只,体质量240~260 g,由北京中医药大学东直门动物实验中心提供。将其随机分为假手术组、模型组、中药+ G-CSF组和G-CSF组。
1.2 实验用药物、试剂
G-CSF:哈药集团生物工程有限公司;血塞通注射液:昆明制药集团股份有限公司;VEGF小鼠源性单克隆抗体、Ki-67山羊源性多克隆抗体、CD34小鼠源性单克隆抗体、CD34兔源性单克隆抗体:圣克鲁斯;DAB免疫组化显色试剂盒、山羊SP试剂盒、小鼠SP试剂盒:中杉金桥生物技术有限公司。
1.3 实验方法
急性心肌梗死模型的建立[8-9]:大鼠适应性饲养观察3 d,以3%水合氯醛10m l/kg腹腔麻醉,仰面固定于鼠板,经口气管插管行小动物呼吸机辅助呼吸,有氧正压通气,呼吸频率80次/m in,吸呼比1∶2,潮气量5~6m l。经左前胸廓旁第3、4肋间逐层开胸,暴露心脏,分离心包,在肺动脉圆锥和左心耳交界处用5/ 0号丝线结扎左冠状动脉前降支(leftanterior descending,LAD)近端制成心肌梗死模型,结扎后观察心脏数分钟,可见左心室前壁颜色变苍白、收缩力减弱即认为造模成功,然后逐层缝合心腔。术后常规抗感染治疗。
假手术组大鼠经历上述手术过程,丝线从冠状动脉下穿过但不结扎。
术后立即腹腔注射给药,给药量按《药理实验方法学》所示剂量换算法计算:大鼠剂量(g/kg)=成人的剂量[1 g/(kg·d)]×0.018。
G-CSF组每天注射G-CSF注射液5μl。中药+ G-CSF组每天注射血塞通注射液2.5m l及G-CSF液5 μl。模型组及假手术组同上法注射等量的生理盐水。每天1次,共用6 d。
1.4 病理形态学检查
第7天各组处死大鼠,取心肌组织,切心脏最大横径,把下半部分进行包埋。用4%多聚甲醛固定,石蜡包埋,常规苏木素-伊红(HE)染色。在光镜下进行病理观察。
1.5 免疫组化染色
连续给药6 d,第7天各组处死大鼠,取出心脏,4%多聚甲醛固定,石蜡包埋切片,常规脱蜡浸水,0.01 mol/L枸橼酸钠缓冲液(pH=6.0)中抗原修复23 m in;取出静止30 m in,恢复至室温,PBS冲洗2 m in,共3次。
滴加1∶50稀释的CD34、VEGF一抗(PBS做阴性对照),放入湿盒,4℃过夜,PBS冲洗2min,共3次;滴加生物素标记羊抗小鼠IgG工作液(二抗),37℃孵育15m in,PBS冲洗5m in,共3次;滴加辣根酶标记链酶卵白素工作液(二抗),37℃孵育15min,PBS冲洗5m in,共3次。
3%H2O2室温避光孵育15m in,以消除内源性过氧化物酶;PBS冲洗2m in,共3次;滴加1∶200稀释的Ki-67一抗(PBS做阴性对照),放入湿盒,4℃过夜,PBS冲洗2m in,共3次;滴加二抗工作液生物素标记小鼠抗羊IgG工作液(二抗),37℃孵育15min, PBS冲洗5m in,共3次;滴加辣根酶标记链酶卵白素工作液(二抗),37℃孵育15m in,PBS冲洗5m in,共3次。
DAB显色剂显色5m in,流水冲洗3次;苏木素复燃,梯度酒精脱水,二甲苯透明,中性树胶封片观察。400倍光镜下取4个视野,摄片,图像分析软件计算积分光密度值(IOD)。
1.6 统计学分析
2 结果
32只大鼠造模成功,取8只作为假手术组,其余每组8只。
2.1 病理形态学观察
模型组梗死区室壁变薄,心肌细胞数量减少,大量炎性细胞浸润,结缔组织整片广布,成纤维细胞多,梗死边缘区可见充血及炎性细胞带。中药+ G-CSF组大鼠心肌细胞排列紊乱,部分出现坏死,梗死边缘区可见炎性细胞带。G-CSF组心肌细胞排列紊乱,心肌细胞数量减少,可见炎性细胞侵润。假手术组心肌细胞排列规则,细胞间偶见炎性细胞。见图1。
2.2 CD34阳性细胞
心肌CD34阳性细胞存在于胞浆,以心肌梗死边缘区多见。模型组可见梗死区细胞溶解,假手术组未见梗死区。模型组、中药+G-CSF组、G-CSF组心肌梗死边缘区CD34阳性细胞表达均高于假手术组(P< 0.05);中药+G-CSF组与G-CSF组均明显高于模型组(P<0.01);中药+G-CSF组高于G-CSF组(P<0.05)。见表1、图2。

表1 各组心肌梗死边缘区CD34阳性细胞表达(IOD)
2.3 VEGF阳性细胞
心肌VEGF阳性细胞存在于胞浆,阳性染色多数位于心肌梗死边缘区,也有部分位于心肌内膜区,考虑可能是由于时间窗的影响。假手术组有少量阳性细胞表达。模型组、中药+G-CSF组、G-CSF组VEGF阳性细胞表达均高于假手术组(P<0.05);中药+G-CSF组、G-CSF组VEGF阳性细胞表达高于模型组(P< 0.05);中药+G-CSF组VEGF阳性细胞表达显著高于G-CSF组(P<0.001)。见表2、图3。
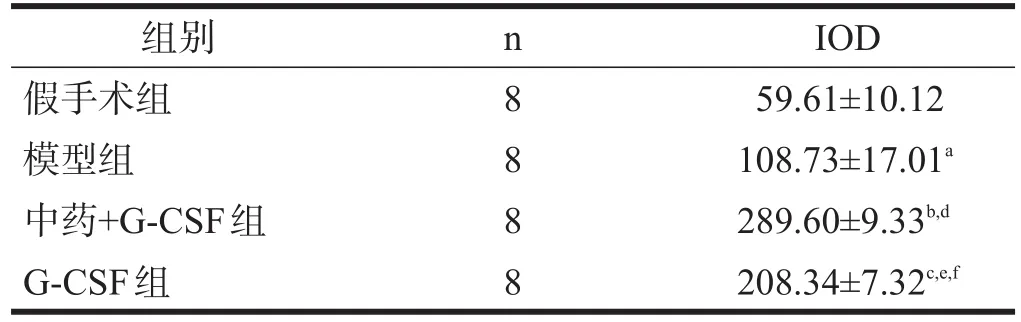
表2 各组心肌梗死边缘区VEGF阳性细胞表达(IOD)
2.4 Ki-67阳性细胞
Ki-67抗体染色细胞核是反映处于细胞周期中增殖状态细胞的理想标志物[7]。Ki-67阳性细胞染色显示,模型组梗死区细胞浆溶解,但仍可见苏木素复染的细胞核阳性表达。假手术组未见梗死区,阳性细胞数量少,Ki-67表达弱;模型组、中药+G-CSF组、G-CSF组Ki-67阳性细胞表达均显著高于假手术组(P< 0.001);中药+G-CSF组与G-CSF组Ki-67阳性细胞表达均高于模型组(P<0.05);中药+G-CSF组Ki-67阳性细胞表达高于G-CSF组,但差异不具有统计学意义(P>0.05)。见表3、图4。

表3 各组大鼠心肌梗死边缘区Ki-67阳性细胞数百分比

图1 各组心肌组织HE染色(200×)

图2 各组心肌组织CD34阳性细胞免疫组化染色(400×)
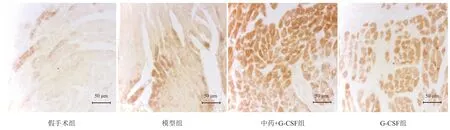
图3 各组心肌组织VEGF阳性细胞免疫组化染色(400×)

图4 各组心肌组织Ki-67阳性细胞免疫组化染色(400×)
3 讨论
在既往的研究中,可能有利于心肌微环境的构成因素并不单一。在MRL小鼠链中,多个基因位点导致一些器官再生能力的提高。在这些小鼠中有时可以观察到几个有力的机制联合在一起导致心脏再生能力的提高,包括血管形成和细胞增殖的增加,凋亡和纤维化的减少[11]。研究表明,AM I发生后,CD34阳性细胞移植能促进缺血、梗死的心肌细胞再生以及血管新生[12-14]。CD34阳性细胞在向受损区域归巢后,开启了可以滋养心肌细胞的旁分泌系统,即可以通过分泌细胞因子如VEGF、肿瘤坏死因子α等,来调节损伤局部的微环境,刺激内源性干细胞样细胞/祖细胞的增殖和分化[15],降低炎症反应[16-18]和免疫反应[19],从而促进受损组织的再生修复能力。VEGF除了由归巢干细胞的旁分泌功能产生以外,缺氧坏死的心肌组织细胞也可产生,并参与损伤后的炎症反应和组织修复。除此之外,VEGF还有通过动员机体的干细胞参与心脏修复的功能[20]。CD34阳性细胞与VEGF的交叉功能可视为强有力的联合机制。
本实验结果显示,心肌梗死边缘区存在大量CD34阳性细胞浸润和VEGF阳性细胞浸润。提示以CD34阳性细胞及VEGF阳性细胞作为靶点调节梗死微环境,可以有效促进修复。
结扎冠状动脉前降支的大鼠,血道闭塞血脉不通,瘀血阻滞脉络,以 “血气不至”、“血凝而不流”、“血瘀滞不行”等为主要病理机制,证型为心血瘀阻型[21]。既往的研究也为实验造模的大鼠具有急性心肌梗死心血瘀阻证的中医证候特点提供了证据[8]。
本课题使用主要成分为三七总皂苷的血塞通作为中药干预,取其活血祛瘀、通脉活络之性,意在采取活血化瘀法随证治之,使 “疏其气血,令其条达”。我们在实验中观察到,模型组大鼠皮肤颜色苍白、紫暗,活动减少、活跃度降低。经过药物治疗,中药+ G-CSF组与其他组对比,大鼠皮肤颜色红润,行为也比较活跃。中药+G-CSF组VEGF阳性细胞染色、CD34阳性细胞染色均高于G-CSF组(P<0.05)。此结果验证了活血化瘀药影响微环境对心脏的修复有促进功能。
本实验采取活血化瘀法,一方面通过化瘀、化旧等方法来祛除体内沉积的瘀血及其他陈旧性的病理产物,另一方面强调活血、生血[22]。实验研究证明,具有活血祛瘀功效的牛膝精能促进CD34阳性细胞的增殖分化,考虑该作用可能与改善造血组织的微环境有关[23]。王宗仁等发现有益气活血功能的芪丹通脉片能够预防急性心肌缺血,刺激心肌分泌VEGF及碱性成纤维细胞生长因子[24]。本实验中,中药+G-CSF组Ki-67阳性细胞多于G-CSF组,但无显著性差异(P>0.05)。因此推测,以活血化瘀法影响CD34、VEGF来调整微环境促进梗死心肌修复,具有一定意义的治疗作用。AM I后微环境的其他作用靶点及从更深层次的基因层面论证活血化瘀法的疗效等值得更进一步的研究。
[1]杨敏,李玉光,吴贤仁,等.体内心肌微环境诱导骨髓干细胞分化的研究[J].汕头大学医学院学报,2004,17(1):15-17.
[2]艾旗.阿托伐他汀联合人脐血单个核细胞静脉移植对急性心梗心肌组织血管再生影响实验研究[D].长沙:中南大学, 2012:51.
[3]邓柳霞,余国龙,艾旗,等.人脐血单个核细胞静脉移植联合复方丹参滴丸对急性心肌梗死局灶炎症反应的影响[J].中国中西医结合杂志,2013,11(12):1532-1537.
[4]Vertesaljai M,Piroth Z,Fontos G,et al.Drugs,gene transfer, signa-ling factors:abench to bedside approach to myocardial stem cell therapy[J].Heart FailRew,2008,13(2):227-244.
[5]陈晴.人胚胎生殖细胞移植治疗猪急性心肌梗死的实验研究[D].苏州:苏州大学.2010:23.
[6]赵海滨,张秀静,王帅,等.BMSCs“归巢”在AM I后心肌重塑中的作用及活血化瘀药的干预研究[J].天津中医药大学学报, 2013,32(1):28-31.
[7]赵海滨,张秀静,王帅,等.急性心肌梗死后TGF-β1/Smad3通路的表达及活血化瘀中药的干预[J].吉林中医药,2013,33 (5):499-502.
[8]李勇华,袁肇凯,郑景辉,等.养心通脉有效部位方与急性心肌梗死大鼠骨髓间充质干细胞的动员及定向归巢[J].中国组织工程与临床康复,2010,23(14):4285-4289.
[9]袁肇凯.中医诊断实验方法学[M].北京:科学技术出版社, 2006:257-258.
[10]汪进益,范慧敏,刘中民.建立适用于细胞移植研究的大鼠心肌梗死动物模型[J].上海医学,2007,30:63-64.
[11]Guo J,Lin OS,Bao CY,etal.Anti-inflammation role formesenchymal stem cell transplantation inmyocardial infarction[J]. Inflammation,2007,30(3-4):97-104.
[12]Cho HJ,Lee J,Wecker A,et al.Bonemarrow-derived stem cell therapy in ischemic heart disease[J].Regen Med,2006,1 (3):337-345.
[13]Manginas A,Goussetis E,Koutelou M,et al.Pilot study to evaluate the safety and feasibility of intracoronary CD133(+)and CD133(-)CD34(+)cell therapy in patientswith nonviable anterior myocardial infarction[J].Catheter Cardiovasc Interv,2007,69(6):773-781.
[14]Collins SD,Baffour R,Waksman R.Cell therapy inmyocardial infarction[J].Cardiovasc Revasc Med,2007,8(1):43-51.
[15]Munoz JR,Stoutenger BR,Robinson AP,et al.Human stem/ progenitor cells from bonemarrow promoteneurogenesisof endogenous neural stem cells in the hippocampus of m ice[J]. Proc NatlAcad SciUSA,2005,102(50):18171-18176.
[16]Ortiz LA,Dutreil M,Fattman C,et al.Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury[J].Proc NatlAcad SciUSA,2007,104(26):11002-11007.
[17]Xu J,Woods CR,Mora AL,etal.Prevention of endotoxin-induced system ic response by bonemarrow-derived mesen-chymal stem cells inm ice[J].Am JPhysiol Lung CellMol Physiol,2007,293(1):L131-L141.
[18]Gupta N,Su X,Popov B,et al.Intrapulmonary delivery of bonemarrow-derivedmesenchymalstem cells improves survival and attenuates endotoxin-induced acute lung injury in m ice[J].JImmunol,2007,179(3):1855-1863.
[19]Uccelli A,Pistoia V,Moretta L.Mesenchymal stem cells:a new strategy for immunosuppression?[J].Trends Immunol, 2007,28(5):219-226.
[20]邓争荣,杨春,马爱群,等.急性心肌梗死患者血浆VEGF、SDF-1和外周血CD34+细胞的动态改变及其意义[J].南方医科大学学报,2006,26(11):1637-1640.
[21]赵海滨,王帅,张秀静,等.祛瘀生新法对AM I后心肌重塑及TGF-β1/Smads通路的干预研究[C].北京:中华中医药学会心病分会、北京中医药学会心血管病专业委员会2012年会论文集,2012:10-16.
[22]张秀静,赵海滨,王帅,等.转化生长因子β1/Smads通路在急性心肌梗死后心肌重塑中的作用及祛瘀生新法的干预研究[J].中国康复理论与实践,2013,19(4):329-333.
[23]邹丹,全宏勋,胡群员.牛膝精对辐射小鼠造血干细胞增殖与分化的影响[J].四川中医,2003,7(11):16-17.
[24]王宗仁,李晶华,肖铁卉,等.芪丹通脉片预防大鼠急性心肌缺血及对VEGF、bFGF表达的影响[J].第四军医大学学报, 2003,24(7):628-630.
书讯
《特殊儿童教育与康复文库》已由南京师范大学出版社出版。本文库系国家出版基金项目、国家 “十二五”重点图书出版规划项目,由顾明远、张海迪任总顾问,朴永馨、林宝贵、方俊明、励建安、贝维斯、卓大宏等任各分册学术顾问,南京特殊教育师范学院丁勇任总主编,励建安、李晓捷、陈小娟、许家成、杜晓新、黄冬、盛永进、何侃等任分册主编。
本文库分为 “特殊儿童教育系列”与 “特殊儿童康复系列”两个子系列共20分册。“特殊儿童教育系列”包括《残疾儿童权利与保障》《特殊儿童教育导论》《特殊儿童教育评估》《特殊儿童早期发展支持》《特殊儿童沟通与交往》《特殊儿童认知训练》《特殊儿童行为管理》《特殊儿童生活教育》《特殊儿童体育与运动》《特殊儿童生涯发展与转衔教育》。“特殊儿童康复系列”包括《特殊儿童康复概论》《特殊儿童物理治疗》《特殊儿童作业治疗》《特殊儿童语言与言语治疗》《特殊儿童心理治疗》《特殊儿童艺术治疗》《特殊儿童舞动治疗》《特殊儿童功能性视力训练》(附DVD光盘)《特殊儿童定向行走训练》《特殊儿童辅助技术》。
本文库倡导与心理、教育相结合的康复理念;强调家庭、社区、学校(康复机构)的配合协作;注重运用多种手段进行综合康复,以帮助残障儿童尽可能像健全儿童那样学习和生活。图文并茂,操作性强,适用面广,读者群大,可供各类、各级残疾儿童教育机构教育与研究工作者、各级康复机构服务人员、残疾儿童及其他特殊需要儿童家长以及其他从事相关工作的人员参考。
精装总定价:1200元(20册),平装总定价:880元(20册)。总编办电话:025-83598919,营销部电话:025-83598712/83598412,邮购部电话:025-83598297,网址:http://www.njnup.com,邮箱:nspzbb@163.com,联系地址:南京市宁海路122-1号,邮政编码:210097。
Effect of Activating Blood to Resolve Stagnation on Cells Expressing CD34and Vascular EndothelialGrow th Factor in Ratswith Acute Myocardial Infarction
SHIWei1,LIYe-zi2,ZHAOHai-bin2,YANG Dan-dan2,JIANG Tian-yuan2,LIDong-fang2,ZHAIYao-yao2
1.Health Bureau of Chaoyang District,Beijing 100026,China;2.Department of Cardiology,the Third A ffiliated Hospitalof Beijing University of ChineseMedicine,Beijing 100029,China
Objective To explore the effectof Activating Blood to Resolve Stagnation on the expression of CD34and vascular endothelialgrow th factor(VEGF)in ratswith acutemyocardial infarction.Methods32Sprague-Daw ley ratswere random ly divided into sham operation group(A,n=8),model group(B,n=8),Xuesaitong Injection+granulocyte colony-stimulating factor(G-CSF)group(C,n=8)and G-CSF group(D,n=8).Correspondingmedicinewas given to each group 3 hours aftermodeling,for 6 days.Pathomorphological changes wereobserved through HE staining,and theexpression of CD34,VEGFand Ki-67wereobserved through immunohistochemicalstaining.Results The expressions of CD34,VEGF and Ki-67 were higher in groups B,C and D than in group A(P<0.05),and were higher in group groups C and D than in group B(P<0.05).The expressions of CD34and VEGFwere higher in group C than in group D(P<0.05).However, therewasno significantdifference in the expression of Ki-67 between 2 groups(P>0.05).Conclusion Theexpression of CD34and VEGF increaseswith Activating Blood to Resolve Stagnationmethod,which is superior to using G-CSF only.Activating Blood to Resolve Stagnationmay play an important role in the treatmentof acutemyocardial infarction.
acutemyocardial infarction;marrow stem cells;vascular endothelial grow th factor;micro environment;Activating Blood to Resolve Stagnationmethod
10.3969/j.issn.1006-9771.2015.08.005
R541.4
A
1006-9771(2015)08-0894-06
2015-02-05
2015-04-27)
北京中医药科技项目(No.JJ2011-67)。
1.北京市朝阳区卫生局,北京市100026;2.北京中医药大学第三附属医院心内科,北京市100029。
师伟(1960-),男,汉族,河北东光县人,博士,主任医师,主要研究方向:疾病预防控制工作。通讯作者:赵海滨,男,博士,教授。E-mail:haibin999@126.com。
