碱性成纤维细胞生长因子和转化生长因子-β1复合骨髓间充质干细胞对大鼠退变椎间盘的修复作用
2015-12-21李大鹏张志坚束浩明李正南黄永辉
江 潮,李大鹏,张志坚,束浩明,胡 浪,李正南,黄永辉
1江苏大学附属医院骨科,江苏镇江 2120012江苏大学医学院外科学,江苏镇江 212013
碱性成纤维细胞生长因子和转化生长因子-β1复合骨髓间充质干细胞对大鼠退变椎间盘的修复作用
江 潮1,2,李大鹏1,张志坚2,束浩明1,2,胡 浪1,李正南1,2,黄永辉1
1江苏大学附属医院骨科,江苏镇江 212001
2江苏大学医学院外科学,江苏镇江 212013
目的 探讨碱性成纤维细胞生长因子(bFGF)和转化生长因子-β1(TGF-β1)复合骨髓间充质干细胞(BMSCs)以温敏性壳聚糖(TCH)为载体对大鼠退变椎间盘的修复作用。方法 针刺法建立SD大鼠椎间盘退变模型,4周后核磁共振下观察退变效果。体外培养BMSCs,并用含增强型绿色荧光蛋白的腺病毒转染使带有增强型绿色荧光蛋白基因,作荧光标记。将椎间盘退变的SD大鼠分成4组,实验组A组使用bFGF+TGF-β1+BMSCs+TCH凝胶移植入退变的椎间盘中,B组和C组分别使用BMSCs+TCH凝胶和bFGF+TGF-β1+TCH凝胶,对照组D组使用PBS缓冲液。继续培养4周后核磁共振观察各组椎间盘的修复情况。HE、Masson染色、组织病理学观察各组椎间盘结构。逆转录PCR,Western blot检测各组髓核蛋白聚糖、Ⅱ型胶原、Sox-9、Ⅰ型胶原的表达。结果 移植注射的BMSCs能在椎间盘中生长,呈类髓核分化。核磁共振结果显示:A组髓核信号明显高于其他3组,B组高于C组,D组髓核信号最低,硬脊膜受压,脊髓呈串珠状改变,各组间Pfirrmann分级结果差异有统计学意义(P<0.05)。HE、Masson染色显示:A组椎间盘结构完整,髓核细胞数量优于其他3组,髓核和纤维环界限清楚,B组髓核数量多于C组,B组纤维环未见断裂,而C组可见断裂的纤维环,D组髓核细胞被杂乱的纤维组织取代。逆转录PCR、Western blot显示:A组蛋白聚糖、Ⅱ型胶原、Sox-9的表达最高,B组优于C组,D组表达最低(P<0.05)。而Ⅰ型胶原的表达在4组之间差异无统计学意义(P>0.05)。结论 移植的BMSCs在退变椎间盘中能够存活,呈类髓核分化。bFGF+TGF-β1+BMSCs+TCH凝胶复合体对退变的椎间盘具有明显修复作用。BMSCs+TCH凝胶治疗退变椎间盘的效果优于bFGF+TGF-β1+TCH凝胶但低于bFGF+TGF-β1+BMSCs+ TCH凝胶复合体。
碱性成纤维细胞生长因子;转化生长因子-β1;骨髓间充质干细胞;温敏性壳聚糖;腺病毒;椎间盘退变
Acta Acad Med Sin,2015,37(4):456-465
腰椎间盘退变是腰腿痛最常见的原因之一。椎间盘是一个特殊的结构,由外层的纤维环和中央的髓核以及上下软骨终板构成[1]。研究表明,椎间盘退变起自髓核,由于髓核细胞坏死凋亡,细胞外基质如蛋白聚糖合成分泌减少,Ⅱ型胶原向Ⅰ型胶原转化,而细胞外基质的减少使髓核微环境发生改变,进一步使髓核细胞数量减少,如此形成一个恶性循环。目前针对腰椎间盘退变的治疗方法主要是椎间盘摘除术和椎间融合术。这些治疗方法能在一定程度上缓解患者的疼痛但并不能从根本上逆转椎间盘退变[2]。研究表明骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)在体外能诱导向类髓核细胞分化,并合成蛋白聚糖等细胞外基质[3]。但有关BMSCs在体内经生长因子诱导对退变椎间盘的修复作用报道较少。本研究将成纤维细胞生长因子(basic fibroblast growth factor,bFGF)+转化生长因子-β1(transforming growth factorβ1,TGF-β1)+BMSCs+温敏性壳聚糖(temperatureresponsive chitosan hydrogel,TCH)凝胶复合体、BMSCs+ TCH凝胶、bFGF+TGF-β1+TCH凝胶分别注射入大鼠退变的椎间盘中,比较各组退变椎间盘修复作用的差异,以期进一步为腰椎间盘退变的生物学治疗应用到临床提供理论依据。
材料和方法
材料 雄性SD大鼠68只,体质量300 g,江苏大学动物中心提供,动物许可证号:SYXK(苏)2008-0024,清洁级;DMEM/Fl2培养基、胎牛血清、胰蛋白酶(美国 Gibco公司),bFGF、TGF-β1(美国PeproTech公司),增强型绿色荧光蛋白腺病毒(江苏大学基础与技术实验室),壳聚糖、β-甘油磷酸钠、羟乙基纤维素、Ⅰ、Ⅱ型胶原基因引物、Sox-9基因引物、蛋白聚糖基因引物、β-actin基因引物(上海生工生物工程有限公司),Ⅰ、Ⅱ型胶原抗体、蛋白聚糖多克隆抗体、Sox-9抗体(美国Santa公司),CO2恒温细胞培养箱(美国Forma公司),PCR仪(美国Applied Biosystems公司),Western blot仪(美国Biorad公司),荧光显微镜(德国Leica公司)。
SD大鼠针刺椎间盘退变动物模型的建立 取SD大鼠68只,雄性,术前禁食10 h,以10%水合氯醛(4 ml/kg)腹腔注射麻醉,腰背部备皮,沿髂嵴平对L6棘突向上摸到L5~L2棘突记号笔标记,俯卧于C臂机球管上,碘伏消毒铺巾,沿L3~L5做3 cm纵切口,切开皮肤、筋膜,沿棘突右侧1 mm切开剥离椎旁肌肉,显露L23、L34、L45、L56关节突关节,选用27G穿刺针沿关节突外侧偏下与水平方向呈40°进针,进针深度3~4 mm,触及柔韧感的纤维环,继续再进针约2 mm,达髓核(图1),C臂机正侧位透视确认针尖均位于椎间盘中央[4]。碘伏生理盐水1∶4冲洗,逐层缝合至皮肤,术后分笼饲养,青霉素肌注5万~10万U/d×3 d。4周后核磁共振下观察椎间盘退变情况。
BMSCs的分离培养及荧光标记 取SD大鼠1只,6周龄,雄性,100 g。取出双下肢股骨、胫骨,用含PBS的1 ml注射器,反复冲洗骨髓腔至干净的培养皿内,至骨髓腔由红变白,用滴管吹打骨髓液,移入离心管内,1000×g,离心5 min,弃上清,用含10%胎牛血清的DMEM/Fl2培养基重悬稀释,调整细胞密度为1×106ml接种于25 cm2细胞培养瓶中。37℃、5% CO2饱和湿度条件下培养。48 h全量换液,以后每3天全量换液1次,倒置显微镜观察细胞形态,待细胞铺满80%细胞培养瓶时,用0.25%胰蛋白酶消化,按1∶2传代。
BMSCs流式细胞仪鉴定及BMSCs荧光标记 取第3代BMSCs,0.25%胰蛋白酶消化,用含有5%胎牛血清的冷PBS冲洗,调整细胞密度为5×106ml。取50 μl细胞悬液,分别加入下列单克隆抗体:CD90-PE、CD29-PE、CD44-PE、CD34-PE,置4℃孵育30 min,PBS洗3次,流式细胞仪检测并分析结果[5]。
取第3代BMSCs,待细胞铺满瓶底70%时用无血清DMEM/F12培养基调整腺病毒载体增强型绿色荧光蛋白滴度为100颗粒数/细胞进行转染。在转染最初1 h内,每15分钟轻摇细胞培养瓶使病毒与细胞充分接触。24 h更换为正常含10%胎牛血清的培养基。转染后第3天于荧光倒置显微镜下观察腺病毒转染细胞情况,荧光显微镜拍照记录,与普通光镜细胞图对照,计算转染效率。

图1 C臂机下针刺退变模型Fig 1 The acupuncture degeneration model under C arm X-ray machine
温敏性壳聚糖凝胶与bFGF、TGF-β1溶液的制备
用0.1 mol/L的盐酸溶解壳聚糖,配成2%的壳聚糖溶液,并在磁力搅拌器中搅拌2 h,高压灭菌后4℃冰箱备用。将β-甘油磷酸钠溶解在双蒸水中,配置成β-甘油磷酸钠水溶液,控制浓度为20%,用0.22 μm小滤器过滤除菌。羟乙基纤维素粉末经紫外线照射3 h灭菌,溶于PBS缓冲液,浓度为2%。测定3种溶液pH值,然后将上述3种溶液按8∶2∶2比例混合(pH值为7.2),即配置成TCH。置于37℃恒温水浴箱,配置好的温敏性壳聚糖溶液10 min后凝结成壳聚糖凝胶。用pH值7.2的PBS将bFGF、TGF-β1粉末溶解,与壳聚糖溶液混合,控制最终浓度为10 ng/ml。取第3代荧光标记的BMSCs与配置好的含bFGF、TGF-β1壳聚糖溶液混匀,控制细胞浓度为1×106ml,现配现用。
实验动物移植模型的建立 将针刺椎间盘退变的SD大鼠分成4组,A组:bFGF+TGF-β1+BMSCs+ TCH凝胶组;B组:BMSCs+TCH凝胶组;C组: bFGF+TGF-β1+TCH凝胶组;D组:PBS缓冲液组。按上述针刺腰椎间盘退变模型的方法,分别将20 μl bFGF+TGF-β1+BMSCs+TCH凝胶、BMSCs+TCH凝胶、bFGF+TGF-β1+TCH凝胶、PBS缓冲液用微量注射器穿刺注射入椎间盘中心,为防止细胞流失,针尖过10 min后等壳聚糖溶液在髓核中央凝结成凝胶再缓慢拔出,逐层缝合至皮肤。术后分笼饲养,青霉素肌注5万~10万U/d×3 d(整个观察期,3只SD大鼠出现右下肢轻度跛行,4只伤口浅表感染,予换药抗感染处理后伤口愈合,2只不明原因死亡)。
磁共振成像分析 每组大鼠分别选取15只于移植治疗前和治疗后4周统一行核磁共振成像(magnetic resonance imaging,MRI)检查。采用SIMENS 3.0T MR扫描仪(江苏大学附属医院磁共振室)。扫描序列如下:常规自旋回波序列T2加权像矢状面及横断面。自旋回波序列T2加权像扫描参数为重复时间4070 ms,恢复时间241 ms,层厚1.5 mm,视野160 mm。SD大鼠椎间盘退变程度MRI评估按照Pfirrmann分级法共分为5级[6]。
组织病理切片检查及移植BMSCs的示踪标记各组SD大鼠磁共振扫描后随机选取4只,完整取出L23、L34、L45、L56椎间盘,包括髓核、纤维环、上下软骨板,4%多聚甲醛固定24 h,10%稀硝酸脱钙48 h,石蜡包埋切片,切片厚度5 μm,组织切片行HE、Masson三色染色。每组选取1只SD大鼠,取出椎间盘,迅速放入液氮中,行冰冻切片,荧光显微镜下观察绿色荧光蛋白的表达。
逆转录PCR法检测蛋白聚糖、Ⅱ型胶原,Sox-9及Ⅰ型胶原基因的表达 每组SD大鼠随机选取5只,完整取出L23、L34、L45、L56髓核组织置于研钵中,边研磨边添加液氮,组织研磨成粉状后,加入1 ml Trizol,按照说明书提取总RNA,按逆转录试剂盒说明书将RNA逆转录为cDNA,然后进行PCR扩增,引物均由上海生工生物工程有限公司合成,引物序列见表1。

表1 引物序列Table 1 Primer sequences
PCR反应条件:(1)蛋白聚糖反应条件为:94℃3 min;94℃30 s,61℃45 s,72℃1 min,36个循环; 72℃,6 min。(2)Ⅱ型胶原反应条件为:94℃3 min; 94℃30 s,60℃ 30 s,72℃ 45 s,35个循环;72℃7 min。(3)Sox-9反应条件为:94℃3 min;94℃30 s,59℃30 s,72℃45 s,35个循环;72℃7 min。(4)Ⅰ型胶原反应条件为:94℃3 min;94℃30 s,60℃30 s,72℃ 45 s,35个循环;72℃ 7 min。(5)βactin反应条件为:94℃3 min;94℃30 s,57℃30 s,72℃45 s,30个循环;72℃ 7 min。PCR产物在1%琼脂糖凝胶上进行电泳,应用凝胶成像分析系统分析条带,将目的基因与内参β-actin的像素强度值进行对比后得到的相对表达值(目的基因/β-actin)进行统计分析。
Western blot检测蛋白聚糖、Ⅱ型胶原,Sox-9及Ⅰ型胶原蛋白的表达 每组5只SD大鼠,取出L23、L34、L45、L56椎间盘髓核组织,用细胞裂解液提取髓核总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,1∶1加入2×上样缓冲液,100℃煮沸10 min。10%的聚丙烯酰胺凝胶电泳,将蛋白印迹转至聚偏氟乙烯膜上,体积分数5%脱脂奶粉TBST室温下封闭2 h。分别与蛋白聚糖、Ⅱ型胶原,Sox-9及Ⅰ型胶原及β-actin多克隆抗体4℃孵育过夜,TBST漂洗3×10 min,二抗室温孵育2 h,TBST漂洗3×15 min后化学发光显色剂暗室曝光显影拍照,凝胶图像分析系统分析光密度值。
统计学处理 采用SPSS 18.0统计软件进行数据分析,MRI等级资料分布采用Kruskal-Wallis H检验,其组间两两比较采用Wilcoxon秩和检验;PCR、Western blot数据以均数±标准差表示,组间比较行单因素方差分析和LSD-t检验,P<0.05为差异有统计学意义。
结果
BMSCs形态学与表面抗原鉴定结果 贴壁生长的BMSCs形态均一,呈长梭形,原代生长缓慢,为散在的小集落。消化传代至第3代生长迅速,细胞排列有方向性,呈漩涡样生长,经增强型绿色荧光蛋白腺病毒转染后,在荧光显微镜下能观察到绿色荧光(图2)。与普通光镜细胞图对照,计算转染率>90%。BMSCs表型鉴定结果显示:CD29阳性率99.6%、CD44阳性率99.1%、CD90阳性率95.3%、CD34阳性率1.2%(图3)。
大鼠术后4周MRI观察结果 MRI、T2加权像示4组SD大鼠L23、L34、L45、L56腰椎间盘髓核信号强度比邻近上下椎间盘髓核信号低,A组髓核信号比邻近椎间盘信号稍有降低,椎间隙高度未见下降;B组髓核信号低于A组,高信号区域缩小,脊髓出现轻度压际,椎间隙高度未见明显下降;C组髓核信号明显降低,呈凸面向后的弧形改变,硬脊膜前缘有弧形压际;D组髓核信号进一步减低,有些甚至呈“黑椎间盘”样改变,髓核向后突出,硬脊膜受压,成弧形改变(图4)。Pfirrmann分级结果显示,从A组到D组,SD大鼠的 Pfirrmann分级越来越高,Kruskal-Wallis H检验结果显示各组间分级结果差异有统计学意义(P<0.05)(表2)。
组织病理切片检查及移植BMSCs的示踪标记结果
冰冻切片:荧光显微镜观察显示术后4周bFGF+ TGF-β1+BMSCs+TCH凝胶组和BMSCs+TCH凝胶组椎间盘冰冻切片可观察到绿色荧光,而未注射荧光标记BMSCs的两组未观察到绿色荧光(图5)。

图2 细胞形态学观察(×100)Fig 2 Morphologies of the cells(×100)

图3 第3代BMSCs流式细胞仪检测Fig 3 The third generation of BMSCs detected by flow cytometry

图4 大鼠腰椎间T2加权像矢状位Fig 4 Sagittal T2weighted images of the rat’s lumbar
椎间盘HE染色:A组椎间盘结构清晰,髓核与纤维环分界清楚,纤维胶原排列整齐,髓核内细胞数量较多,细胞质与细胞核染色明显;B组椎间盘结构欠清晰,纤维胶原排列不规则,未见明显断裂,髓核体积缩小,髓核内细胞数量减少;C组椎间盘结构紊乱,髓核与纤维环界限模糊,纤维胶原分层、断裂,髓核组织结构紊乱;D组椎间盘结构更加紊乱,纤维环与髓核界限不清,纤维环断裂,见外层的纤维进入中央髓核,髓核软骨样细胞被杂乱的纤维软骨样组织取代(图6)。
Masson三色染色:A组胶原纤维排列规则,纤维环与髓核分界清楚,髓核内软骨样细胞较多;B组胶原纤维排列紊乱,但未见纤维胶原断裂,能观察到髓核与纤维环分界;C组和D组胶原纤维排列紊乱,各层间裂隙明显,能明显看到胶原纤维断裂(图7)。
蛋白聚糖、Ⅱ型胶原、Sox-9、Ⅰ型胶原的mRNA表达 A组中蛋白聚糖、Ⅱ型胶原、Sox-9的mRNA表达最高,与B组相比,差异有统计学意义(P<0.05);D组这3种mRNA表达最弱,与C组相比,差异有统计学意义(P<0.05);C组3种mRNA表达高于D组,但低于B组,与B组相比,差异有统计学意义(P<0.05);A、B、C、D 4组Ⅰ型胶原表达差异均无统计学意义(P>0.05)(图8、表3)。

表2 各组髓核核磁共振T2加权像信号Pfirrmann分级结果(n)Table 2 Pfirrmann grading result of 4 groups’T2-weighted signal intensity(n)

图5 BMSCs移植术后带绿色荧光(×400)Fig 5 Green fluorescent protein expression can be observed after transplantation(×400)

图6 4组大鼠椎间盘HE染色(×50)Fig 6 Hematoxylin-eosin staining of the rat discs in 4 groups(×50)
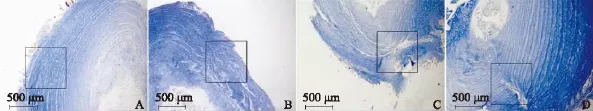
图7 4组大鼠纤维环Masson氏三色染色(×50)Fig 7 Masson’s staining of rat discs in 4 groups(×50)

图8 蛋白聚糖、Ⅱ型胶原、Sox-9和Ⅰ型胶原的逆转录PCR电泳结果Fig 8 Reverse transcription polymerase chain reaction of aggrecan,collagenⅡ,Sox-9 and collagen I
表3 各组目的基因的mRNA表达(n=4,±s)Table 3 Target gene mRNA expressions in each group(n=4,±s)
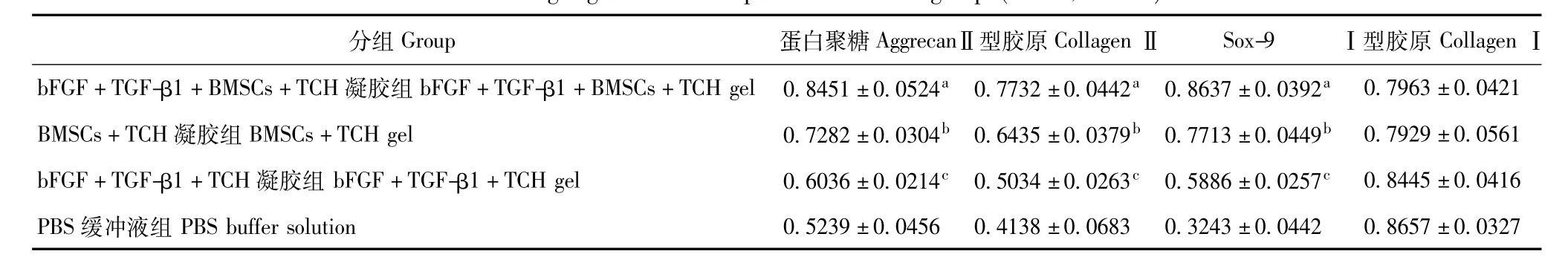
表3 各组目的基因的mRNA表达(n=4,±s)Table 3 Target gene mRNA expressions in each group(n=4,±s)
目的基因相对值=目的基因灰度值/β-actin灰度值;与BMSCs+TCH凝胶组相比,aP<0.05;与bFGF+TGF-β1+TCH凝胶组相比,bP<0.05;与PBS缓冲液组相比,cP<0.05Target gene relative value=target gene gray value/the gene gray value of β-actin;aP<0.05 compared with the BMSCs+TCH gel;bP<0.05 compared with bFGF+ TGF-β1+TCH gel;cP<0.05 compared with PBS buffer solution
分组Group 蛋白聚糖AggrecanⅡ型胶原CollagenⅡ Sox-9 Ⅰ型胶原CollagenⅠbFGF+TGF-β1+BMSCs+TCH凝胶组bFGF+TGF-β1+BMSCs+TCH gel 0.8451±0.0524a 0.7732±0.0442a 0.8637±0.0392a0.7963±0.0421 BMSCs+TCH凝胶组BMSCs+TCH gel 0.7282±0.0304b 0.6435±0.0379b 0.7713±0.0449b 0.7929±0.0561 bFGF+TGF-β1+TCH凝胶组bFGF+TGF-β1+TCH gel 0.6036±0.0214c 0.5034±0.0263c 0.5886±0.0257c 0.8445±0.0416 PBS缓冲液组PBS buffer solution 0.5239±0.0456 0.4138±0.0683 0.3243±0.0442 0.8657±0.0327
蛋白聚糖、Ⅱ型胶原、Sox-9、Ⅰ型胶原的蛋白表达A组蛋白聚糖、Ⅱ型胶原、Sox-9的蛋白表达最高,与B组相比,差异有统计学意义(P<0.05);D组3种蛋白表达最弱,与C组相比,差异有统计学意义(P<0.05);C组3种蛋白表达高于D组,但低于B组,与B组相比,差异有统计学意义(P<0.05);A、B、C、D 4组Ⅰ型胶原表达差异无统计学意义(P>0.05)(图9、表4)。
讨论
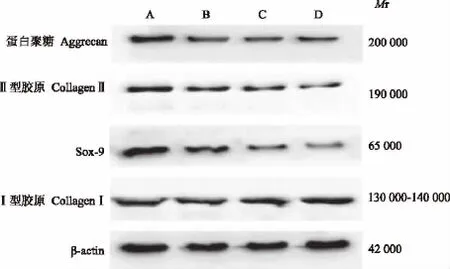
图9 蛋白聚糖、Ⅱ型胶原、Sox-9和Ⅰ型胶原的Western blot检测结果Fig 9 Western blot of aggrecan,collagenⅡ,Sox-9,and collagenⅠ
表4 各组目的蛋白的表达(n=4,±s)Table 4 Expressions of target proteins in each group(n=4,±s)
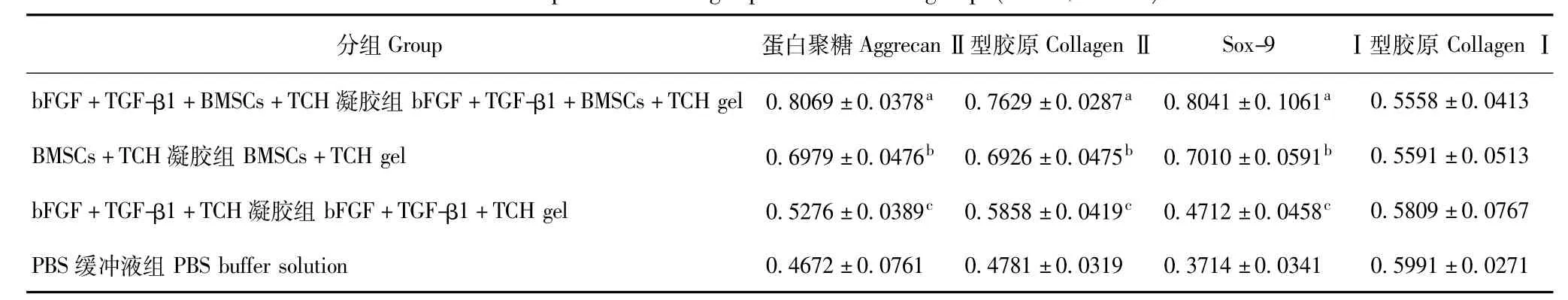
表4 各组目的蛋白的表达(n=4,±s)Table 4 Expressions of target proteins in each group(n=4,±s)
目的蛋白相对值=目的蛋白灰度值/β-actin灰度值;与BMSCs+TCH凝胶组相比,aP<0.05;与bFGF+TGF-β1+TCH凝胶组相比,bP<0.05;与PBS缓冲液组相比,cP<0.05Target protein relative value=target protein relative value/the protein gray value of β-actin;aP<0.05 compared with the BMSCs+TCH gel;bP<0.05 compared with bFGF+TGF-β1+TCH gel;cP<0.05 compared with PBS buffer solution
分组Group 蛋白聚糖AggrecanⅡ型胶原CollagenⅡ Sox-9 Ⅰ型胶原CollagenⅠbFGF+TGF-β1+BMSCs+TCH凝胶组bFGF+TGF-β1+BMSCs+TCH gel0.8069±0.0378a 0.7629±0.0287a 0.8041±0.1061a0.5558±0.0413 BMSCs+TCH凝胶组BMSCs+TCH gel 0.6979±0.0476b 0.6926±0.0475b 0.7010±0.0591b 0.5591±0.0513 bFGF+TGF-β1+TCH凝胶组bFGF+TGF-β1+TCH gel 0.5276±0.0389c 0.5858±0.0419c 0.4712±0.0458c 0.5809±0.0767 PBS缓冲液组PBS buffer solution 0.4672±0.0761 0.4781±0.0319 0.3714±0.0341 0.5991±0.0271
骨髓间充质干细胞具有多种分化潜能,体外实验表明BMSCs在适当的刺激下能诱导分化成类髓核细胞,且取材方便,体外扩增容易,无免疫原性,是退变椎间盘移植的合适细胞来源[7]。Bertolo等[8]体外诱导BMSCs向软骨细胞分化,检测出类似于髓核细胞表型的BMSCs,并向外分泌多种细胞外基质,增加细胞外基质、Ⅱ型胶原等蛋白的表达。Strassburg等[9]证实BMSCs可分泌多种细胞因子,如:集落刺激因子、干细胞生长因子、内皮细胞生长因子及多种白细胞介素,能够促进退变髓核细胞的增殖,逆转退变髓核的功能。将动物自体骨髓间充质干细胞移植入退变的椎间盘组织内,结果显示BMSCs分化为类髓核细胞并能长时间存活至少24周[10],经细胞移植治疗的退变椎间盘形态的改变、髓核细胞的丢失以及纤维环的排列紊乱等均得到一定程度的修复。而在细胞移植的同时加入适当的生长因子和细胞支架,对移植的细胞进行促增殖和诱导分化被证实能增强细胞移植的疗效[11]。bFGF是一种强有力的有丝分裂原,对BMSCs的作用主要表现为促增殖和软骨分化。Visser等[12]研究表明,在众多生长因子中bFGF对BMSCs具有最强的促增殖作用,能使体外培养的BMSCs集落增大2.5倍,且扩增后细胞维持成纤维细胞样形态。Yanada等[13]研究显示,在低密度培养的BMSCs,bFGF能促使其维持增殖能力达80 PD(population doublings);维持其软骨分化达至少46 PD;而且维持其长的端粒达105 PD。TGF-β1具有多种功能,可以调节细胞增值、黏附、迁移及分化。Morigele等[14]研究显示,经TGF-β1诱导后的BMSCs基因表型与髓核细胞相似,并能增加细胞外基质如Ⅱ型胶原蛋白的表达。将bFGF与TGF-β1混合干预BMSCs,既能够促进BMSCs的增殖,又能促进BMSCs向类髓核细胞分化,从而使bFGF和TGF-β1在生物学功能上形成互补,进而加速BMSCs的增殖与定向分化。
壳聚糖是近年研究应用较多的新型细胞支架材料,这种天然高分子材料具有良好的生物相容性、机械稳定性、微生物降解性等优良性能[15],同时也是唯一带正电荷的碱性多糖,其阳离子特性能捕获高价阴离子蛋白聚糖,与bFGF和TGF-β1混合后能使其免于被灭活和流失,使生长因子缓慢释放。壳聚糖能将生长因子集中在细胞周围,增加生长因子同受体接触的机会,促进细胞的增殖与分化[16]。而温敏性壳聚糖在常温下是液体,注射入机体后可在体温的作用下形成凝胶样物质。将BMSCs和生长因子用温敏性壳聚糖包裹可以无损注射入椎间盘,很好地解决了椎间盘组织工程支架导入过程对椎间盘产生附加损伤的问题。与单纯注射BMSCs和生长因子相比,能够减少BMSCs和生长因子的流失,以及侧位骨赘的形成[17]。
本研究核磁共振、HE和Masson病理切片、逆转录PCR和Western blot结果均提示,bFGF+TGF-β1+ BMSCs+TCH凝胶复合体移植治疗SD大鼠退变的椎间盘有明显的效果,其原因可能为:(1)移植的BMSCs在bFGF、TGF-β1和髓核的微环境作用下朝类髓核细胞分化,一定程度上增加了椎间盘中央髓核细胞的数量;(2)移植存活的BMSCs能分泌胰岛素样生长因子、血小板衍化生长因子等多种生长因子,能促进退变髓核细胞的生长,使髓核细胞数量增加,向外分泌更多的细胞外基质,一定程度逆转了退变髓核细胞的功能;(3)由于髓核细胞和细胞外基质的增多,从而有较高的膨胀张力分担椎体压力负荷,使椎间隙高度增加,外周纤维环和上下软骨板的退变程度减低。而BMSCs+TCH凝胶组效果优于bFGF+TGF-β1+TCH凝胶组,其原因可能为:(1)针刺退变椎间盘中央的髓核细胞已经开始凋亡,髓核细胞数量减少,且细胞已呈退变趋势,向外分泌细胞外基质功能减弱,虽然生长因子能在一定程度上营养退变的髓核细胞,但其逆转退变髓核细胞的功能有限;(2)将外源性的BMSCs注入到椎间盘,BMSCs朝类髓核细胞分化,并向外分泌细胞外基质,增加了椎间盘中央类髓核细胞的数量和细胞外基质的表达;(3)移植存活的BMSCs在退变的椎间盘中具有抗炎和免疫调节作用[18],能有效减少退变椎间盘中炎症介质的释放。
综上,本研究结果表明注射bFGF、TGF-β1治疗退变的椎间盘只适用于椎间盘退变的早中期,后期髓核细胞数量减少、功能下降,纤维环断裂,治疗效果有限。而BMSCs移植可以有效增加中央类髓核细胞的数量,并分泌多种生长因子逆转残存的髓核细胞,与髓核细胞共同分泌多种细胞外基质,可以明显改善退变的椎间盘。在移植BMSCs时同时复合bFGF、TGF-β1和TCH凝胶支架,既能促进BMSCs的增殖和定向分化,又能防止BMSCs的流失造成侧位骨赘的形成,比单纯 BMSCs移植效果更明显。但 BMSCs复合bFGF、TGF-β1的最佳浓度,以及是否可以找到一种高效的非病毒目的基因载体,将目的基因导入到BMSCs,通过目的基因的持续表达,对BMSCs产生特定的生物学作用,增强其对椎间盘的修复作用,同时又避免病毒载体免疫和诱导肿瘤的风险,有待于进一步研究。
[1]Kepler CK,Anderson DG,Tannoury C,et al.Intervertebral disk degeneration and emerging biologic treatments[J].J Am Acad Orthop Surg,2011,19(9):543-553.
[2]王海,熊承杰,黄博,等.椎间盘组织工程学种子细胞来源的研究进展[J].中国脊柱脊髓杂志,2012,22(1):77-81.
[3]Steck E,Bertram H,Abel R,et al.Induction of intervertebral disc-like cells from adult mesenchymal stem cells [J].Stem Cells,2005,23(3):403-411.
[4]Li D,Yang H,Huang Y,et al.Lumbar intervertebral disc puncture under C-arm fluoroscopy:a new rat model of lumbar intervertebral disc degeneration[J].Exp Anim,2014,63(2):227-234.
[5]Takemitsu H,Zhao D,Yamamoto I,et al.Comparison ofbone marrow and adipose tissue-derived canine mesenchymal stem cells[J].BMC Vet Res,2012,8:150.
[6]Yu LP,Qian WW,Yin GY,et al.MRI assessment of lumbar intervertebral disc degeneration with lumbar degenerative disease using the Pfirrmann grading systems[J].PLoS One,2012,7(12):e48074.
[7]Hee HT,Ismail HD,Lim CT,et al.Effects of implantation of bone marrow mesenchymal stem cells,disc distraction and combined therapy on reversing degeneration of the intervertebral disc[J].J Bone Joint Surg Br,2010,92(5): 726-736.
[8]Bertolo A,Mehr M,Aebli N,et al.Influence of different commercial scaffolds on the in vitro differentiation of human mesenchymal stem cells to nucleus pulposus-like cells[J].Eur Spine J,2012,21(Suppl 6):S826-S838.
[9]Strassburg S,Richardson SM,Freemont AJ,et al.Coculture induces mesenchymal stem cell differentiation and modulation of the degenerate human nucleus pulposus cell phenotype[J].Regen Med,2010,5(5):701-711.
[10]Sobajima S,Vadala G,Shimer A,et al.Feasibility of a stem cell therapy for intervertebral disc degeneration[J].Spine J,2008,8(6):888-896.
[11]Stoyanov JV,Gantenbein-Ritter B,Bertolo A,et al.Role of hypoxia and growth and differentiation factor-5 on differentiation of human mesenchymal stem cells towards intervertebral nucleus pulposus-like cells[J].Eur Cell Mater,2011,21:533-547.
[12]Visser R,Arrabal PM,Santos-Ruiz L,et al.Basic fibroblast growth factor enhances the osteogenic differentiation induced by bone morphogenetic protein-6 in vitro and in vivo[J].Cytokine,2012,58(1):27-33.
[13]Yanada S,Ochi M,Kojima K,et al.Possibility of selection of chondrogenic progenitor cells by telomere length in FGF-2-expanded mesenchymal stromal cells[J].Cell Prolif,2006,39(6):575-584.
[14]Morigele M,Shao Z,Zhang Z,et al.TGF-beta1 induces a nucleus pulposus-like phenotype in Notch 1 knockdown rabbit bone marrow mesenchymal stem cells[J].Cell Biol Int,2013,37(8):820-825.
[15]Mathews S,Bhonde R,Gupta PK,et al.Novel biomimetic tripolymer scaffolds consisting of chitosan,collagen type 1,and hyaluronic acid for bone marrow-derived human mesenchymal stem cells-based bone tissue engineering[J].J Biomed Mater Res B Appl Biomater,2014,102(8): 1825-1834.
[16]Sheridan WS,Grant OB,Duffy GP,et al.The application of a thermoresponsive chitosan/beta-GP gel to enhance cell repopulation of decellularized vascular scaffolds[J].J Biomed Mater Res B Appl Biomater,2014,102(8): 1700-1710.
[17]Vadala G,Sowa G,Hubert M,et al.Mesenchymal stem cells injection in degenerated intervertebral disc:cell leakage may induce osteophyte formation[J].J Tissue Eng Regen Med,2012,6(5):348-355.
[18]Murphy MB,Moncivais K,Caplan AI.Mesenchymal stem cells:environmentally responsive therapeutics for regeneratitive medicine[J].Exp Mol Med,2013,45:e54.
Effect of Basic Fibroblast Growth Factor and Transforming Growth Factor-β1 Combined with Bone Marrow Mesenchymal Stem Cells on the Repair of Degenerated Intervertebral Discs in Rat Models
JIANG Chao1,2,LI Da-peng1,ZHANG Zhi-jian2,SHU Hao-ming1,2,HU Lang1,LI Zheng-nan1,2,HUANG Yong-hui1
1Department of Orthopaedics,Affiliated Hospital of Jiangsu University,Zhenjiang,Jiangsu 212001,China
2Department of Surgery,Medicine School,Jiangsu University,Zhenjiang,Jiangsu 212013,China
Objective To evaluate the effects of the combination of basic fibroblast growth factor(bFGF),transforming growth factor-β1(TGF-β1),bone marrow mesenchymal stem cells(BMSCs),and temperature-responsive chitosan hydrogel(TCH)gel on the repair of degenerative intervertebral disc in rat models.Methods Rat models of intervertebral disc degeneration were established by acupuncture.The degenerative effects were observed under magnetic resonance imaging(MRI).The BMSCs was cultured in vitro and then transfected by adenovirus with enhanced green fluorescent protein to make it carry the gene of enhanced green fluorescent protein,which functioned as fluorescence labeling.The SD rat models of intervertebral disc degeneration were divided into four groups:group A,treated with the combination of bFGF,TGF-β1,BMSCs,and TCH gel;group B,treated with the combination of BMSCs and TCH gel;group C,treated with the combination of bFGF,TGF-β1,and TCH gel;and group D,treated with PBS buffer solution.After the corresponding reagents were injected into the degenerative intervertebral discs of each group,the rats were cultivated for another four weeks and then the repair effects of the intervertebral discs were observed under MRI.Furthermore,the intervertebral discs of each group were taken out and observed by HE and Masson staining.The nucleus pulposus was aspirated and the expressions of aggrecan,collagenⅡ,Sox-9,and collagen I of nucleus pulposus of each group were tested by reverse transcription polymerase chain reaction and Western blot.Results The transplanted BMSCs survived in the intervertebral disc and differentiated into nucleus pulposus-like cells.MRI showed that:the signal intensity of the nucleus pulposus of group A was much higher than that of the rest groups,the signal intensity of group B was higher than that of group C,and the signal intensity of group D was the lowest,in which the dura mater spinalis was in compression and the spinal cord changed in beaded shape.The differences of the Pfirrmann grading among the four groups had statistical significance(P<0.05).The results of the HE and Masson stains showed:the intervertebral disc of group A was well-structured,the quantity of nucleus pulposus cells was larger than that of the other three groups,and the boundary between the nucleus pulposus and the annulus fibrosus was clearly defined;the quantity of the nucleus pulposus cells of group B was larger than that of group C,and the broken annulus fibrosus was not observed in group B,while the broken annulus fibrosus could be observed in group C;and,the nucleus pulposus cells of group D were replaced by fibrous tissue.The results of the reverse transcription polymerase chain reaction and Western blot tests showed that,in terms of the expressions of aggrecan,collagenⅡ and Sox-9,group A was the highest,followed by group B,group C,and group D(P<0.05);in terms of the expression of collagenⅠ,there was no obvious difference among these four groups(P>0.05).Conclusions The transplanted BMSCs can survive in the degenerative intervertebral disc and differentiate into nucleus pulposus-like cells.The combination of bFGF,TGF-β1,BMSCs,and TCH gel has obvious repair effect on the degenerative intervertebral discs.The effect of the combination of BMSCs and TCH gel on transplantation therapy of the degenerative intervertebral discs is better than that of the combination of bFGF,TGF-β1 and TCH gel but worse than that of the combination of bFGF,TGF-β1,BMSCs,and TCH gel.
basic fibroblast growth factor;transforming growth factor-β1;bone marrow mesenchymal stem cell;temperatureresponsive chitosan;adenovirus;intervertebral disc degeneration
HUANG Yong-huiTel:05ll-8508225l,E-mail:huangyh8855@l63.com
R659
A
1000-503X(2015)04-0456-10
10.3881/j.issn.1000-503X.2015.04.016
2014-08-05)
黄永辉 电话:05ll-85082251,电子邮件:huangyh8855@l63.com
镇江市科技计划项目(SH20l003l)、江苏大学附属医院博士引进基金(jdfyrc-2013018)和镇江市医学重点人才项目 Supported by the Scientific and Technological Planning Item of Zhenjiang City(SH20l003l),Doctor Introduction Fund of Affiliated Hospital of Jiangsu University(jdfyrc-2013018),and the Notable Talented Man of Medicine of Zhenjiang City
