肿瘤浸润淋巴细胞与非小细胞肺癌预后关系的Meta分析
2015-12-21焦顺昌
燕 翔,焦顺昌
中国人民解放军总医院肿瘤内科,北京100853
肿瘤浸润淋巴细胞与非小细胞肺癌预后关系的Meta分析
燕 翔,焦顺昌
中国人民解放军总医院肿瘤内科,北京100853
目的 对肿瘤浸润淋巴细胞在非小细胞肺癌中的表达情况进行系统回顾和Meta分析,探讨其在非小细胞肺癌中的预后价值。方法 计算机检索PubMed、EMBASE和Cochrane Library databases、NIH英文数据库以及中国生物医学文献统计库(CBM)、中国期刊全文数据库(CNKI)、中文科技期刊数据库(VIP)等中文数据库,并检索所获得文献的参考文献、综述及重要会议资料,纳入CD3+、CD4+、CD8+和FoxP3+细胞在非小细胞肺癌中预后价值的研究。采用RevMan 5.1软件进行Meta分析。结果 共纳入8个研究,对1197例非小细胞肺癌患者数据的Meta分析结果显示:CD3+ 和CD8+细胞的高表达与总生存期(OS)延长有关(OR=0.52,95%CI=0.40~0.68,P<0.0001;OR=0.52,95% CI=0.34~0.79,P=0.002),且CD8+高表达与无病生存期(DFS)延长显著相关(OR=0.68,95%CI=0.51~0.91,P=0.01)。CD4+细胞表达水平与OS、DFS均无相关(P=0.14,P=0.73)。FoxP3+细胞高表达不利于DFS的延长(OR=1.78,95%CI=1.36~2.31;P<0.0001)。结论 CD3+、CD8+及FoxP3+细胞在微环境中的表达水平是非小细胞肺癌预后的相关因素,CD3+高表达与OS的延长相关,CD8+高表达与DFS和OS的延长均相关,而FoxP3+高表达不利于DFS的延长,CD4+细胞与生存及复发的关系还有待进一步确认。
非小细胞肺癌;免疫微环境;肿瘤浸润淋巴细胞;细胞因子;预后
Acta Acad Med Sin,2015,37(4):406-414
非小细胞肺癌 (non-small cell lung cancer,NSCLC)是威胁城镇人口健康的重要原因之一。研究显示患者的免疫状态与肿瘤病理特征同样影响肿瘤的发展与转归[1]。抗肿瘤免疫治疗是攻克肿瘤的新希望,但既往的应用发现疗效不如预期。经过深入研究发现,肿瘤微环境内的免疫耐受可能是导致免疫治疗效果不尽如人意的最关键原因[2-3]。肿瘤浸润淋巴细胞(tumor infiltrated lymphocytes,TILs)是主要存在于肿瘤微环境内的以T细胞为主的一个异质性淋巴细胞群体,与微环境中的免疫逃逸有着密不可分的关系。在肿瘤的临床病理检查中发现TILs相关病理特征在不同组织器官、不同肿瘤来源及不同病理分型中均存在较大的差异性。目前关于肿瘤浸润淋巴细胞在NSCLC肿瘤局部表达及其与预后关系的报道较少,结论存在不一致性,有些试验甚至得出了完全相反的结论,这极大地限制了相关标志物在临床中的应用。为了更好地了解肿瘤浸润淋巴细胞在NSCLC肿瘤局部表达的情况及其意义,本研究对既往研究中肿瘤浸润淋巴细胞与NSCLC预后的相关结果进行系统分析,以期为肿瘤生物治疗提供新的线索。
资料和方法
资料来源 计算机检索PubMed、EMBASE以及Cochrane Library databases、NIH databases英文数据库以及中国生物医学文献统计库(China Biology Medicine disc,CBM disc)、中国期刊全文数据库(China National Knowledge Infrastructure,CNKI)、中文科技期刊数据库(VIP)中文数据库,并检索所获得文献的参考文献、综述及国内外重要肿瘤学会议资料,以获取2003年1月至2012年12月有关非小细胞肺癌患者肿瘤微环境中 TILs的研究文献。英文检索词为“prognosis[tw]”,“prognos*[tw]”,“mortality[tw]”,“surviv*[tw]”,“survival[tw]”,“disease free survival”,“disease specific survival”,“progression free survival”,“tumor infiltrating lymphocyte*”,“intratumoral lymphocyte*”,“intratumoural lymphocyte*”,“intratumoural lymphocyte*”,“intra-tumoral lymphocyte*”,“TIL[tw]”,“lung cancer [tw]”,“small lung cancer*[tw]”,“tumor*[tw]”,“tumour*[tw]”,“carcinoma*[tw]”。中文检索词为“肺癌”、“肿瘤浸润淋巴细胞”、“预后”以及这些检索词的同义词。同时手工查阅纳入文献的参考文献及PubMed提示的相关文献以避免遗漏。
文献纳入和排除标准 由两名研究员独立地浏览文题和摘要,选择相关文献,然后查找并阅读全文,根据设定的纳入标准对文献的研究设计、纳入患者、干预措施及观察结果进行评价,筛选合适试验。如有不同意见则由第3名研究员参与讨论产生最终研究结果。
文献的纳入标准:(1)公开发表的原创性研究;(2)研究对象为人类;(3)用免疫组织化学方法评价NSCLC患者肿瘤微环境中的CD3+和/或CD4+和/或CD8+和/或FoxP3+细胞;(4)数据中包含无病生存期(disease free survival,DFS)或总生存期(overall survival,OS); (5)根据初步筛选结果,若有必要,可补充纳入基本符合条件的资料用于评估效果 [优势比(odd ratio,OR)]及相应的不确定性(置信区间,P值,标准误或标准差); (6)文献以英语或汉语出版;(7)当一组临床试验数据具有多篇文献报道,资料最详尽或者时间最新的文献被选择采纳。
文献的排除标准:(1)肺癌细胞系研究、动物研究、文献中未提供关于具体数据的资料、摘要与综述;(2)非原发肺癌的研究如转移癌;(3)小细胞肺癌或其他部位恶性肿瘤的研究;(4)随访时间未超过半数生存期的文献;(5)原文中未提供可提取数据,E-mail联系原作者15 d后未回复的文献; (6)免疫治疗临床试验; (7)未清楚描述肿瘤浸润淋巴细胞分布。
文献资料提取和质量评估 两名研究员使用统一的标准单独从每个入选文献中提取相关数据,录入的主要内容包括: (1)一般资料:包括文献题目、作者、发表时间、来源国家和文献出处; (2)病例特征,包括每个研究的病例数、随访时间(均数或中位数)、病例来源的时间、年龄、性别分布及病理类型、分期、分级; (3)方法学特征,包括纳入分析指标(CD3+、CD4+、CD8+、FoxP3+)、实验方法(免疫组织化学染色)、TILs阳性的判断标准、TILs阳性病例数、TILs阴性病例数、TILs分布、单因素或多因素生存分析的结果[包括P值,OR值,95%置信区间(confidence interval,CI)]。如无法达成一致意见,则交由第3名研究者裁定。
纳入文献质量评估:目前暂无关于预后标记研究的质量评价体系。本研究主要参考De Graeff方法。该方法依据 Hayes及 McShane文献。主要指标包括:(1)是否符合入选标准;(2)前瞻性研究还是回顾性研究; (3)患者的临床及病理信息是否描述充分;(4)所用方法是否描述清晰; (5)是否定义疗效标准;(6)随访时间是否记录;(7)统计分析时是否报道失访人数。为了避免出现评价偏差,两名评价者独立评估,交叉核对,有不同意见时共同讨论,最后取得一致。
统计学处理 认真阅读所有纳入文献,根据Meta分析要求提取并整理数据,建立数据表格,并审核数据,保证数据的准确性。使用Cochrane协作网提供的Meta分析专用统计软件RevMan 5.1版(Cochrane协作网)进行统计分析。具体分析内容包括:各纳入研究结果间的异质性检验,P>0.05表明各实验之间无显著异质性。若各独立实验是同质的(I2<50%),则选择固定效应模型合并分析;若存在显著异质性(I2>50%),则釆用随机效应模型法进行处理[4]。随机效应模型融会上述差异情况下所得的结果。采用效应值分析反映各项研究的处理和效应的关联程度。本试验采取意向性分析原则,即对失访者假设无研究事件的发生。计算OR及95%CI等作为各项实验效应的测量指标,并对综合效应值进行统计检验。计算结果采用森林图显示,OR值为低表达TILs与高表达TILs的统计指标之比,OR>1表明低TILs表达的患者死亡风险较大,即相对高表达TILs统计指标相对较高。OR<1则相反。以漏斗图法评价发表偏倚。必要时采用敏感性分析,以评价Meta结果的稳健性。
结果
文献检索结果及研究特点 最初检索出532篇文献,通过阅读文章题目、摘要和对文献去重后排除478篇不相关文献;剩余54篇仔细阅读全文。根据纳入和排除标准进一步筛选文献,最终得到8篇相关文献(表1),纳入1197例非小细胞肺癌患者。均有DFS和OS数据。全部研究纳入CD3+,6个研究纳入CD4+,5个研究纳入CD8+,6个研究纳入FoxP3+。
CD3+细胞与生存及复发的关系 纳入8项研究,共1197例患者。各组数据之间无明显异质性存在(P=0.36,I2=9%),采用固定效应模型,结果显示,在OS分析中,CD3+高表达有利于OS的延长(OR=0.52,95%CI=0.40~0.68,P<0.00001)。在DFS分析中,CD3+的表达水平对DFS无明显提示作用(OR=0.94,95%CI=0.74~1.18,P=0.57)(图1)。

表1 纳入分析文献特征Table 1 General characteristics of included trials

图1 CD3+细胞生存与复发转移分析森林图Fig 1 Forest plot of CD3+cell with survival and recurrence
CD4+细胞与生存及复发转移的关系 纳入6项研究,共926例患者。各组数据之间有一定异质性(P=0.17,I2=36%),采用固定效应模型,结果显示,在OS分析中,CD4+的表达水平对OS无明显提示作用(OR=0.73,95%CI=0.48~1.11,P= 0.14);在DFS分析中,CD4+的表达水平对DFS无明显提示作用(OR=0.94,95%CI=0.66~1.33,P=0.73)(图2)。
CD8+细胞与生存及复发转移的关系 纳入5项研究,共760例患者。各组数据之间无异质性(P= 0.72,I2=0%),采用固定效应模型,结果显示,在OS分析中,CD8+高表达与OS延长显著相关(OR= 0.52,95%CI=0.34~0.79,P=0.002);在DFS分析中,CD8+高表达与 DFS延长显著相关(OR= 0.68,95%CI=0.51~0.91,P=0.01)(图3)。
FoxP3+细胞与生存及复发转移的关系 纳入6项研究,共926例患者。各组数据之间无异质性(P=0.22,I2=28%),采用固定效应模型,结果显示,在OS分析中,FoxP3+高表达与OS延长无相关性(OR=1.33,95%CI=0.95~1.86,P=0.09); 在DFS分析中,FoxP3+高表达与DFS延长呈显著负相关(OR=1.78,95% CI=1.36~2.31,P<0.0001)(图4)。
敏感性 将数据按随机效应模型进行计算,并与固定效应模型结果进行比较,敏感性分析结果显示,8个指标分别用固定效应模型和随机效应模型估计其合并的OR值,结果非常接近(表2)。
发表偏倚 漏斗图可见纳入的8篇文献相对集中而对称地分布于纵轴两侧,即研究结果受发表偏倚的影响较小(图5)。

图2 CD4+细胞生存与复发转移分析森林图Fig 2 Forest plot of CD4+cell with survival and recurrence
讨论
利用免疫组织化学方法对肿瘤浸润淋巴细胞进行定量是研究抗肿瘤免疫的常用方法。本研究系统回顾分析了近年针对非小细胞肺癌TILs的免疫组织化学研究结果,以寻找其一致性和共同点。虽然纳入的研究在方法学上有相当的异质性,但还是得出了令人鼓舞的结果。本研究发现,CD3+和CD8+细胞的高表达与良好预后有关。CD4+细胞高表达与DFS、OF均无明显相关。FoxP3+的高表达不利于DFS的延长。总的来说,这些有统计学意义的OR值反应在生存时间绝对值上的差异都不太大。有研究提示在一些肿瘤中CD8+与FoxP3+的比值得出的OR值更明显,似乎与生存关系更大[13]。但这需要更多数据来证实。
分层分析提示,随访时间及样本量等因素可能对结果产生影响。CD3+及CD8+细胞在小样本量的研究中能得出更高的OR值,而随访时间越长,越不容易得出有效统计结果。由于不是所有的研究都提供了中位随访时间,因此结论具有不确定性。由样本量或随访时间造成的结果差异可能是由于发表偏倚引起的。对于发表偏倚的识别最常采用的方法就是漏斗图,本研究采用漏斗图的评价方式,结果显示本研究受发表性偏倚影响程度较小,结论较可靠,但漏斗图的分析相对粗糙且有假阳性的趋势。在对本研究的漏斗图进行分析时,应考虑到纳入研究数偏少,且研究对象由不同人群组成等因素的影响。这意味着不对称可能不仅仅是由发表或选择偏倚带来的,也可能是来源于不同研究人群的内在差异,包括人种及地区的差异[14]。由于纳入的几项研究存在差异,合并后结果出现偏差,因此需要进一步的大样本试验验证。
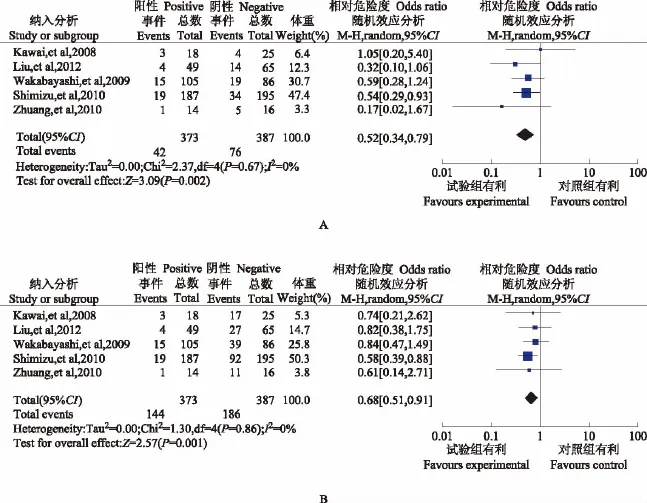
图3 CD8+细胞生存与复发转移分析森林图Fig 3 Forest plot of CD8+cell with survival and recurrence
Meta分析是现代科学研究中一种新的研究手段和方法,与单一研究相比,可提高统计检验的效能,评价各研究结果的不一致或矛盾,定量评估效应大小,在医学领域决策评价方面具有独特的作用,然而由于Meta分析本身的局限性,在分析过程中存在各种偏倚。本研究在亚组分析中,截止点的确认方式差别很大。有的研究用四分位数,有的用三分位数,有的用中位数,有的用阳性/阴性,还有的用最小P值点,甚至根本不报道截止点。此外,虽然所有研究均采用免疫组织化学方法,但该方法由于组织固定、染色步骤等操作上的不统一性,导致结果差异很大,这造成了本研究不可避免的技术偏倚。因此,尽管免疫组织化学是一种非常好的筛查方法,但仍需要建立可重复性更高的方法来获得更可靠的结果。
纳入资料方面,由于本研究的语种限定为英文和中文,而其他语种如日、法、韩文等资料未包括在内,影响了资料的全面性。另外,本研究设立的纳入标准排除了较小样本量的研究。然而目前发表的大量文章都是小样本量研究,由此损失了较大病例数,无法对TILs各亚群进行分层分析,从而无法得知免疫细胞亚群间的相互作用对预后带来的影响。这些小样本研究的结果虽然不能作为量化结果进行统计分析,但可为进一步研究提供思路。
本研究分析结果显示,TILs对复发及生存的确存在影响,这些显著性结果并不是单纯由分析方法产生的。体外研究证实,免疫细胞可在特异性肿瘤抗原的刺激下增殖,而免疫细胞在肿瘤中的聚集能够形成炎性肿瘤微环境[15-16]。动物研究也证实,肿瘤特异的CD8+细胞过继治疗可使肿瘤完全消退[17-20]。另外,器官移植患者由于免疫抑制药物的应用,肿瘤发生率也升高,提示免疫监视的抗肿瘤作用[15]。
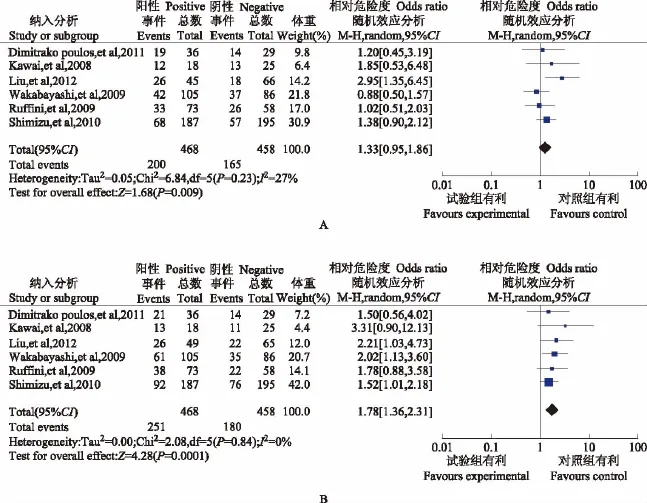
图4 FoxP3+细胞生存与复发转移分析森林图Fig 4 Forest plot of FoxP3+cell with survival and recurrence

表2 固定效应模型和随机效应模型计算结果比较[ORs(95%CI)]Table 2 Comparison between fixed-effects model and random-effects model[ORs(95%CI)]
肿瘤微环境中同时存在免疫抑制机制。这些机制阻止了TILs的抗肿瘤效应。可能的机制包括:由于免疫逃避及免疫耐受,TILs在微环境中的活性受到影响;免疫反应产生Th1/Th2飘移,Treg细胞活性增高;TILs也可能被正常激活,但由于肿瘤生长过于迅速,超出其控制能力等。然而这些假说都无法通过对TILs单一免疫组织化学染色得到验证。为了进一步探讨功能学问题,有研究对活性标记物进行了染色,如Granzyme-B[21-22]、CD25[23]、OX40(CD134)[24]、CD69;或抑制共刺激分子,如PD-1[25]及其连接物B7-H1[26-27]。这些研究结果都相当引人瞩目,然而目前却未在临床治疗策略的制定及预后判断中得到应用。可能的原因包括,TILs缺乏明确的定义,其阳性表达的判断方法尚未统一等。本研究目的之一就是为了从分散的研究中提取出相对稳定的预后指标,为临床实践提供预后指标。

图5 纳入研究漏斗图分析Fig 5 Funnel plot of involved trials
随着对免疫和化疗之间相互作用认识的不断深入,TILs表达将来可能指导化疗药物的选择[28]。例如,脂质体紫杉醇、拓普替康等细胞周期特异性药物可在卵巢癌动物模型中激活免疫反应,而吉西他滨等非细胞周期特异性药物则不能[29-30],提示TILs阳性表达的患者可能更能从特异的联合化疗中获益。另外,TILs也是潜在的免疫治疗目标,为免疫治疗提供更多线索,该领域研究目前得到相当发展[31-32]。
综上,本研究显示TILs对NSCLC预后有一定的影响,不同淋巴细胞间的比例对预后的影响可能更大。然而,由于本研究受到方法学的限制,仍不能完全解释TILs对预后的影响,提高研究质量是揭示TILs临床意义的重要前提。另外,仅TILs的定量研究远不能解释肿瘤微环境中的复杂效应,需要设计更严谨、样本量更大、生存分析更规范以及随访时间更长的研究得出更有可信度的统计数据。
[1]Prendergast GC,Jaffee EM.Cancer immunologists and cancer biologists:why we didn’t talk then but need tomorrow [J].Cancer Res,2007,67(8):3500-3504.
[2]Poggi A,Zocchi MR.Mechanisms of tumor escape:role of tumor microenvironment in inducing apoptosis of cytolytic effector cells[J].Arch Immunol Ther Exp(Warsz),2006,54(5):323-333.
[3]Liotta LA,Kohn EC.The microenvironment of the tumourhost interface[J].Nature,2001,411(6835):375-379.
[4]Huedo-Medina TB,Sanchez-Meca J,Marin-Martinez F,et al.Assessing heterogeneity in meta-analysis:Q statistic or I2 index[J].Psychol Methods,2006,11(2):193-206.
[5]Liu H,Zhang T,Ye J,et al.Tumor-infiltrating lymphocytes predict response to chemotherapy in patients with advance non-small cell lung cancer[J].Cancer Immunol Immunother,2012,61(10):1849-1856.
[6]Zhuang X,Xia X,Wang C,et al.A high number of CD8+ T cells infiltrated in NSCLC tissues is associated with a favorable prognosis[J].Appl Immunohistochem Mol Morphol,2010,18(1):24-28.
[7]Dimitrakopoulos FI,Papadaki H,Antonacopoulou AG,et al.Association of FOXP3 expression with non-small cell lung cancer[J].Anticancer Res,2011,31(5):1677-1683.
[8]Wakabayashi O,Yamazaki K,Oizumi S,et al.CD4+T cells in cancer stroma,not CD8+T cells in cancer cell nests,are associated with favorable prognosis in human nonsmall cell lung cancers[J].Cancer Sci,2003,94(11): 1003-1009.
[9]Ruffini E,Asioli S,Filosso PL,et al.Clinical significance of tumor-infiltrating lymphocytes in lung neoplasms[J].Ann Thorac Surg,2009,87(2):365-371;discussion 371-372.
[10]Kawai O,Ishii G,Kubota K,et al.Predominant infiltration of macrophages and CD8(+)T Cells in cancer nests is a significant predictor of survival in stageⅣnonsmall cell lung cancer[J].Cancer,2008,113(6):1387-1395.
[11]Liu H,Zhang T,Ye J,et al.TNF receptor-associated factor 6 in advanced non-small cell lung cancer:clinical and prognostic implications[J].J Cancer Res Clin Oncol,2012,138(11):1853-1863.
[12]Shimizu K,Nakata M,Hirami Y,et al.Tumor-infiltrating Foxp3+regulatory T cells are correlated with cyclooxygenase-2 expression and are associated with recurrence in resected nonsmall cell lung cancer[J].J Thorac Oncol,2010,5(5): 585-590.
[13]Saifi M,Maran A,Raynaud P,et al.High ratio of interfollicular CD8/FOXP3-positive regulatory T cells is associated with a high FLIPI index and poor overall survival in follicular lymphoma[J].Exp Ther Med,2010,1(6):933-938.
[14]Lau J,Ioannidis JP,Terrin N,et al.The case of the misleading funnel plot[J].BMJ,2006,333(7568): 597-600.
[15]Kim R,Emi M,Tanabe K.Cancer immunoediting from immune surveillance to immune escape[J].Immunology,2007,121(1):1-14.
[16]Finn OJ.Cancer immunology[J].N Engl J Med,2008,358(25):2704-2715.
[17]Vierboom MP,Nijman HW,Offringa R,et al.Tumor eradication by wild-type p53-specific cytotoxic T lymphocytes[J].J Exp Med,1997,186(5):695-704.
[18]Palmer DC,Balasubramaniam S,Hanada K,et al.Vaccinestimulated,adoptively transferred CD8+T cells traffic indiscriminately and ubiquitously while mediating specific tumor destruction[J].J Immunol,2004,173(12): 7209-7216.
[19]Ruttinger D,Li R,Urba WJ,et al.Regression of bone metastases following adoptive transfer of anti-CD3-activated and IL-2-expanded tumor vaccine draining lymph node cells[J].Clin Exp Metastasis,2004,21(4):305-312.
[20]Wall EM,Milne K,Martin ML,et al.Spontaneous mammary tumors differ widely in their inherent sensitivity to adoptively transferred T cells[J].Cancer Res,2007,67(13):6442-6450.
[21]Oshikiri T,Miyamoto M,Shichinohe T,et al.Prognostic value of intratumoral CD8+T lymphocyte in extrahepatic bile duct carcinoma as essential immune response[J].J Surg Oncol,2003,84(4):224-228.
[22]Gao Q,Qiu SJ,Fan J,et al.Intratumoral balance of regulatory and cytotoxic T cells is associated with prognosis of hepatocellular carcinoma after resection[J].J Clin Oncol,2007,25(18):2586-2593.
[23]Ladanyi A,Somlai B,Gilde K,et al.T-cell activation marker expression on tumor-infiltrating lymphocytes as prognostic factor in cutaneous malignant melanoma[J].Clin Cancer Res,2004,10(2):521-530.
[24]Hillen F,Baeten CI,de Winkel AV,et al.Leukocyte infiltration and tumorcellplasticity are parameters of aggressiveness in primary cutaneous melanoma[J].Cancer Immunol Immunother,2008,57(1):97-106.
[25]Thompson RH,Dong H,Lohse CM,et al.PD-1 is expressed by tumor-infiltrating immune cells and is associated with poor outcome for patients with renal cell carcinoma[J].Clin Cancer Res,2007,13(6):1757-1761.
[26]Thompson RH,Gillett MD,Cheville JC,et al.Costimulatory molecule B7-H1 in primary and metastatic clear cell renal cell carcinoma[J].Cancer,2005,104(10):2084-2091.
[27]BoorjianSA,Sheinin Y,Crispen PL,etal. T-cell coregulatory molecule expression in urothelial cell carcinoma: clinicopathologic correlations and association with survival [J].Clin Cancer Res,2008,14(15):4800-4808.
[28]Kandalaft LE,Singh N,Liao JB,et al.The emergence of immunomodulation:combinatorial immunochemotherapy opportunities for the next decade[J].Gynecol Oncol,2010,116(2):222-233.
[29]Alagkiozidis I,Facciabene A,Carpenito C,et al.Increased immunogenicity of surviving tumor cells enables cooperation between liposomal doxorubicin and IL-18[J].J Transl Med,2009,7:104.
[30]Alagkiozidis I,Facciabene A,Tsiatas M,et al.Timedependent cytotoxic drugs selectively cooperate with IL-18 for cancer chemo-immunotherapy[J].J Transl Med,2011,9:77.
[31]Kandalaft LE,Powell DJ Jr,Singh N,et al.Immunotherapy for ovarian cancer:what’s next[J].J Clin Oncol,2011,29(7):925-933.
[32]Kandalaft LE,Singh N,Liao JB,et al.The emergence of immunomodulation:combinatorial immunochemotherapy opportunities for the next decade[J].Gynecol Oncol,2010,116(2):222-233.
Roles of Tumor-infiltrating Lymphocytes in Non-small Cell Lung Cancer Recurrence and Metastasis:A Meta Analysis
YAN Xiang,JIAO Shun-chang
Department of Oncology,Chinese PLA General Hospital,Beijing 100853,China
Objective To determine the prognostic value of tumor-infiltrating lymphocytes in the recurrence and metastasis of non-small cell lung cancer(NSCLC).Methods A PubMed,EMBASE,Cochrane Library databases,NIH databases,and China Biology Medicine disc,China National Knowledge Infrastructure,Chinese Science and Technology Periodical literature search strategy was designed.Studies on the prognostic values of intratumoural CD3+,CD4+,CD8+,and FoxP3+lymphocytes for NSLCL were retrieved.RevMan 5.1 was applied for Meta analysis.Results Totally 8 studies entered the final analysis.In pooled analysis of 1197 patients,the high expressions of CD3+and CD8+cells were correlated with the increase of overall survival(OS)(OR=0.52,95%CI=0.40-0.68,P<0.0001;OR=0.52,95%CI=0.34-0.79,P=0.002),and the high expression of CD8+was significantly correlated with the increase of disease-free survival(DFS)(OR=0.68,95%CI=0.51-0.91,P=0.01).The CD4+cell expression level was not significantly correlated with OS or DFS(P=0.14,P=0.73).The high expression of FoxP3+cells did not favor the DFS(OR=1.78,95%CI=1.36-2.31;P<0.0001).Conclusion The expression levels of CD3+,CD8+and FoxP3+in NSCLC microenviroment are related with the prognosis of NSCLC,while the role of CD4+in the development of NSCLC warrants further investigations.
non-small cell lung cancer;immune microenvironment;tumor-infiltrating lymphocyte;cytokine;prognosis
JIAO Shun-chang Tel:010-66939761,E-mail:jsc301@163.com
R73-31/R734.2
A
1000-503X(2015)04-0406-09
10.3881/j.issn.1000-503X.2015.04.007
2014-09-30)
焦顺昌 电话:010-66939761,电子邮件:jsc301@163.com
中国人民解放军总医院科技创新苗圃基金项目(13KMM07)Supported by the Garden Foundation for Technology Progression of PLA General Hospital(13KMM07)
