增生性瘢痕形态学观察及血管内皮生长因子和转化生长因子β激活性激酶1表达的检测与意义
2015-12-21张羽飞李厚忠王学勇马洪闯袁晓环初彦辉
张羽飞,李厚忠,王学勇,马洪闯,武 艳,袁晓环,初彦辉
1牡丹江医学院医药研究中心,黑龙江牡丹江1570112牡丹江医学院 药学院药理教研室,黑龙江牡丹江1570113中国人民解放军第209医院烧伤外科,黑龙江牡丹江157011
增生性瘢痕形态学观察及血管内皮生长因子和转化生长因子β激活性激酶1表达的检测与意义
张羽飞1,李厚忠2,王学勇3,马洪闯1,武 艳1,袁晓环1,初彦辉1
1牡丹江医学院医药研究中心,黑龙江牡丹江157011
2牡丹江医学院 药学院药理教研室,黑龙江牡丹江157011
3中国人民解放军第209医院烧伤外科,黑龙江牡丹江157011
目的 研究血管内皮生长因子(VEGF)和转化生长因子β激活性激酶1(TAK1)在正常皮肤及增生性瘢痕组织中的表达,并结合增生性瘢痕的形态学观察,探讨其在病理性瘢痕发病机制中的作用,为病理性瘢痕的临床治疗提供一定的依据与参考。方法 采用常规HE、Masson染色、免疫荧光方法和荧光定量PCR法对10例来自体正常皮肤及15例增生性瘢痕进行VEGF和TAK1在组织中的定位与表达量的检测、病理形态学观察。结果 形态学观察显示增生性瘢痕的表皮形态异常,增生性瘢痕组织中的真皮成纤维细胞较正常皮肤排列紊乱、致密。免疫荧光结果显示增生性瘢痕组织中VEGF和TAK1的表达强度明显高于正常皮肤组织。荧光定量PCR结果显示VEGF和TAK1在增生性瘢痕组织中表达均增强(P<0.01,P<0.05)。结论 增生性瘢痕组织胶原纤维化程度明显高于正常皮肤组织,且瘢痕组织中VEGF与TAK1表达程度均高于正常组织,对增生性瘢痕的形成可能发挥促进作用。VEGF与TAK1可作为增生性瘢痕诊断与鉴别诊断的参考指标,为防治病理性瘢痕形成提供新的治疗靶点。
增生性瘢痕;胶原纤维化;血管内皮生长因子;转化生长因子β激活性激酶1
Acta Acad Med Sin,2015,37(4):446-450
近年来,内源性生长因子与创面修复及瘢痕形成的关系愈来愈受到人们的关注。血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前发现的作用最强的促血管生成细胞生长因子,在血管形成、促进创伤愈合与组织修复、促进组织再生方面发挥重要的作用[1]。转化生长因子 β激活性激酶1(transforming growth factor-beta-activated kinase 1,TAK1),又名有丝分裂原激活蛋白激酶激酶激酶7,属于丝裂原活化蛋白激酶中的一种,目前认为TAK1蛋白主要通过丝裂原活化蛋白激酶三级级联信号通路,参与炎症反应、纤维化和肿瘤等[2-3]。TAK1在瘢痕组织中的异常表达,在国外已有报道,但为数尚少,TAK1与增生性瘢痕形成的关系在国内却罕见报道。为此,本研究以增生性瘢痕以及自体正常皮肤作为研究对象,采用免疫荧光方法和荧光定量PCR法检测VEGF和TAK1在增生性瘢痕及正常皮肤组织中的表达水平和分布特点,探讨其表达与病理性瘢痕形成之间的关系。同时,结合常规染色方法光镜下观察增生性瘢痕的形态学变化,初步探讨VEGF和TAK1在增生性瘢痕组织中表达的意义,为增生性瘢痕发病机制的研究和防治提供新的思路和方法,从而为病理性瘢痕的临床治疗提供一定的依据与参考。
材料和方法
材料 本研究标本收集于在解放军第209医院实施手术切除的15例增生性瘢痕组织标本作为研究对象,同时收集瘢痕切除术患者对应的边缘正常组织作为对照,共10例。临床诊断均为增生性瘢痕患者,为一年生瘢痕,其中男性8例、女性7例。增生性瘢痕主要位于面颈部2例、躯干5例、上肢3例、下肢5例。增生性瘢痕病因主要有烧伤5例、热液烫伤2例、化学烧伤3例、机械性创伤3例、其他2例。每份标本均分为两部分,分别用于形态学观察和分子水平检测。临床收集标本,一份标本及时固定,常规脱水、浸蜡、包埋、切片。另一份组织保存于-80℃。所有患者均无器质性疾病,亦未经任何特殊治疗。手术中所取标本均取得患者或家属知情同意。Masson染色试剂盒购于上海杰美基因医药科技有限公司,SYBR Green Master购于Roche公司,Trizol购于Invitrogen公司,小鼠多克隆抗VEGF抗体、兔多克隆抗TAK1抗体、二抗购于abcam公司,牛血清白蛋白、4’,6-二脒基-2-苯基吲哚购于Sigma公司,Taq酶、反转录试剂盒购于TaKaRa公司,NanoDrop分光光度计购于Thermo公司,实时定量PCR扩增仪购于BioRad公司,激光共聚焦显微镜购于Olympus公司。
HE染色 分别取正常皮肤、增生性瘢痕组织,4%多聚甲醛固定,常规石蜡包埋,制片,厚5 μm,HE染色,光镜下对比观察,拍照。
Masson染色 分别取正常皮肤、增生性瘢痕组织,4%多聚甲醛固定,常规石蜡包埋,制片,Masson染色。光镜下观察心肌细胞呈红色或黄色,纤维组织呈蓝色,光镜下对比观察,拍照。
免疫荧光检测 分别取正常皮肤、增生性瘢痕组织,4%多聚甲醛固定,常规石蜡包埋,连续切片(片厚8 μm),冷风干燥后,室温下1%BSA封闭1 h,PBS充分洗涤(5 min×3),滴加抗VEGF/抗TAK1工作浓度为 1∶150,4℃孵育过夜,PBS充分洗涤(5 min×3),滴加工作浓度为l∶200异硫氰酸荧光素标记的二抗,孵育1 h,PBS充分洗涤(5 min×3),4’,6-二脒基-2-苯基吲哚染色,室温放置15 min,PBS充分洗涤(5 min×2),甘油封片,激光共聚焦显微镜进行观察。绿色(TAK1)/红色(VEGF)荧光为阳性表达。
荧光定量PCR检测瘢痕和正常组织中VEGF和TAK1 mRNA的表达 将100 mg组织加入1 ml TRIzol置匀浆器中,氯仿-异丙醇法提取总RNA。经NanoDrop分光光度计定量后,取1 μg RNA,20 μl逆转录体系合成cDNA,然后用SYBR Green Master行实时定量PCR反应:即在20 μl PCR反应体系进行PCR扩增。引物设计:(1)内参GADPH:5’-GAAGGTGAAGGTCGGAGTC-3’(上游),5’-AAGATGGTGATGGGATTTC-3’(下游),扩增片段225 bp;(2)VEGF:5’-CGAGACCCTGGTGGACATCTT-3’(上游),5’-TGGCCTTGGTGAGGTTTGATC-3’(下游),扩增片段180 bp;(3)TAK1: 5’-CATTTGGCAACATTCTGG-3’(上游),5’-CATTCTGACACTGGGACT-3’(下游),扩增片段143 bp。PCR反应条件:95℃预变性1 min,95℃变性15 s,60℃退火15 s,72℃延伸45 s,40个循环,72℃终延伸10 min。每份标本进行2个复管检测。
统计学处理 采用GraphPad prism 5.0进行统计学分析,实验数据用±s表示,两组计量资料数据比较用两独立样本非参数检验,P<0.05为差异有统计学意义。
结果
HE染色结果 与正常皮肤组织相比,增生性瘢痕真皮乳突消失,无表皮皮突与真皮乳突相互交错现象,而正常皮肤的表皮皮突与真皮乳突相互交错,形态规则。此外,增生性瘢痕镜下可见为数众多的成纤维细胞与大量的胶原纤维,粗细不一,排列紊乱、致密,而正常对照组织中胶原纤维排列疏松、规则(图1)。
Masson染色结果 增生性瘢痕组织中胶原纤维表达明显高于正常组织,且呈条束状,排列紊乱,密度分布不均,呈涡轮状或结节状等不规则排列现象(图2)。
免疫荧光检测结果 VEGF表达呈红色荧光,免疫荧光检测显示在增生性瘢痕组织下表皮光斑大量表达,而正常皮肤组织真皮层的光斑较少(图3)。 TAK1表达呈绿色荧光,免疫荧光检测显示正常皮肤组织中真皮层中TAK1表达较少,而增生性瘢痕组织中TAK1大量表达(图4)。

图1 正常皮肤(A)和增生性瘢痕(B)组织形态学观察(HE染色,×100)Fig 1 Morphological observation of normal skin(A)and hypertrophic scar(B)(HE staining,×100)

图2 正常皮肤(A)和增生性瘢痕(B)组织形态学观察(Masson染色,×100)Fig 2 Morphological observation of normal skin(A)and hypertrophic scar(B)(Masson staining,×100)
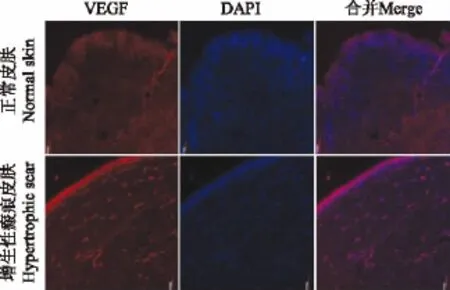
图3 VEGF在正常组织和增生性瘢痕组织的表达(免疫荧光,×100)Fig 3 VEGF expressions in normal skin and hypertrophic scar(immunofluorescence staining,×100)
VEGF和TAK1 mRNA水平的表达 荧光定量PCR检测显示增生性瘢痕组织内VEGF和TAK1 mRNA表达水平均较正常组织明显升高,差异具有统计学意义(P<0.01,P<0.05)(图5)。
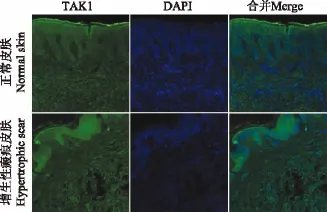
图4 TAK1在正常组织和增生性瘢痕组织的表达(免疫荧光,×200)Fig 4 TAK1 expression in normal skin and hypertrophic scar(immunofluorescence staining,×200)

图5 正常组织和增生性瘢痕组织中VEGF(A)和TAK1(B)mRNA的表达Fig 5 Expressions of VEGF(A)and TAK1(B)mRNA in normal skin and hypertrophic scar
讨论
创面的愈合以及正常组织损伤修复过程中形成瘢痕组织,是正常的生理表现。当皮肤受到创伤后,通过肉芽组织改建成熟后变为老化阶段的纤维结缔组织修复创面,即形成瘢痕组织[4]。而皮肤出现严重创伤或伴有感染时,在修复的过程中可能会出现过度修复或异常修复的结果,最终形成病理性瘢痕(包括增生性瘢痕、瘢痕疙瘩)。病理性瘢痕往往会造成关节、局部器官的正常功能障碍,给患者造成巨大的痛苦。目前治疗瘢痕的方法有许多,但均不能从根本上达到防治病理性瘢痕的目的。由于其发病机制尚不明确,因此尽早发现增生性瘢痕的病理机制成为当下科研工作者的一个重要课题,随着基因疗法的研究深入,人们逐渐将治疗瘢痕的目光投入到与瘢痕形成有关的相应的基因中[5]。
随着对增生性瘢痕发生机制研究的深入,内源性生长因子与瘢痕发生、发展的关系愈来愈受到重视[6]。有研究证实VEGF是新生血管形成中最重要的血管内皮细胞刺激因子之一,具有强烈的促血管生成作用,人们发现新血管形成在瘢痕增生中发挥关键作用[1,7-8]。本研究通过免疫荧光法显示,VEGF在增生性瘢痕真皮层的分布与表达明显高于正常皮肤中的表达量,荧光定量PCR结果显示VEGF mRNA表达水平也较正常组织增高(P<0.01),表明增生性瘢痕组织中有新生血管形成,新生血管的形成为增生性瘢痕的增生提供了营养基础,在增生性瘢痕的形成、发展中可能发挥重要的作用。这与文献[9]报道结果一致。因此,在临床上如能针对新生血管形成施加因素,理论上讲,能对瘢痕组织的过度增生有一定的防治作用[10]。
TAK1是固有免疫和适应性免疫信号通路中的重要调节蛋白,在转化生长因子β1(transforming growth factor β1,TGF-β1)和肿瘤坏死因子α等因素刺激下,TAK1被活化,能够启动下游一系列的信号级联反应,主要参与细胞凋亡、周期调控、细胞分化、纤维化疾病等重要生理病理过程[3,11]。研究显示TAK1具有抑制小鼠的小肠上皮细胞、皮肤角化细胞、肝细胞等细胞凋亡的作用[12-14]。TAK1的异常表达已经在其他真皮纤维化疾病和多种肿瘤疾病中发现,在纤维化疾病(如系统性硬皮病)中TAK1表达增强[15],另有报道显示在皮肤伤口部位注射TAK1可明显促进伤口愈合,而且TAK1缺陷小鼠表现为皮肤厚度和胶原沉积逐步减少[16-17]。本研究显示TAK1在增生性瘢痕组织中的表达明显增多,免疫荧光和荧光定量PCR结果显示的趋势一致,提示TAK1处于活化状态,表明其在瘢痕发生和演变过程中具有重要作用。TAK1与增生性瘢痕形成的关系在国内报道较少,其较深入的机制尚有待于进一步探讨。
在增生性瘢痕纤维化形成过程中,有多种因素参与,其中TGF-β1发挥关键作用,TAK1为TGF-β1下游因子,可以被TGF-β1激活,主要直接地通过促进瘢痕组织内成纤维细胞增殖以及合成胶原纤维,参与瘢痕增生与形成。而VEGF通过促进瘢痕内部大量的血管增生,为瘢痕增生提供充分的氧气、营养供应,间接地促进瘢痕胶原合成,两细胞因子均能明显地促进瘢痕增生与形成。
综上,本研究为进一步深入探索生长因子在瘢痕发生过程中调控作用及临床瘢痕防治手段的建立提供了实验依据。而TAK1与其他生长因子在瘢痕发生和发展过程中的相互关系尚不清楚,值得进一步探讨。
[1]Wilgus TA,Ferreira AM,Oberyszyn TM,et al.Regulation of scar formation by vascular endothelial growth factor[J].Lab Invest,2008,88(6):579-590.
[2]Delaney JR,Mlodzik M.TGF-beta activated kinase-1:new insights into the diverse roles of TAK1 in development and immunity[J].Cell Cycle,2006,5(24):2852-2855.
[3]Sakurai H.Targeting of TAK1 in inflammatory disorders and cancer[J].Trends Pharmacol Sci,2012,33(10):522-530.
[4]Pitzer GB,Patel KG.Proper care of early wounds to optimize healing and prevent complication[J].Facial Plast Surg Clin North Am,2011,19(3):491-504.
[5]Wolfram D,Tzankov A,Pülzl P,et al.Hypertrophic scars and keloids-a review of their pathophysiology,risk factors,and therapeutic management[J].Dermatol Surg,2009,35(2):171-181.
[6]Matthew RJ,Gautam GS,Joseph PA,et al.Novel therapies for scar reduction and regenerative healing of skin wounds [J].Trends Biotechnol,2008,4(26):173-180.
[7]Johnson KE,Wilgus TA.Vascular endothelial growth factor and angiogenesis in the regulation of cutaneous wound repair [J].Adv Wound Care(New Rochelle),2014,3(10): 647-661.
[8]Qing C,Wang ZY,Song F,et al.Dynamic biological changes in fibroblasts during hypertrophic scar formation and regression [J].Int Wound J,2014[Epub ahead of print].
[9]Keswani SG,Balaji S,Le LD,et al.Role of salivary vascular endothelial growth factor(VEGF)in palatal mucosal wound healing[J].Wound Repair Regen,2013,21(4):554-562.
[10]Wietecha MS,DiPietro LA.Therapeutic approaches to the regulation of wound angiogenesis[J].Adv Wound Care(New Rochelle),2013,2(3):81-86.
[11]Schuman J,Chen Y,Podd A,et al.A critical role of TAK1 in B-cell receptor-mediated nuclear factor kappa B activation [J].Blood,2009,113(19):4566-4574.
[12]Kajino Sakamoto R,Inagaki M,Lippert E,et al.Enterocytederived TAK1 signaling prevents epithelium apoptosis and the development of ileitis and colitis[J].J Immunol,2008,181(2):1143-1152.
[13]Omori E,Matsumoto K,Sanjo H,et al.TAK1 is a master regulator of epidermal homeostasis involving skin inflammation and apoptosis[J].J Biol Chem,2006,281(28):19610-19617.
[14]Inokuchi S,Aoyama T,Miura K.Disruption of TAK1 in hepatocytes causes hepatic injury,inflammation,fibrosis,and carcinogenesis[J].Proc Natl Acad Sci USA,2010,107(2):844-849.
[15]Xu SW,Parapuram SK,Pala D,et al.Requirement of transforming growth factor beta-activated kinase 1 for transforming growth factor beta-induced alpha-smooth muscle actin expression and extracellularmatrixcontraction in fibroblasts[J].Arthritis Rheum,2009,60(1):234-241.
[16]Guo F,Hutchenreuther J,Carter DE,et al.TAK1 is required for dermal wound healing and homeostasis[J].J Invest Dermatol,2013,133(6):1646-1654.
[17]Sayama K,Hanakawa Y,Nagai H,et al.Transforming growth factor-beta-activated kinase 1 is essential for differentiation and the prevention of apoptosis in epidermis[J].J Biol Chem,2006,281(31):22013-22020.
Morphology of Hypertrophic Scar Tissues and Expressions of Vascular Endothelial Growth Factor and Transforming Growth Factor Beta Activated Kinase 1 in These Tissues
ZHANG Yu-fei1,LI Hou-zhong2,WANG Xue-yong3,MA Hong-chuang1,WU Yan1,YUAN Xiao-huan1,CHU Yan-hui1
1Medical Research Center,Mudanjiang Medical University,Mudanjiang,Heilongjiang 157011,China2Department of Pharmacology,Mudanjiang Medical University,Mudanjiang,Heilongjiang 157011,China
3Department of Burn Surgery,the 209 Hospital of Chinese People’s Liberation Army,Mudanjiang,Heilongjiang 157011,China
Objective To observe the morphology of hypertrophic scar tissue and explore the expressions and distribution of vascular endothelial growth factor(VEGF)and transforming growth factor beta activatedkinase 1(TAK1)in these tissues.Method Hematoxylin-eosin staining,Masson staining,immunofluorescence,and real-time polymerase chain reaction were used to detect the localization and expression of VEGF and TAK1 in 15 hypertrophic scar tissues and 10 normal skin tissues.Results Morphological observation showed that the dermal fibroblasts in hypertrophic scar were disorderly and densely arranged(compared to the normal skin).Immunofluorescence displayed that the expressions of VEGF and TAK1 in hypertrophic scar tissue were higher than in normal skin tissues.Real-time polymerase chain reaction showed the mRNA expressions of both VEGF and TAK1 were significantly higher in hypertrophic scar tissue than in normal tissue(P<0.01,P<0.05,respectively).Conclusions Hypertrophic scar tissue has higher collagen fibrosis degree and higher TAK1 and VEGF expressions than the normal skin.VEGF and TAK1 can be used as the reference indicators for the diagnosis and differential diagnosis of hypertrophic scar and serve as new therapeutic targets.
hypertrophic scar;collagen fibrosis;vascular endothelial growth factor;transforming growth factor-beta-activated kinase 1
CHU Yan-hui Tel:0453-6984634,E-mail:yanhui_chu@sina.com
R619.6
A
1000-503X(2015)04-0446-05
10.3881/j.issn.1000-503X.2015.04.014
2015-01-19)
初彦辉 电话:0453-6984634,电子邮件:yanhui_chu@sina.com
国家自然科学基金(81401599)和牡丹江市科学技术研究项目(Z2014s021)Supported by the National Natural Sciences Foundation of China(81401599)and the Science and Technology Program of Mudanjiang(Z2014s021)
