肠道缺血再灌注对小鼠体内脂肪细胞因子chemerin表达的影响
2015-12-21朱乾坤何桂珍李海龙
朱乾坤,何桂珍,李海龙
中国医学科学院 北京协和医学院 北京协和医院肠外肠内营养科,北京100730
肠道缺血再灌注对小鼠体内脂肪细胞因子chemerin表达的影响
朱乾坤,何桂珍,李海龙
中国医学科学院 北京协和医学院 北京协和医院肠外肠内营养科,北京100730
目的 探讨小鼠肠道缺血再灌注损伤对体内组织器官脂肪细胞因子chemerin的影响。方法 无特定病原体级C57BL/6J小鼠16只,体质量(25±2)g,适应性饲养5 d后,按照随机数字表尾数法分为肠道缺血再灌注组和假手术组,每组8只。肠道缺血再灌注组夹闭小鼠肠系膜上动脉60 min,然后再灌注60 min造成肠道损伤,假手术组只开腹不夹闭120 min。实验结束后,处死动物取材检测。应用酶联免疫吸附实验方法测定各组织器官chemerin的浓度变化,用Western blot方法检测chemerin蛋白表达。结果 酶联免疫吸附实验结果显示肠道缺血再灌注损伤后小鼠体内各组织器官chemerin浓度显著增加(P<0.05),Western blot结果显示chemerin蛋白表达显著增加(P<0.05)。结论 肠道缺血再灌注损伤时小鼠各器官组织的脂肪细胞因子chemerin浓度和蛋白表达显著增加。
肠道缺血再灌注;chemerin;脂肪因子;炎症;氧化损伤
Acta Acad Med Sin,2015,37(4):440-445
chemerin是近几年新发现的脂肪细胞因子,主要由脂肪细胞分泌,表达于白色脂肪组织、肝脏和肺脏等多种器官和组织[1]。chemerin基因定位于7q36.1,蛋白的相对分子质量为16 000[2]。chemerin以前体-chemerin的形式分泌,被丝氨酸蛋白酶激活后,成为具有生物活性的chemerin[3]。chemerin参与多种病理生理过程。最近研究表明chemerin与炎症反应[4]和氧化损伤[5]密切相关。肠道缺血再灌注(ischemiareperfusion,I/R)损伤是指当肠道缺血一段时间,血流重新恢复后,细胞结构破坏和功能代谢障碍反而较缺血时进一步加重,器官功能进一步恶化的临床综合征[6]。缺血再灌注过程中,内皮细胞被激活,导致活性氧簇增加,激活的补体系统和相关危险信号分子能引发无菌性炎症,循环中各种炎性介质增多,损伤细胞和组织[7]。由于无菌性炎症和氧化损伤可以加重I/R,且chemerin与炎症反应和氧化损伤相关,因此,笔者推测I/R可能影响体内chemerin的表达。但是目前缺乏关于chemerin和肠道缺血再灌注的相关研究,因此,本研究应用小鼠肠道缺血再灌注模型探讨肠道损伤时体内各脏器chemerin的变化。
材料和方法
材料 C57BL/6J小鼠购于北京维通利华实验动物技术有限公司;酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉优尔生科技股份有限公司;chemerin多克隆抗体(ab103153)、β-actin抗体(ab179467)和IgG二抗(ab97160)均购自美国 Abcam公司;聚偏氟乙稀(polyvinylidene fluoride,PVDF)膜购自Amersham Biosciences公司。
肠道缺血再灌注 健康雄性无特定病原体(specific pathogen free,SPF)级C57BL/6J小鼠16只,体质量(25±2)g,饲养于北京协和医院动物中心,自由进食和饮水,12 h光/黑循环,适应性饲养5 d后,小鼠按照随机数字表尾数法分为肠道I/R组和假手术组,每组8只。具体过程如下:所有小鼠术前12 h禁食,4 h禁饮,手术当天,小鼠腹腔注射戊巴比妥钠溶液(60 mg/kg)麻醉后,将小鼠固定于操作台,用碘伏和70%酒精消毒两遍,沿着腹腔正中线做一长约2 cm的直线切口,依次剪开皮肤和肌肉各层,沿腹主动脉前壁找到肠系膜上动脉,钝性分离肠系膜上动脉,用小血管夹钳闭动脉,造成肠道缺血。夹闭后,观察到肠系膜根部血管搏动消失,肠壁苍白,肠道蠕动减弱,管壁塌陷,证明缺血造模成功。缺血60 min后,松解小血管夹,再灌注60 min。整个手术过程中每隔15 min对腹腔内滴注0.1 ml 0.9%生理盐水维持湿润。假手术组除了不夹闭外,其他实验过程与肠道I/R组相同。所有手术过程均在无菌条件下进行。所有小鼠实验结束后自心脏穿刺取血,3000×g离心10 min后取上层血清,液氮冷冻,转移至-80℃保存。小鼠被处死后,其他组织包括脑、心、肺、肝、回肠、空肠、肾脏和内脏脂肪,分别存贮于-80℃冰箱。
酶联免疫吸附实验法检测chemerin浓度 取适量组织块,于预冷磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.0~7.2)中清洗去除血液后,移入玻璃匀浆器,加入5~10 ml预冷PBS充分研磨,研磨过程在冰上进行。匀浆液研磨充分后于5000×g离心5 min,留取上清液。分别设标准孔、待测样品孔、空白孔。设标准孔7孔,依次加入100 μl不同浓度的标准品。空白孔加100 μl,余孔加待测样品100 μl或者血清20 μl,酶标板加上覆膜,37℃温育2 h。弃去液体,甩干。每孔加检测溶液A工作液100 μl,酶标板加上覆膜,37℃温育1 h。弃去孔内液体,每孔用350 μl的洗涤液洗涤,浸泡1~2 min,吸去酶标板内的液体,在实验台上铺垫几层吸水纸,酶标板朝下,轻拍将孔内液体拍干,重复洗板3次。最后一次洗涤后,把孔内的洗涤液完全甩干。每孔加检测溶液B工作液100 μl,加上覆膜,37℃温育30 min。弃去孔内液体,甩干,洗板5次,每孔加底物溶液90 μl,酶标板加上覆膜,37℃避光显色,每孔加终止溶液50 μl,终止反应,确保酶标板底无水滴及孔内无气泡,立即用酶标仪在450 nm波长测量各孔的光密度(optical density,OD)值。各标准品及样本OD值扣除空白孔OD值后作图,复孔取其平均值计算。以标准品的浓度为纵坐标,OD值为横坐标,绘出标准曲线,根据样品OD值,由标准曲线查出相应的浓度,乘以稀释倍数,算出样品的实际浓度。
Western blot法检测chemerin的表达 将组织置于1~2 ml匀浆器中,用剪刀将组织尽量剪碎。加入100 μl裂解液于匀浆器中,裂解30 min后,将裂解液移至1.5 ml离心管中,在4℃ 10 800×g离心5 min。取上清液。将蛋白样品与上样缓冲液混合后放入沸水浴中10 min。配置上层浓缩胶和下层分离胶。将配好的凝胶取出,放入电泳槽,加入10×电泳液。按照一定顺序将组织样品加入凝胶孔中。每个孔上样50 μg。电压 80 V,恒压模式电泳 15 min,待到标记物(marker)浓缩成一条均匀直线后,将电压调到恒压140 V,观察标记物(marker),直至条带电泳到分离胶底部。取出凝胶,将上层浓缩胶切去扔掉,留下下层分离胶。将PVDF膜裁成合适大小进行转膜后,取出PVDF膜,做好正反标记,找到标记物(marker)所在位置,根据目标蛋白相对分子质量大小,剪下目标蛋白附近的膜。用Tris-盐酸缓冲盐溶液洗膜3次,放在5%脱脂牛奶中封闭膜。1∶1000的一抗孵育过夜,然后Tris-盐酸缓冲盐溶液洗3次,每次5 min。孵育二抗,40 min,室温摇床,然后Tris-盐酸缓冲盐溶液洗3次,每次5 min。曝光:配置反应液,均匀滴在整个PVDF膜上,覆盖到全部膜,放入曝光机,电脑操作,曝光。
统计学处理 所有数据采用SPSS 19.0统计软件分析,连续性变量以均数±标准差描述。对于符合正态分布且方差齐性的计量资料,采用独立样本t检验。P<0.05为差异有统计学意义。
结果
正常小鼠各脏器chemerin的表达 在各个器官表达分布中,内脏脂肪、肾脏和肝脏表达相对较高,回肠和空肠表达较低(图1)。
肠道I/R对各脏器chemerin蛋白表达的影响 肠道I/R损伤后,各组织器官chemerin浓度与假手术组比较,均显著增高(P<0.05)(图2)。Western blot检测I/R和假手术组之间chemerin的蛋白表达结果显示,I/R后肺脏、肝脏、肾脏、回肠、空肠、内脏脂肪的chemerin表达较对照组显著升高(P<0.05)(图3)。
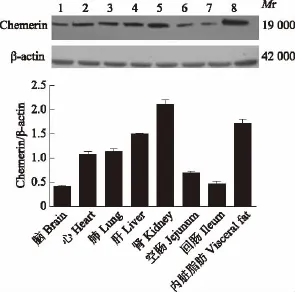
图1 chemerin在正常小鼠各脏器的表达分布Fig 1 Expression of chemerin in normal mice
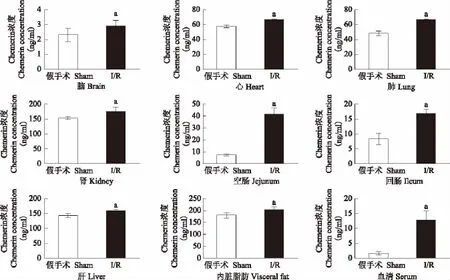
图2 酶联免疫吸附实验检测I/R对各脏器chemerin浓度的影响Fig 2 Changes of chemerin in various tissues and serum after intestinal I/R,which were determined by enzyme-linked immunosorbent assay
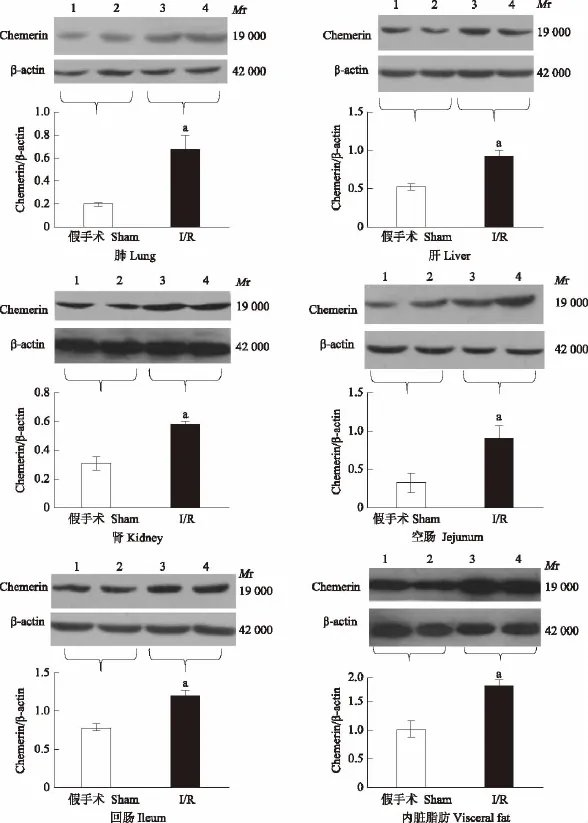
图3 Western blot检测各脏器chemerin蛋白表达Fig 3 Changes of chemerin expression in different tissues after I/R,protein expression was measured by Western blot
讨论
chemerin是新发现的脂肪细胞因子,其生理作用主要通过与趋化因子样受体1(chemeokine like receptor 1,CMKLR1)结合而实现[8]。chemerin与CMKLR1结合后,通过趋化Gi/o亚型G蛋白,抑制环腺苷酸和丝裂原活化蛋白激酶细胞外调节蛋白激酶1信号通路,激活钙通道,钙离子内流增加[9]。有研究表明chemerin在类风湿关节炎的患者中,chemerin水平高于正常[10]。在牛皮癣、动脉粥样硬化、多发性硬化等慢性疾病中,血清或炎症病灶中的chemerin和其受体水平也升高[11-13],表明 chemerin具有致炎作用。chemerin致炎作用的机制可能与 chemerin趋化chemR23受体的抗原提成细胞(树突状细胞和巨噬细胞)向炎症部位迁移有关[14]。然而,另有研究表明chemerin可能具有抗炎作用。Cash等[14]在小鼠腹腔内注射重组chemerin,发现注射后由酵母聚糖诱发的腹膜炎减轻,中性粒细胞聚集增加70%,提示chemerin对于腹膜炎具有保护作用。Luangsay等[15]的研究表明,chemerin可以减少由脂多糖诱导产生的炎性介质肿瘤坏死因子-α、白介素-6的数量,炎症部位的嗜中性粒细胞浸润减少,提示 chemerin的抗炎作用。chemerin在炎症反应中的双向作用可能是因为酶切位置的不同[16],巨噬细胞分泌的半胱氨酸蛋白酶产生的chemerin具有抗炎作用,中性粒细胞分泌的丝氨酸蛋白酶产生的chemerin具有致炎作用。除了与炎症密切相关外,chemerin还与氧化损伤有关。Fulop等[5]的研究表明,非糖尿病肥胖患者的血清中chemerin与氧化性低密度脂蛋白呈正相关,chemerin与抗氧化物质对氧磷酶1-芳基酯酶呈负相关,表明chemerin参与介导氧化损伤。Shen等[17]用chemerin干预人主动脉内皮细胞,结果细胞内线粒体活性氧簇增加,同时用短发夹核糖核酸沉默chemerin受体后,线粒体活性氧簇减少,表明 chemerin增加细胞内氧化性物质产生。Chemerin在炎症中的双向作用目前已成为临床研究者关注的热点。
本研究应用小鼠肠道I/R模型,观察肠道I/R损伤对chemerin的影响。目前认为,I/R损伤的机制为无菌性炎症反应和氧化损伤。本研究结果显示,chemerin在正常小鼠体内各组织中均有表达,其中内脏脂肪、肾脏、肝脏等组织器官表达较高,在空肠和回肠中表达相对较低,表明chemerin的组织器官特异性。在肠道I/R以后,小鼠体内各组织器官chemerin的浓度均显著升高,表明chemerin在肠道I/R时具有促进炎症的作用,而不是抗炎作用。其中在肠道I/R组的chemerin均值与假手术组的chemerin均值的差值中,空肠组织的差值是最大的,这可能是由于肠道I/R阻断的是肠系膜上动脉的血流,而肠系膜上动脉主要供应空肠和回肠的血流,因此空肠和回肠部分的炎症反应和氧化损伤最强烈,而其他器官的炎症反应和氧化损伤是继发于肠道的。由于ELISA敏感性较高,特异性没有Western blot强,本研究部分组织的Western blot结果显示chemerin的表达结果与ELISA趋势一致,即I/R组的chemerin表达较假手术组显著升高。将各器官的I/R组与假手术组的chemerin平均值做差值,发现空肠组织的差值最大,这也进一步验证了ELISA的结果。脂肪组织Western blot条带颜色整体最深,原因是chemerin在脂肪组织高表达。
综上,本研究结果显示,肠道I/R损伤时小鼠各组织器官的chemerin水平升高。一方面可能是肠道I/R时激活体内的炎症反应,使chemerin增加,趋化巨噬细胞等向炎症灶迁移;另一方面可能是由于肠道I/R引发的氧化损伤需要通过chemerin来介导。其具体机制有待进一步深入研究。
[1]Goralski KB,Mccarthy TC,Hanniman EA,et al.Chemerin,a novel adipokine that regulates adipogenesis and adipocyte metabolism[J].J Biol Chem,2007,282(38):28175-28188.
[2]Fatima SS,Rehman R,Baig M,et al.New roles of the multidimensional adipokine:chemerin[J].Peptides,2014,62:15-20.
[3]Roman AA,Parlee SD,Sinal CJ.Chemerin:a potential endocrine link between obesity and type 2 diabetes[J].Endocrine,2012,42(2):243-251.
[4]Mariani F,Roncucci L.Chemerin/chemR23axis in inflammation onset and resolution[J].Inflamm Res,2015,64(2):85-95.
[5]Fulop P,Seres I,Lorincz H,et al.Association of chemerin with oxidative stress,inflammation and classical adipokines in non-diabetic obese patients[J].J Cell Mol Med,2014,18(7):1313-1320.
[6]Gregova K,Cikos S,Bilecova-Rabajdova M,et al.Intestinal ischemia-reperfusion injury mediates expression of inflammatory cytokines in rats[J].Gen Physiol Biophys,2015,34(1): 95-99.
[7]Cerqueira NF,Hussni CA,Yoshida WB.Pathophysiology of mesenteric ischemia/reperfusion:a review[J].Acta Cir Bras,2005,20(4):336-343.
[8]Rourke JL,Muruganandan S,Dranse HJ,et al.Gpr1 is an active chemerin receptor influencing glucose homeostasis in obese mice[J].J Endocrinol,2014,222(2):201-215.
[9]Mattern A,Zellmann T,Beck-Sickinger AG.Processing,signaling,and physiological function of chemerin[J].IUBMB Life,2014,66(1):19-26.
[10]Chen X,Lu J,Bao J,et al.Adiponectin:a biomarker for rheumatoid arthritis?[J].Cytokine Growth Factor Rev,2013,24(1):83-89.
[11]Nakajima H,Nakajima K,Nagano Y,et al.Circulating level of chemerin is upregulated in psoriasis[J].J Dermatol Sci,2010,60(1):45-47.
[12]Xiaotao L,Xiaoxia Z,Yue X,et al.Serum chemerin levels are associated with the presence and extent of coronary artery disease[J].Coron Artery Dis,2012,23(6):412-416.
[13]Tomalka-Kochanowska J,Baranowska B,Wolinska-Witort E,et al.Plasma chemerin levels in patients with multiple sclerosis[J].Neuro Endocrinol Lett,2014,35(3): 218-223.
[14]Cash JL,Hart R,Russ A,et al.Synthetic chemerinderived peptides suppress inflammation through ChemR23 [J].J Exp Med,2008,205(4):767-775.
[15]Luangsay S,Wittamer V,Bondue B,et al.Mouse ChemR23 is expressed in dendritic cell subsets and macrophages,and mediates an anti-inflammatory activity of chemerin in a lung disease model[J].J Immunol,2009,183(10):6489-6499.
[16]Yoshimura T,Oppenheim JJ.Chemerin reveals its chimeric nature[J].J Exp Med,2008,205(10):2187-2190.
[17]Shen W,Tian C,Chen H,et al.Oxidative stress mediates chemerin-induced autophagy in endothelial cells[J].Free Radic Biol Med,2013,55:73-82.
Effect of Intestinal Ischemia-reperfusion Injury on the Expression of Chemerin in Mice
ZHU Qian-kun,HE Gui-zhen,LI Hai-long
Department of Parenteral and Enteral Nutrition,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
Objective To investigate the effect of intestinal ischemia-reperfusion on the protein expression of chemerin in C57BL/6J mice.Methods A total of 16 mice(C57BL/6J,specific pathogen free level)were randomly assigned into two groups(n=8 each):the intestinal ischemia-reperfusion group and the sham group.The intestinal ischemia-reperfusion state was achieved by blocking the super-mesenteric artery.After 60 minutes of ischemia followed by 60 minutes of reperfusion,we determined the protein level of chemerin in various organs and tissues by enzyme-linked immunosorbent assay and Western blot.The sham group underwent the same operation process except for the blocking of the super-mesenteric artery.Result The protein level of chemerin was significantly elevated in distinctive organs and tissues in the state of intestinal ischemia-reperfusion(P<0.05).Conclusion The intestinal ischemia-reperfusion can remarkably increase the protein expression of chemerin in some organs and tissues.
intestinal ischemia-reperfusion;chemerin;adipocytokine;inflammation;oxidative damage
HE Gui-zhen Tel:010-69154096,E-mail:hgzpumc@126.com
R656.7
A
1000-503X(2015)04-0440-06
10.3881/j.issn.1000-503X.2015.04.013
2015-02-09)
何桂珍 电话:010-69154096,电子邮件:hgzpumc@126.com
国家自然科学基金(30940069)Supported by the National Natural Sciences Foundation of China(30940069)
