老年SD大鼠脑组织间液内MR示踪剂扩散特征的研究
2015-12-21王帅文WANGShuaiwen
王帅文 WANG Shuaiwen
石春彦2 SHI Chunyan
左 龙2 ZUO Long
韩鸿宾2 HAN Hongbin
郭顺林1 GUOShunlin
雷军强1 LEI Junqiang
老年SD大鼠脑组织间液内MR示踪剂扩散特征的研究
王帅文1WANG Shuaiwen
石春彦2SHI Chunyan
左 龙2ZUO Long
韩鸿宾2HAN Hongbin
郭顺林1GUOShunlin
雷军强1LEI Junqiang
作者单位
1. 兰州大学第一医院放射科 甘肃兰州730000
2.北京大学第三医院放射科 北京 100191
目的 随着脑组织衰老的进展,神经细胞代谢及分泌产物在脑细胞外间隙(ECS)转运及引流特性发生不可逆性改变,本研究通过MR示踪剂在ECS内扩散的特征反映老年SD大鼠脑组织间液流动的改变,并通过软件计算将其量化。材料与方法 分别选择实验组老年SD大鼠(15~17个月)8只及对照组正常成年SD大鼠(7~10个月)15只,尾状核注射MR示踪剂钆喷酸葡胺,分别于0.25 h、0.5 h、1 h、2 h、3 h、4 h进行MRI扫描,观察造影剂在尾状核的动态分布,并测量造影剂的扩散及清除速率。结果 实验组SD大鼠的示踪剂在ECS内的扩散率D*为(3.25±0.46)×10-4mm2/s,与对照组的(3.32±0.70)×10-4mm2/s比较,差异无统计学意义(t=1.739,P>0.05);但实验组尾状核区的示踪剂清除速率k'为(0.29±0.08)×10-4/s,较对照组的(0.62±0.12)×10-4/s明显减低,差异有统计学意义(t=11.602,P<0.05)。结论SD大鼠脑衰老组织的退行性改变引起ECS结构等变化,使脑组织间液清除减慢,这可能与代谢产物蓄积并最终诱发多种老年性疾病有密切的关系。
磁共振成像;脑细胞外隙;组织间液;造影剂;代谢清除率;衰老;模型,动物;大鼠,Sprague-Dawley
脑细胞外间隙(extracellular space,ECS)是存在于脑间质内、细胞膜之间相互连通、结构极不规则的狭窄空隙,又称为组织通道[1],ECS内流动的组织间液(interstitial fluid,ISF)由特异的、通透性低的毛细血管限制性地滤过和分泌形成,其内含有细胞代谢及信号传递的各种物质,是维持细胞内环境的重要组成部分。而ECS作为ISF的容纳空间,其形成及变化贯穿于整个脑细胞的发育及衰老退变过程。既往研究发现,生后10 d鼠皮层的ECS占脑实质体积的41%,这一比例随着发育成熟而下降,成年时为22%[2],这与神经细胞发育成熟及神经纤维髓鞘形成密切相关;而随着脑组织的衰老,引起神经系统损害的危险因素也逐渐增多,神经细胞数量逐渐减少、神经纤维髓鞘脱失均会引起ECS结构改变,使ECS体积缩小,但ECS的纡曲度变化不大或仅有较小幅度的下降[3]。本研究通过MRI扫描观察示踪剂在正常成年及老年SD鼠大脑尾状核区的扩散现象,比较两个年龄组大鼠脑的清除能力,反映老年脑内组织间液的代谢特征,并为衰老脑内代谢物堆积引起的神经损害提供间接的影像学依据。
1 材料与方法
1.1 实验动物 实验用SD大鼠均购自北京维通利华实验动物技术有限公司,并由北京大学医学部动物部饲养、管理(动物合格证编号:SCXK[jing]2011-0012)。实验组选择月龄15~17个月的老年SD大鼠8只,体重300~320 g;对照组选择月龄7~10个月的正常成年SD大鼠15只,体重260~280 g。本实验方案经北京大学医学部伦理委员会批准。
1.2 实验方法 分别对实验组及对照组SD大鼠进行编号,并经腹腔注射复合麻醉剂3 ml/kg麻醉,后每隔1 h视大鼠状态适量追加麻醉剂0.1~0.3 ml。先对大鼠行MRI预扫描:采用Siemens Magnetom Trio 3.0T超导MRI扫描仪,采用腕线圈采集大鼠颅脑快速采集磁化准备梯度回波序列(MP-RAGE)T1加权图像,扫描参数:TR 1500 ms,TE 3.7 ms,翻转角9°,TI 900 ms,视野267 mm,矩阵512×512,分辨率0.5 mm ×0.5 mm×0.5 mm,获取每只大鼠的T1WI图像。然后将大鼠固定于鼠脑立体定位仪(美国Stoelting公司),切开大鼠头皮,分离骨膜,暴露前囟,依照《大鼠脑立体定位图谱》[4]定位尾状核,颅骨钻孔,缓慢进针,将钆喷酸葡胺(Gd-DTPA,10 mmol/L)水溶液2 μl以0.4 μl/min经微量注射泵(瑞士Hamilton)缓慢匀速泵入,注射完毕后再次行MRI扫描,扫描参数同前,于第0.25 h、0.5 h、1 h、2 h、3 h、4 h连续观察示踪剂的扩散特征。扫描结束后处死大鼠,并取鼠脑浸泡于4%多聚甲醛溶液固定后制作HE染色病理切片,观察局部脑组织结构。
1.3 图像分析 由1名有MRI诊断经验的副主任医师和1名主任医师对影像质量作出评价,用MATLAB平台下实验室自主开发的软件测量扩散参数,参数计算公式根据示踪剂扩散的偏微方程推导、拟合得出[5];针道周围脑组织由于受创伤影响故分别测量距离注射中心点1~3 mm范围内的左、右侧(x轴方向)、头、尾侧(z轴方向)及腹侧(y轴方向)示踪剂扩散速率D*及清除速率k',计算平均值;并测量各观察时间点SD大鼠尾状核区示踪剂分布体积,再由MATLAB拟合计算出对照组及实验组示踪剂Gd-DTPA尾状核注射后在大鼠脑内的清除半衰期(half life,t½)。
1.4 统计学方法 采用SPSS 18.0软件,组间计量资料比较采用配对样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 示踪剂扩散及清除情况 分别于第0.25 h、0.5 h、 1 h、2 h、3 h、4 h连续观察示踪剂的扩散特征(图1)发现,示踪剂在实验组SD大鼠尾状核的被清除速度明显低于对照组。实验组与对照组尾状核示踪剂扩散速率D*比较,差异无统计学意义(t=1.739,P>0.05);而实验组尾状核区的示踪剂清除速率k'小于对照组、示踪剂清除半衰期t½较对照组延长,差异有统计学意义(t=11.602,P<0.05),见表1。
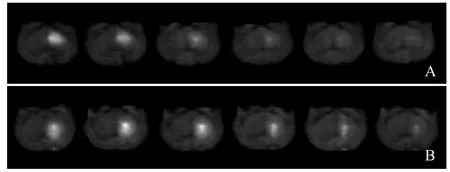
图1 对照组(A)与实验组(B)SD大鼠尾状核区不同时间点扩散分布。由左向右依次为0.25 h、0.5 h、1 h、2 h、3 h、4 h,注射示踪剂0.25 h及以后各时间点示踪剂的信号强度逐渐减弱,表明示踪剂在ISF内随观察时间延长逐渐被清除,在扫描记录开始后各时间点内,实验组SD大鼠尾状核内示踪剂的清除速度均小于对照组

表1 实验组与对照组SD大鼠大脑尾状核区示踪剂平均扩散速率D*、清除速率k'及t½比较
2.2 两组大鼠尾状核区示踪剂各时间点扩散分布体积比较 测量0.25 h、0.5 h、1 h、2 h、3 h、4 h实验组与对照组SD大鼠尾状核示踪剂分布的像素加权体积变化(图2),可见注射造影剂后由第1个扫描时间点测量开始,随着时间的延长,两组SD大鼠的加权像素体积呈下降、减小趋势,对照组SD大鼠的示踪剂清除速率明显高于实验组SD大鼠,根据各时间点拟合曲线得出实验组示踪剂清除半衰期时间较对照组延长。
2.3 病理结果 两组行HE染色观察神经细胞及神经纤维数量的变化,可见实验组与对照组在相同倍数、近似脑切片层面的视野内毛细血管数量减少,并在高倍镜视野下观察到血管壁结构的变化(图3)。
3 讨论
脑ECS是神经细胞与血液之间最重要的物质交换通道。正常脑组织中ECS的平均容积分数超过20%[6],远高于脑微血管占全脑容积的比例(<3%);ISF在脑间质内的流动同样受到ECS形态改变的影响,在病理情况下,如神经细胞水肿、细胞密度增加,均可以引起ECS结构异常,使空间内纡曲度增加,造成ISF在脑间质内的流动速率下降[7-8],从而导致清除速率减慢。本实验研究测得两组大鼠尾状核示踪剂扩散速率D*并无明显差异,这可能是由于神经细胞退行性变导致的ISF流动改变尚不能引起其内水分子的扩散速度异常,但老年SD大鼠的ISF清除速率较成年SD大鼠明显下降,而示踪剂Gd-DTPA几乎不被细胞吸收,并且能够缩短周围水分子的T1WI弛豫时间,因此提示ISF在清除示踪剂的过程中,间接反映出示踪剂所在ISF的流动及代谢特征,老年组由于ECS的异常改变导致示踪剂清除速率下降。
在生理条件下,Zador等[9]的微纤维荧光光学研究发现,在不同脑区各ECS内的ISF流速也不同,故本实验将示踪剂注射及测量位点定位于同一区域,避免因生理状态下不同脑区内ISF流速不同导致的测量误差。在病理情况下,局部区域的ISF流速及内部所含物质也会由于ECS结构的改变而出现明显的变化,多种老年性神经系统疾病均因ISF清除率降低导致脑组织内神经毒性蛋白增多所致,如阿尔茨海默病、帕金森病[10]等;在上述研究对ISF来源的分析假说来看,ISF的循环一方面通过血管旁途径与脑脊液相互沟通,另一方面通过白质束进入蛛网膜下腔,最后经脑静脉吸收回流入血;Weller等[11]的研究证实了血管周围间隙作为示踪剂的分布通路具有一定的方向性。Geer等[12]通过向大鼠脑实质内注射相对大剂量(20 μl)含示踪剂的人工脑脊液,发现两种示踪剂在脑内的运动均具有各向异性,沿白质纤维束方向运动距离更远,而这两种不同分子量的示踪剂分布范围相同。上述研究表明,血管周围间隙和神经轴索是脑内分子运动的优势通路。而ISF经血管旁途径循环的动力又是来自于血管的搏动[13],但从血管的几何形态、机械动能、纤维弹性的观察均显示人类脑血管的功能减退与衰老相关,血管壁变薄、弹性蛋白减少导致血管搏动力下降及微血管数量减少,萎缩的盘状血管比例增多,血管曲度增加,基底膜增厚,外膜细胞坏变和管腔扭曲等,均导致ISF与脑脊液间循环速度减慢[14-15],这种循环过程并不是单一的依靠水分子扩散作用实现的,而是通过液体流动(bulk flow)作用完成的,本实验中对大鼠脑切片进行HE染色后发现,所观察到的神经细胞数量未见明显变化,但实验组神经纤维较对照组稀疏,视野内毛细血管数量减少,血管壁变薄,细节结构显示明显低于对照组,这与以往研究观察得出的血管退变造成ISF流速下降的结果一致,并且也可能是导致ISF清除速率下降的原因之一,而血管数量下降及血管壁异常改变又使得周围脑组织细胞变性、脱失及代谢异常[16-17]。Liu等[18]的研究中,穿刺同一阿尔茨海默病实验鼠小脑延髓区CSF发现Aβ明显升高。Aβ沉积一方面造成ISF所伴行的动脉血管和毛细血管受损,而受损的血管又会加剧代谢产物的沉积,导致ISF的清除下降[19]。

图2 实验组与对照组SD大鼠尾状核区示踪剂各时间点扩散分布体积变化
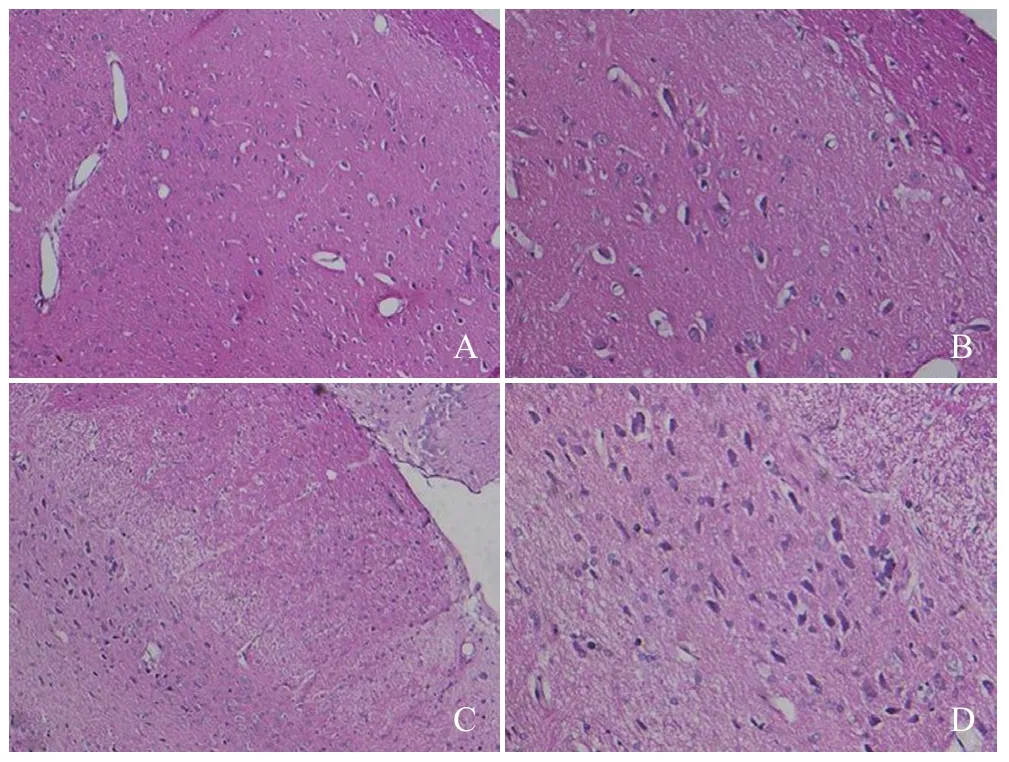
图3 对照组及实验组HE染色病理切片。A、B为对照组,C、D为实验组,两组HE染色观察神经细胞数量未见明显变化,但实验组神经纤维较对照组稀疏(D、B),视野内毛细血管数量减少,血管壁结构失常(A、C:×100;B、D:×200)
另外,ISF的清除还依赖于星形胶质细胞的水通道蛋白(AQP4)含量,极化的AQP4的表达主要分布在星形胶质细胞与血管壁周足的连接处,是血管旁通路水分子的转运蛋白。Iliff等[20]通过免疫荧光染色研究ISF经血管旁途径的流出通路发现,随着脑衰老的发展,血管周围组织表达的AQP4明显减少,使得ISF清除减慢,这与本实验观察并测量对比得出的结果一致,而滞留的ISF又会导致神经递质及神经毒性产物蓄积,引起一系列病理性改变。
本实验的不足之处在于未将幼年大鼠纳入设计,对整个脑发育过程的ISF流动特征把握不充分,以及对各组间血管结构的具体观察欠细致;此外,对星形胶质细胞内AQP4含量的检测也有待在后续研究中进一步观察并加以补充完善。
总之,ISF的清除是一个复杂的综合过程,在脑发育及衰老过程中受到多种因素的影响,老年脑组织由于神经、血管退化等多因素综合引起ISF代谢降低,本实验根据既往研究通过脑间质途径给药方法[5]观察老年SD大鼠脑与正常成年SD大鼠脑内MR示踪剂的扩散及清除特征,连续动态地记录、测量老年SD大鼠ISF内示踪剂的清除速率较成年组明显降低,并通过病理切片进一步发现老年SD大鼠发生血管数目及形态的异常改变,也与以往对血管退变影响ISF运转动力的研究结果相符。
[1] 田牛, 李玉珍, 刘凤英. 脑微循环的特点. 微循环学杂志, 1999, 9(3): 40-44.
[2] Lehmenkühler A, Syková E, Svoboda J, et al. Extracellular space parameters in the rat neocortex and subcortical white matter during postnatal development determined by diffusion analysis. Neuroscience, 1993, 55(2): 339-351.
[3] Syková E, Nicholson C. Diffusion in brain extracellular space. Physiol Rev, 2008, 88(4): 1277-1340.
[4] Paxinos G, Watson C. 大鼠脑立体定位图谱. 诸葛启钏, 译.第3版. 北京: 人民卫生出版社, 2005: 82-106.
[5] Han H, Li K, Yan J, et al. An in vivo study with MRI tracer method reveals biophysical properties of interstitial fluid in rat brain. Sci China Life Sci, 2012, 55(9): 782-787.
[6] Yao X, Hrabetová S, Nicholson C, et al. Aquaporin-4-deficient mice have increased extracellular space without tortuosity change. J Neurosci, 2008, 28(21): 5460-5464.
[7] Vargová L, Homola A, Zámecník J, et al. Diffusion parameters of the extracellular space in human gliomas. Glia, 2003, 42(1): 77-88.
[8] Vorísek I, Hájek M, Tintera J, et al. Water ADC, extracellular space volume, and tortuosity in the rat cortex after traumatic injury. Magn Reson Med, 2002, 48(6): 994-1003.
[9] Zador Z, Magzoub M, Jin S, et al. Microfiberoptic fluorescence photobleaching reveals size-dependent macromolecule diffusion in extracellular space deep in brain. FASEB J, 2008, 22(3): 870-879.
[10] 吴恺, 胡刚, 国泓, 等. Alzheimer病患者脑脊液β淀粉样蛋白的检测. 中华老年医学杂志, 1999, 18(1): 12-14.
[11] Weller RO, Galea I, Carare RO, et al. Pathophysiology of the lymphatic drainage of the central nervous system: Implications for pathogenesis and therapy of multiple sclerosis. Pathophysiology, 2010, 17(4): 295-306.
[12] Geer CP, Grossman SA. Interstitial fluid flow along white matter tracts: a potentially important mechanism for the dissemination of primary brain tumors. J Neurooncol, 1997, 32(3): 193-201.
[13] Hadaczek P, Yamashita Y, Mirek H, et al. The "perivascular pump" driven by arterial pulsation is a powerful mechanism for the distribution of therapeutic molecules within the brain. Mol Ther, 2006, 14(1): 69-78.
[14] Fonck E, Feigl GG, Fasel J, et al. Effect of aging on elastin functionality in human cerebral arteries. Stroke, 2009, 40(7): 2552-2556.
[15] de la Torre JC. Critical threshold cerebral hypoperfusion causes Alzheimer's disease? Acta Neuropathol, 1999, 98(1): 1-8.
[16] 张岚, 程敬亮. 血管性痴呆大鼠脑血流、行为学和形态学对比及磁共振灌注成像的应用价值. 中国医学影像学杂志, 2013, 21(7): 485-489.
[17] 安维民, 蔡幼铨, 邱本胜, 等. 磁共振波谱定量分析脑内代谢产物鉴别诊断早老痴呆和血管性痴呆. 中国医学影像学杂志, 2006, 14(1): 11-15.
[18] Liu L, Duff K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. J Vis Exp, 2008, (21): pii: 960.
[19] Arbel-Ornath M, Hudry E, Eikermann-Haerter K, et al. Interstitial fluid drainage is impaired in ischemic stroke and Alzheimer's disease mouse models. Acta Neuropathol, 2013, 126(3): 353-364.
[20] Iliff JJ, Wang M, Liao Y, et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Sci Transl Med, 2012, 4(147): 147ra111.
(本文编辑 张春辉)
MR Tracer Diffusion in Cerebral Interstitial Fluid of Elderly SD Rats
Purpose With the progression of brain tissue aging, the transport and drainage characteristics of metabolites and secretory products for neurons in extracellular space occurs irreversible change. This paper aims to investigate and quantify MR tracer diffusion characteristics in cerebral interstitial fluid of elderly SD rats. Materials and Methods MR contrast agent Gd-DTPA was injected into the caudate nucleus of two groups of rats including 8 in experimental group (15-17 month old) and 15 in control group (7-10 month old). MR scan was performed at 0.25 h, 0.5 h, 1 h, 2 h, 3 h and 4 h to observe the dynamic distribution in the caudate and measure the diffusion and clearance rate. Results There was no statistically significant difference in diffusion rate and D* between control group with (3.32±0.70)×10-4mm2/s and experimental group with (3.25±0.46)×10-4mm2/s (t=1.739, P>0.05). The clearance rate k' was significantly different between control group (0.62±0.12)×10-4/s and experimental group (0.29±0.08)×10-4/s (t=11.602, P<0.05). Conclusion The degeneration of aging brain tissue changes the composition of extracellular space resulting in decreased speed of ISF clearance. This may cause accumulation of metabolites which eventually triggers a variety of age-related diseases.
Magnetic resonance imaging; Extracellular space; Interstitial fluid; Contrast media; Metabolic clearance rate; Aging; Models, animal; Rats, Sprague-Dawley
10.3969/j.issn.1005-5185.2015.06.003
韩鸿宾
Department of Radiology, Peking University Third Hospital, Beijing 100191, China
Address Correspondence to: HAN Hongbin
E-mail: hanhongbin@bjmu.edu.cn
国家自然科学基金项目(81171080)。
R-33;R445.2
2015-02-06
修回日期:2015-05-10
中国医学影像学杂志
2015年 第23卷 第6期:409-412
Chinese Journal of Medical Imaging
2015 Volume 23(6): 409-412
