扩散加权成像信号与液体内蛋白质的相关性实验研究
2015-12-21LIKun
李 坤 LI Kun
李 威2 LI Wei
潘振宇1 PAN Zhenyu
伊慧明3 YI Huiming
陈英敏4 CHEN Yingmin
扩散加权成像信号与液体内蛋白质的相关性实验研究
李 坤1LI Kun
李 威2LI Wei
潘振宇1PAN Zhenyu
伊慧明3YI Huiming
陈英敏4CHEN Yingmin
作者单位
1. 首都医科大学附属北京朝阳医院京西院区放射科 北京 100043
2.天津医科大学总医院放射科 天津 300052
3. 中国医学科学院血液病医院放射科 天津300020
4. 河北省人民医院放射科 河北石家庄050057
目的 蛋白质是影响扩散加权成像(DWI)信号及表观扩散系数(ADC)值的主要因素,使囊液于DWI上呈高信号,ADC值降低,但在实际工作中并非完全如此,本研究拟深入了解蛋白质的类型、浓度对其的影响。材料与方法 通过在体外制作不同浓度的白蛋白溶液、球蛋白溶液及同浓度不同比例的白蛋白和球蛋白混合溶液体模,采用GE 1.5T超导型MRI成像系统,定量研究其对DWI信号和ADC值的影响。结果 ①ADC值与白蛋白及球蛋白溶液浓度呈线性负相关(37℃时,r白=-0.849,P白<0.05;r球=-0.843,P球<0.05;40℃时,r白=-0.894,P白<0.05;r球=-0.819,P球<0.05);DWI信号强度与白蛋白溶液的浓度呈线性正相关(37℃时,r=0.753,P<0.05;40℃时,r=0.845,P<0.05),而与球蛋白溶液的浓度无相关性(37℃时,r=-0.222,P>0.05;40℃,r=-0.270,P>0.05)。②相同浓度和温度下,白蛋白溶液DWI信号强度高于球蛋白溶液(t=3.96,P<0.001),ADC值差异无统计学意义(t=0.61,P>0.05)。结论 通过对囊液DWI及ADC值的定量分析,可以初步了解囊液的性质,从而为体内囊性病变的定性诊断提供理论依据。
蛋白质;磁共振成像;扩散加权成像;表观扩散系数;体外研究
扩散加权成像(DWI)对体内囊性病变具有较高的鉴别诊断价值,Carter等[1]及Zhang等[2]在分析不同类型的卵巢囊性病变时发现,囊液T2WI信号较低时,DWI呈高信号,表观扩散系数(ADC)值有明显下降趋势,因此推测囊液中蛋白质含量是影响DWI信号和ADC值的主要因素,并与ADC值呈明显负相关[3]。既往研究[4-6]报道脑脓肿时,因脓液中富含蛋白成分,DWI呈明显高信号,ADC值显著降低,其诊断敏感度及特异度均在90%以上[7];但也有文献报道个别脑脓肿的ADC值不仅不降低反而升高,或与正常脑质ADC值类似,DWI呈低信号或等信号[7];囊性转移瘤DWI呈高信号者亦有报道[8]。然而,目前对囊性病变的扩散特性及囊液性质对DWI及ADC值的影响尚缺少深入系统的研究和定量分析。本实验研究拟对蛋白质对DWI信号和ADC值的影响进行系统定量体外研究,以了解不同的蛋白质类型及浓度对其影响的内在规律,从而为探讨体内富含蛋白质的囊性病变的DWI信号特点及ADC值提供理论依据。
1 材料与方法
1.1 实验材料 95%电泳纯牛血清白蛋白(分子量66 000 Da)、γ-球蛋白(分子量84 000 Da)及适量蒸馏水;直径为3 cm的玻璃瓶10个;防震泡沫方形容器,大小约21 cm×19 cm×17 cm;电子天平(精确度0.001 g);GE 1.5T超导型MRI成像系统。
1.2 蛋白质溶液体模的制备 将蛋白质溶液分成3个组,每组以蒸馏水作为对照。A组:牛血清白蛋白溶液组,B组:牛血清γ-球蛋白溶液组,C组:混合蛋白质溶液组(白蛋白∶γ-球蛋白)。A组和B组蛋白质溶液的浓度分别为30~110 g/L,其中≥90 g/L为高浓度蛋白液,<90 g/L为低浓度蛋白液[9];C组混合蛋白质溶液的总浓度为60 g/L,白蛋白和γ-球蛋白按不同比例配置(表1),溶液体积均为20 ml。将上述标本在不同温度下置入MRI扫描仪内扫描。
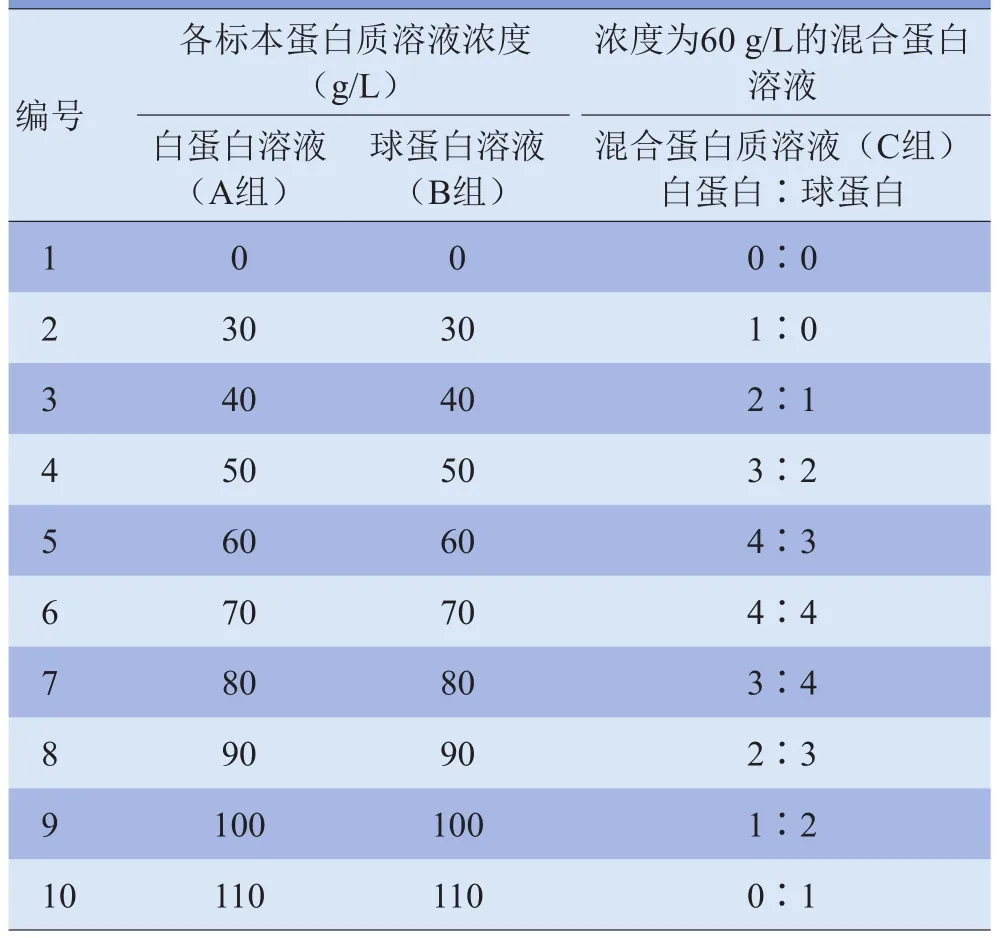
表1 实验体模各标本的蛋白质溶液浓度
1.3 DWI扫描 将标本溶液分两排放入盛有一定浓度氯化镍溶液的容器中,1为空白对照(蒸馏水),2~10蛋白质溶液浓度由30~110 g/L依次升高。按照标本的排列方向与进床方向垂直的方式在室温(20℃)下行DWI扫描。扫描参数:头标准线圈,横轴位,b=1000 mm2/s,层厚5.0 mm,间隔0 mm,视野24 cm×24 cm,矩阵128×128,激励次数4。将上述标本分别置于水浴箱内依次加热至37℃、40℃,分别行DWI扫描,扫描参数不变。
1.4 图像后处理 将所得图像采用AW 4.0分析软件中的Function 2.0软件包进行后处理。采用阈值定义去除周围背景的影响,在b=1000 mm2/s时,分别获取各标本的ADC图。为了减少磁敏感伪影的影响,将测量的感兴趣区置于ADC图和DWI图的中心位置,面积均为80 mm2,分别测量ADC值及DWI信号强度各3次,取平均值作为最终的ADC值和DWI信号强度。
1.5 统计学方法 采用SAS V9.0软件,不同蛋白质溶液的浓度与DWI信号强度和ADC值的关系采用Pearson相关分析,同温度和浓度的白蛋白与球蛋白溶液的DWI信号强度和ADC值比较采用配对资料t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 DWI信号强度、ADC值与白蛋白及球蛋白浓度的关系 在37℃和40℃时,DWI信号强度与白蛋白溶液浓度呈线性正相关(37℃时,r=0.753,P<0.05;40℃时,r=0.845,P<0.05);而与球蛋白溶液浓度无显著相关性(37℃时,r=-0.222,P>0.05;40℃,r=-0.270,P>0.05)。ADC值与白蛋白及球蛋白溶液浓度呈线性负相关(37℃时,r白=-0.849,P白<0.05,r球=-0.843,P球<0.05;40℃时,r白=-0.894,P白<0.05,r球=-0.819,P球<0.05),见表2、3及图1、2。
2.2 DWI信号强度、ADC值与不同比例白蛋白及球蛋白混合溶液的关系 在37℃和40℃时,ADC值与混合蛋白质溶液中白蛋白和球蛋白的比例无显著相关性(37℃时,r=0.116,P>0.05;40℃时,r=0.641,P>0.05)。37℃时,DWI信号强度与混合蛋白质溶液中白蛋白和球蛋白的比例呈线性正相关性(r=0.816,P<0.05);而40℃时,DWI信号强度与混合蛋白质溶液中白蛋白和球蛋白的比例无显著相关性(r=0.594,P>0.05),见表4及图3。
2.3 相同浓度和温度下白蛋白和球蛋白DWI信号强度和ADC值比较 相同浓度和温度下,白蛋白DWI信号强度高于球蛋白,差异有统计学意义(t=3.96,P<0.01),ADC值差异无统计学意义(t=0.61,P>0.05),见表5。
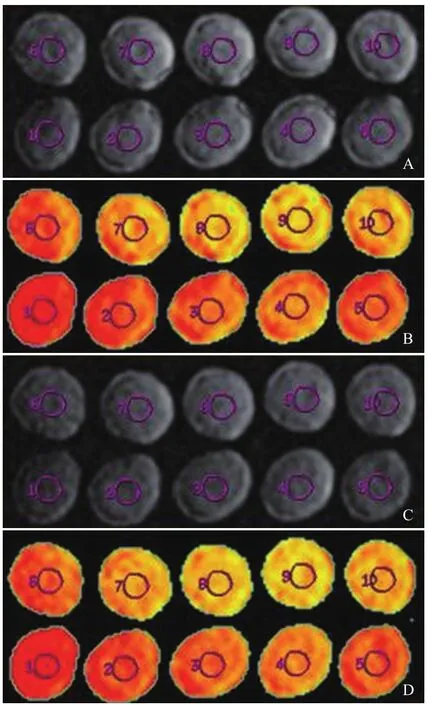
图1 不同浓度白蛋白溶液在37℃(A、B)和40℃(C、D)时的DWI图和ADC图。1为空白对照(蒸馏水),2~10为白蛋白溶液浓度由30~110 g/L依次升高,环形区域为选定的感兴趣区。肉眼观察,DWI信号差异不明显,ADC值逐渐降低(ADC图由红到蓝,ADC值依次减小)

图2 不同浓度球蛋白溶液在37℃(A、B)和40℃(C、D)时的DWI图和ADC图。1为空白对照(蒸馏水),2~10为球蛋白溶液浓度由30~110 g/L依次升高,环形区域为选定的感兴趣区。肉眼观察,DWI信号差异不明显,ADC值逐渐降低(ADC图由红到蓝,ADC值依次减小)

表2 在37℃和40℃时不同浓度白蛋白溶液的ADC值及DWI信号强度
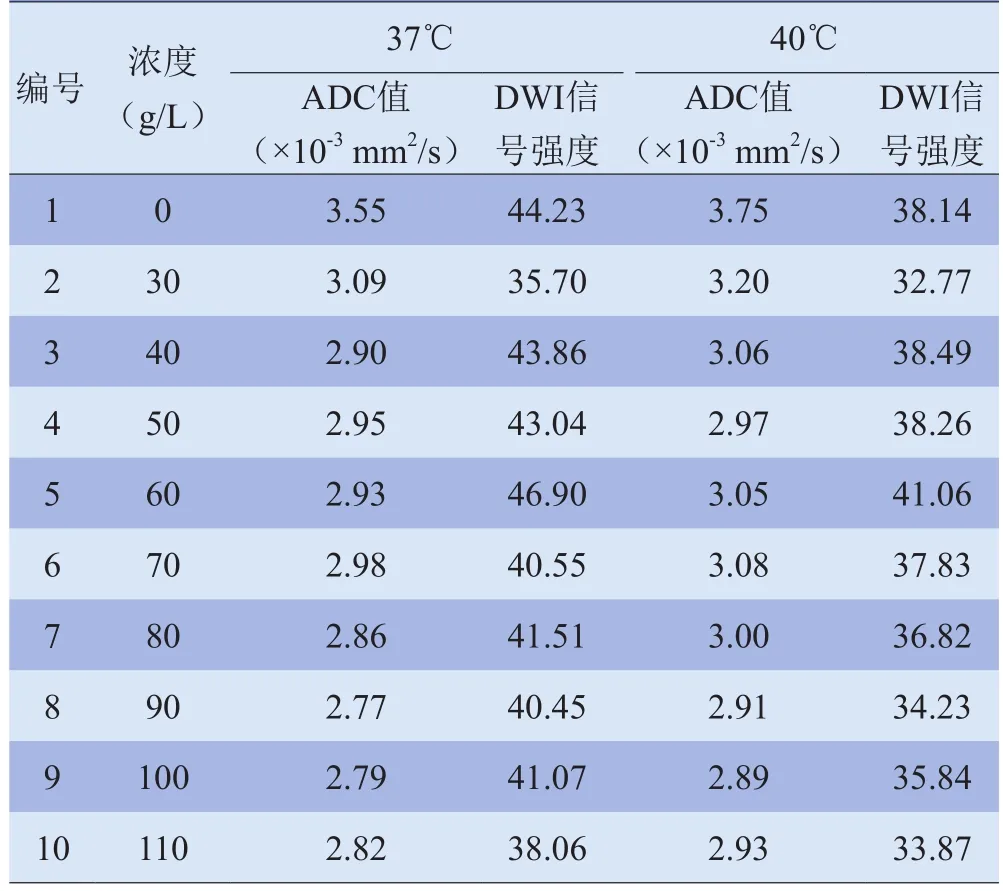
表3 在37℃和40℃时不同浓度球蛋白溶液的ADC值及DWI信号强度

表4 在37℃和40℃时同浓度不同比例白蛋白和球蛋白混合溶液的ADC值及DWI信号强度

表5 相同浓度和温度下白蛋白和球蛋白溶液的ADC值及DWI信号强度

图3 同浓度不同比例混合蛋白质溶液在37℃(A、B)和40℃(C、D)时的DWI图和ADC图。1为空白对照(蒸馏水),2~10为白蛋白/球蛋白的比值(1∶0~0∶1)依次降低,环形区域为选定的感兴趣区。肉眼观察,DWI信号差异不明显,ADC值无明显变化规律(ADC图由红到蓝,ADC值依次减小)
3 讨论
DWI是基于水分子微观运动成像的一种MRI技术,能从分子水平反映组织器官微观的病理学特点,对囊性病变具有较高的诊断价值。由于囊性病变内缺少正常的细胞结构及血供,其DWI信号强度差异主要是由于囊液理化性质不同所致。
蛋白质是影响DWI信号及ADC值的主要因素。对胶质瘤、血管母细胞瘤、颅咽管瘤等部分肿瘤性病变的囊液成分进行分析发现,其囊液成分与血浆相似,以白蛋白为主[10-11]。王存丰等[12]对未合并出血和感染的单纯性肾囊肿的囊液进行生化分析发现,其囊液成分类似于血浆。白蛋白由肝脏合成,主要存在于血浆中,常见于由于血浆渗出并局部聚集而形成的囊性病变,如晚期肝硬化及肾病综合征引起的浆膜腔积液、腹腔积液等。
球蛋白是当人体受到细菌、病毒或异种蛋白质等物质刺激后,由浆细胞产生的具有免疫功能的球状蛋白质,其含量反映自身免疫功能,正常情况下免疫球蛋白含量较低;但发生感染性病变、恶性肿瘤等引起的积液中免疫球蛋白含量较高。
本实验研究选择白蛋白和球蛋白为研究对象,结果表明,ADC值与蛋白质溶液浓度呈正相关,与既往文献报道一致,白蛋白和球蛋白随着溶液浓度的升高,其黏滞度均增加,均可使水分子的扩散运动受到限制,导致ADC值下降。此外,蛋白质分子表面的氨基、羧基、羟基等亲水基团与水分子结合,使水分子呈凝胶状态,自由水分子减少,也使ADC值下降。
本实验中对同浓度的两种溶液及同浓度不同比例的混合溶液的ADC值进行比较,结果显示ADC值无显著差异,即ADC值仅与蛋白质的总浓度有关,而与蛋白质的分子量及类型无关,其可能原因是尽管球蛋白分子量较大,但相同浓度下其分子数量较少,而且球蛋白的二级结构使其分子形态更接近于球形,其暴露在分子表面的亲水基团的数量相应地减少,结合水的能力较白蛋白弱,处于凝胶状态的水分子较少,因此,虽然白蛋白和球蛋白的分子量及分子构型不同,但是对水分子随机扩散运动的限制程度相似。
影响DWI信号强度的因素较多,凡是能够影响ADC值的因素均可以影响DWI信号强度,另外还受到b值及T2透射效应的影响。本实验中,蛋白质溶液标本均设置为b=1000 mm/s2,因此,各标本间DWI信号强度的差异排除了b值的影响。DWI信号强度与白蛋白溶液浓度呈线性正相关,而DWI信号强度与球蛋白溶液浓度无相关性,其原因可能与自身构型有关。Som等[13]在分析慢性鼻窦炎患者的分泌物及进行纯溶菌酶蛋白质体模实验时发现,蛋白质浓度增加会导致T1及T2弛豫时间缩短,而且蛋白质分子之间的相互作用会明显影响T1及T2弛豫时间,且对T2弛豫时间的影响比对T1弛豫时间的影响更明显,即T2弛豫时间更依赖于分子间的相互作用。球蛋白的二级结构使其分子形态更接近于球形,造成暴露在分子表面的基团数量较少,分子间的相互作用较弱,对T2弛豫时间缩短不明显,因此球蛋白溶液DWI信号强度主要受到T2透射效应的影响。本实验中,DWI信号强度与混合蛋白质溶液中白蛋白和球蛋白比值呈线性正相关(37℃时,r=0.816,P<0.05),但当温度为40℃时,DWI信号强度与混合蛋白质溶液中白蛋白和球蛋白比值无相关性,其原因可能为温度较高时,造成蛋白质分子构型发生改变,对DWI信号强度产生的影响发生变化;可能是由于本实验的测量误差所致,有待后续实验进一步证实。
本实验采用在体外制作不同蛋白质溶液体模的方法,系统定量地研究了白蛋白和球蛋白对DWI信号强度及ADC值影响的内在规律,从而为富含蛋白质的囊液性质的定性诊断提供理论依据。通过对囊液的ADC值及DWI信号强度进行定量分析,可以进一步了解囊液的性质,从而可以提高DWI对体内囊性病变的鉴别诊断能力。
然而,本实验仅就蛋白质单一因素对ADC值及DWI信号强度的影响进行了定量研究,体内囊性病变囊液成分复杂,且囊液的pH、渗透压、黏滞度等均可以对ADC值及DWI信号强度产生影响,而且部分因素互为因果,因此,今后需对影响ADC值及DWI信号强度的因素进行多因素分析,为囊性病变的定性诊断提供更准确的信息。
[1] Carter JS, Koopmeiners JS, Kuehn-Hajder JE, et al. Quantitative multiparametric MRI of ovarian cancer. J Magn Reson Imaging, 2013, 38(6): 1501-1509.
[2] Zhang P, Cui Y, Li W, et al. Diagnostic accuracy of diffusionweighted imaging with conventional MR imaging for differentiating complex solid and cystic ovarian tumors at 1.5T. World J Surg Oncol, 2012, 10: 237.
[3] Baysal T, Bulut T, Gökirmak M, et al. Diffusion-weighted MR imaging of pleural fluid: differentiation of transudative vs exudative pleural effusions. Eur Radiol, 2004, 14(5): 890-896.
[4] Moritani T, Kim J, Capizzano AA, et al. Pyogenic and nonpyogenic spinal infections: emphasis on diffusion-weighted imaging for the detection of abscesses and pus collections. Br J Radiol, 2014, 87(141): 20140011.
[5] Ohba S, Ushioda T, Nakagawa T, et al. Diffusion magnetic resonance imaging for enhanced visualization of malignant cerebral tumors and abscesses. Neurol India, 2011, 59(5): 674-678.
[6] Peeler C, Parmar H, Trobe JD. Subretinal abscess causing restricted diffusion on magnetic resonance imaging. J Neuroophthalmol, 2013, 33(4): 354-358.
[7] Chang SC, Lai P, Chen W, et al. Diffusion-weighted MRI features of brain abscess and cystic or necrotic brain tumors: comparison with conventional MRI. Clin Imaging, 2002, 26(4): 227-236.
[8] Tung GA, Evangelista P, Rogg JM, et al. Diffusion-weighted MR imaging of rim-enhancing brain masses: is markedly decreased water diffusion specific for brain abscess? Am J Roentgenol, 2001, 177(3): 709-712.
[9] Ahmadi J, Destian S, Apuzzo ML, et al. Cystic fluid in craniopharyngiomas: MR imaging and quantitative analysis. Radiology, 1992, 182(3): 783-785.
[10] Bader HL, Hsu T. Systemic VHL gene functions and the VHL disease. FEBS Lett, 2012, 586(11): 1562-1569.
[11] Crisi G, Filice S, Pertinhez TA, et al. In vivo and ex vivo magnetic resonance spectroscopy in the characterization of hemangioblastoma cyst fluid. J Comput Assist Tomogr, 2014, 38(1): 29-32.
[12] 王存丰, 楚天舒, 石洪林. 常染色体显性遗传性多囊肾治疗方法及营养保健. 中国保健营养(中旬刊), 2013, (5): 513-514.
[13] Som PM, Dillon WP, Fullerton GD, et al. Chronically obstructed sinonasal secretions: observations on T1 and T2 shortening. Radiology, 1989, 172(2): 515-520.
(本文编辑 张春辉)
Correlation Between Diffusion Weighted Imaging Parameters and Protein Content in Fluid: An Experimental Study
Purpose Protein is the main influencing factors for diffusion weighted imaging (DWI) signals and apparent diffusion coefficient (ADC), it results in hyperintensity on DWI and low ADC, but not fully matched in clinic. This paper aims to investigate the effect of protein type and concentration on the signal intensity (SI) and ADC of DWI. Materials and Methods Different concentrations of albumin, globulin solution and the mixed solution were created in vitro. DWI was performed on GE 1.5T superconducting nuclear MRI system. Results ①There was a linear negative correlation between the ADC value and the concentrations of protein solution (at 37℃, ra=-0.849, Pa<0.05; rg=-0.843, Pg<0.05; at 40℃, ra=-0.894, Pa<0.05; rg=-0.819, Pg<0.05); there was a linear positive correlation between the SI of DWI and the concentrations of the albumin solution (at 37℃, r=0.753, P<0.05; at 40℃, r=0.845, P<0.05). There was no correlation between the SI of DWI and the concentrations of the globulin solution (at 37℃, r=-0.222, P>0.05; at 40℃, r=-0.270, P>0.05). ②SI of the albumin solution was significantly higher than the globulin solution at the same concentration and temperature (t=3.96, P<0.001); the ADC values were not statistically different between the albumin and the globulin solution (t=0.61, P>0.05). Conclusion The nature of the cystic fluid can be understood preliminarily through quantitative analysis of the cystic fluid DWI and ADC values, so as to provide theoretical basis for the qualitative diagnosis of cystic lesions in vivo.
Protein; Magnetic resonance imaging; Diffusion weighted imaging; Apparent diffusion coefficient; In vitro
10.3969/j.issn.1005-5185.2015.06.004
李 坤
Department of Radiology, Beijing Chaoyang Hospital--the Jingxi Campus, the Affiliated College of Capital Medical University, Beijing 100043, China
Address Correspondence to: LI Kun
E-mail: likun19801001@sina.com
R445.2
2015-02-24
修回日期:2015-05-10
中国医学影像学杂志
2015年 第23卷 第6期:413-417,422
Chinese Journal of Medical Imaging
2015 Volume 23(6): 413-417, 422
