基于复杂网络的偏头痛患者脑功能连通性研究
2015-12-21陈敦耀CHENDunyao
陈敦耀 CHEN Dunyao
杨嘉君2 YANG Jiajun
曾卫明1 ZENG Weiming
徐艳红2 XU Yanhong
焦 磊3 JIAO Lei
王倪传1 WANG Nizhuan
基于复杂网络的偏头痛患者脑功能连通性研究
陈敦耀1CHEN Dunyao
杨嘉君2YANG Jiajun
曾卫明1ZENG Weiming
徐艳红2XU Yanhong
焦 磊3JIAO Lei
王倪传1WANG Nizhuan
作者单位
1. 上海海事大学信息工程学院 上海 201306
2. 上海交通大学附属第六人民医院神经内科上海 201306
3. 上海交通大学附属第六人民医院放射科上海 201306
目的 应用图理论构建静息态脑功能复杂网络,研究偏头痛患者与正常人之间的网络拓扑结构差异。资料与方法 获取22例偏头痛患者(研究组)和22例正常人(对照组)的静息态脑功能MRI数据,分别构建两组的脑功能复杂网络,计算和比较两组复杂网络的平均聚类系数、特征路径长度、小世界性、同配性、介数中心度等测度参数。结果 与对照组相比,研究组患者的静息态功能复杂网络的平均聚类系数较大,小世界性与同配性等拓扑测度发生改变,尾状核、豆状壳核等节点特征路径长度发生异常,部分区域(如丘脑、枕下回、枕中回)的介数中心度明显增大。结论 偏头痛患者静息态脑功能网络中发生异常的区域与大脑的疼痛处理、视觉处理以及感觉中继有关,本研究发现有助于更好地解释偏头痛的相关临床病症。
偏头痛;磁共振成像;静息态;图像处理,计算机辅助;脑功能网络
偏头痛是一种常见的反复发作的慢性神经综合征,常伴有恶心、呕吐、畏光、畏声等[1]。随着神经影像技术在偏头痛研究中的发展,人们对偏头痛的生理病理机制的认识已从最初的血管学说发展为神经血管学说,直至中央神经系统紊乱学说,并认为皮层扩散性抑制是先兆性偏头痛的重要病理生理机制[2-3]。偏头痛患者局部大脑皮层的结构和功能较正常人存在显著异常,这些区域包括前额皮层、前喙扣带皮层、眶额皮层以及脑岛等[4-9],而这些皮层在大脑中均参与疼痛处理,这说明偏头痛的产生与大脑疼痛处理机制的异常有关[9-11]。
作为一种新型的、非侵入式的测量神经元自发活动的方法,静息态功能MRI成像技术越来越受到关注。有学者采用局部一致性以及低频振幅比率等方法分析偏头痛患者的神经元自发性活动,发现偏头痛患者在左侧前喙扣带皮层、双侧前额叶和右丘脑等区域较正常人发生了改变[9,11-12]。近年来,将图论知识应用于功能MRI成像数据分析成为研究热点,研究人员通过定义人的大脑区域为节点、区域之间的功能连接为边,构建人脑网络[13-21]。用图论的方法研究发现许多神经疾病患者(如精神分裂症、阿尔茨海默病等)的大脑静息态脑功能网络的拓扑结构(如聚类系数、特征路径长度等)较正常人存在显著异常,这些异常可以作为辅助相关疾病诊断的生理病理标志[22-26]。本文基于图论构建偏头痛患者的大脑静息态脑功能复杂网络,并分析相关的网络拓扑结构测度在偏头痛患者与正常人之间的差异。
1 资料与方法
1.1 研究对象 选取2014年4—9月上海交通大学附属第六人民医院(东院)经临床确诊的24例偏头痛患者作为研究组,其中男10例,女14例,中位年龄45.6岁。同期选取22例正常人作为对照组,其中男10例,女12例,中位年龄43.5岁。
1.2 方法
1.2.1 MRI数据采集 采用Siemens MRI仪(3T)。数据获取过程中要求受试者保持大脑清醒,平躺于MRI仪内,不做任何定性思考。扫描参数:采用单次激发敏感梯度回波平面成像,切片数为38,覆盖整个脑区,TR 3.0 s,扫描分辨率为64×64,片内分辨率为4 mm×4 mm,片厚度4 mm。
1.2.2 MRI数据预处理 采用DPARSF软件包[27]对被试的静息态功能MRI数据进行预处理,主要包括时间层矫正、头动矫正、图像标准化等。其中,配准时在任何方向上位移>1.5 mm或头部转动>1.5°的数据均被丢弃(24例偏头痛患者中,被丢弃2例,保留22例);带通滤波器参数为0.01 Hz<f<0.1 Hz。
1.2.3 网络构建 预处理结束后,采用自动解剖标签模板[28]进行大脑复杂网络构建,将大脑划分为90个感兴趣区域,通过计算所有可能连接节点之间皮尔森偏相关系数组成的90×90的矩阵[22,29-30],构建大脑的复杂网络。
1.3 复杂网络的特性参数 构建两组被试的脑复杂网络后计算其相关测度,包括平均聚类系数、特征路径长度、介数中心度、同配性及小世界性,并分析两组的网络测度的差异性(置信水平P=0.01)。
1.3.1 平均聚类系数 平均聚类系数是表示一个网络中节点的集群连接程度的系数,它反映了大脑网络中功能分离的平均程度[16]。平均聚类系数Ci定义为:其中,Ki表示与节点i相邻的节点的数量,Ei表示连接节点i相邻节点的边数。
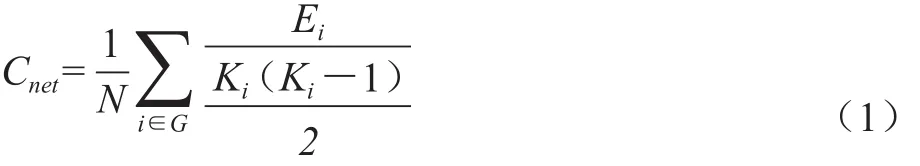
1.3.2 特征路径长度 特征路径长度又称为平均最短路径长度,指网络中任意节点对之间的最短路径长度的平均值,它反映了大脑功能整合能力程度[16]。通常定义为:
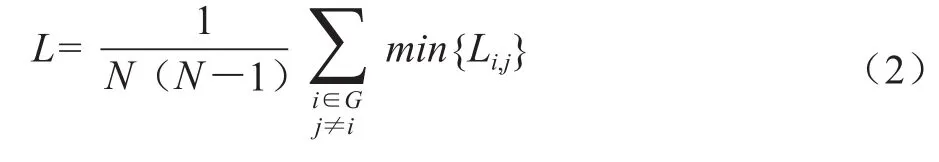
其中,Lij为节点i和j之间的路径, min{Lij}为i和j之间的最短路径。
1.3.3 介数中心度 介数中心度(Betweenness)是反映节点在网络中重要性的参数[16]。网络中任意两个节点的最短路径通过某特定节点的数量称为该节点的介数中心度,节点i的介数中心度定义如下:其中,δjk是从节点j到k的最短路径数, δjk(i)是从节点j到k的最短路径数中通过节点i的数量。

1.3.4 同配性 同配性用作考察度值相近的节点是否倾向于互相连接[16]。同配系数(assortativity coefficient)
是一种基于“度”的皮尔森相关系数,用来度量相连节点对的关系。同配系数r定义如下:

其中,ejk是节点j、k的联合度分布,qk、qj分别是节点k和j的余度分布,为余度分布qk的方差。如果r为正值,则表示相同度的点倾向于连接,如果为负值则表示不同度数的节点间有某种联系。
1.3.5 小世界性 小世界网络是介于规则网络和随机网络之间的一种特殊的复杂网络,既像随机网络一样有着较小的特征路径长度,同时又有与规则网络同一个数量级的较高的聚类系数。通常将小世界网络的聚类系数和特征路径长度与随机网络的聚类系数和特征路径长度进行比较,即:
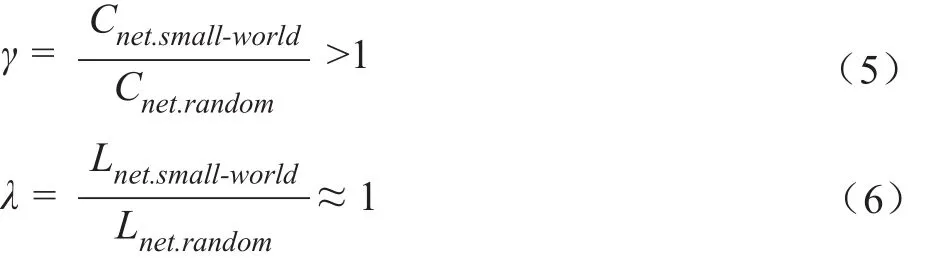
而小世界性则通常用γ和λ的比值来度量[30],即:

当σ>1时,本研究认为网络具有小世界性。因此,当要计算小世界性时,通常需要先计算与该网络的度分布相似的随机网络的聚类系数和特征路径长度。早期研究表明,这两种理论值为:

其中,Knet和N 分别表示当前网络的度和节点数。
1.4 统计学方法 采用REST V1.8软件对两组进行双样本t检验,P<0.05 表示差异有统计学意义。由于本研究的实验必须在一定的t阈值范围内进行,本研究采用假发现率(FDR)校正的方法对多重比较的P值进行校正。
2 结果
2.1 两组平均聚类系数比较 研究组与对照组的静息态脑功能网络的归一化聚类系数均>1;研究组的平均聚类系数在不同稀疏度下均大于对照组(P=0.01),见图1。
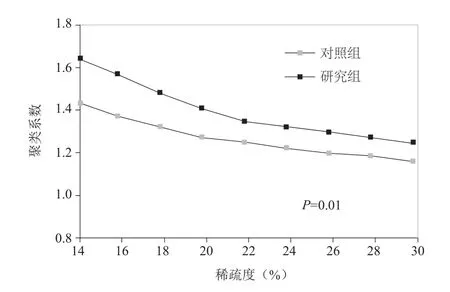
图1 两组静息态脑功能复杂网络的平均聚类系数比较
2.2 两组特征路径长度比较 研究组与对照组的静息态脑功能网络的特征路径长度归一化后均≈1;与对照组相比,研究组的部分节点[(尾状核(Caudate L,Caudate R)、豆状壳核(Putamen L)]的特征路径长度却呈现显著的异常,见图2。
2.3 两组介数中心度比较 与对照组相比,研究组患者静息态脑功能网络中丘脑(Thalamus L,Thalamus R)、左侧枕下回(Occipital Inf L)、右侧枕中回(Occipital Mid R)的介数中心度明显增大,见图3。
2.4 两组小世界性比较 在不同的稀疏度(从10%~30%,增量为1%)下,研究组与对照组的静息态脑功能复杂网络均具有小世界网络特性。与对照组相比,研究组患者的小世界特性呈现显著差异(P=0.01)。见图4。
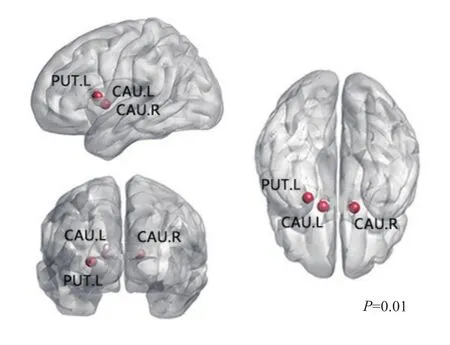
图2 研究组患者大脑静息态脑功能网络中尾状核(CAU.L、CAU.R)、豆状壳核(PUT.L)等节点的特征路径长度显著异常,红色区域表示人脑中特征路径长度较长的区域
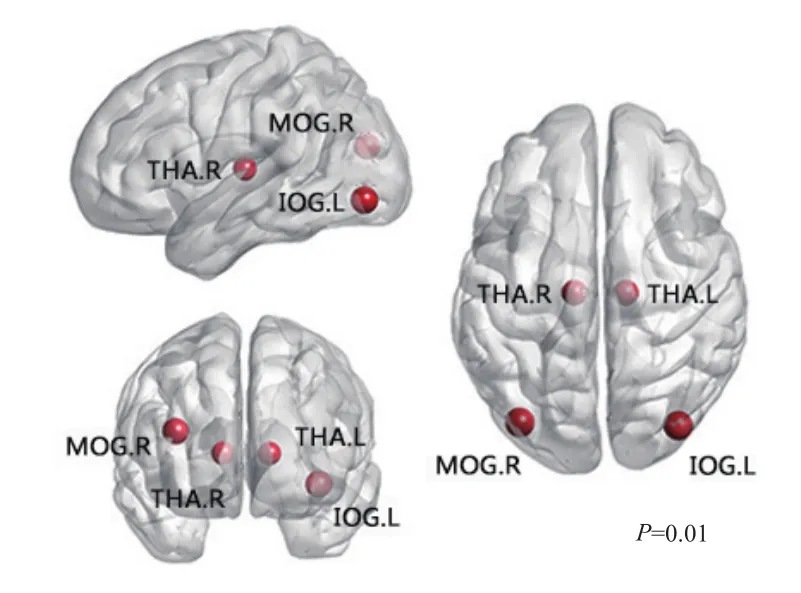
图3 研究组患者大脑静息态脑功能网络中丘脑(THA.R、THA.L)、左侧枕下回(IOG.L)、右侧枕中回(MOG.L)等节点的介数中心度较高。红色区域表示人脑中介数中心度较高的区域
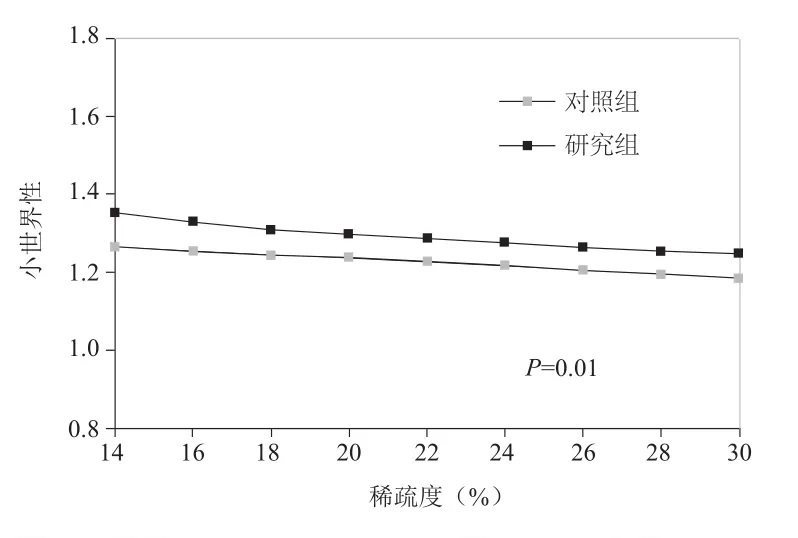
图4 两组静息态脑功能复杂网络的小世界性比较
2.5 两组同配性比较 两组同配性的同配系数均为负值。对照组的同配系数在不同稀疏度下均大于研究组的同配系数(P=0.01)。见图5。
3 讨论
聚类系数是复杂网络的一项重要参数,它反映了网络中节点的聚集程度,能很好地用来度量网络皮层之间的相互连接及功能分割情况。研究组患者的静息态脑功能网络的聚类系数均大于对照组,本研究认为该结果的产生是因为相对于正常人而言,偏头痛患者由于头痛、畏光等临床病症的反复发生,人脑中涉及疼痛处理以及视觉刺激的皮层之间相互连接更强,聚集程度较大,信息传递的效率异常偏高。
路径反映了大脑不同区域之间潜在的信息流。而特征路径长度则是对全脑网络的平均连通情况或者全局路由效率的度量,节点间更短的路径长度则反映了不同皮层之间具有更高效的相互作用。本研究发现,偏头痛患者部分节点的特征路径长度呈现异常,这些节点主要包括尾状核和豆状核,这与喻大华[4]和薛婷[12]发现的偏头痛患者丘脑、尾状核、豆状核等区域有异常的研究相同。尾状核和豆状核都是基底核的重要组成部分,基底核是人体神经细胞体集中的区域,与疼痛的调节有关。偏头痛患者的基底核异常可能是因为在头痛反复发作的过程中,基底核不断地参与到疼痛调节所引起的。
介数中心度是用来衡量节点在网络中相对重要程度的最为有效的方式。丘脑是大脑感觉传导的中继站,除了嗅觉外,人体的各种感觉的传导通路均在丘脑内更换神经元,然后投射到大脑皮层中。偏头痛反复发作的过程中,头痛的感觉传导通路需要更为频繁地通过丘脑完成中继,并投射到大脑皮层中,丘脑在偏头痛患者的疼痛处理中的重要性反映在复杂网络的拓扑结构上就是较大的介数中心度。枕中回是人脑中主要进行视觉处理的区域,左侧枕中回的异常也能很好地用来解释偏头痛患者常见的畏光以及伴随眼眶疼痛等临床现象。同时,在喻大华[4]与薛婷[12]的研究中也发现了偏头痛患者的枕中回异常。
本研究中,研究组和对照组的同配系数均为负值,说明度较大的节点都倾向于连接度更小的节点,而且相对于正常人,偏头痛患者的静息态脑功能网络的同配系数更小,且两者的差异显著,提示偏头痛患者的度不同的节点互相连接的倾向更强。
本研究发现偏头痛患者和对照组的静息态脑功能网络在较大的稀疏度范围内均具有小世界性,说明偏头痛患者的大脑信息处理能力依旧是高效的,但是与正常人相比,偏头痛患者的静息态脑功能网络的小世界性具有明显的异常,这种小世界性拓扑结构的改变,有可能是由于头痛的反复攻击造成的。
总之,通过研究偏头痛患者的静息态脑功能复杂网络拓扑结构的性质,并与正常人相比,发现偏头痛患者的复杂网络的某些测度会发生改变,部分与疼痛处理、视觉处理以及感觉相关的区域均呈现显著异常。以上发现能帮助医师更好地了解和解释偏头痛患者的临床病症,未来还应深入研究这些异常背后的潜在机制,尝试建立能够辅助偏头痛诊断和治疗的神经影像生理标志。
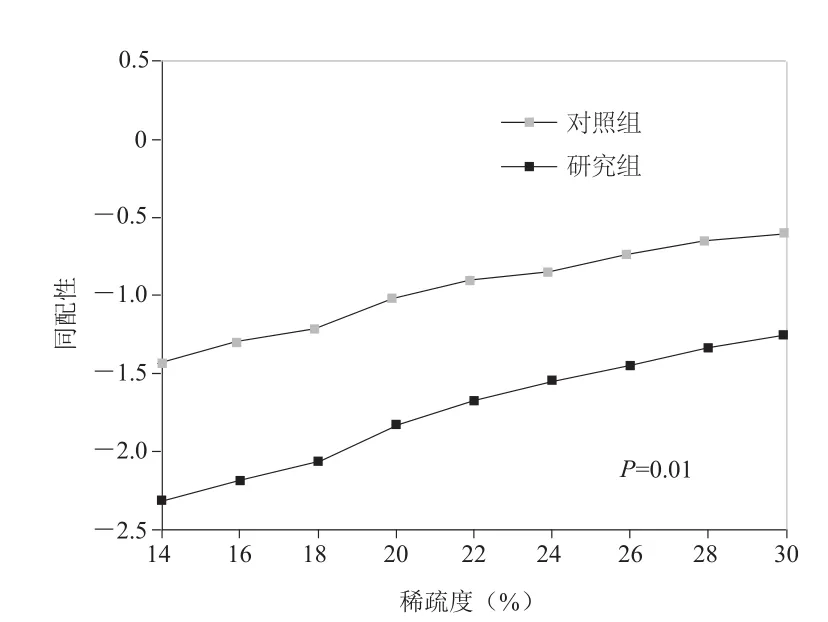
图5 两组静息态脑功能复杂网络的同配系数比较
[1] Cutrer FM, Black DF. Imaging findings of migraine. Headache, 2006, 46(7): 1095-1107.
[2] Schwedt TJ, Dodick DW. Advanced neuroimaging of migraine. Lancet Neurol, 2009, 8(6): 560-568.
[3] Bhaskar S, Saeidi K, Borhani P, et al., Recent progress in migraine pathophysiology: role of cortical spreading depression and magnetic resonance imaging. Eur J Neurosci, 2013, 38(11): 3540-3551.
[4] 喻大华. 无先兆偏头痛患者大脑结构与功能异常的磁共振影像学研究. 西安: 西安电子科技大学博士学位论文, 2013.
[5] Kim JH, Suh SI, Seol HY, et al. Regional grey matter changes in patients with migraine: a voxel-based morphometry study. Cephalalgia, 2008, 28(6): 598-604.
[6] Mainero C, Boshyan J, Hadjikhani N. Altered functional magnetic resonance imaging resting-state connectivity in periaqueductal gray networks in migraine. Ann Neurol, 2011, 70(5): 838-845.
[7] May A. New insights into headache: an update on functional and structural imaging findings. Nat Rev Neurol, 2009, 5(4): 199-209.
[8] Szabó N, Kincses ZT, Párdutz A, et al. White matter microstructural alterations in migraine: a diffusion-weighted MRI study. Pain, 2012, 153(3): 651-656.
[9] Yuan K, Zhao L, Cheng P, et al. Altered structure and restingstate functional connectivity of the basal ganglia in migraine patients without aura. J Pain, 2013, 14(8): 836-844.
[10] Schmitz N, Admiraal-Behloul F, Arkink EB, et al. Attackfrequency and disease duration as indicators for brain damage in migraine. Headache, 2008, 48(7): 1044-1055.
[11] Xue T, Yuan K, Cheng P, et al. Alterations of regional spontaneous neuronal activity and corresponding brain circuit changes during resting state in migraine without aura. NMR Biomed, 2013, 26(9): 1051-1058.
[12] 薛婷. 基于功能磁共振成像的无先兆偏头痛患者大脑静息状态异常模式研究. 西安: 西安电子科技大学博士学位论文, 2013.
[13] Bullmore E, Sporns O. Complex brain networks: graph theoretical analysis of structural and functional systems. Nat Rev Neurosci, 2009, 10(3): 186-198.
[14] Van den Heuvel MP, Hulshoff Pol HE. Exploring the brain network: a review on resting-state fMRI functional connectivity. Eur Neuropsychopharmacol, 2010, 20(8): 519-534.
[15] Reijneveld JC, Ponten SC, Berendse HW, et al. The application of graph theoretical analysis to complex networks in the brain. Clin Neurophysiol, 2007, 118(11): 2317-2331.
[16] Rubinov M, Sporns O. Complex network measures of brain connectivity: uses and interpretations. Neuroimage, 2010, 52(3): 1059-1069.
[17] Stam CJ, Reijneveld JC. Graph theoretical analysis of complex networks in the brain. Nonlinear Biomed Phys, 2007, 1(1): 3.
[18] Bassett DS, Bullmore E. Small-world brain networks. Neuroscientist, 2006, 12(6): 512-523.
[19] Smith SM, Miller KL, Salimi-Khorshidi G, et al. Network modelling methods for FMRI. Neuroimage, 2011, 54(2): 875-891.
[20] Uehara T, Yamasaki T, Okamoto T, et al. Efficiency of a "small-world" brain network depends on consciousness level: a resting-state FMRI study. Cerebral Cortex, 2014, 24(6): 1529-1539.
[21] Wang J, Qiu S, Yong X, et al. Graph theoretical analysis reveals disrupted topological properties of whole brain functional networks in temporal lobe epilepsy. Clin Neurophysiol, 2014, 125(9): 1744-1756.
[22] Liu Y, Liang M, Zhou Y, et al. Disrupted small-world networks in schizophrenia. Brain A Journal of Neurology, 2008, 131(7): 945-961.
[23] Micheloyannis S, Pachou E, Stam CJ, et al. Smallworld networks and disturbed functional connectivity in schizophrenia. Schizophr Res, 2006, 87(1-3): 60-66.
[24] Sanz-Arigita EJ, Schoonheim MM, Damoiseaux JS, et al. Loss of 'small-world' networks in alzheimer's disease: graph analysis of fmri resting-state functional connectivity. PloS One, 2010, 5(11): e13788.
[25] Stam CJ, Jones BF, Nolte G, et al. Small-world networks and functional connectivity in Alzheimer's disease. Cereb Cortex, 17(1): 92-99.
[26] Tomasi D, Volkow ND. Mapping small-world properties through development in the human brain: disruption in schizophrenia. PLoS One, 2014, 9 (4): e96176.
[27] Chao-Gan Y, Yu-Feng Z. DPARSF: A MATLAB toolbox for "pipeline" data analysis of resting-state fMRI. Front Syst Neurosci, 2010, (4): 13.
[28] Tzourio-Mazoyer N, Landeau B, Papathanassiou D, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI singlesubject brain. Neuroimage, 2002, 15(1): 273-289.
[29] Salvador R, Suckling J, Coleman MR, et al. Neurophysiological architecture of functional magnetic resonance images of human brain. Cereb Cortex, 2005, 15(9): 1332-1342.
[30] Achard S, Salvador R, Whitcher B, et al. A resilient, lowfrequency, small-world human brain functional network with highly connected association cortical hubs. J Neurosci, 2006, 26(1): 63-72.
(本文编辑 冯 婕)
Brain Functional Connectivity in Patients with Migraine Based on Complex Networks Analysis
Purpose To investigate the topological structure differences between the migraine patients group and the normal control group by using resting-state brain complex networks constructed based on graph theory. Materials and Methods Restingstate functional magnetic resonance imaging dataset were obtained from 22 migraine patients and 22 normal subjects. The functional complex networks of the two groups were constructed, and parameters including average clustering coefficient, characteristic path length, small worldness, assortativity, and betweenness of the two groups were respectively calculated. Results When compared with the parameters of normal control group, average clustering coefficient of migraine patients group was larger, small worldness and assortativity were also changed. The characteristic path length of the caudate nucleus and putamen areas presented abnormal in the migraine patients group. Betweenness centrality of the thalamus, inferior occipital gyrus and occipital gyrus increased in the migraine patients group. Conclusion The abnormal brain regions in the migraine patients group were mainly associated with pain processing, visual processing and sensory information relay. This study may contribute to better understanding and interpreting corresponding clinical condition of migraine.
Migraine disorders; Magnetic resonance imaging; Resting state; Image processing, computer-assisted; Brain functional network
10.3969/j.issn.1005-5185.2015.06.005
杨嘉君
Department of Neurology, the Sixth People's Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 201306, China
Address Correspondence to: YANG Jiajun
E-mail: yangjiajunfzy@sina.com
国家自然科学基金项目(31170952);上
海市2014年度浦东新区科技发展基金创新
资金(医疗卫生)项目(PKJ2014-Y08)。
R743.045;R445
2015-01-05
修回日期:2015-05-23
中国医学影像学杂志
2015年 第23卷 第6期:418-422
Chinese Journal of Medical Imaging
2015 Volume 23(6): 418-422
