毕赤酵母高密度发酵产脂肪酶条件的研究
2015-12-20付会兵钱建阳求赵明王浩均柳志强郑裕国
徐 明 ,付会兵 ,刘 鹏 ,钱建阳 ,求赵明 ,王浩均 ,柳志强 ,郑裕国
(1.浙江来益生物技术有限公司,浙江 嵊州 312400;2.浙江工业大学 生物工程研究所,浙江 杭州 310014)
脂肪酶(EC 3.1.1.3),又称三酰基甘油酰基水解酶,是一类能够催化高级脂肪酸和丙三醇形成脂肪酸甘油酯键或者催化天然底物油脂 (三脂酰甘油酯)水解产生脂肪酸和甘油的酶[1]。目前,脂肪酶被广泛应用于食品、饲料、化工等工业领域[2-3]。脂肪酶是人们研究最早的酶之一,其广泛存在于原核生物和真核生物中,由于哺乳动物和植物脂肪酶的量较少而且分离纯化难度也较大,而微生物脂肪酶在这方面表现出了很好的优越性[4],所以微生物脂肪酶自发现后就得到了较深入的研究。南极假丝酵母脂肪酶是近几年通过极端环境取样筛选到的一株酵母菌所产的酶,同时该酶又分为南极假丝酵母脂肪酶A和B两类[5],其中南极假丝酵母脂肪酶B因特殊的结构不表现出界面活性而使其在有机相和水相中均表现出较强的生物活性[6],得到了更广泛的应用。
近年来,随着分子生物学的发展,基因工程、遗传工程等方法越来越广泛地应用到育种上来,创造出更加高效的工业菌株。本研究所用菌株即是通过基因工程手段将南极假丝酵母脂肪酶B基因转入到毕赤酵母[7]获得的基因重组菌株,然后通过高密度发酵培养得到高产量的脂肪酶B。高密度培养是指在传统发酵基础上建立起来的通过提高菌体的发酵密度而最终提高产物比生产率的发酵技术,具有减少生产设备投资、强化下游分离提取、综合提高比生产率等诸多优点[8]。同时本研究利用毕赤酵母高密度培养来表达南极假丝酵母脂肪酶B,主要采用单因素实验和正交试验设计优化产酶条件[9-13],最终确定了一条可行性强的发酵产酶工艺路线。
1 材料与方法
1.1 菌种
Pichia pastoris X-33/pPICZα A-CALB。
1.2 培养基
斜面培养基(YPD培养基+Zeocin):酵母抽提物:1%,蛋白胨:2%,葡萄糖:2%,pH 自然,灭菌,冷却,加入Zeocin至终浓度100 μg/mL。
种子培养基:酵母抽提物10 g,胰蛋白胨20 g,氮基酵母 3.4 g,硫酸铵 10 g,1 mol/L磷酸钾缓冲液(pH 6.0)100 mL,甘油 10 g,定容至 1 L。 上述培养基配好后灭菌,冷却至室温,每升加2 mL 500×生物素,10.4 mL 96×组氨酸。
基础盐培养基:85%的 H3PO426.7 mL,CaSO4·2H2O 0.93 g,K2SO418.2 g,MgSO4·7H2O 14.9 g,KOH 4.31 g,甘油40.0 g。加水定容至1 L。
1.3 毕赤酵母高密度培养
种子斜面:从甘油管取样划YPD斜面,在30°C下培养24~48 h,待长出较大的单菌落。
摇瓶培养:取种子斜面上长势较好的单菌落接种至种子培养基,于30°C培养24 h。
种子罐培养:待种子摇瓶菌种长好时按10%的接种量转接至种子培养基,30°C培养24 h。
发酵培养:按10%的接种量将种子液转接至发酵罐,30°C开始发酵培养。
高密度培养发酵过程:
1)基础盐培养基阶段:此阶段,菌体的生长消耗培养基中的甘油。
2)甘油补加阶段:此阶段菌体生长消耗所补加的甘油,在这个阶段菌体可以实现快速生长,达到很高的菌体量。
3)甲醇诱导阶段:经过第二阶段的甘油流加,菌体量达到一个较高的值,待培养基中甘油完全消耗掉,间隔2~3 h后即可以开始甲醇诱导。
1.4 生物量的测定
1.4.1 菌体湿重的测定
发酵过程中,每隔12 h取样一次。用2个10 mL离心管,离心前先称量2个空离心管的质量,每个离心管的装量为8 mL,在电子天平上测量平衡后放于离心机中,8000 r/min,离心5 min,之后弃上清,称重并由下列公式计算出发酵液的菌浓度(g/L)。
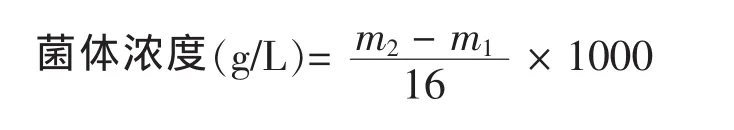
m1:2 个空离心管的质量(g);m2:离心后 2 个离心管的总质量(g)
1.4.2 发酵液OD600的测定
取上述发酵液的样品,将样品稀释到OD600的值处在0.6左右,测量此时的OD值。发酵液OD600的值由以下公式可以计算得出:
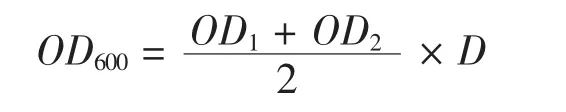
OD1、OD2:样品测量两次的吸光值;D:发酵液的稀释倍数
1.5 脂肪酶酶活的测定(p-NPA法)
酶活定义为:在45°C和pH 8.0条件下,1 min内催化对硝基苯乙酸酯生成1 μmol对硝基苯酚(p-NP)所需要的酶量为1个酶活单位(U)。
以对硝基苯乙酸酯(p-NPA)为底物,利用多功能酶标仪在96孔板上测定脂肪酶的活性。具体操作如下:先加入50 μL酶液到900 μL 20 mmol/L Tris-HCl缓冲液(pH 8.0)中,45 °C 保温,预热1 min,加入 50 μL 20 mmol/L p-NPA 乙腈溶液反应2 min后测定反应液在405 nm的OD值。
1.6 单因素实验对酵母菌发酵条件的优化
设计单因素实验,分别考察不同通气量、搅拌转速、pH、接种量、诱导剂量对酵母发酵产酶的影响。
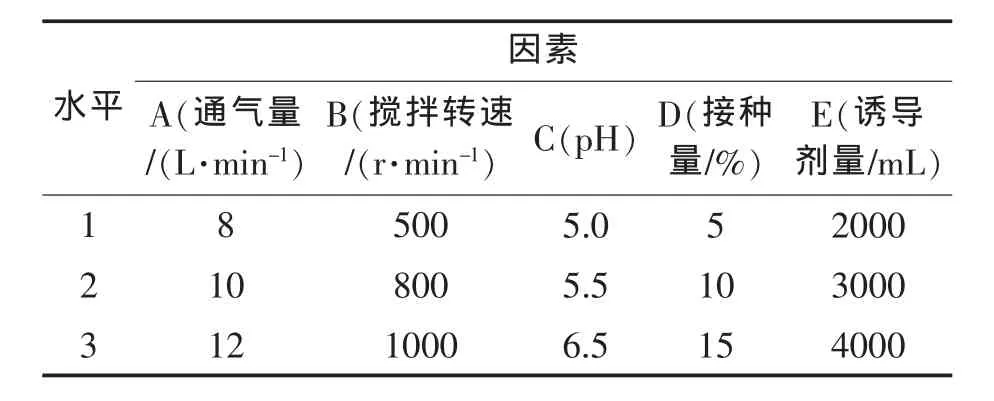
表1 单因素试验的设计
说明:单因素实验在15 L发酵罐中进行[14],具体发酵条件如下:
1)研究通气量的影响时,维持pH 5.5,接种量为10%,搅拌转速为800 r/min,溶氧控制在20%~30%上,发酵时间为72 h。
2)研究搅拌转速的影响时,维持pH 5.5,接种量为10%,通气量为10 L/min,溶氧控制在20%~30%上,发酵时间为72 h。
3)研究pH的影响时,接种量为10%,搅拌速度为800 r/min,通气量为 10 L/min,溶氧控制在20%~30%上,发酵时间为72 h。
4)研究接种量的影响时,维持pH 5.5,搅拌速度为800 r/min,通气量为10 L/min,溶氧控制在20%~30%上,发酵时间为72 h。
5)研究诱导剂用量的影响时,维持pH 5.5,搅拌速度为800 r/min,通气量为10 L/min,溶氧控制在20%~30%上,发酵过程中,记录酶活及生物量随诱导剂流加的变化情况。
1.7 正交试验设计对酵母菌发酵条件的优化
由单因素实验结果可以得出接种量、pH、诱导剂的量这三个因素对实验结果有较大的影响,故对这三个因素进行进一步的研究。实验采用正交试验设计的方法对酵母菌发酵条件进行优化,实验在700 L发酵罐中进行。
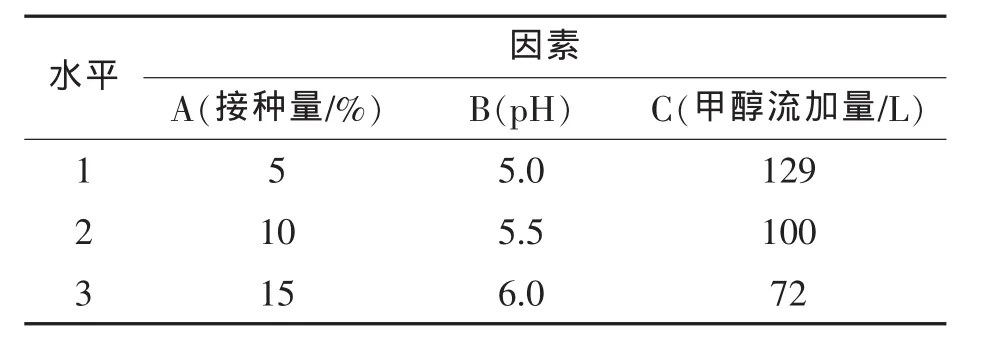
表2 正交设计中的因素和水平
2 结果与讨论
2.1 单因素试验结果
2.1.1 不同通气量对毕赤酵母高密度发酵产酶的影响
通气量对发酵效果的影响如表3所示,随着通气量的增加发酵液的单位酶活会增加,继续增加通气量发酵液的单位酶活并没有增加,所以选择以10 L/min为最佳的发酵通气量。

表3 通气量对毕赤酵母发酵液体积酶活的影响
2.1.2 不同搅拌转速对毕赤酵母高密度发酵产酶的影响
搅拌转速对发酵产酶的影响如表4所示,当转速为800 r/min时发酵液的单位酶活最大,达到了4.6 U/mL。

表4 搅拌转速对毕赤酵母发酵液体积酶活的影响
2.1.3 不同pH对毕赤酵母高密度发酵产酶的影响
实验中,维持其他实验条件不变,主要考查发酵pH为5.0、5.5、6.5对毕赤酵母发酵产酶的影响。实验结果如表5所示,结果表明,pH对发酵产酶的影响较大,当发酵pH为5.5时,发酵液的酶活最高,达到了5.3 U/mL。

表5 pH对毕赤酵母发酵液体积酶活的影响
2.1.4 不同接种量对毕赤酵母高密度发酵产酶的影响
接种量对发酵产酶的影响如表6所示,主要考查接种量为5%、10%、15%时对毕赤酵母发酵产酶的影响。结果表明,接种量对发酵产酶的影响较小,当接种量为10%,发酵液的酶活为5.4 U/mL,达到最高。
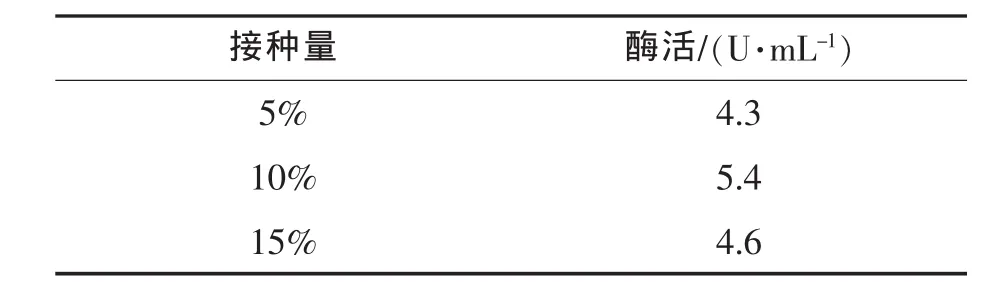
表6 接种量对毕赤酵母发酵液体积酶活的影响
2.1.5 不同的诱导剂量对毕赤酵母高密度发酵产酶的影响
诱导剂的量对发酵产酶的影响如表7所示,在单因素实验确定的最优发酵条件(pH 5.5、接种量10%、搅拌转速800 r/min、通气量为10 L/min)的基础上,考察诱导剂的添加量对发酵产酶的影响。主要考察诱导剂用量为2000 mL,3000 mL,4000 mL时毕赤酵母的产酶情况。结果表明:诱导剂的量为3000 mL时发酵液的单位酶活达到最高,继续增加诱导剂的量并没有增加发酵液的单位酶活。所以考虑经济节约,诱导剂的用量为3000~3500 mL 即可。
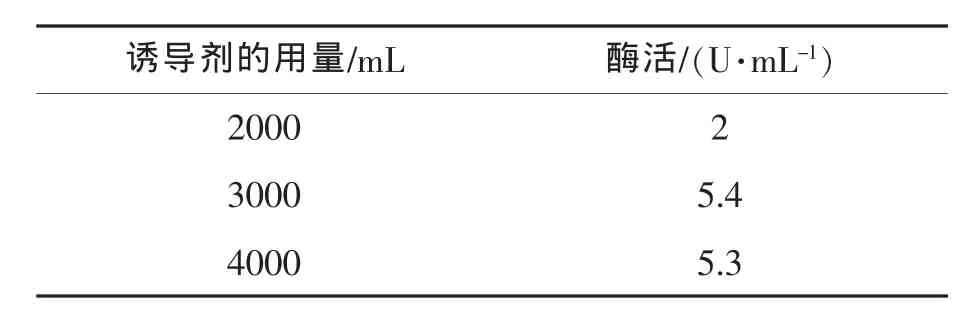
表7 诱导剂的用量对毕赤酵母发酵液体积酶活的影响
2.2 正交试验优化结果
由单因素实验结果可得:发酵液pH、接种量、诱导剂的量,这三个因素对发酵产酶有着比较大的影响,因此,对这三个因素做进一步优化。本实验采用三因素三水平正交试验进行,实验结果如表8所示。
由正交表可以看出,对发酵液菌体浓度及发酵液酶活大小影响的顺序为B>A>C,即pH>接种量>诱导剂的用量。其中pH影响最大,诱导剂用量的影响最小。我们还可以得出如下结论:
1)对于发酵菌体量(即生物量)的最优条件组合为 A1B2C1。
2)对于发酵产酶(即酶活)的最优组合为A1B1C1。
2.3 甘油的流加对毕赤酵母发酵产酶的影响
因毕赤酵母培养过程中,产酶的量和发酵液的生物量有一定的相关性,所以可以通过提高发酵液的生物量来提高产酶。由于在毕赤酵母高密度培养中通常是通过流加甘油来提高菌体浓度,所以实验中采取增加甘油的量来提高发酵液的菌体浓度。通过前期实验发现选择发酵甘油的流加量为原发酵流加量的1.5倍时效果最佳,因此在中试规模下亦选择此流加量进行实验,实验结果如图1所示。从图中可以看出,发酵液的菌体量在甘油流加过程中快速增长,在培养50 h左右时即达到230 g/L左右,但是在后期培养过程中,菌体浓度并没有增加很多。发酵结束时,发酵液体积酶活达到了10 U/mL。所以可以得到,虽然通过流加过量的甘油可以使菌体浓度提前达到很高的值,但对最终的菌体量及产酶的提高却影响不大,分析其原因可能是生长过快导致菌群提前进入平衡期所致。
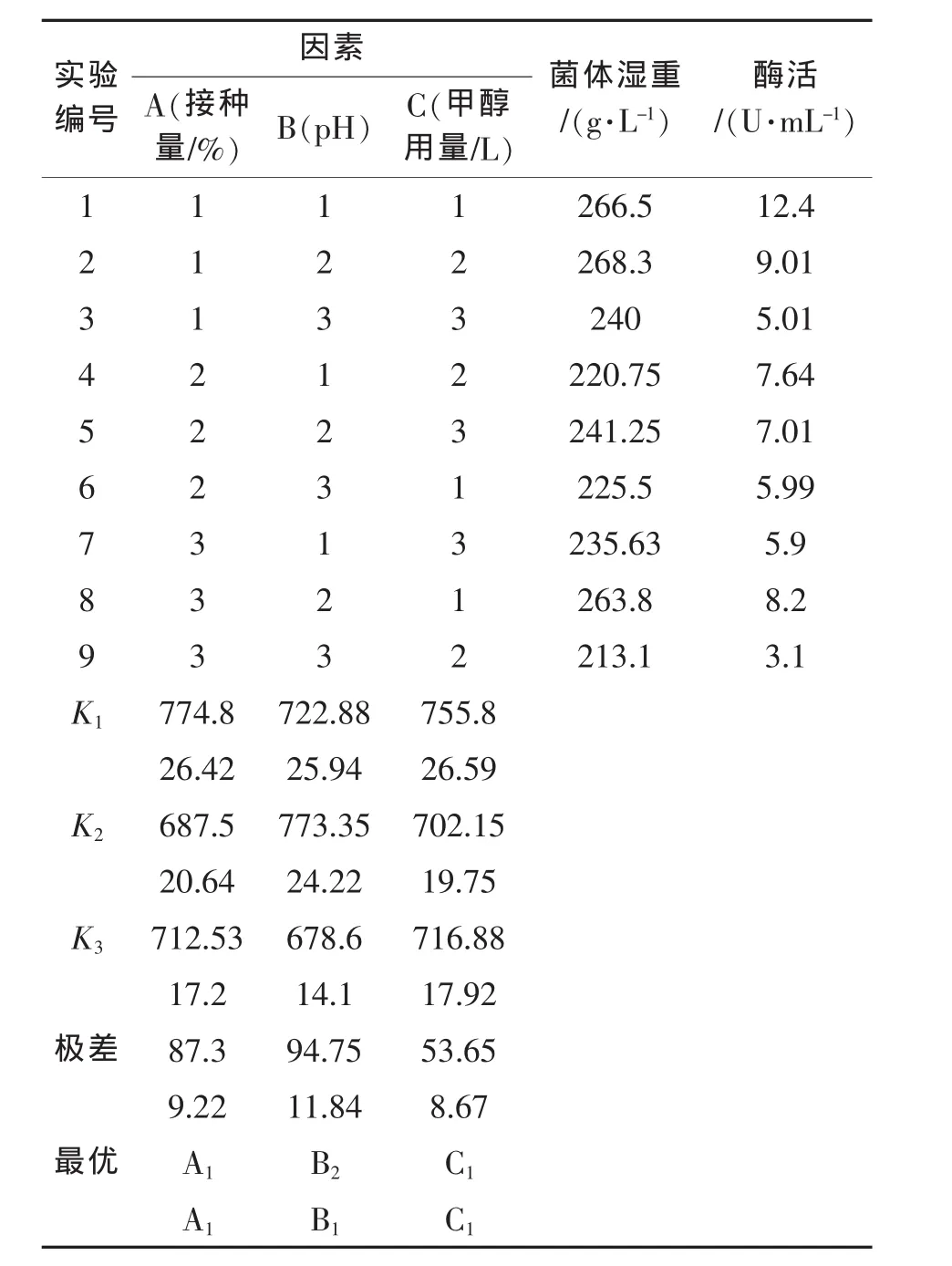
表8 正交试验的结果
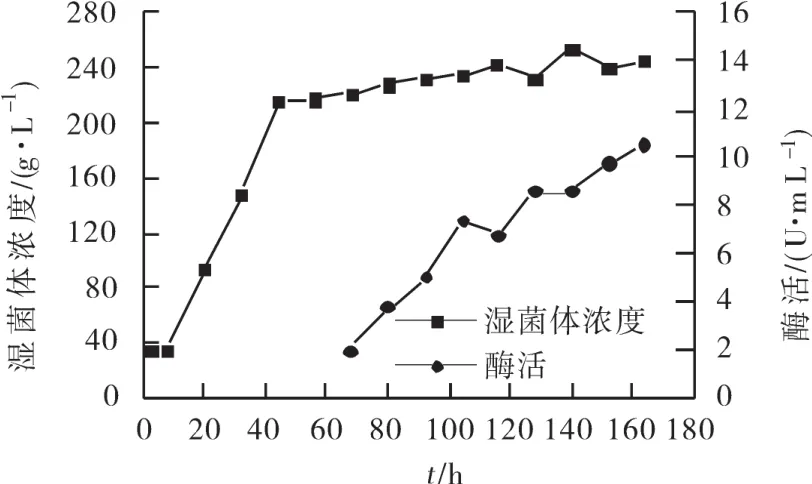
图1 增加甘油的流加量对发酵过程的影响
2.4 添加酵母膏和蛋白胨对毕赤酵母发酵培养的影响
毕赤酵母生长的特点是非常好氧,而且会分泌蛋白酶从而会引起自身分泌蛋白的降解,文献有报道向发酵液中添加酵母膏和蛋白胨可以有效减少分泌蛋白的降解[15]。根据前期的优化实验确定了酵母膏的最佳添加量为0.5%(v/v),蛋白胨的最佳添加量为1%(v/v),因此本实验采用0.5%的酵母膏和1%的蛋白胨进行组合添加,每隔48 h添加一次,整个发酵过程添加3次,实验结果如图2所示。从图中可以看出,添加蛋白类物质后的发酵液的菌体浓度达到了310 g/L左右,体积酶活达到了18 U/mL。由此可以得出,在毕赤酵母高密度培养过程中,在有过量蛋白类物质存在的情况下,能减少脂肪酶的降解,从而提高发酵液的体积酶活。
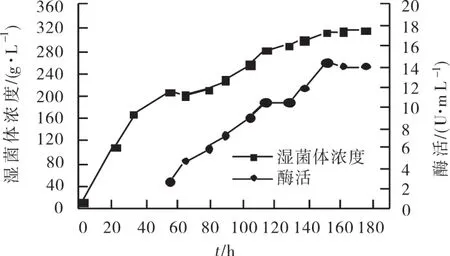
图2 添加酵母膏、蛋白胨对发酵过程的影响
3 结 论
本文通过单因素实验和正交试验对毕赤酵母高密度发酵产酶的条件进行研究,正交试验的结果与单因素实验结果不完全一致,可能是多个因素之间产生交互影响所致。通过三因素三水平正交试验,最终得出在公称体积700 L,装液量为400 L的发酵罐中,毕赤酵母最佳的发酵产酶条件为:pH 为 5.0,温度为 30°C,转速为 250 r/min,接种量为5%,溶氧为20%~30%,诱导剂甲醇的量为129 L,培养160~170 h时发酵培养的酶活及生物量达到了最高。在开始诱导后,向发酵液添加0.5%的酵母膏和1%的蛋白胨(v/v),每隔48 h加入一次,分3次加入,可以有效地防止脂肪酶的降解,提高发酵液的体积酶活。同时,本实验是在中试规模下进行,故实验结果对该产品的工业化生产具有重要的指导意义。
[1]Jaeger K E,Eggert T.Lipases for biotechnology[J].Current Opinion in Biotechnology,2002,13(4):390-397.
[2]谭天伟,陈必强.Candida sp.1992125脂肪酶及其在化学品合成中的应用[J].化工学报,2010,61(7):1685-1692.
[3]葛清秀,黄祖新,陈建平.脂肪酶有机相催化在食品工业中的应用[J].福建轻纺,2005,(2):6-11.
[4]张中义,吴新侠.脂肪酶的研究进展[J].食品与药品,2007,9(12):54-56.
[5]Kirk O,Christensen M W.Lipases from Candida antarctica:U-nique biocatalysts from a unique origin[J].Organic Process Research&Development,2002,(6):446-451.
[6]Martinelle M,Hult K.Kinetics of acyl transfer-reactions in organicmediacatalyzedbyCandida-antarctica lipase-b[J].Bba-Protein Struct M,1995,1251(2):191-197.
[7]Veenhuis M,Van Dijken J P,Harder W.The significance of peroxisomes in the metabolism of one-carbon compounds in yeasts[J].Adv Microb Physiol,1983,24:1-82.
[8]李洪淼,王红宁,许钦坤.毕赤酵母高密度发酵研究进展[J].生物技术通讯,2005,2(16):210-212.
[9]刘瑞江,张业旺,闻崇炜,等.正交试验设计和分析方法研究[J].实验技术与管理,2010,27(9):52-55.
[10]孙迅,马远忠,孙宝聚,等.产胞外木聚糖酶链霉菌发酵条件的正交试验[J].微生物学杂志,1999,19(4):22-24.
[11]顾薇,潘自皓,潘永兰.谷氨酸脱氢酶发酵工艺的正交试验设计[J].化工时刊,2010,24(1):16-19.
[12]桑海峰,何大阔,张大鹏.发酵过程中比生长率的在线估计[J].东北大学学报(自然科学版).2006,10(27):1079-1082.
[13]刘均洪,邱龙辉,何为,等.南极假丝酵母脂肪酶发酵条件优化及酶学性质[J].化学工业与工程技术,2005,26(1):1-5.
[14]李燕妮,衣婷婷,李龙森.南极假丝酵母产脂肪酶在15 L发酵罐中培养条件的研究[J].化学与生物工程,2007,7(24):43-48.
[15]Patrick-Fickers VS,Nicaud J-M.The Lipases from Y.lipolytica:Genetics,Production,Regulation,and Biochemical Characterization[J].Yarrowia lipolytica,2013,(25):99-119.
