重组蛋白LuxS诱导表达及纯化条件的优化
2015-12-20孟祥晨
杨 杰,张 筠,孟祥晨
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
重组蛋白LuxS诱导表达及纯化条件的优化
杨 杰,张 筠,孟祥晨*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
目的:优化重组蛋白LuxS诱导表达及纯化条件,提高具有生物活性的重组蛋白LuxS的表达量,为体外合成自诱导物2(autoinducer-2,AI-2)奠定基础。方法:采用单因素试验,优化诱导培养基、诱导温度、诱导前菌体生物量、诱导时间以及异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)的浓度;采用Ni-NTA Purifi cation System对重组蛋白进行纯化,比较Native Elution Buffer 的咪唑浓度和pH值对重组蛋白纯化的影响,确定最佳的Native Elution Buffer;对比蛋白与树脂结合时不同缓冲液的纯化效果,选择最优的结合缓冲液。结果:重组蛋白的最佳诱导表达条件为:以LB培养基为诱导培养基,菌液OD600 nm为0.6~0.8,IPTG浓度为0.1 mmol/L,诱导温度为37 ℃,诱导时间为12 h。采用添加3 mol/L NaCl的磷酸盐缓冲液作为蛋白与树脂结合的缓冲液,含500 mmol/L咪唑的Native Elution Buffer(pH 6.5)作为蛋白洗脱液。使用分离获得的LuxS蛋白合成的AI-2生物活性约为阳性对照的6 倍。结论:本研究成功优化了重组蛋白LuxS的诱导表达及纯化条件,获得了具有生物活性的重组蛋白,并成功合成了AI-2。
重组蛋白;LuxS;诱导表达;纯化;自诱导物2
群体感应是细菌间通过小分子信号分子进行信息交流、感知菌体密度,进而调控相应基因表达的一种机制[1-2]。细菌在生长繁殖过程中会向环境中分泌特定的信号分子,这种信号分子被称为自诱导物(autoinducers,AI)[3]。许多细菌中存在几种群体感应系统,研究发现在哈氏弧菌中就存在两种群体感应系统。这两种群体感应系统分别利用酰基高丝氨酸内酯(acylhomoserine lactone)和AI-2作为信号分子[4]。以AI-2介导的群体感应系统存在于革兰氏阴性菌和革兰氏阳性菌中,因此AI-2是一种种间通用的信号分子[5-7]。
目前发现,所有能够产生AI-2的细菌中的AI-2合成途径都是相同的,即都是S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)经过3 步酶催化反应生成的[8-10]。S-腺苷甲流氨酸作为甲基供体,脱去甲基后生成S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),SAH经Pfs催化生成S-核糖高半胱氨酸(S-ribosylhomocysteine,SRH)和腺嘌呤,LuxS催化S-核糖高半胱氨酸生成4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)和高半胱氨酸(homocysteine,HCY)[11-13]。DPD在水溶液中不稳定,自动分子重排形成有活性的AI-2信号分子。通过AI-2的合成途径知道,LuxS在AI-2的合成过程中起着关键酶的作用,是AI-2合成所必需的。本实验室前期人员成功构建了重组原核表达载体pQE-30-luxS,并在大肠杆菌中成功表达了重组蛋白LuxS[14],为得到大量LuxS蛋白奠定了基础。本研究将对重组蛋白的诱导表达、纯化条件进行优化,进而提高重组蛋白产量,为体外合成AI-2奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌(Escherichia coli)M15菌株 上海显益化学科技有限公司;哈氏弧菌(V. harveyi)BB170、哈氏弧菌(V. harveyi)BB120 美国模式培养物集存库(American Type Culture Collection,ATCC)。
表达载体pQE-30由黑龙江八一农垦大学郭东华老师惠赠。
1.1.2 试剂
Ni-NTA Purification System 美国Invitrogen公司;2,2’-联喹啉-4,4-二甲酸二钠(2,2’-biquinoline-4,4-dicarboxylic acid disodium salt,BCA)法蛋白定量试剂盒 北京百泰克生物技术有限公司;异丙基硫代半乳糖苷(isopropyl β-D-thiogalactopyranoside,IPTG) 萨默斯(Summus)公司;低分子质量蛋白质Marker 宝生物工程(大连)有限公司;氨苄青霉素(ampicillin,Amp)、卡那霉素(kanamycin,Kana)、溶菌酶(酶活力>20 000 U/mg)、苯甲基磺酰氟(phenylmethylsulfonyl fl uoride,PMSF)、咪唑(imidazole)美国Amresco公司;S-腺苷高半胱氨酸(SAH) 美国Sigma公司。
1.1.3 仪器与设备
迷你型垂直凝胶电泳仪、Model 680型酶标仪 美国Bio-Rad公司;冷冻高速离心机 美国Sigma公司;UVP凝胶成像系统 美国UVP公司;ZHWY200B型全温度恒温培养摇床 上海智城分析仪器制造有限公司。
1.2 方法
1.2.1 诱导培养基的确定
将含有重组质粒pQE-30-luxS的E. coli M15单菌落接种到5 mL含100 μg/mL Amp和25 μg/mL Kana的LB培养基中,37 ℃、150 r/min摇床培养12 h;将培养12 h的菌液按1%接种量分别接种到M9、自诱导、TB、2YT、SOC和LB培养基[15]中(各种培养基均添加100 μg/mL Amp和25 μg/mL Kana),37 ℃、150 r/min摇床培养,其中M9、TB、2YT、SOC和LB培养基菌液OD600 nm=0.6~0.8时,加入终浓度为1 mmol/L的IPTG,自诱导培养基无需添加诱导剂IPTG,于37 ℃、150 r/min诱导20 h后,取1 mL诱导菌液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分析。
1.2.2 诱导温度的确定
将培养12 h的含有重组质粒pQE-30-luxS的E. coli M15菌液按1%接种量接种至LB培养基(添加100 μg/mL Amp 和25 μg/mL Kana)中,37 ℃、150 r/min培养至菌液OD600 nm=0.6~0.8,加入终浓度为1 mmol/L的IPTG进行重组蛋白诱导表达,分别于25、30、37 ℃,150 r/min诱导20 h后,取1 mL诱导菌液进行SDS-PAGE分析。
1.2.3 诱导前菌体生物量的确定
将培养12 h的含有重组质粒pQE-30-luxS的E. coli M15菌液按1%接种量接种至LB培养基(添加100 μg/mL Amp和25 μg/mL Kana)中,37 ℃、150 r/min培养至菌液OD600 nm分别为0.2、0.4、0.6、0.8、1.0、1.2时,加入终浓度为1 mmol/L的IPTG进行重组蛋白诱导表达,于37 ℃、150 r/min诱导20 h后,取1 mL诱导菌液进行SDS-PAGE分析。
1.2.4 诱导时间的确定
将培养12 h的含有重组质粒pQE-30-luxS的E. coli M15菌液按1%接种量接种至LB培养基(添加100 μg/mL Amp 和25 μg/mL Kana)中,37 ℃、150 r/min培养至菌液OD600 nm=0.6~0.8,加入终浓度为1 mmol/L的IPTG进行重组蛋白诱导表达,分别于37 ℃、150 r/min诱导4、6、8、10、12、14、16、18、20 h后,取1 mL诱导菌液进行SDS-PAGE分析。
1.2.5 诱导剂IPTG浓度的确定
将培养12 h的含有重组质粒pQE-30-luxS的E. coli M15菌液按1%接种量接种至LB培养基(添加100 μg/mL Amp 和25 μg/mL Kana)中,37 ℃、150 r/min培养至菌液OD600 nm=0.6~0.8,加入不同浓度的IPTG(终浓度分别为0、0.1、0.25、0.5、0.75、1.0、1.25 mmol/L)进行重组蛋白诱导表达,于37 ℃、150 r/min诱导12 h后,取1 mL诱导菌液进行SDS-PAGE分析。
1.2.6 重组蛋白LuxS存在形式的检测
将培养12 h的含有重组质粒pQE-30-luxS的E. coli M15菌液按1%接种量接种至LB培养基(添加100 μg/mL Amp和25 μg/mL Kana)中,37 ℃、150 r/min培养至菌液OD600 nm=0.6~0.8,加入终浓度为0.1 mmol/L的IPTG进行重组蛋白诱导表达,37 ℃、150 r/min诱导12 h后,6 000 r/min离心10 min收集菌体,用磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗菌体2 次,将菌体重悬于1/10原体积的PBS中,加入溶菌酶(终质量浓度为1 mg/mL)、PMSF(终质量浓度为100 μg/mL),于37 ℃、150 r/min振荡孵育1 h,然后液氮反复冻融3 次裂解菌体(每次在液氮中冷冻3 min后,置于37 ℃水浴融化);14 000 r/min、4 ℃离心10 min,分别收集上清和沉淀,沉淀用PBS漂洗2 次后重悬于原体积的PBS中,将上清和沉淀进行SDS-PAGE分析。
1.2.7 纯化条件的优化
按1.2.6节所述方法收集重组蛋白溶液,参照Ni-NTA Purification System说明书分别对重组蛋白LuxS纯化过程中Native Elution Buffer的咪唑浓度及pH值进行优化,首先进行咪唑浓度优化,Native Elution Buffer咪唑浓度分别为250、375、500、625 mmol/L(pH 8.0),在得到的最优咪唑浓度水平上对Native Elution Buffer的pH值进行优化,pH值分别为8.0、7.5、7.0、6.5,分别用4 mL和2 mL的Native Elution Buffer先后进行2 次蛋白洗脱,通过SDS-PAGE分析纯化效果。
按1.2.6节所述方法收集诱导后菌体,分别进行3 组实验,样品分别编号1、2、3号。第1组:将菌体重悬于1/10原体积的PBS中,然后按照1.2.6节所述方法进行菌体裂解,收集上清。参照Ni-NTA Purification System说明书对重组蛋白LuxS进行纯化,用4 mL优化后的Native Elution Buffer对重组蛋白LuxS进行洗脱。第2组:按照第1组方法收集裂解上清后,在上清中加入终浓度为3 mol/L的NaCl溶液后,对重组蛋白LuxS进行纯化,其他同第1组操作相同。第3组:将菌体重悬于1/10原体积的Native Binding Buffer中,然后按照1.2.6节所述方法进行菌体裂解,收集上清后对重组蛋白LuxS进行纯化,其他同第1组操作相同。3 组实验的纯化效果通过SDS-PAGE进行分析。
1.2.8 在优化条件下重组蛋白LuxS的合成
按1.2.6节所述方法收集重组蛋白溶液,在重组蛋白溶液中加入终浓度为3 mol/L的NaCl,参照Ni-NTA Purification System说明书对重组蛋白LuxS进行纯化,用4 mL含500 mmol/L咪唑的Native Elution Buffer(pH 6.5)洗脱LuxS蛋白。将洗脱液密封于透析袋(截留分子质量3 500 u)中,置于10 mmol/L磷酸钠缓冲液(pH 7.5)中透析过夜,期间更换几次透析液。将透析过的蛋白溶液用超滤管(截留分子质量3 000 u)进行浓缩5~10 倍,采用BCA法蛋白定量试剂盒进行蛋白定量。在10 mmol/L的磷酸钠缓冲液(pH 7.5)中添加1 mmol/L的SAH、1 mg/mL 的Pfs蛋白和1 mg/mL的LuxS蛋白[16],37 ℃水浴1 h,用超滤管(截留分子质量3 000 u)滤除蛋白,收集滤液,用哈氏弧菌BB170报告菌株检测AI-2生物活性[17],以哈氏弧菌BB120无细胞培养上清作为阳性对照,10 mmol/L磷酸钠缓冲液(pH 7.5)作为阴性对照,将阳性对照中AI-2生物活性定义为100%。
2 结果与分析
2.1 诱导条件的优化
本课题组前期通过聚合酶链式反应(polymerase chain reaction,PCR)克隆出植物乳杆菌KLDS1.0391中的luxS基因,成功将其插入表达载体pQE-30中,构建成重组质粒pQE-30-luxS,并将重组质粒导入E. coli M15中,成功表达出重组蛋白LuxS[14]。为了提高重组蛋白的表达量,本研究从诱导培养基、诱导温度、诱导前菌体生物量、诱导时间以及诱导剂IPTG浓度5 个方面进行优化[18-20]。
2.1.1 诱导培养基的确定

图1 诱导培养基对重组蛋白LuxS表达的影响Fig.1 Effect of different induction media on the expression of recombinant protein LuxS
将含有重组质粒pQE-30-luxS的E. coli M15在不同培养基中进行诱导表达,其中LB、2TY、SOC、TB和M9培养基以IPTG作为诱导剂,自诱导培养基以乳糖作为诱导剂。SDS-PAGE分析结果显示如图1所示,LB、2YT、TB 和M9培养基均可诱导重组蛋白LuxS的表达,其中LB、2YT和TB培养基诱导效果较好,由于2YT、TB培养基比LB培养基成本高,且LB培养基完全满足菌体生长与蛋白表达的需要,综合考虑选择LB培养基作为诱导培养基。结果表明,LB、2YT和TB培养基作为诱导培养基时,重组蛋白诱导表达量较高,LB、2YT和TB培养基均营养物质丰富,尤其是氮源和碳源丰富,由此说明,培养基成分对重组蛋白的表达有很大的影响。同时,自诱导培养基以乳糖作为诱导剂,没有诱导重组蛋白LuxS的表达,并且乳糖在培养基中既可作为诱导剂,又能够作为一种碳源被菌体代谢,所以在诱导过程中也会很不稳定,需要的乳糖剂量也比IPTG高出很多[21]。

图2 诱导温度对重组蛋白LuxS表达的影响Fig.2 Effect of induction temperature on the expression of recombinant protein LuxS
2.1.2 诱导温度的确定
由图2可知,重组蛋白LuxS在37 ℃条件下诱导表达量最高(泳道1),选择37 ℃作为重组蛋白LuxS的诱导温度。诱导温度不仅影响菌体的生长,同样影响着重组蛋白的诱导表达及蛋白的可溶性[22]。一些种类的蛋白在诱导表达时容易出现错误性折叠,从而形成包涵体沉淀,而低温诱导可以有助于蛋白的可溶性表达[23]。本研究中的LuxS蛋白可溶性较好、不易形成包涵体,主要以可溶性蛋白形式存在。37 ℃是大肠杆菌最适的生长温度,并且从图2中看出,诱导温度为37 ℃时LuxS蛋白表达量最高,所以本研究选取37 ℃作为LuxS蛋白的诱导温度。
2.1.3 诱导前菌体生物量的确定

图3 诱导前菌体生物量对重组蛋白LuxS表达的影响Fig.3 Effect of bacterial biomass before induction on the expression of recombinant protein LuxS
由图3可知,诱导前菌体生物量对重组蛋白LuxS诱导表达无明显影响,所以选择OD600nm= 0.6~0.8的代谢相对旺盛的对数生长期菌体进行重组蛋白LuxS的诱导表达。此时的菌体生长迅速,代谢旺盛,有利于重组蛋白的表达。
2.1.4 诱导时间的确定

图4 诱导时间对重组蛋白LuxS表达的影响Fig.4 Effect of induction time on the expression of recombinant protein LuxS
由图4可知,重组蛋白LuxS诱导表达量在诱导12 h后达到最高,12 h后产量无明显变化,所以选择12 h作为重组蛋白LuxS的诱导时间。随着诱导时间的延长,重组蛋白产量增加,同时菌体内的蛋白酶对重组蛋白的降解也会增加,所以过长时间的诱导对重组蛋白的表达同样不利。
2.1.5 诱导剂IPTG浓度的确定

图5 IPTG浓度对重组蛋白LuxS表达的影响Fig.5 Effect of IPTG concentration on the expression of recombinant protein LuxS
由图5可知,IPTG浓度对重组蛋白LuxS诱导表达无明显影响,由于高浓度的IPTG对菌株有一定的毒害作用,所以选择终浓度为0.1 mmol/L的IPTG作为重组蛋白LuxS的诱导剂。IPTG作为一种强诱导剂,在菌体中不能够被代谢,可以持续地发挥作用,所以少量的IPTG就可以起到很好的诱导效果。采用较低浓度的IPTG可以适当的降低转录速率,有利于蛋白的可溶性表达[24]。
2.2 重组蛋白LuxS的存在形式
由图6可知,重组蛋白LuxS以可溶性蛋白形式存在(泳道4),沉淀中(泳道3)只有少量蛋白残留。
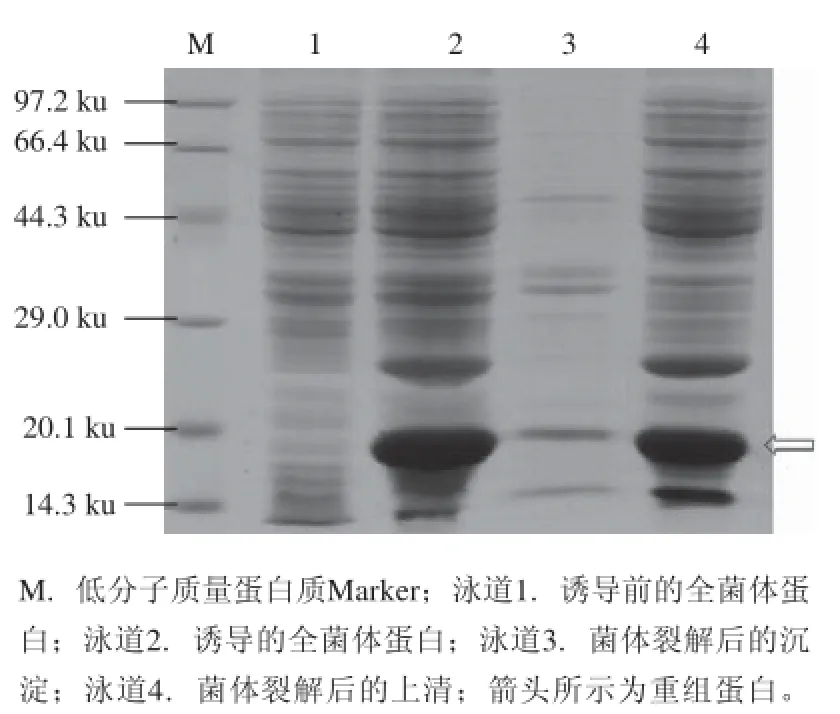
图6 重组蛋白LuxS的存在形式Fig.6 Detection of the form of recombinant protein LuxS
2.3 纯化条件的优化

图7 不同Native Elution Buffer对重组蛋白LuxS纯化的影响Fig.7 Effect of different types of native elution buffer on the purifi cation effi ciency of recombinant protein LuxS
由图7A可知,随咪唑浓度提高,Native Elution Buffer对LuxS蛋白的洗脱效果逐渐提高,咪唑浓度达到500 mmol/L后继续提高咪唑浓度洗脱效果无明显差异。所以选定500 mmol/L作为Native Elution Buffer的咪唑浓度。在500 mmol/L咪唑浓度的基础上继续优化Native Elution Buffer的pH值,SDS-PAGE分析结果(图7B)显示,随pH值降低Native Elution Buffer对LuxS蛋白的洗脱效果逐渐提高,pH值降至6.5时Native Elution Buffer洗脱效果最好,经4 mL的Native Elution Buffer洗脱后残留蛋白最少(图7B的泳道9)。
本研究对重组蛋白的纯化条件进行优化。采用Ni-NTA Purification System对重组蛋白进行纯化,镍离子亲和树脂与带有组氨酸标记的重组蛋白结合,通过漂洗去除杂蛋白后,对目的蛋白进行洗脱回收。重组蛋白的洗脱采用含有咪唑的溶液,咪唑作为一种竞争性取代剂,与重组蛋白竞争树脂上的结合位点,使重组蛋白得以洗脱[21]。本研究中先采用提高咪唑浓度的方法改善洗脱效果,发现效果并不太理想,进而又采用了降低洗脱液pH值的方法进行优化。较低的pH值可以减弱重组蛋白与树脂结合位点的作用,从而使重组蛋白更容易被竞争性洗脱[25]。不过过低的pH值对蛋白活性有影响,所以最终确定洗脱液的pH值为6.5。
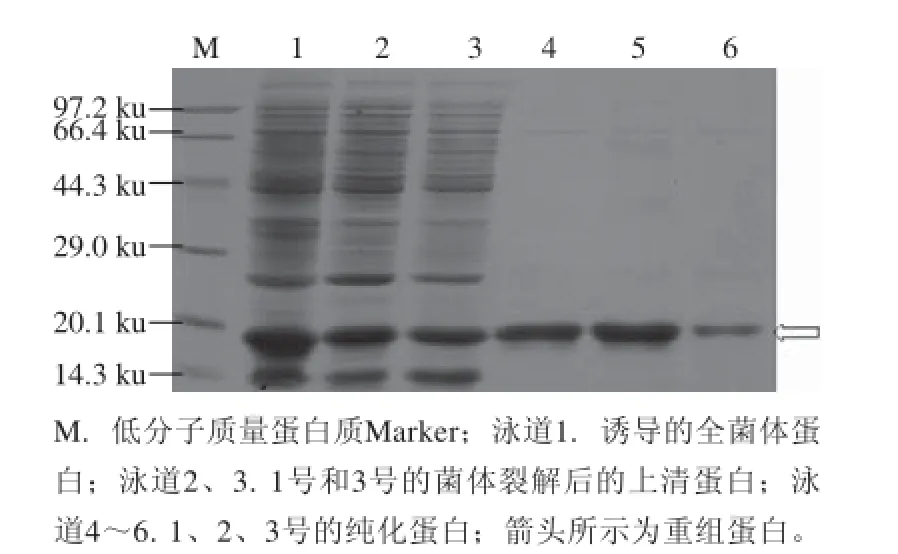
图8 不同结合缓冲液对重组蛋白LuxS纯化的影响Fig.8 Effect of different types of binding buffer on the purifi cation effi ciency of recombinant protein LuxS
在对洗脱液进行优化的同时,本研究也优化了蛋白与树脂结合的缓冲液,由图8可知,在用PBS重悬菌体得到的裂解上清中添加3 mol/L的NaCl后,进行重组蛋白LuxS的纯化,获得的纯化效果最好(图8泳道5)。NaCl可以减弱重组蛋白与树脂结合位点的结合,从而使重组蛋白在洗脱时更易被洗脱。
2.4 在优化条件下重组蛋白LuxS的合成

图9 在优化条件下重组蛋白LuxS的诱导表达与纯化结果Fig.9 Expression and purifi cation of recombinant protein LuxS
由图9可知,在优化条件下诱导表达并纯化得到重组蛋白LuxS,经透析、浓缩后对LuxS蛋白质量浓度进行测定,获得的重组蛋白质量浓度为5.23 mg/mL。以SAH为底物,经Pfs和LuxS蛋白催化,合成了具有生物活性的AI-2(图10),体外合成的AI-2活力约为阳性对照的6 倍,说明纯化得到的重组蛋白LuxS具有生物活性。

图10 AI-2的生物活性Fig.10 Determination of AI-2 activity
通过对重组蛋白诱导表达、纯化条件的优化,提高了重组蛋白的产量,获得了大量的重组蛋白LuxS。以SAH为底物,通过Pfs和LuxS蛋白的催化,成功合成了具有生物活性的AI-2,为后续研究AI-2信号分子的作用奠定基础。
3 结 论
本研究成功优化了重组蛋白LuxS的诱导表达条件及纯化条件,最佳诱导表达条件为:以LB培养基为诱导培养基,菌液OD600 nm为0.6~0.8,IPTG浓度为0.1 mmol/L,诱导温度为37 ℃,诱导时间为12 h。最佳纯化条件为:采用添加3 mol/L NaCl的PBS溶液作为蛋白与树脂结合的缓冲液,含500 mmol/L咪唑的Native Elution Buffer(pH 6.5)作为蛋白洗脱液对蛋白进行纯化。在优化条件下对重组蛋白LuxS进行诱导表达及纯化,获得5.23 mg/mL的重组蛋白LuxS。
[1] CAMILLI A, BASSLER B L. Bacterial small-molecule signaling pathways[J]. Science, 2006, 311: 1113-1116.
[2] TSAO C Y, WANG Liang, HASHIMOTO Y, et al. LuxS coexpression enhances yields of recombinant proteins in Escherichia coli in part through posttranscriptional control of GroEL[J]. Applied and Environmental Microbiology, 2011, 77(6): 2141-2152.
[3] 满丽莉, 孟祥晨, 王辉, 等. 群体感应系统在乳酸菌产细菌素中的作用[J]. 食品科学, 2011, 32(13): 360-364.
[4] SURETTE M G, MILLER M B, BASSLER B L. Quorum sensing in Escherichia coli, Salmonella typhimurium, and Vibrio harveyi: a new family of genes responsible for autoinducer production[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(4): 1639-1644.
[5] HOLMES K, TAVENDER T J, WINZER K, et al. AI-2 does not function as a quorum sensing molecule in Campylobacter jejuni during exponential growth in vitro[J]. BMC Microbiology, 2009, 9: 214. doi: 10.1186/1471-2180-9-214.
[6] CHEN X, SCHAUDER S, POTIER N, et al. Structural identifi cation of a bacterial quorum-sensing signal containing boron[J]. Nature, 2002, 415: 545-554.
[7] MILLER S T, XAVIER K B, CAMPAGNA S R, et al. Salmonella typhimurium recognizes a chemically distinct form of the bacterial quorum-sensing signal AI-2[J]. Molecular Cell, 2004, 15(5): 677-687.
[8] SAO C Y, HOOSHANGI S, WU H C, et al. Autonomous induction of recombinant proteins by minimally rewiring native quorum sensing regulon of E. coli[J]. Metabolic Engineering, 2010, 12: 291-297.
[9] HAN Xiangan, LU Chengping. In vitro biosynthesis of autoinducer 2 of Steptococcus suis serotype 2 using recombinant LuxS and Pfs[J]. Enzyme and Microbial Technology, 2009, 44: 40-45.
[10] PLUMMER P, ZHU Jinge, AKIBA M, et al. Identifi cation of a key amino acid of LuxS involved in AI-2 production in Campylobacter jejuni[J]. PLoS ONE, 2011, 6(1): e15876. doi: 10.1371/journal. pone.0015876.
[11] SCHAUDER S, SHOKAT K, SURETTE M G, et al. The LuxS family of bacterial autoinducers: biosynthesis of a novel quorum-sensing signal molecule[J]. Molecular Microbiology, 2001, 41(2): 463-476.
[12] WANG Qian, HE Zhiyan, HU Yuejian, et al. luxS mutant regulation: quorum sensing impairment or methylation disorder?[J]. Sensors, 2012, 12: 6176-6185.
[13] WINZER K, HARDIE K R, BURGESS N, et al. LuxS: its role in central merabolism and the in vitro synthesis of 4-hydroxy-5-methyl-3(2H)-furanone[J]. Microbiology, 2002, 148: 909-922.
[14] 赵日红, 孟祥晨, 满丽莉. 重组原核表达载体pQE-30-luxS的构建与表达[J]. 食品工业科技, 2013, 34(3): 150-154.
[15] 彭丽桃, 李琼, 刘合生, 等. 重组植物硫化激动素PSK-A融合蛋白诱导表达条件的优化[J]. 华中农业大学学报, 2007, 26(6): 865-870.
[16] LI M, VILLARUZ A E, VADYVALOO V, et al. AI-2-dependent gene regulation in Staphylococcus epidermidis[J]. BMC Microbiology, 2008, 8: 4. doi: 10.1186/1471-2180-8-4.
[17] JANG Yunji, CHOI Y J, LEE S H, et al. Autoinducer 2 of Fusobacterium nucleatum as a target molecule to inhibit biofilm formation of periodontopathogens[J]. Archives of Oral Biology, 2013, 58(1): 17-27.
[18] MÜHLE M, LÖCHELT M, DENNER J. Optimisation of expression and purifi cation of the feline and primate foamy virus transmembrane envelope proteins using a 96 deep well screen[J]. Protein Expression and Purifi cation, 2012, 81(1): 96-105.
[19] BIRD P I, PAK S C, WORRALL D M, et al. Production of recombinant serpins in Escherichia coli[J]. Methods, 2004, 32(2): 169-176.
[20] 陈伟, 刘文恩, 李艳华, 等. 艰难梭菌毒素B受体结合区CDB3融合蛋白诱导表达条件优化及其纯化[J]. 检验医学与临床, 2014, 11(6): 725-731.
[21] STUDIER F W. Protein production by auto-induction in high-density shaking cultures[J]. Protein Expression and Purifi cation, 2005, 41(1): 207-234.
[22] 叶姣, 陈长华, 夏杰, 等. 温度对重组大肠杆菌生长及外源蛋白表达的影响[J]. 华东理工大学学报, 2002, 28(4): 364-367.
[23] 任增亮, 堵国成, 陈坚, 等. 大肠杆菌高效表达重组蛋白策略[J]. 中国生物工程杂志, 2007, 27(9): 103-109.
[24] TUMER P, HOLST O, KARLSSON E N. Optimized expression of soluble cyclomaltodextrinase of thermophilic origin in Escherichia coli by using a soluble fusion-tag and by tuning of inducer concentration[J]. Protein Expression and Purifi cation, 2005, 39(1): 54-60.
[25] UEDA E K M, GOUT P W, MORGANTI L. Current and prospective applications of metal ion-protein binding[J]. Journal of Chromatography A, 2003, 988(1): 1-23.
Optimization of Expression and Purifi cation Conditions of Recombinant Protein LuxS
YANG Jie, ZHANG Yun, MENG Xiangchen*
(Key Laboratory of Dairy Science, Ministry of Education, Northeast Agricultural University, Harbin 150030, China)
Objective: To optimize the expression and purifi cation conditions of recombinant protein LuxS. Methods: The induction conditions, including medium components, induction temperature, bacterial biomass before induction, induction time and IPTG concentration were optimized by single-factor design. Recombinant protein was purified using Ni-NTA purifi cation system under native conditions. The optimum native elution buffer was determined by comparing the effects of imidazole concentration and native elution buffer pH on purifi cation effi ciency. The optimum binding buffer for protein and resin was determined by comparing the effects of different types of binding buffer on purifi cation effi ciency. Results: The optimum conditions for expression of recombinant protein were determined as follows: when the OD600 nmreached 0.6-0.8, using LB medium as the induction medium, the induction was initiated with 0.1 mmol/L IPTG at 37 ℃ for 12 h. PBS buffer containing 3 mol/L NaCl was used for the binding of protein and resin. The recombinant protein was eluted with native elution buffer (pH 6.5) containing 500 mmol/L imidazole. The biological activity of the synthesized AI-2 in vitro, which was produced catalytically by Pfs and recombinant protein LuxS obtained in this study, was approximately 6-fold higher than that from the positive control. Conclusion: The expression and purifi cation conditions of recombinant protein LuxS were optimized, and the recombinant protein LuxS with bioactivity was obtained. Finally, AI-2 was synthesized successfully in vitro.
recombi nant protein; LuxS; induced expression; purifi cation; autoinducer-2 (AI-2)
TS201.3
A
1002-6630(2015)19-0170-06
10.7506/spkx1002-6630-201519030
2014-10-21
教育部博士学科点专项科研基金项目(20122325110017);黑龙江省教育厅科学技术研究(重点)计划项目(12521Z002)
杨杰(1990-),男,硕士研究生,研究方向为食品微生物与生物技术。E-mail:yangjingjie1990902@163.com
*通信作者:孟祥晨(1970-),女,教授,博士研究生,研究方向为食品微生物与生物技术。E-mail:xchmeng@163.com
