纳豆芽孢杆菌(Bacillus natto)发酵鱿鱼碎肉的工艺优化
2015-12-20令狐青青童晓倩王秋萍罗红宇
令狐青青,张 雪,童晓倩,王秋萍,罗红宇,宋 茹
(浙江省海产品健康危害因素关键技术研究重点实验室,浙江海洋学院食品与医药学院,浙江 舟山 316022)
纳豆芽孢杆菌(Bacillus natto)发酵鱿鱼碎肉的工艺优化
令狐青青,张 雪,童晓倩,王秋萍,罗红宇,宋 茹*
(浙江省海产品健康危害因素关键技术研究重点实验室,浙江海洋学院食品与医药学院,浙江 舟山 316022)
为进一步提高鱿鱼碎肉的利用价值,本实验以鱿鱼碎肉作为纳豆芽孢杆菌发酵基质,研究料液比、葡萄糖添加量、发酵pH值、发酵时间和发酵温度对鱿鱼碎肉发酵效果的影响。在以单因素试验确定发酵时间72 h和发酵温度37 ℃的条件后,再对料液比、发酵pH值和加糖量进行三因素三水平的Box-Behnken响应面试验分析,以发酵液的氨基态氮含量为响应值,得到纳豆芽孢杆菌发酵鱿鱼碎肉最佳条件为:料液比1∶1.2(m/V)、发酵pH 8.8和加糖量3.13%。在最优发酵条件下,鱿鱼碎肉发酵液的氨基态氮实际含量达到2.457 mg/mL。氨基酸分析结果显示鱿鱼碎肉发酵液富含具有鲜味和甜味特征的谷氨酸(84.141 mg/g)、天冬氨酸(49.480 mg/g)和甘氨酸(49.425 mg/g),达到氨基酸总量的39.05%。必需氨基酸总量为149.320 mg/g,占氨基酸总量的31.86%。Sephadex G25凝胶过滤层析显示鱿鱼碎肉纳豆芽孢杆菌发酵液由多肽、小肽及游离氨基酸组成。
鱿鱼碎肉;纳豆芽孢杆菌;发酵;响应面法;氨基酸组成;相对分子质量分布
发酵在人类文明史上有着悠久的应用历史,食物通过微生物的发酵作用,不仅能够延长保质期,而且发酵作用还可以提高食物的感官品质和营养价值[1-3]。纳豆芽孢杆菌(Bacillus natto)属细菌科,芽孢杆菌属,是制备发酵食品常用的一种有益菌,最早分离自传统发酵豆制品--纳豆[4]。1987年Sumi等[5]报道从纳豆中提取出对人体无任何毒副作用的溶血栓物质--纳豆激酶(nattokinase,NK),积极地推动了国内外对纳豆芽孢杆菌及其发酵产物的研究热潮。
纳豆芽孢杆菌除了用于发酵豆制品外,还可用于一些药用动植物的发酵,如海参、金针菇等经纳豆芽孢杆菌发酵后具有溶栓作用[6-7]。近几年,在大力倡导食物原料综合加工利用、提高原料“零浪费”背景下,一些食品加工副产物,如:豆粕[8-10]、啤酒糟[11]、米糠[12]等也被用作纳豆芽孢杆菌发酵基质,有效地拓宽了纳豆芽孢杆菌的应用范围。纳豆芽孢杆菌能够分泌多种蛋白酶[4,13],这些蛋白酶能将发酵基质中蛋白质分解为易被人体吸收利用的寡肽和氨基酸,据报道纳豆芽孢杆菌发酵制品多具有抗氧化[12,14-16]、抑菌[17-18]、抗癌[19]等生理活性。
鱿鱼碎肉是鱿鱼加工过程中产生的边角料,这些碎肉蛋白质含量高、营养丰富,采用添加商业蛋白酶进行水解的方式可以制备功能型鱿鱼蛋白酶解液[20-22],但是商业蛋白酶成本较高。本实验以鱿鱼碎肉为发酵基质,结合纳豆芽孢杆菌发酵技术以期提高碎肉蛋白的利用价值,在研究发酵影响因素基础上对发酵工艺条件进行优化,分析发酵液的氨基酸组成和相对分子质量分布,旨在为鱿鱼碎肉后续的新型应用以及纳豆芽孢杆菌发酵水产动物蛋白研究提供理论和技术依据。
1 材料与方法
1.1 材料与试剂
鱿鱼碎肉,由舟山富丹旅游食品有限公司提供,-20 ℃冻藏。
纳豆芽孢杆菌(Bacillus natto) 中国工业微生物菌种保藏管理中心;蛋白胨、琼脂粉 杭州天和微生物试剂有限公司;酵母浸膏 中国医药集团上海化学试剂有限公司;其余化学试剂均为国产分析纯。
1.2 仪器与设备
HWS-270型恒温恒湿培养箱 宁波东北仪器有限公司;HZQ-B全温培养摇床 金坛市华城开元实验仪器厂;LD2X-40BI型立式电热压力蒸汽灭菌器 上海申安医疗器械厂;722型分光光度计 上海精密科学仪器有限公司;L-8900型氨基酸分析仪 日本东京日立公司;HL-2S型恒流泵、BS-160A自动部分收集器 上海沪西分析仪器厂有限公司。
1.3 方法
1.3.1 纳豆芽孢杆菌冻干菌粉复活
将纳豆芽孢杆菌冻干管在无菌条件下开管,用无菌吸管吸取0.5 mL左右LB液体培养基(酵母浸膏5.0 g、蛋白胨10.0 g、NaCl 10.0 g,蒸馏水1 000 mL,调节pH 7.0)溶解冻干菌粉,将溶解后菌悬液转移至盛有5 mL的LB液体培养基试管中,在37 ℃条件下培养24 h,然后再用LB液体培养基转接2~3 代恢复菌种活力,最后将菌种转接到LB固体斜面培养基质中,4 ℃条件下冷藏保存。
1.3.2 鱿鱼碎肉发酵培养基制备
将鱿鱼碎肉解冻,清洗干净,加入一定量水后在打浆机中打浆,调节浆液pH值,按照鱿鱼碎肉质量加入一定量葡萄糖,然后在121 ℃灭菌15 min,得鱿鱼碎肉发酵培养基,备用。
1.3.3 单因素试验优化发酵工艺
在发酵工业中常用甲醛滴定法测定发酵液中氨基态氮含量的变化,以了解可被微生物利用的氮源及利用情况,同时甲醛滴定法也反映出蛋白质水解程度[23]。本实验在250 mL锥形瓶中固定鱿鱼碎肉发酵培养基装量为50 g,将1.3.1节中斜面保藏的纳豆芽孢杆菌用LB液体培养基活化至菌悬液浓度约为106个/mL,然后根据鱿鱼碎肉发酵培养基中碎肉质量以2%比例接入相应体积的纳豆芽孢杆菌菌悬液。以发酵液的蛋白质含量和氨基态氮含量为指标,分别研究鱿鱼碎肉发酵培养基中鱿鱼碎肉质量与水体积比(料液比,m/V)(1∶2、1∶3、1∶4、1∶5)、发酵时间(24、48、72、96 h)、发酵初始pH值(6.0、7.0、8.0、9.0)、葡萄糖添加量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%)和发酵温度(27、32、37、42 ℃)对鱿鱼碎肉发酵培养基的发酵效果影响。
1.3.4 响应面优化发酵工艺
在发酵单因素研究基础上,进行三因素三水平Box-Behnken响应面分析试验,以发酵液的氨基态氮含量为响应值,采用Design Expert(v ersion 7.1.4, USA)软件对试验结果进行Quadratic模型拟合。
1.3.5 蛋白质含量测定
采用考马斯亮蓝法[24]测定。做法如下:取稀释适当倍数的发酵液1 mL,加入5 mL考马斯亮蓝试剂(自行配制),振荡混合,室温下放置5 min,测定595 nm波长处的吸光度(A),其中蒸馏水代替样品在同样反应条件下为调零管,牛血清白蛋白为标准品。
1.3.6 发酵液中氨基态氮含量测定
采用甲醛电位滴定法[23]测定。
1.3.7 氨基酸组成分析
取鱿鱼碎肉发酵液冻干品(红褐色,黏稠状)50 mg,加入15 mL 6 mol/L的HCl溶解,在110 ℃条件下氮气保护水解22 h,冷却后转移至25 mL容量瓶中,定容。取200 μL用55 ℃氮气吹干,加入1 mL蒸馏水再烘干,反复3 次,再用1 mL的0.02 mol/L HCl溶解,经0.45 μm滤膜过滤后取滤液20 μL上氨基酸分析仪分析。
1.3.8 发酵液的相对分子质量分布
采用凝胶过滤法对鱿鱼碎肉发酵液的相对分子质量分布进行分析,具体洗脱条件为:发酵液经0.45 μm滤膜过滤,取1.0 mL滤液上Sephadex G25分离柱(1.6 cm×56 cm),去离子水洗脱,流速为1.0 mL/min,每3 min收集一管,逐管检测280 nm波长处的光密度值,以洗脱体积(mL)为横坐标,OD280 nm值为纵坐标,采用Origin Pro 8.5绘图软件绘制鱿鱼碎肉发酵液的相对分子质量分布图。以牛血清白蛋白(Mr68 000)、抑肽酶(Mr6 512)、VB12(Mr1 355)和氧化型谷胱甘肽(Mr613)为相对分子质量标准物质,在相同条件下洗脱,判定鱿鱼碎肉发酵液的相对分子质量分布范围。
2 结果与分析
2.1 发酵条件的单因素试验结果


图1 纳豆芽孢杆菌发酵鱿鱼碎肉的单因素试验结果Fig.1 Infl uence of fermentation conditions on protein and amino nitrogen contents
由图1a可知,当料液比为1∶3(m/V)时,鱿鱼碎肉发酵液的蛋白质含量最低,而氨基态氮含量则保持在较高水平。纳豆芽孢杆菌以鱿鱼碎肉为营养物质,通过自身分泌蛋白酶将碎肉中的蛋白质水解为多肽、小肽和氨基酸,使得发酵液中氨基态氮含量增加。当料液比为1∶4时,发酵液的氨基态氮含量降低明显,可能与菌体直接吸收利用小分子肽和游离氨基酸并作为营养物质有关。而当料液比加大到1∶5时,发酵液中氨基态氮含量与料液比1∶4时相比无明显变化,说明在料液比1∶4~1∶5范围发酵液的氨基态氮物质产生量与被菌体利用量保持平衡。
当料液比一定时,发酵液中蛋白质含量和氨基态氮含量相互影响更为明显,如图1b所示,当发酵时间在24~72 h时,发酵液中蛋白质含量随着发酵时间的延长而急剧地降低,而氨基态氮含量则是大幅度地增加。当发酵时间大于72 h时,纳豆芽孢杆菌分泌的蛋白酶减少,而且菌体也逐渐进入衰亡期,对营养物质需求减少,所以发酵液中蛋白质和氨基态氮含量变化平缓。
由图1c可知,当鱿鱼碎肉发酵培养基的pH值为6.0~8.0时,发酵液中氨基态氮含量呈增加趋势。当发酵pH值为8.0时,发酵液中氨基态氮含量达到最高值,而当pH值为9.0时,虽然发酵液的蛋白质含量与pH 8.0时的蛋白质含量相比无明显变化,但是氨基态氮含量则明显降低,可能与pH值过高不利于纳豆芽孢杆菌分泌蛋白酶有关。而且菌体又会优先吸收发酵液中小肽和氨基酸小分子物质作为氮素营养,结果加快了发酵液中氨基态氮含量的降低。潘进权[25]曾报道一株高产蛋白酶的纳豆芽孢杆菌在优化的培养基上生长繁殖,当发酵起始培养基pH值在8.0~8.5时有利于该菌种发酵产酶。所以,图1c中pH 8.0时鱿鱼碎肉发酵液的氨基态氮含量较高,可能与该pH值条件下纳豆芽孢杆菌产酶量大或酶活力高有关。
在蛋白发酵基质中加入适当外源糖可以提供菌体生长所需碳源,能加快菌体的生长繁殖速率,促进代谢产物的产生[26],而发酵液中氨基酸及肽类物质的积累实际上是菌体吸收利用和代谢形成这些产物相互平衡的结果。图1d结果显示,当葡萄糖添加量从0.5%增加到1.5%时,发酵液中蛋白质含量几乎保持不变,但是氨基态氮含量急剧降低,应与菌体快速生长繁殖需要大量氮素营养且发酵液中小分子肽及氨基酸类被优先吸收作为氮素营养有关。当葡萄糖添加量在1.5%~3.0%时,发酵液中氨基态氮含量变化平缓,说明发酵液中氨基态氮类物质处于生成和被菌体利用的动态平衡中。但是当葡萄糖添加量为3.5%时,发酵液中氨基态氮含量急剧地增加,可能与葡萄糖添加量高导致发酵液渗透压变大,纳豆芽孢杆菌的生长繁殖速率变慢,结果氨基态氮物质被菌体吸收利用速率降低,从而造成发酵液中氨基态氮类物质的大量积累。
由图1e可知,在发酵温度为37℃时,鱿鱼碎肉发酵液中蛋白质含量最低,而氨基态氮含量则保持在较高水平,说明该温度下纳豆芽孢杆菌产酶活性高,有效地促进了鱿鱼碎肉蛋白水解为小肽和游离氨基酸,与文献报道的纳豆芽孢杆菌适宜产酶及发酵温度35~38 ℃具有一致性[25,27]。
2.2 响应面分析优化发酵条件
在固定发酵时间72 h和发酵温度37 ℃条件下,选择料液比、发酵pH值和加糖量进行三因素三水平Box-Behnken响应面试验分析,因为氨基态氮含量有助于反映蛋白质的水解程度以及菌体吸收利用发酵液中小分子肽和游离氨基酸情况,所以选取氨基态氮含量为响应值,对纳豆芽孢杆菌发酵鱿鱼碎肉条件进行优化。在综合考虑发酵液中氨基态氮含量变化规律(单因素试验结果)基础上,设计料液比、发酵pH值和加糖量的因素水平及编码值,具体Box-Behnken响应面试验设计方案及结果见表1。
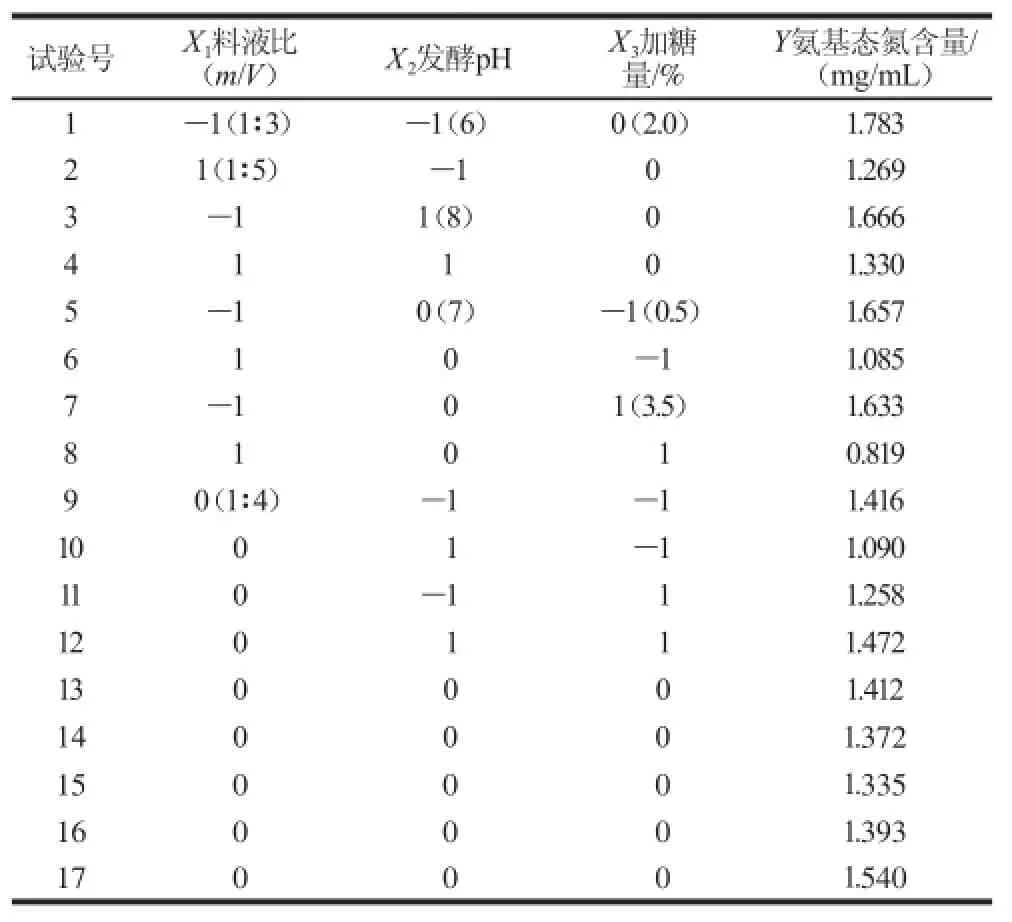
表1 Box-Behnken响应面试验设计及结果Table 1 Box-Behnken design with experimental values of amino nitrogen content
对表1结果进行Quadratic拟合,确定氨基态氮含量(Y)与料液比(X1)、发酵pH值(X2)和加糖量(X3)回归方程为:Y=8.064 34-0.873 53X1-1.163 94X2-0.195 37X3+0.044 33X1X2-0.040 44X1X3+0.090 22X2X3+ 0.045 58X12+0.056 08X22-0.069 96X32。

表2 Box-Behnken响应面试验方差分析Table 2 Analysis of variance (ANOVA) of response surface quadratic model
对表1结果进行方差分析,结果见表2。模型P值为0.008 8(P<0.05),具有显著性,失拟项P值为0.114 8不显著(P>0.05),说明该模型能够预测实际结果。一次项X1和平方项X32对鱿鱼碎肉发酵效果有显著性影响(P<0.05),即:在发酵过程中要严格控制料液比和加糖量。此外,由表2还能够看出,X2X3交互作用P= 0.051 8,略高于0.05,表明发酵pH值和加糖量对发酵液中氨基态氮含量具有一定的交互作用。在固定发酵时间72 h和发酵温度37 ℃条件下,经拟合得出纳豆芽孢杆菌发酵鱿鱼碎肉最佳条件为:料液比1∶1.2、发酵pH 8.8、加糖量3.13%,该条件下发酵液的氨基态氮理论含量为2.687 mg/mL。在最优发酵条件下进行3 次平行发酵实验,测定鱿鱼碎肉发酵液的氨基态氮实际含量平均值为2.457 mg/mL,与模型预测理论值无显著性差异(P>0.05),所以响应面法确定的鱿鱼碎肉蛋白发酵条件比较稳定可靠。
2.3 氨基酸组成分析

表3 鱿鱼碎肉发酵液的氨基酸组成分析Table 3 Amino acid composition of fermented squid meat
由表3可知,鱿鱼碎肉发酵液中具有鲜味作用的谷氨酸含量为84.141 mg/g,占测定氨基酸总量的17.95%。另外两种与鲜味和甜味有关的天冬氨酸(49.480 mg/g)和甘氨酸含量(49.425 mg/g)分别占测定氨基酸总量的10.56%和10.54%。此外,该发酵液中的苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸这7 种必需氨基酸总量为149.320 mg/g,占测定氨基酸总量的31.86%。因此,鱿鱼碎肉经纳豆芽孢杆菌发酵后得到的发酵液不仅呈味氨基酸含量丰富,而且必需氨基酸含量较高,有进一步开发为功能型风味料的应用前景。
2.4 发酵液的相对分子质量分布

图2 鱿鱼碎肉发酵液的Sephadex G25凝胶过滤色谱图Fig.2 Chromatogram profi le of fermented squid meat isolated by Sephadex G25 gel
鱿鱼碎肉经纳豆芽孢杆菌在最优发酵条件下发酵,所得发酵液的凝胶过滤色谱图如图2所示,鱿鱼碎肉发酵液在280 nm波长处有特征吸收峰,且发酵液的茚三酮反应、双缩脲反应均呈阳性,说明该发酵液含有肽类和游离氨基酸。鱿鱼碎肉发酵液经Sephadex G25分离得到6 个分离峰,通过与相对分子质量标准物质的凝胶过滤图谱比较可知:鱿鱼碎肉发酵液中峰1组分应属于Mr介于1 500~6 000的多肽类,而其余5 个分离组分(峰2~峰6)应与小肽(Mr<1 500)和游离氨基酸有关。鱿鱼碎肉纳豆芽孢杆菌发酵液的肽谱解析有待于后续进一步研究。
3 结 论
本实验采用纳豆芽孢杆菌发酵法发酵鱿鱼碎肉,以期提高其利用价值,通过单因素试验确定发酵时间72 h和发酵温度37 ℃条件下,在此基础上进行响应面优化试验得出纳豆芽孢杆菌发酵鱿鱼碎肉的最佳发酵条件为:鱿鱼碎肉发酵培养基料液比为1∶1.2、发酵pH 8.8、加糖量3.13%。在此条件下,鱿鱼碎肉发酵液的氨基态氮实际含量达到2.457 mg/mL,该发酵液不仅鲜味和甜味风味氨基酸含量丰富,而且必需氨基酸含量高,发酵液中含有多肽、小肽及游离氨基酸。纳豆芽孢杆菌一般主要用于豆类食品的发酵,本实验研究结果表明鱿鱼碎肉可以作为纳豆芽孢杆菌发酵基质,为纳豆芽孢杆菌在水生生物蛋白高值化应用方面提供了技术依据。
[1] FRIAS J, MIRANDA M L, DOBLADO R, et al. Effect of germination and fermentation on the antioxidant vitamin content and antioxidant capacity of Lupinus albus L. var. Multolupa[J]. Food Chemistry, 2005, 92(2): 211-220.
[2] HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry, 2014, 160: 346-356.
[3] LIMON R I, PEÑAS E, TORINO M I, et al. Fermentation enhances the content of bioactive compounds in kidney bean extracts[J]. Food Chemistry, 2015, 172: 343-352.
[4] 孙晓鸣, 王萍, 陈静. 纳豆芽孢杆菌配伍发酵产中性蛋白酶的性质研究[J]. 江西农业大学学报, 2010, 32(1): 163-168.
[5] SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable chess natto, a typical and popular soybean food in the Japanese diet[J]. Experientia, 1987, 15: 1110-1111.
[6] 沈明花, 彭瀛, 宋晓琳. 金针菇发酵液的溶栓作用研究[J]. 食品科学, 2012, 33(17): 246-248.
[7] 杨慧宁, 张苓花, 王运吉. 海参液态发酵制备枯草杆菌蛋白酶的研究[J]. 水产科学, 2006, 25(11): 559-562.
[8] WANG Jianlei, LIU Zhemin, WANG Yue, et al. Production of a water-soluble fertilizer containing amino acids by solid-state fermentation of soybean meal and evaluation of its efficacy on the rapeseed growth[J]. Journal of Biotechnology, 2014, 187: 34-42.
[9] LU Zhiyong, GAO Xuejun, HUAN Jianguo, et al. Study on lysine and methionine content promotion of soybean meal by probiotic fermentation process[J]. Journal of Northeast Agricultural University: English Edition, 2012, 19(1): 62-67.
[10] 杨学娟, 陈钧, 张春晓, 等. 纳豆芽孢杆菌js-1固体发酵低温豆粕的工艺条件优化[J]. 中国粮油学报, 2012, 27(6): 20-26.
[11] 邹正. 以啤酒糟为基质发酵纳豆芽孢杆菌及其抗氧化肽研究[D]. 长沙: 湖南农业大学, 2012.
[12] 祁红兵, 陈钧, 何佳, 等. 纳豆芽孢杆菌发酵麸皮的抗氧化功能研究[J].中国粮油学报, 2008, 23(1): 32-35.
[13] 范荟, 韦荣编, 宋茹. 微生物发酵制备纤溶因子的研究进展[J]. 安徽农业科学, 2013, 41(31): 12452-12454.
[14] HATTORI T, OHISHI H, YOKOTA T, et al. Antioxidative effect of crude antioxidant preparation from soybean fermented by Bacillus natto[J]. LWT-Food Science and Technology, 1995, 28(1): 135-138.
[15] HE Rong, JU Xingrong, YUAN Jian, et al. Antioxidant activities of rapeseed peptides produced by solid state fermentation[J]. Food Research International, 2012, 49(1): 432-438.
[16] SONG Ru, WEI Rongbian, LUO Hongyu. Biochemical properties and stability of antioxidative activity of half-fi n anchovy (Setipinna taty) fermented product[J]. Journal of Aquatic Food Product Technology, 2015, 24(4): 397-410.
[17] 曹小红, 廖振宇, 王春玲, 等. Bacillus natto TK-1产脂肽的纯化、抑菌活性及其表面活性剂特性[J]. 中国生物工程杂志, 2008, 28(1): 44-48.
[18] 孙月娥, 钱和. 豆豉纤溶酶生产菌发酵液功能性研究[J]. 江苏调味副食品, 2005, 22(5): 22-25; 28.
[19] LEE J H, NAM S H, SEO W T, et al. The production of surfactin during the fermentation of cheonggukjang by potential probiotic Bacillus subtilis CSY191 and the resultant growth suppression of MCF-7 human breast cancer cells[J]. Food Chemistry, 2012, 131: 1347-1354.
[20] 夏松养, 罗红宇, 罗国立, 等. 酶解鱿鱼蛋白的制备[J]. 浙江海洋学院学报: 自然科学版, 2005, 24(3): 271-274.
[21] 靳挺, 高一勇, 武玉学, 等. 复合酶法水解鱿鱼蛋白及水解产物的研究[J]. 食品科技, 2008, 33(9): 79-83.
[22] 宋茹, 谢超, 崔晓旭. 酶解法制备鱿鱼蛋白抗氧化肽工艺优化[J]. 浙江海洋学院学报: 自然科学版, 2009, 28(3): 311-314.
[23] 吴谋成. 食品分析与感官评定[M]. 2版. 北京: 中国农业出版社, 2010: 63-64.
[24] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[25] 潘进权. 纳豆芽孢杆菌发酵产蛋白酶工艺优化[J]. 中国粮油学报, 2011, 26(9): 33-37.
[26] 陈洁, 黄佩佩, 宋茹. 枯草芽孢杆菌发酵鱼蛋白制备抗氧化型发酵液工艺的初步研究[J]. 浙江海洋学院: 自然科学版, 2011, 30(3): 254-258.
[27] 明飞平, 赵培静, 廖春芳, 等. 纳豆芽孢杆菌液体发酵条件的优化研究[J]. 现代食品科技, 2009, 25(6): 625-628.
Optimization of Fermentation Conditions of Minced Squid Meat by Bacillus natto
LINGHU Qingqing, ZHANG Xue, TONG Xiaoqian, WANG Qiuping, LUO Hongyu, SONG Ru*
(Zhejiang Provincial Key Laboratory of Health Risk Factors for Seafood, College of Food Science and Pharmacy, Zhejiang Ocean University, Zhoushan 316022, China)
In the present study, minced squid meat was used as the fermentation substrate for Bacillus natto to improve the application value of squid minced meat. The effects of liquid-solid ratio (1:2-1:5), glucose concentration (0.5%-3.5%), initial pH (6.0-9.0), fermentation time (24-96 h) and fermentation temperature (27-42℃) on the amino nitrogen content of fermented broth were evaluated. Using one-factor-at-a-time method, the fermentation time and temperature were selected as 72 h and 37 ℃, respectively. Subsequently, three variables including solid to liquid ratio (m/V), initial pH and glucose concentration were optimized by response surface methodology based on Box-Behnken design using the amino nitrogen content of fermented broth as the response. The optimal conditions for solid to liquid ratio, initial pH and glucose concentration were determined as 1:1.2, 8.8 and 3.13%, respectively. Experiments carried out under these conditions led to an amino nitrogen content of 2.457 mg/mL. Moreover, amino acid composition analysis demonstrated that the fermented squid minced meat was rich in glutamic acid (84.141 mg/g), aspartic acid (49.480 mg/g) and glycine (49.425 mg/g). These amino acids were responsible for umami and sweet taste characteristics with total content of 39.05%. The total essential amino acid concentration was 149.320 mg/g, accounting for 31.86% of all determined amino acids. In addition, the relative molecular weight distribution indicated that the fermented squid minced meat was composed of polypeptides, small peptides and free amino acids.
minced squid meat; Bacillus natto; fermentation; response surface methodology; amino acid composition; relative molecular weight distribution
TS254.9
A
1002-6630(2015)19-0148-05
10.7506/spkx1002-6630-201519026
2014-11-20
海洋公益性行业科研专项(201305013);浙江省科技厅重大科技专项重点农业项目 (2013C02003);
2013年度国家星火计划项目(2013GA700260);舟山市科技计划项目(2013C41008)
令狐青青(1994-),女,本科生,研究方向为食品科学与工程。E-mail:952553230@qq.com
*通信作者:宋茹(1976-),女,副教授,博士,研究方向为水产品加工与贮藏、食品化学与营养支持。E-mail:rusong@zjou.edu.cn
