浸提法、超声波法和微波法提取紫薯花色苷的抗氧化性比较研究
2015-12-20冯叙桥王晶晶杜玉慧
朱 璐,董 福,冯叙桥,王晶晶,3,杜玉慧,程 丞
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.渤海大学食品科学研究院,辽宁省食品安全重点实验室,辽宁 锦州 121013;3.辽宁医学院食品科学与工程学院,辽宁 锦州 121001)
浸提法、超声波法和微波法提取紫薯花色苷的抗氧化性比较研究
朱 璐1,董 福1,冯叙桥2,*,王晶晶1,3,杜玉慧1,程 丞1
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.渤海大学食品科学研究院,辽宁省食品安全重点实验室,辽宁 锦州 121013;3.辽宁医学院食品科学与工程学院,辽宁 锦州 121001)
本实验通过羟自由基(·OH)清除率、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、还原力、超氧阴离子自由基(O2-·)清除率、总抗氧化性和金属螯合能力6 个抗氧化测定方法对浸提法、微波辅助提取法和超声波辅助提取法提取的紫薯花色苷的抗氧化活性进行了综合评价。结果表明:除金属螯合能力较弱外,其余5 种抗氧化活性检测结果均表明紫薯花色苷具有一定的抗氧化能力,且5 种抗氧化活性检测结果一致性地表明微波辅助提取法、超声波辅助提取法和浸提法提取的紫薯花色苷抗氧化能力依次降低,它们都总体表现为对·OH、DPPH自由基、O2-·的清除能力较强,还原力和总抗氧化性次之,金属螯合能力最差;采用超声波或微波辅助提取有助于保持提取的紫薯花色苷的抗氧化活性,且微波辅助提取法效果最好;对紫薯花色苷抗氧化活性的检测和判定可以·OH、DPPH自由基和O2-·清除能力作为主要指标。
紫薯花色苷;抗氧化性;对比
目前,2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluence,BHT)、2-叔丁基对苯二酚(butylhydroquinone,TBHQ)等人工合成抗氧化剂可能对生物体有一定危害,如潜在的致畸性、致癌性,导致许多合成色素的使用受到限制,这使得天然抗氧化剂的发展得到重视[1-2]。流行病学研究已证实,增加水果、蔬菜和全麦食品的摄入,可降低慢性病(如癌症、心血管疾病)的发病率,这种情况要归因于植物中的抗氧化性化合物,主要发挥作用的是广泛存在于红、蓝、紫色水果,豆类,谷物和蔬菜等植物中的花色苷[3-6]。
紫薯除含有普通甘薯富含的营养素外,如维生素(VB1、VB2、VC和VE)、矿物质(Ca、Mg、K和Zn)、膳食纤维和碳水化合物,还含有大量的具有生物学特性和潜在价值的花色苷[7]。紫薯花色苷作为天然的黄酮类色素,不仅能直接、稳定地被血液吸收,产物没有任何毒副作用,而且具有抗氧化、抗突变、延缓衰老等功效[8-9]。Hwang等[10]的研究结果表明,紫薯花色苷可通过多种生化机制达到保护肝脏的作用。Zhang Zifeng等[11]通过小鼠的体内抗氧化实验说明,紫薯花色苷可有效地降低血糖水平。紫薯花色苷的这些功效使之在保健品领域受到普遍重视[12]。
紫薯由于其颜色呈紫色,可以判定其中含有大量的花色苷,它比其他果蔬(如:草莓、紫甘蓝、紫苏等)中的花色苷稳定性强,是花色苷的良好来源[13-14]。目前对紫薯花色苷抗氧化性的研究,多数拘于对一种提取方式提取物的抗氧化性研究[15-16]。本实验以3 种不同提取方法(浸提法、超声波辅助提取法和微波辅助提取法)提取的紫薯花色苷粗提取物为原料,采用羟自由基(·OH)清除率、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、铁离子还原力、超氧阴离子自由基(O2-·)清除率、总抗氧化性和金属螯合能力6 种抗氧化性检测方法对上述3 种提取方式所得紫薯花色苷的抗氧化活性进行评价,以说明不同提取方法对紫薯花色苷抗氧化性的影响;同时,为紫薯花色苷提取液抗氧化性的有效判定和测试提供参考依据,并探讨从人体保健角度快速有效利用植物中的生物活性物质、避免繁杂而漫长的具体成分确定过程的可能性。
1 材料与方法
1.1 材料与试剂
“越南”紫薯,于2013年9月下旬购于锦州果蔬批发市场。
柠檬酸、无水乙醇、水杨酸 天津市大茂化学试剂厂;30%过氧化氢溶液 天津市化学试剂厂;FeCl2天津市风船化学试剂有限公司;盐酸 锦州古城化学试剂厂;DPPH 东京化工厂;焦性没食子酸、FeCl3天津市光复科技发展有限公司;铁氰化钾 国药集团化学试剂有限公司;三氯乙酸 天津市福晨化学试剂厂。以上试剂均为分析纯。
1.2 仪器与设备
ML104电子天平、FE-20实验室pH计 梅特勒-托利多仪器(上海)有限公司;TD5A-WS型台式低速离心机湘仪离心机厂;UV-2550紫外-可见分光光度计 日本岛津公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;DF-101S集热式恒温加热磁力搅拌器 郑州长城科工贸有限公司;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;G70F23格兰仕微波炉 广州格兰仕微波炉电器制造有限公司;HH-6数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 紫薯花色苷提取
以Liu Xingli[17]、余凡[18]和顾红梅[19]等的研究为基础,本课题组得到了浸提法、超声波辅助提取法和微波辅助提取法提取紫薯花色苷的最佳工艺参数。浸提法:提取剂是质量分数为8%的柠檬酸水溶液、提取时间3 h、料液比1∶70(m/V)、提取温度70 ℃;超声波法:料液比1∶60(m/V)、提取时间42.7 min,柠檬酸的质量分数为5.2%,提取温度72 ℃,超声功率180 W;微波法:微波功率630 W,提取时间50.73 s,提取剂是质量分数为6.48%的柠檬酸水溶液,料液比1∶83.86(m/V)。在4 800 r/min条件下离心25 min,60 ℃旋转蒸发一段时间,直至溶液黏稠。先置于超低温冰箱一段时间,后放于干燥器,制成紫薯花色苷粗提取冻干粉。配制不同质量浓度的紫薯花色苷溶液,于4 ℃冰箱中保存待用。
1.3.2 羟自由基(·OH)清除能力测定
参照Smironff等[20]的方法,略有改进。H2O2与Fe2+反应产生·OH,在体系中加入水杨酸捕捉并产生有色物质,该物质在510 nm波长处有最大吸收。分别取8.8 mmol/L H2O2、10.0 mmol/L FeSO4、10.0 mmol/L水杨酸(用无水乙醇溶解、定容)1.0 mL于比色管中,再加入不同质量浓度的紫薯花色苷溶液各1.0 mL。最后以1.0 mL 8.8 mmol/L H2O2启动反应,在37 ℃水浴中反应30 min,以体积分数40%乙醇(pH 3.2)作空白对照,在510 nm波长处测定反应液的吸光度。·OH清除率按下式计算。

式中:A0为1.0 mL 40%乙醇(pH 3.2)+1.0 mL H2O2+ 1.0 mL FeSO4+1.0 mL水杨酸+1.0 mL H2O2反应体系的吸光度;A1为1.0 mL紫薯花色苷溶液+1.0 mL H2O2+ 1.0 mL FeSO4+1.0 mL水杨酸+1.0 mL H2O2反应体系的吸光度;A2为1.0 mL紫薯花色苷溶液+1.0 mL H2O2反应体系的吸光度。
1.3.3 DPPH自由基清除能力测定
准确称取0.002 5 g DPPH粉末,用无水乙醇溶解、定容于100 mL容量瓶,避光保存、备用。取2.0 mL不同质量浓度的紫薯花色苷溶液于10.0 mL比色管中,加入2.0 mL上述的DPPH溶液,摇匀,避光室温保存30 min,用紫外-可见分光光度计于517 nm波长处测吸光度,以无水乙醇作空白[21-22],重复3 次实验,计算IC50值(IC50为清除率达到50%时,所需抗氧化剂的质量浓度(mg/mL))。

式中:A1为2.0 mL DPPH溶液+2.0 mL紫薯花色苷溶液反应体系的吸光度;A2为2.0 mL紫薯花色苷溶液+ 2.0 mL无水乙醇反应体系的吸光度;A0为2.0 mL DPPH溶液+2.0 mL无水乙醇反应体系的吸光度。
1.3.4 还原力测定
参照Tuba等[23]的方法,略有改进。取2.0 mL不同质量浓度的紫薯花色苷溶液,加入2.0 mL质量分数为1%的铁氰化钾溶液,混匀后,放于50 ℃水浴锅加热20 min,让其充分反应,迅速冷却,加入2.0 mL质量分数为10.0%的三氯乙酸溶液,离心,取2.0 mL上清液,加入2.0 mL蒸馏水、0.4 mL 质量分数为0.1%的FeCl3溶液。室温静置10 min,用紫外-可见分光光度计于700 nm波长处测吸光度,根据吸光度大小判断紫薯花色苷的还原力,吸光度越大,还原力越强。
1.3.5 超氧阴离子自由基(O2-·)清除能力测定
邻苯三酚在Tris-HCl(pH 8.2)环境中会发生自氧化反应,其产物在紫外光区内有强烈的吸收[24]。参照蔡碧琼等[25]的方法,略有改进,取4.5 mL 50 mmol/L Tris-HCl(用NaOH溶液调节溶液pH值至8.2)于试管中,在25 ℃水浴中加热20 min,加入2.0 mL不同质量浓度的紫薯花色苷溶液,然后加入0.4 mL 25 mmol/L邻苯三酚溶液(用8.0 mmol/L HCl配制),摇匀,在25 ℃水浴中加热4 min,以2 滴8.0 mol/L HCl终止反应,用体积分数40%的乙醇溶液作为空白对照,在320 nm紫外条件下测定吸光度。

式中:A0为4.5 mL Tris-HCl+0.4 mL邻苯三酚+2 滴40%乙醇反应体系的吸光度;A1为4.5 mL Tris-HCl+2.0 mL紫薯花色苷溶液+0.4 mL邻苯三酚+2滴8 mol/L盐酸反应体系的吸光度;A2为4.5 mL Tris-HCl+2.0 mL紫薯花色苷溶液反应体系的吸光度。
1.3.6 总抗氧化性测定[26]
钼酸铵法之所以能测定抗氧化性,是因为在具有抗氧化活性物质的作用下,Mo6+被还原为Mo5+,且Mo5+的磷酸盐在酸性条件下呈绿色。钼酸铵工作液的配制:分别取13.34 mL浓硫酸、4.26 g磷酸钠、1.98 g四水合钼酸铵于烧杯中,加入400.0 mL蒸馏水,充分溶解。取0.3 mL不同质量浓度的紫薯花色苷溶液,加入3.0 mL钼酸铵工作液,于95 ℃水浴中加热90 min,待溶液冷却后,以钼酸铵工作液作空白,用紫外-可见分光光度计在695 nm波长处测定反应液的吸光度。
1.3.7 金属离子螯合能力测定
参照Chung等[27]的方法,略有改进。取2.4 mL不同质量浓度的紫薯花色苷溶液,依次加入30 μL 2.0 mmol/L FeCl2溶液、0.06 μL 5 mmol/L菲咯嗪溶液,混合均匀,静置10 min,用紫外-可见分光光度计于562 nm波长处测定吸光度,以40%乙醇作空白。

式中:As为测试样的吸光度;A0为对照样的吸光度。
1.4 数据分析
所有实验重复3 次,采用Origin8.5作图,并用SPSS 17.0软件进行显著性分析。
2 结果与分析
2.1 ·OH清除能力
·OH是对机体危害最大的一种活性氧自由基,可造成生物体膜过氧化,蛋白质、核酸突变、损伤,有关研究表明,·OH与大多数的肿瘤、癌症、衰老、动脉硬化等有关[28-29]。紫薯花色苷能提供氢离子,可以把机体内有害自由基还原成稳定的化合物[30]。

图1 3 种提取法所得紫薯花色苷清除·OH的能力Fig.1 Hydroxyl radical scavenging activity of anthocyanins extracted from purple sweet potato by three extraction methods
由图1可知,紫薯花色苷质量浓度在0.005~0.025 mg/mL范围内,随着其质量浓度的增加,·OH清除能力逐渐增大;3 种方法提取物中·OH清除能力大小顺序为微波提取物>超声提取物>浸提法提取物,紫薯花色苷质量浓度在0.020 mg/mL时,浸提法、超声波、微波提取紫薯花色苷的·OH清除率分别为84.64%、91.36%、93.83%;在0.005~0.015 mg/mL时,微波提取物与浸提法提取物清除·OH能力差异显著(P<0.05),超声波提取物与浸提法提取物对·OH清除能力差异不显著(P>0.05)。用Origin 8.5软件对3 种提取方式进行线性拟合,结果表明,它们均具有良好的线性关系,R2都在0.98以上(表1)。实验结果表明,紫薯花色苷是一种可开发的天然色素,其清除·OH的能力很强,质量浓度在0.020 mg/mL时,·OH清除率就达到80%以上。

表1 3 种提取方法提取紫薯花色苷清除·OH能力的拟合方程Table 1 Linear concentration dependence of hydroxyl radical scavenging activity of anthocyanins extracted from purple sweet potato by three extraction methods
2.2 DPPH自由基清除能力
DPPH自由基在乙醇溶液中是一种稳定的自由基,呈紫色,在可见光区517 nm波长处有吸收峰。自由基清除剂与DPPH自由基结合,使之吸收消失,颜色褪去,且成定量关系,所以紫薯花色苷清除DPPH自由基的能力可用分光光度计进行定量分析[31]。

图2 3 种提取法所得紫薯花色苷清除DPPH自由基的能力Fig.2 DPPH free radical scavenging capacity of anthocyanins extracted from purple sweet potato by three extraction methods
由图2可知,紫薯花色苷质量浓度在0.005~0.035 mg/mL范围内,随着其质量浓度的增加,对DPPH自由基的清除能力逐渐增强。质量浓度为0.035 mg/mL时,浸提法、超声波、微波提取紫薯花色苷的清除率分别为78.32%、83.69%、88.32%。由图2可知,微波提取物、超声波提取物、浸提法提取物清除DPPH自由基的能力依次减小。DPPH自由基清除率与紫薯花色苷质量浓度线性关系良好(表2),表明DPPH自由基清除率与花色苷质量浓度正相关性显著。且质量浓度范围在0.005~0.010 mg/mL时,3 种提取物对DPPH自由基清除能力的差异不显著(P>0.05);在0.015~0.035 mg/mL时,微波提取物与浸提法提取物对DPPH自由基清除能力差异极显著(P<0.01),超声提取物与浸提法提取物对DPPH自由基清除能力差异显著(P<0.05)。

表2 3 种提取方法提取紫薯花色苷清除DPPH自由基的拟合方程Table 2 Linear concentration dependence of DPPH free radical scavenging capacity of anthocyanins extracted from purple sweet potato by three extraction methods
2.3 铁离子还原力

图3 3 种提取法所得紫薯花色苷的还原能力Fig.3 Ferric reducing power of anthocyanins extracted from purple sweet potato by three extraction methods
铁氰化钾测定姜黄素抗氧化性大小的实验表明[23],吸光度越大,物质的抗氧化能力越强。由图3可知,随着紫薯花色苷质量浓度的增加,吸光度逐渐增加,说明其铁离子还原能力增大。当紫薯花色苷质量浓度为0.30 mg/mL时,浸提法、超声波、微波提取紫薯花色苷的吸光度分别为0.490、0.560、0.594,铁离子还原能力大小依次为微波提取物、超声提取物、浸提法提取物;质量浓度范围在0.05~0.15 mg/mL时,3 种紫薯花色苷粗提取物的还原能力无明显差异;在0.20~0.30 mg/mL时,微波提取物和浸提法提取物的铁离子还原力差异极显著(P<0.01),超声波提取物与浸提法提取物的铁离子还原力差异显著(P<0.05)。
物质具有强还原能力,说明它可以提供电子,该电子不但可以使三价铁还原成二价铁,而且可使带电子的自由基变成稳定的化合物,所以活性物质的抗氧化能力与还原力有一定的相关性,即还原力大小可以反映该物质的抗氧化能力[32]。本实验结果表明,微波提取物的抗氧化能力较强。
2.4 超氧阴离子自由基(O2-·)清除能力
生物体的代谢中可产生O2-·,O2-·本身不仅可导致机体氧中毒,而且能使核酸、多糖和蛋白质突变、坏死[24,33]。在碱性条件下,邻苯三酚发生自氧化,产生O2-·,并生成在紫外光区有强烈吸收的中间产物,当O2-·受到抑制时,中间产物的积累也受到抑制,紫薯花色苷对邻苯三酚自氧化的抑制作用可间接的体现其对O2-·的清除能力[30]。由图4可知,质量浓度在0.005~0.035 mg/mL范围内,紫薯花色苷清除O2-·的能力随着其质量浓度的增加而增大;在质量浓度0.035 mg/mL时,浸提法、超声波和微波提取紫薯花色苷的O2-·清除率分别为78.18%、80.17%、82.67%,微波提取法、超声提取法、浸提法提取的紫薯花色苷的O2-·清除能力依次降低,IC50值同样说明该结果(表3)。质量浓度范围在0.005~0.020 mg/mL时,微波提取物、超声波提取物与浸提法提取物之间的O2-·清除率差异均极显著(P<0.01);在0.025~0.035 mg/mL时,3 种提取物的O2-·清除率差异不显著(P>0.05)。

图4 3 种提取法所得紫薯花色苷清除OO-2·的能力Fig.4 Superoxide anion scavenging capacity of anthocyanins extracted from purple sweet potato by three extraction methods

表3 3 种提取方法提取紫薯花色苷清除O-2·能力的拟合方程Table 3 Linear concentration dependence of superoxide anion radical scavenging capacity of anthocyanins extracted from purple sweet potato by three extraction methods
2.5 总抗氧化性
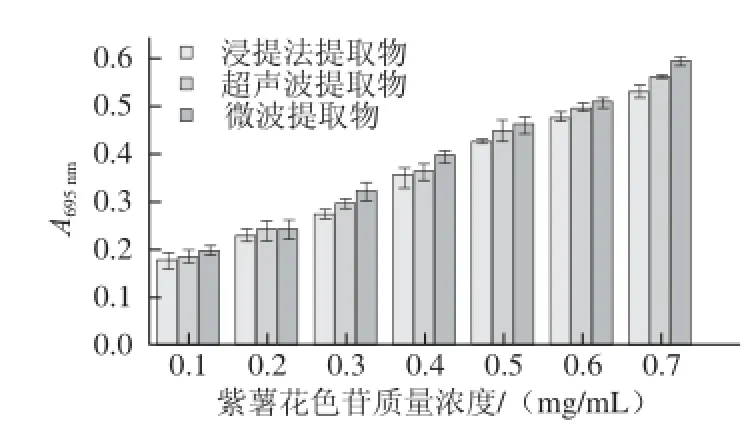
图5 3 种提取法所得紫薯花色苷提取物的总抗氧化能力Fig.5 Total antioxidant capacity of anthocyanins extracted from purple sweet potato by three extraction methods
由图5可知,质量浓度在0.10~0.70 mg/mL范围内,随着质量浓度的增加,紫薯花色苷的总抗氧化性呈增加趋势,3 种提取方式提取的紫薯花色苷总抗氧化性能力大小依次为微波提取法、超声提取法、浸提法,且质量浓度范围在0.1~0.2 mg/mL时,3 种提取物总抗氧化性差异不显著(P>0.05);在0.3~0.7 mg/mL时,微波提取物与浸提法提取物之间总抗氧化性差异显著(P<0.05)。以上结果在一定程度上说明,紫薯花色苷经过微波处理,对其生理功能保存较好,超声波处理次之,溶剂浸提处理对紫薯花色苷功能活性成分的影响较大。
2.6 金属离子螯合能力
过量的金属离子在生物体内可诱导脂质过氧化,并产生脂质过氧化物和自由基。菲咯嗪可与Fe2+结合产生紫红色络合物,而有些抗氧化剂能与Fe2+形成螯合物,使反应体系颜色变浅,通过颜色变化可评价该物质对Fe2+的络合能力,所以活性物质的金属螯合能力可间接地表示该物质抗氧化、清除自由基的能力[34-35]。

图6 超声波提取紫薯花色苷的金属螯合能力Fig.6 Metal ion chelating capacity of anthocyanins extracted from purple sweet potato by ultrasonic-assisted method
由图6可知,超声波提取物质量浓度范围在0~0.25、0~0.025 mg/mL时,随着紫薯花色苷质量浓度的增加,反应物的吸光度未见明显变化,通过计算,超声波提取物金属螯合能力只有(31.6±3.1)%左右。在相同条件下,重复微波法、浸提法提取的紫薯花色苷,得到的金属螯合能力分别为(33.1±2.8)%和(29.5±2.3)%。说明浸提法、超声波法和微波法提取的紫薯花色苷金属螯合能力均较差。Ebrahimzadeh等[36]的研究表明,果蔬黄酮类提取物的金属螯合能力较差;Ghasemi[37]、阎林茂[38]等的研究结果均说明,有些黄酮类提取物的金属螯合能力较差。本实验结果与上述几位学者的研究结果基本相符。
3 结论与讨论
以有关学者的研究为基础,用本课题组得到的浸提法、超声波法和微波法的最佳工艺参数提取紫薯花色苷,上述3 种花色苷粗提取物对·OH、DPPH自由基、O2-·的清除能力、铁离子还原力、总抗氧化性和金属螯合能力6 种抗氧化活性的检测说明,除金属螯合能力较弱外,其余5 种抗氧化活性检测结果均表明紫薯花色苷具有一定的抗氧化能力,且5 种抗氧化活性检测结果一致性地表明微波辅助提取法、超声波辅助提取法和浸提法提取的紫薯花色苷抗氧化能力依次降低,它们都总体表现为对·OH、DPPH自由基、O2-·的清除能力较强,还原力和总抗氧化性次之。
采用超声波或微波辅助提取有助于保持提取的紫薯花色苷的抗氧化活性,超声波辅助法提取的紫薯花色苷对·OH、DPPH自由基、O2-·清除能力的IC50值分别为0.010、0.021、0.021 mg/mL;微波辅助法提取的紫薯花色苷相对应的IC50值分别为0.009、0.020、0.020 mg/mL;浸提法提取的紫薯花色苷相对应的IC50值分别为0.011、0.023、0.022 mg/mL。
由上述结论可知,对紫薯花色苷的提取应采用微波辅助提取法,对其抗氧化活性的检测和判定可以·OH、DPPH自由基、O2-·清除能力作为主要指标。这样可以有效地对紫薯提取液的抗氧化性进行判定,方法简单、操作容易、节省时间,运用该方法可以快速地判断植物中可利用的功能活性成分。
[1] 周作渝. 对食用合成色素标准品的探讨[J]. 食品科学, 1992, 13(3): 57-58.
[2] 岳静, 方宏筠, 黄红光. 紫甘薯红色素的研究进展[J]. 辽宁农业科学, 2003(5): 22-25.
[3] SHIH P H, YEH C T, YEN G C. Effects of anthocyanidin on the inhibition of proliferation and induction of apoptosis in human gastric adenocarcinoma cells[J]. Food and Chemical Toxicology, 2005, 43(10): 1557-1566.
[4] ISABELLE M, LEE B L, MENG T L, et al. Antioxidant activity and profiles of common fruits in Singapore[J]. Food Chemistry, 2010, 123(1): 77-84.
[5] LIU Riuhai. Potential synergy of phytochemicals in cancer prevention: mechanism of action[J]. Journal of Nutrition, 2005, 134(Suppl 12): 3479-3485.
[6] HE Jian, GIUSTI M M. Anthocyanins: natural colorants with healthpromoting properties[J]. Annual Review of Food Science and Technology, 2010, 1: 163-187.
[7] SUDA, OKI T, MASUDA M, et al. Direct absorption of acylated anthocyanin in purple-fleshed sweet potato into rats[J]. Journal of Agricultural and Food Chemistry, 2002, 50(6): 1672-1676.
[8] KANO M, TAKAYANAGI T, HARADAH K, et al. Antioxidative activity of anthocyanins from purple sweet potato, Ipomoera batatas cultivar Ayamurasaki[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(5): 979-988.
[9] 杨贤松, 杨占苗, 高峰. 紫色甘薯色素的研究进展[J]. 中国农学通报, 2006, 22(4): 94-98.
[10] HWANG Y P, CHOI J H, YUN H J, et al. Anthocyanins from purple sweet potato attenuate dimethylnitrosamine-induced liver injury in rats by inducing Nrf2-mediated antioxidant enzymes and reducing COX-2 and iNOS expression[J]. Food and Chemical Toxicology, 2011, 49(1): 93-99.
[11] ZHANG Zifeng, LU Jun, ZHENG Yuanlin, et al. Purple sweet potato color attenuates hepatic insulin resistance via blocking oxidative stress and endoplasmic reticulum stress in high-fat-diet-treated mice[J]. Journal of Nutritional Biochemistry, 2013, 24(6): 1008-1018.
[12] ZHAO Jinge, YAN Qianqian, XUE Renyu, et al. Isolation and identifi cation of colourless caffeoyl compounds in purple sweet potato by HPLC-DAD-ESI/MS and their antioxidant activities[J]. Food Chemistry, 2014, 161: 22-26.
[13] LI Jie, LI Xiaoding, ZHANG Yun, et al. Identification and thermal stability of purple-fleshed sweet potato anthocyanins in aqueous solutions with various pH values and fruit juices[J]. Food Chemistry, 2013, 136(3/4): 1429-1434.
[14] KITA A, BAKOWSKA-BARCZAK A, LISINSKA G, et al. Antioxidant activity and quality of red and purple fl esh potato chips[J]. LWT-Food Science and Technology, 2014, 62(1): 525-531.
[15] 郭城, 张佳灵, 龚苗苗. 紫甘薯花色苷色素的抗氧化性与抑菌作用[J].中国调味品, 2014, 39(4): 1-4.
[16] SHAN Qun, ZHENG Yuanlin, LU Jun, et al. Purple sweet potato color ameliorates kidney damage via inhibiting oxidative stress mediated NLRP3 inflammasome activation in high fat diet mice[J]. Food and Chemical Toxicology, 2014, 69: 339-346.
[17] LIU Xingli, MU Taihua, SUN Hongnan, et al. Optimisation of aqueous two-phase extraction of anthocyanins from purple sweet potatoes by response surface methodology[J]. Food Chemistry, 2013, 141(3): 3034-3041.
[18] 余凡, 杨恒拓, 葛亚龙, 等. 紫薯色素的微波提取及其稳定性和抗氧化活性的研究[J]. 食品工业科技, 2013, 34(4): 322-326.
[19] 顾红梅, 张新申, 蒋小萍. 超声波法和冻结-融解法相结合提取紫薯中花色甙[J]. 食品科学, 2004, 25(7): 104-108.
[20] SMIRONFF N, CUMBES Q J. Hyroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1051-1060.
[21] SHARMA V, KUMAR H V, RAO L J M. Infl uence of milk and sugar on antioxidant potential of black tea[J]. Food Research International, 2008, 41(2): 124-129.
[22] GOLMOHAMADI A, MOLLER G, POWERS J, et al. Effect of ultrasound frequency on antioxidant activity, total phenolic and anthocyanin content of red raspberry puree[J]. Ultrasonics Sonochemistry, 2013, 20(5): 1316-1323.
[23] AK T, GÜLÇIN İ. Antioxidant and radical scavenging properties of curcumin[J]. Chemico-Biological Interactions, 2008, 174(1): 27-37.
[24] 王鸿飞, 刘飞, 徐超, 等. 费菜总黄酮碱法提取工艺及抗氧化活性[J].农业工程学报, 2012, 28(增刊1): 317-321.
[25] 蔡碧琼, 蔡珠玉, 张福娣, 等. 稻壳中黄酮提取物的抗氧化性质研究[J].江西农业大学学报, 2010, 32(4): 813-818.
[26] PRIETO P, PINEDA M, AGUILAR M. Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomolybdenum complex: specific application to the determination of vitamin E[J]. Analytical Biochemistry, 1999, 269(2): 337-341.
[27] CHUNG Y C, CHANG C T, CHAO W W, et al. Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1[J]. Journal of Agricultural and Food Chemistry, 2002, 50(8): 2454-2458.
[28] 肖军霞, 黄国清, 仇宏伟, 等. 红树莓花色苷的提取及抗氧化活性研究[J]. 食品科学, 2011, 32(8): 15-18.
[29] 余凡, 杨恒拓, 葛亚龙, 等. 紫薯色素的微波提取及其稳定性和抗氧化活性的研究[J]. 食品工业科技, 2013, 34(4): 322-326.
[30] 资名扬, 王琴, 温其标. 紫甘薯花色苷光谱特性及抗氧化性的研究[J].现代食品科技, 2009, 25(11): 1279-1281.
[31] 薛红玮, 牟德华. 不同品种紫甘薯体外抗氧化活性的比较[J]. 食品与机械, 2011, 27(1): 36-39.
[32] 张镜, 廖富林, 陈梓云, 等. 阴香果实花色苷的体外抗氧化活性[J].食品科学, 2011, 32(17): 128-132.
[33] 张燕平, 戴志远, 陈肖毅. 紫苏提取物体外清除自由基能力的研究[J].食品工业科技, 2003, 24(10): 67-70.
[34] 范金波, 蔡茜彤, 冯叙桥, 等. 五种天然多酚类化合物抗氧化活性的比较[J]. 食品与发酵工业, 2014, 40(7): 77-83.
[35] 楚文靖. 紫甘薯酒的加工和抗氧化活性研究[D]. 南宁: 广西大学, 2008.
[36] EBRAHIMZADEH M A, NABAYI S M, NABAYI S F. Correlation between the in vitro iron chelating activity and poly phenol and flavonoid contents of some medicinal plants[J]. Pakistan Journal of Biological Sciences, 2009, 12(12): 934-938.
[37] GHASEMI K, GHASEMI Y, EBRAHIMZADEH M A. Antioxidant activity, phenol and fl avonoid contents of 13 citrus species peels and tissues[J]. Pakistan Journal of Pharmaceutical Sciences, 2009, 22(3): 277-281.
[38] 阎林茂, 郭宇龙, 张延龙, 等. 百合花瓣酚类物质及其抗氧化活性的分析[J]. 食品科学, 2013, 34(7): 51-55.
Comparative Antioxidant Activities of Anthocyanins Extracted from Purple Sweet Potato by Organic Solvent, Ultrasonic-Assisted and Microwave-Assisted Extraction
ZHU Lu1, DONG Fu1, FENG Xuqiao2,*, WANG Jingjing1,3, DU Yuhui1, CHENG Cheng1
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China; 2. Food Safety Key Laboratory of Liaoning Provinve, Food Science Research Institute, Bohai University, Jinzhou 121013, China; 3. College of Food Science and Engineering, Liaoning Medical University, Jinzhou 121001, China)
The antioxidant activity of anthocyanins extracted from purple sweet potato by organic solvent, ultrasonicassisted or microwave-assisted extraction was comparatively evaluated by radical scavenging activities against hydroxyl, DPPH and superoxide anion radicals, total antioxidant capacity (TAC), reducing power and ferrous ion chelating activity. The results showed that the anthocyanins extracted from purple sweet potato, irrespective of the extraction method used, exerted antioxidant activities except for ferrous ion chelation. Moreover, the results from 5 antioxidant assays consistently indicated that the antioxidant capacity of anthocyanins extracted by microwave-assisted, ultrasonic-assisted and organic solvent extraction revealed a decreasing trend in turn. The extracted anthocyanins showed the strongest ability to scavenge free radicals followed by reducing power and total antioxidant capacity, and possessed the lowest ferrous ion-chelating activity. Both ultrasonic-assisted and microwave-assisted extraction are benefi cial for maintaining antioxidant activity of anthocyanins extracted from purple sweet potato, with the latter being superior to the former.
anthocyanins from purple sweet potato; antioxidant activity; comparison
TS20
A
1002-6630(2015)19-0083-06
10.7506/spkx1002-6630-201519015
2014-12-03
辽宁省科技厅重点项目(2011205001);渤海大学人才引进基金项目(BHU20120301)
朱璐(1989-),女,硕士研究生,研究方向为食品质量控制。E-mail:zhulu19@hotmail.com
*通信作者:冯叙桥(1961-),男,教授,博士,研究方向为农产品加工与贮藏工程。E-mail:feng_xq@hotmail.com
