鲢鱼酶解产物在冷冻鱼糜中的抗冻性能研究
2015-12-20李向红刘忠祥邓海萍刘永乐王发祥王建辉
李向红 刘忠祥 邓海萍 刘永乐 俞 健 王发祥 王建辉
(1.长沙理工大学食品与生物工程系,湖南 长沙 410114;2.湖南省水生资源食品加工工程技术研究中心,湖南 长沙 410114)
淡水鱼土腥味重、肌间刺多、加工过程中蛋白质易冷冻变性[1],导致其难以贮藏保鲜、加工率低。目前淡水鱼类仍以鲜销为主,鲜销过程中腐败率达30%以上,造成了极大的资源浪费。鲢鱼为中国四大家鱼之一,其价格低、产量大(2012年产量达368.78万t)[2]。近年来,中国一些水产品加工企业开始尝试将鲢鱼加工成冷冻鱼糜,一定程度上避免了其鲜销过程中的资源浪费。
鱼糜冻结过程中,蛋白质结合水部分被冻结,分子内部的次级键发生变化,导致蛋白质变性、鱼糜凝胶性能显著下降。工业生产中一般通过添加糖和糖醇类抗冻剂以防止鱼糜冻藏过程中的蛋白质变性[3],但糖和糖醇类抗冻剂会给鱼糜产品带来较明显的甜味,难以被消费者接受。已有研究[4-7]发现,鱼的酶解产物可作为一种潜在的蛋白质抗冻剂,酶解产物中的游离氨基酸、短肽等相比其他抗冻剂可增加水产品的营养价值,并且避免了甜味的产生[4]。然而,鲢鱼酶解产物在冷冻水产品中的应用研究尚属空白,本研究拟在前期研究[8,9]的基础上,采用复合蛋白酶和碱性蛋白酶对鲢鱼进行酶解,将酶解产物应用于冷冻鱼糜中,通过与常用抗冻剂对比,研究鲢鱼酶解产物对冷冻鱼糜色泽和凝胶结构等的影响,旨在为鲢鱼酶解产物的精深加工及开发利用提供试验依据。
1 材料与方法
1.1 材料与试剂
脱脂鲢鱼粉:本实验室自制;
复合蛋白酶(protamex):12万U/g,丹麦诺维信公司;
碱性蛋白酶(alcalase):20万U/g,丹麦诺维信公司;
异丙醇、氢氧化钠、浓盐酸等:分析纯,国药集团化学试剂有限公司;
17种氨基酸标准品:生化试剂纯,国药集团化学试剂有限公司。
1.2 仪器与设备
多功能粉碎机:JY-10A型,500g,天津浩瀚工贸有限公司;
自动发酵罐:BIOTEOH-5M-7000A型,上海保兴生物设备工程有限公司;
pH计:DELTA 320型,梅特勒—托利多仪器(上海)有限公司;
快速混匀器:SK-1型,江苏金坛市医疗仪器厂;
高速离心:LG10-24A型,北京金立离心机有限公司;
真空冷冻干燥机:FD-1型,北京博医康实验仪器有限公司;
紫外-可见分光光度计:UV2600型,上海舜宇恒平科学仪器有限公司;
全自动氨基酸分析仪:L8800型,日本日立公司;
质构仪:TA.XT.plus型,英国Stable Mico System Corp公司;
色差计:WSC-S型,上海仪电物理光学仪器有限公司;
场发射扫描电子显微镜:JSM-6700F型,日本电子公司。
1.3 试验方法
1.3.1 脱脂鲢鱼粉的制备工艺
新鲜鲢鱼→宰杀(去头、鳞、内脏)→冰水洗净→采肉→漂洗→脱水(3 000r/min,10min)→斩拌成糜→异丙醇脱脂(固液比1︰6,m︰V)→抽滤→二次萃取(固液比1︰4,m︰V)→抽滤→自然干燥48h→粉碎过筛(20目)→产品
1.3.2 鲢鱼酶解产物的制备 酶解过程一般在缓冲盐溶液中进行以保证酶解过程中pH的恒定,但是酶解产物后期干燥前需要进行脱盐处理,工作量很大。本试验酶解时间短,在原有研究[8,9]的基础上进行改进,以水溶液为底液进行酶解反应,分别选用复合蛋白酶和碱性蛋白酶对脱脂鱼粉进行酶解,制备酶解30min的酶解产物。
(1)复合蛋白酶酶解工艺:
脱脂鱼粉→均质(分散于水溶液中,底物浓度4.5%,m/V)→ 调节温度、pH (50℃、pH 7.0)→ 加酶(2%,m/V)→恒温水浴酶解(50℃,30min)→灭酶(90℃,10min)→ 离心(4 000r/min,10min)→上清液冷冻干燥→复合蛋白酶酶解产物
(2)碱性蛋白酶酶解工艺:
脱脂鱼粉→均质(分散于水溶液中,底物浓度3.5%)→调节温度、pH(60℃、pH 8.5)→加酶(1.5%,m/V)→恒温水浴酶解(60℃,30min)→灭酶(90℃,10min)→ 离心(4 000r/min,10min)→上清液冷冻干燥→碱性蛋白酶酶解产物
1.3.3 冷冻鲢鱼鱼糜的制备 为了考察鲢鱼酶解产物在冷冻鱼糜中的应用效果,将其添加于鱼糜中后在-20℃下冻藏,每7d取样1次。
(1)鱼糜制备工艺:
新鲜鲢鱼→清洗→三去(去头、去鳞、去内脏)→采肉→漂洗→脱水→冷却(0~10℃)→斩拌→分装→冻藏(-20℃,每7d取样1次)→解冻→擂溃→低温凝胶化(40℃,60min)→高温蒸煮(90℃,30min)→冷却→4℃冷藏过夜→备测样品
(2)操作要点:① 三去:鱼宰杀后,去头、去内脏、去鱼鳞,并刷除鱼腹腔黑膜;用4~10℃的冷水清洗干净后,将鱼体的温度降到10℃以下。② 采肉:对鱼脊和鱼腩采肉,剔除鱼刺和鱼骨,并避免将鱼皮上的暗色肉、脂溶性色素等混入到鱼肉中,该工序应尽量缩短时间,确保鱼肉温度不超过10℃。③ 漂洗:先用清水漂洗2次,再用2.5g/L盐水漂洗3次,每次漂洗3min,漂洗水温4~10℃;④ 脱水:采用3 000r/min离心脱水4min。⑤ 斩拌:鱼肉斩拌成糜后分别加入蔗糖—山梨醇(4%+4%)、2%PH、8%PH、2%AH、8%AH,分别斩拌混匀,斩拌温度4~10℃,添加量以鱼糜质量计。⑥ 分装:每组样品各以50g为一袋分装,用自封袋保存于-20℃中备用。⑦ 擂溃:将解冻好的鱼糜,加入3%的食盐,4~10℃条件下混匀。
1.4 检测方法
1.4.1 常规成分检测
(1)蛋白质含量的测定:凯氏定氮法,按GB 5009.5—2010执行,氮换算为蛋白质的系数为6.25;
(2)水分含量的测定:直接干燥法,按GB 5009.3—2010执行;
(3)灰分含量的测定:干法灰化法,按GB 5009.4—2010执行;
(4)脂肪含量的测定:索氏抽提法,按GB5009.6—2003执行。
1.4.2 氨基酸组成成分测定 精密称取0.05g左右样品于20mL安培瓶中,加入6mol/L盐酸10mL于酒精喷灯上封口,于110℃下加热12h。取出冷却后过滤,取0.2mL于60℃水浴蒸干,加入1.0mL流动相溶解并转入1.5mL离心管中,12 000r/min离心3min,置于4℃条件下避光保存。取5μL样品于1.5mL离心管中,加入50μL衍生试剂,涡旋震荡1min。取20μL注入全自动氨基酸分析仪,选择Na离子交换柱,记录色谱图,计算峰面积,以样品的峰面积与标准峰面积比较定量,以保留时间定性。流速为1 mL/min,在254nm条件下对脱脂鱼粉、PH和AH进行氨基酸成分分析。
1.4.3 氨基酸态氮含量测定 取脱脂鱼粉、PH和AH粉末溶于水,参照GB/T 5009.39—2003的方法测定氨基酸态氮含量。
1.4.4 酶解产物相对分子质量分布测定 采用体积排阻色谱(size exclusion chromatography,SEC—HPLC)测定酶解产物相对分子质量分布。称取一定质量冷冻干燥后的酶解产物样品,用0.1mol/L Na2SO4的磷酸盐缓冲液(0.1mol/L,pH 6.7)将样品溶解配制成5mg/mL的溶液,8 000r/min离心15min后取上清液用0.45μm微孔滤膜过滤,使用高效液相系统与TSKgel G2000SWXL凝胶柱分析酶解产物的相对分子质量分布。流动相为0.1mol/L的磷酸盐缓冲溶液(0.1mol/L Na2SO4,pH 6.7),洗脱速率1mL/min,检测波长220nm,柱温为25℃。
1.4.5 鱼糜凝胶强度的测定 分别取冻藏0,1,2,3,4周的空白组、蔗糖—山梨醇添加组、PH添加组、AH添加组测定凝胶强度变化。使用P/0.5探头,在室温下进行凝胶强度测定,每个样品测3次,结果取平均值[10]。
1.4.6 鱼糜 TPA全质构测定 分别取冻藏0,1,2,3,4周的空白组、蔗糖—山梨醇添加组、PH添加组、AH添加组,在室温下用质构仪的TPA(texture profile analysis)模型分析样品的硬度、弹性变化。用不锈钢P/36R圆柱形探头对样品进行二次连续挤压,每个样品测3次,结果取平均值[11]。
1.4.7 亨氏白度测定 在室温下将样品切成5mm厚的薄片,用WSC-S测色色差计测定样品色度,仪器采用标准白板校正。每组样品切5片,每片测5次,取25次平均值用于计算白度值W(whiteness)。
1.4.8 扫描电镜观察 分别取冻藏0,1,2,3,4周的空白组、蔗糖—山梨醇添加组、PH添加组、AH添加组用扫描电镜观察微观结构[12]。
1.5 统计分析
采用DPS V 7.05数据处理系统对试验所得数据进行方差分析。
2 结果与分析
2.1 脱脂鱼粉及其酶解产物的常规成分
由表1可知:经过常温条件下异丙醇二次萃取脱脂后的鲢鱼粉干基中脂肪含量不足1%,在水解过程中,可以有效避免因加热、氧化等因素造成的脂肪氧化及不良风味的产生,蛋白质含量达到91%左右,可直接用于后续酶解反应。以水溶液为底液进行酶解反应后,未经脱盐处理的酶解产物PH和AH的灰分含量较低,大大减少了酶解后产物的脱盐处理工作量。
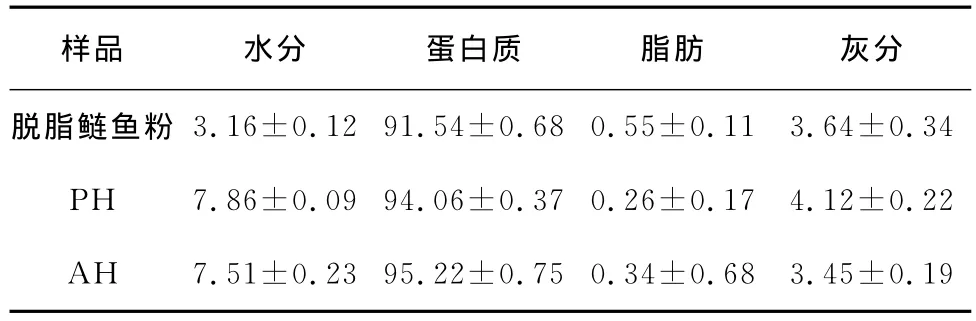
表1 脱脂鱼粉及酶解产物常规成分含量(干基)Table 1 The composition of the defatted silver carp power and the hydrolysates(dry base) %
2.2 脱脂鱼粉及酶解产物中的氨基酸组成
由表2可知:PH中的天冬氨酸、谷氨酸和赖氨酸相比脱脂鱼粉略有升高(P>0.05),已有研究[13,14]指出这几种氨基酸具有较好的抗冻性能;PH中的天冬氨酸和赖氨酸含量显著高于AH(P<0.05),研究[15,16]发现,赖氨酸和天冬氨酸、谷氨酸及精氨酸具有与自由水相互作用及优先使易受攻击的蛋白质水合的能力,这些氨基酸组合在一起是一种非常有效的抗冻成分。
表2 脱脂鱼粉及酶解产物中氨基酸组成分析Table 2 The amino acid composition analysis of defatted silver carp power and the hydrolysates (mg·g-1)
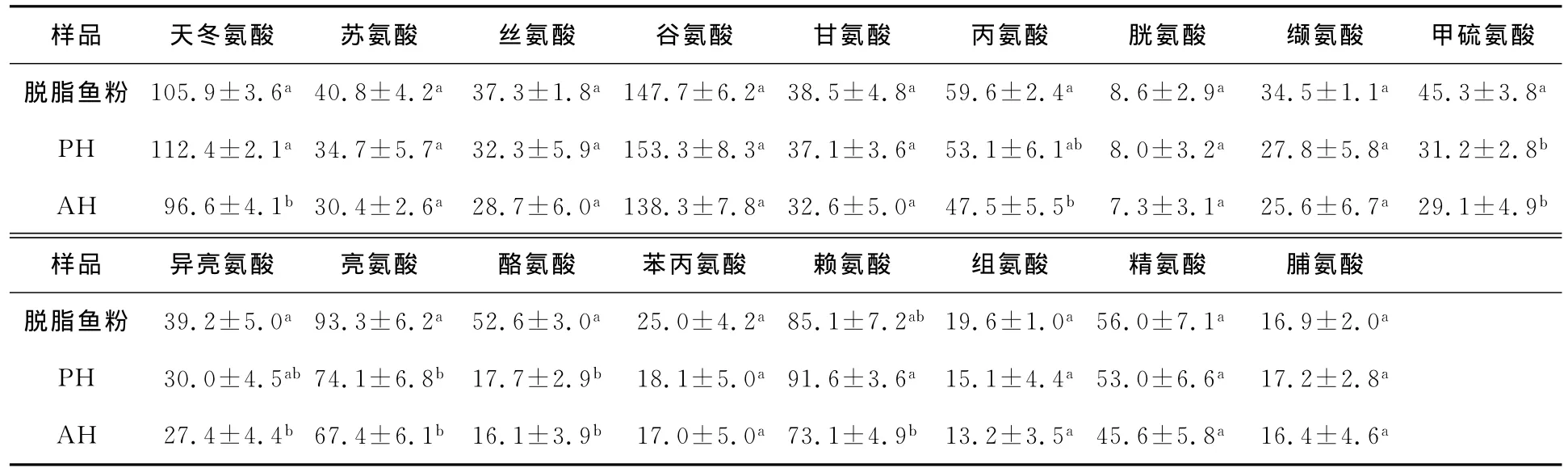
表2 脱脂鱼粉及酶解产物中氨基酸组成分析Table 2 The amino acid composition analysis of defatted silver carp power and the hydrolysates (mg·g-1)
同列不同字母表示在5%的水平上有显著性差异。
样品 天冬氨酸 苏氨酸 丝氨酸 谷氨酸 甘氨酸 丙氨酸 胱氨酸 缬氨酸 甲硫氨酸脱脂鱼粉 105.9±3.6a40.8±4.2a37.3±1.8a147.7±6.2a38.5±4.8a59.6±2.4a8.6±2.9a34.5±1.1a45.3±3.8a PH 112.4±2.1a34.7±5.7a32.3±5.9a153.3±8.3a37.1±3.6a53.1±6.1ab 8.0±3.2a27.8±5.8a31.2±2.8b AH 96.6±4.1b 30.4±2.6a28.7±6.0a138.3±7.8a32.6±5.0a47.5±5.5b 7.3±3.1a25.6±6.7a29.1±4.9b样品 异亮氨酸 亮氨酸 酪氨酸 苯丙氨酸 赖氨酸 组氨酸 精氨酸 脯氨酸脱脂鱼粉 39.2±5.0a93.3±6.2a52.6±3.0a25.0±4.2a85.1±7.2ab 19.6±1.0a56.0±7.1a16.9±2.0a PH 30.0±4.5ab 74.1±6.8b 17.7±2.9b 18.1±5.0a91.6±3.6a15.1±4.4a53.0±6.6a17.2±2.8a AH 27.4±4.4b 67.4±6.1b 16.1±3.9b 17.0±5.0a73.1±4.9b 13.2±3.5a45.6±5.8a16.4±4.6a
由表2还可以发现:PH和AH中其他氨基酸含量均低于脱脂鱼粉,可能与酶解产物中包含部分游离氨基酸有关。其中PH和AH中异亮氨酸、亮氨酸、丙氨酸和甲硫氨酸等疏水性氨基酸的含量明显减少(P<0.05),而前人研究[14]发现疏水性氨基酸是冷冻敏感物;此外,酶解产物中芳香族氨基酸—酪氨酸的含量也显著降低(P<0.05)。
2.3 脱脂鱼粉及酶解产物中的氨基酸态氮含量
脱脂鱼粉、PH和AH中氨基酸态氮的含量测定结果显示:脱脂鱼粉本身的氨基酸态氮含量很低,为(0.58±0.06)g/100g,经酶解后氨基酸态氮含量均有大幅上升。其中,PH的氨基酸态氮含量达到(2.31±0.13)g/100g,相比脱脂鱼粉提高了298.3%;AH的氨基酸态氮含量为(1.26±0.21)g/100g,较脱脂鱼粉提高了129.3%,酶解产物中氨基酸态氮含量增加,是因为酶解过程中部分鱼蛋白被酶水解形成游离态的氨基酸。AH中的氨基酸态氮含量低于PH的(P<0.05),可能是因为碱性蛋白酶属于内切酶,只能从蛋白质分子内部切割肽键,形成的是分子量较小的中间酶解产物;而复合蛋白酶既是内切酶,也是外切酶,能够同时从内部和两端对蛋白质分子进行水解,因此其产物中具有更高的氨基酸态氮含量[5]。
2.4 相对分子质量分布
由表3可知:PH和AH中都包含了不同分子质量的部分。其中,PH 包含了较高含量(7.8%)的大分子部分(>150 000Da)和相对分子质量为2 568Da的部分(相对百分含量达22.3%);而AH中不存在相对分子质量为2 568Da的部分,反而包含了较多相对分子质量小于1 400Da的组分,这可能与碱性蛋白酶对酶解底物有较高的亲和性有关[17]。相对分子质量分布的结果进一步证实了氨基酸态氮含量测定结果:碱性蛋白酶属于内切酶,形成的是分子量较小的中间酶解产物。
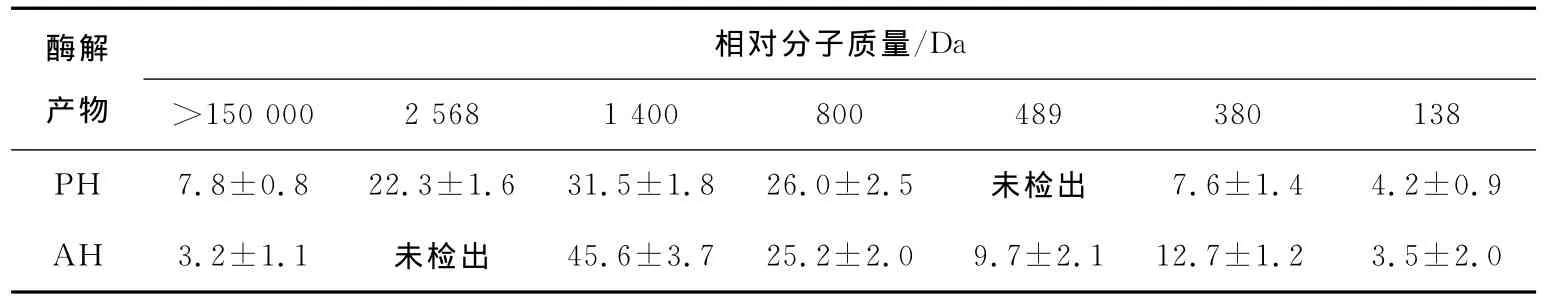
表3 酶解产物中每种分子质量部分的相对百分含量Table 3 Relative proportion of each molecular weight in PH and AH %
2.5 鱼糜凝胶强度的变化
凝胶强度是评价鱼糜品质的一项重要指标,随着添加物种类和量的变化,往往能改变样品的凝胶强度。由图1可知:添加了8%PH和8%AH的鱼糜组凝胶强度均出现了下降、恢复的波动变化,第4周的凝胶强度较冻藏前均有下降;而添加了蔗糖—山梨醇、2%PH和2%AH的鱼糜,凝胶强度较冻藏0周时均有提高。说明在本研究的冻藏时间段内,酶解产物与商业抗冻剂表现出了相类似的抗冻效果。从2.2、2.3分析结果可知:鲢鱼蛋白在酶解过程中形成了一定量的游离氨基酸和小分子肽,而且疏水性氨基酸减少,亲水性氨基酸比例增加,酶解产物可能通过氢键作用与冷冻时形成的冰晶相结合,包围在冰晶表面阻止其继续扩大,避免了对鱼肌原纤维蛋白的破坏,一定程度上保护肌原纤维蛋白在低温冷冻过程中冰晶的变大导致的蛋白质变性;此外,酶解产物可能也可以通过氢键、疏水相互作用等与鱼肌原纤维蛋白相互作用,在冷冻贮藏过程可以起到保护鱼蛋白的作用[14]。添加8%酶解产物的两组鱼糜样品其凝胶强度表现出比添加2%酶解产物的两组鱼糜低,可能是因为高浓度的较低分子量的酶解产物的添加,过多的氨基酸和肽与鱼肌原纤维蛋白相互作用[5],阻碍了鲢鱼蛋白形成稳定的凝胶网络结构。
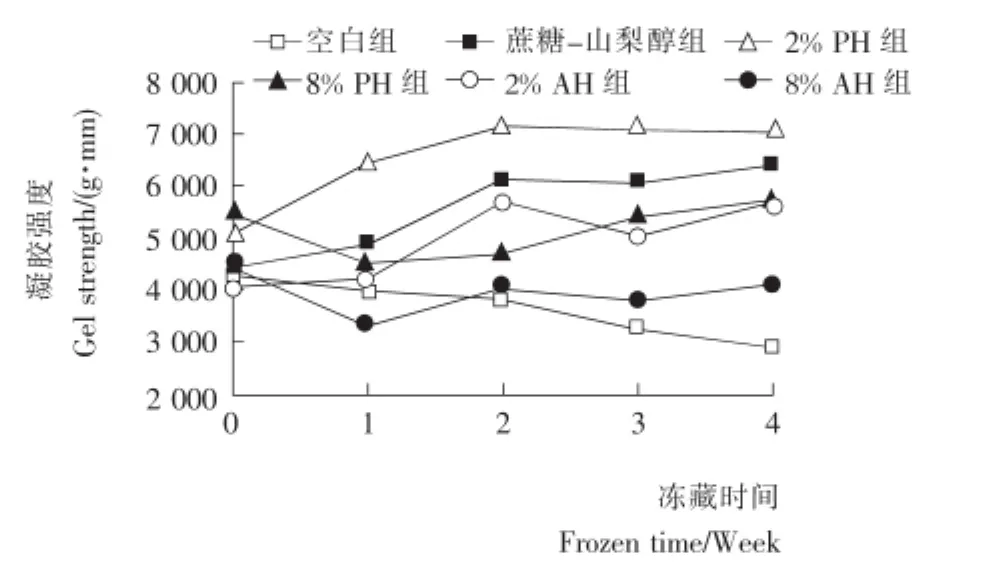
图1 冷冻鱼糜凝胶强度的变化Figure 1 The gel strength changes of frozen surimi
2.6 鱼糜硬度及弹性的变化
由图2可知:空白组样品在整个冻藏周期中硬度呈一直下降的趋势,添加酶解产物的鱼糜样品在冻藏的条件下,硬度总体而言有所下降。冻藏2周后,添加了商业抗冻剂和酶解产物的鱼糜样品其硬度均有逐渐上升的趋势。图3的结果也表明:随着冻藏时间的增加,6组鱼糜的弹性均略有降低。说明即使添加了商业抗冻剂或酶解产物,鱼糜在冷冻过程中,冰晶的形成导致可凝结水含量的降低,鱼肌原纤维蛋白一定程度的变性均会导致鱼糜品质降低。图3还显示:冻藏4周后,2%PH添加组具有略高的弹性。
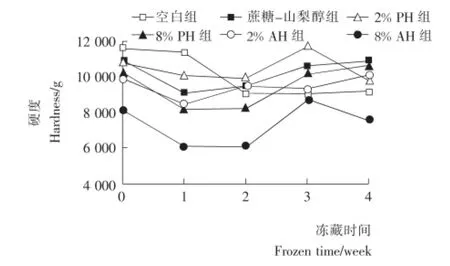
图2 冷冻鱼糜硬度的变化Figure 2 The hardness changes of frozen surimi
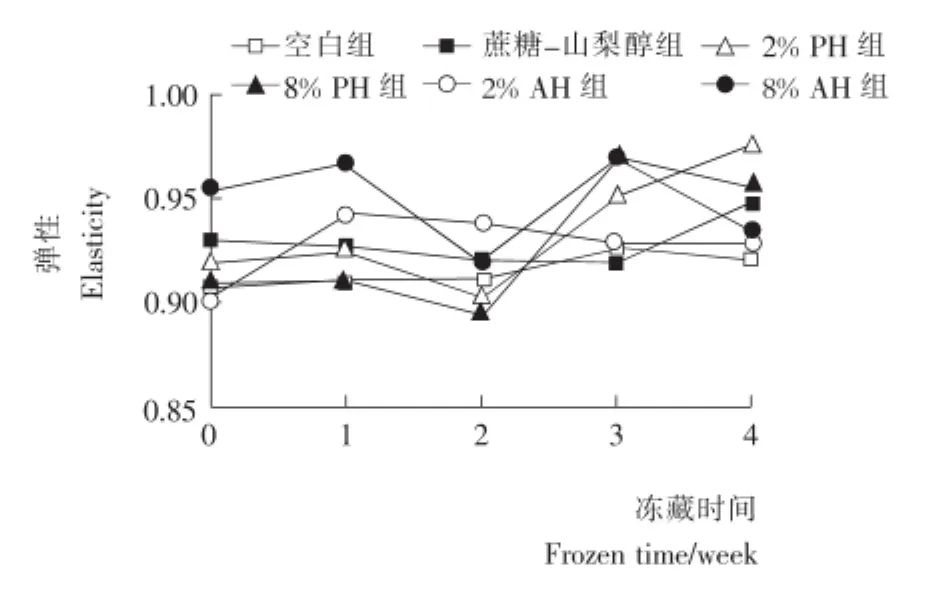
图3 冷冻鱼糜弹性的变化Figure 3 The elastic changes of frozen surimi
2.7 鱼糜白度的变化
由图4可知:随着冻藏天数的变化,鱼糜的白度变化不明显,说明在本研究的时间段内,冻藏条件下6组鱼糜样品的色泽受冷冻影响较小。
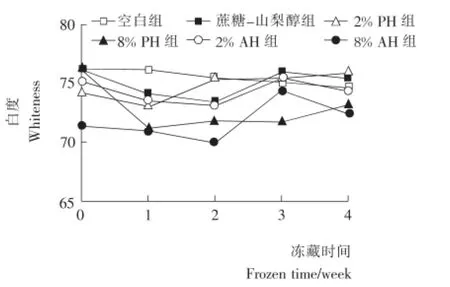
图4 冻藏鱼糜白度的变化Figure 4 The whiteness changes of frozen surimi
2.8 鱼糜微观结构的变化
由于微观结构观察图片较多,本试验仅选取冻藏4周后鱼糜样品的扫描电镜观察结果见图5。由图5可知:6组样品在冻藏过程中均出现了蛋白质分子聚集,表面产生空隙;而2%PH添加组和蔗糖—山梨醇添加组的鱼糜样品分子聚集现象较轻,鱼糜的品质虽然也有一定程度的下降,但相比其他3组样品,其孔隙较小,表面较为均匀。说明冻藏一定时间后,2%PH的加入同蔗糖—山梨醇这种商业抗冻剂一样,能在一定程度上延缓低温冻藏对鱼糜品质的不利影响,与前面凝胶强度和TPA的试验结果相吻合。Wang Shaoyun等[18]认为酶解产物中包含的700~2 500Da的混合组分比单个肽段对于冰的重结晶具有更重要的影响,Mueller等[19]也认为肽的尺寸及其氨基酸组成对于决定酶解产物的抗冻能力均有关键意义,结合本研究氨基酸分析和相对分子质量分布的结果,PH较AH含有更多赖氨酸和天冬氨酸,其分子质量组成中包含了22.4%的分子量为2 568Da的部分,所以添加一定比例的PH到鱼糜中有助于避免鱼肌原纤维蛋白的大幅冷冻变性,稳定鱼糜在冷冻过程中的凝胶结构。前人研究[20,21]也发现酶解产物的抗冻性能不但与其组成肽的分子量大小及各种肽的氨基酸组成有关,氨基酸序列也具有重要影响,游离氨基酸的具体组成也对酶解产物的抗冻性能有一定的影响[5],所以进一步研究中将对本研究中制备的PH肽的组成、序列及其发挥抗冻性能的具体机理进行研究。

图5 冷冻鱼糜微观结构的变化Figure 5 The microstructure of frozen surimi
3 结论
(1)PH中具有较高含量的酸性氨基酸和亲水性氨基酸;其氨基酸态氮含量为脱脂鱼粉的3.98倍。相对分子质量组成分布显示PH中包含了较多分子量较大的部分。
(2)在-20℃冻藏4周的情况下,2%PH添加组和蔗糖—山梨醇添加组的鱼糜凝胶强度和硬度有一定提高,其他样品的凝胶强度与冻藏0周的接近;随着冻藏天数的变化,6组样品的弹性均略有降低,一定程度上反应了鱼糜品质的变化;冻藏条件下各鱼糜样品的色泽受影响较小,白度变化不明显;扫描电镜结果显示,6组样品均出现了鱼蛋白分子聚集现象,而2%PH添加组和蔗糖—山梨醇添加组的鱼糜样品表面较为均匀孔隙较小,空白组和8%AH添加组鱼糜表面出现明显孔洞。
(3)在本研究的冻藏过程中,2%PH与蔗糖—山梨醇抗冻剂一样能在一定程度上延缓低温冻藏对鱼糜品质的不利影响,本研究表明鲢鱼酶解产物可以作为一种潜在的鱼糜抗冻剂,为鱼糜生产中鲢鱼酶解产物的应用提供了科学依据。
(4)本研究只进行了4周的冻藏试验,在今后的研究中将进一步延长研究时间并结合多次冻融循环试验,观察鲢鱼酶解产物在冷冻鱼糜中的作用效果及机理。
1 杨京梅,夏文水.大宗淡水鱼类原料特性比较分析[J].食品科学,2012,33(7):51~54.
2 中华人民共和国农业部渔业局.2013中国渔业统计年鉴[Z].北京:中国农业出版社,2013:23~31.
3 Matsumoto I,Ooizumi T,Arai K.Protective effect of sugar on freeze-denaturation of carp myofibrillar protein[J].Nippon Suisan Gakkaish,1985,51:833~839.
4 Korzeniowska M,Cheung I W Y,Li-chan E C Y.Effects of fish protein hydrolysate and freeze-thaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J].Food Chemistry,2013,138(2~3):1 967~1 975.
5 Cheung I W Y,Liceaga A M,Li-chan E C Y.Pacific hake(Merluccius Productus)hydrolysates as cryoprotective agents in frozen Pacific cod fillet mince[J].Journal of Food Science,2009,74(8):588~594.
6 Khan M A A,Hossain M A,Hara K,et al.Effect of enzymatic fish-scrap protein hydrolysate on gel-forming ability and denaturation of lizard fish Saurida wanieso surimi during frozen storage[J].Fisheries Science,2003,69(6):1 271~1 280.
7 薛勇.鳙鱼鱼糜抗冻变性剂及土腥味脱除方法的研究[D].大连:中国海洋大学,2006.
8 Liu Yong-le,Li Xiang-hong,Chen Zhi-jun,et al.Characteriza-tion of structural and functional properties of fish protein hydrolysates from surimi processing by-products[J].Food Chemistry,2014,151:459~465.
9 李向红,陈志军,刘永乐,等.鲢鱼酶解产物分子质量组成与抗氧化性[J].食品科学,2013,34(17):28~32.
10 Hiroko S,Yoshiyuki K,Kumazawa S,et al.Gel strength enhancement by addition of microbialtransglutaminase during onshore surimi manufacture[J].Journal of Food Science,1995,60(2):300~304.
11 陆剑锋,邵明栓,林琳,等.卡拉胶和超高压对鱼糜凝胶性质的影响[J].农业机械学报,2011,42(12):164~170.
12 陈海华,薛长湖.钙盐溶液漂洗对竹荚鱼鱼糜凝胶特性的影响[J].食品与机械,2009,25(5):5~9.
13 Heinz K A,Glofcheski D J,Lepock J R,et al.Mechanism of freeze–thaw damage to liver alcohol dehydrogenase and protection by cryoprotectants and amino acids[J].Cryobiology,1990,27(5):521~538.
14 Chen N J,Morikawa J,Hashimoto T.Effect of amino acids on the eutectic behavior of NaCl solutions studied by DSC[J].Cryobiology,2005,50(3):264~272.
15 Carpenter J,Crowe J.The mechanism of cryoprotection of proteins by solutes[J].Cryobiology,1988,25(3):244~255.
16 Schobert B,Tschesche H.Unusual solution properties of proline and its interaction with proteins[J].Biochimica et Biophysica Acta(BBA)-General Subjects,1978,541(2):270~277.
17 Klompong V,Benjakul S,Kantachote D,et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroidesleptolepis)as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1 317~1 327.
18 Wang Shao-yun,Damodaran S.Ice-structuring peptides derived from bovine collagen[J].Journal of Agricultural &Food Chemistry,2009,57(12):5 501~5 509.
19 Mueller J P,Liceaga A M.Characterization and cryoprotection of invasive silver carp(Hypophthalmicthysmolitrix)protein hydrolysates[J].Journal of Aquatic Food Product Technology,2014,DOI:10.1080/10498850.2013.832452.
20 Damodaran S.Inhibition of ice crystal growth in ice cream mix by gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry,2007,55(26):10 918~10 923.
21 Ho T C W.Feed attractants for juvenile Chinook salmon(Oncorhynchus tshawytscha)prepared from hydrolysates of Pacific hake(Merluccius productus)[D].Vancouver,BC,Canada:The University of British Columbia,2009.
