甜椒果实总蛋白质双向电泳优化体系的建立
2015-12-20蒋林惠郁志芳
蒋林惠,姜 丽,徐 银,许 昕,郁志芳
(南京农业大学食品科技学院,江苏南京210095)
甜椒果实总蛋白质双向电泳优化体系的建立
蒋林惠,姜丽,徐银,许昕,郁志芳*
(南京农业大学食品科技学院,江苏南京210095)
以甜椒果实“红方”为实验材料,对其果实总蛋白制备方法、蛋白提取液的pH、总蛋白的上样量、IPG胶条的pH范围及等电聚焦程序进行条件优化,建立了适用于甜椒果实总蛋白分析的双向电泳体系。结果表明,采用提取液为pH7.8的酚提法制备的甜椒果实总蛋白、17cm pH5~8的IPG胶条、上样1200μg进行66000VH等电聚焦和垂直凝胶电泳,经过考马斯亮蓝G-250胶体考染后得到可用于进一步质谱分析的电泳图谱,图谱的蛋白点分布均匀、背景清晰、分辨率高。经统计,其总蛋白点达到703±17个。
甜椒果实,蛋白质组学,双向电泳
甜椒(Capsicum annuum L.)又名菜椒,是茄科辣椒属辣椒的一个变种,分布较广,属于“非人工引种栽培”类型植物[1]。甜椒果实富含维生素C、微量元素和维生素K,是餐桌上的常见蔬菜。甜椒果实因采后仍是一个生命有机体故生理代谢活动依旧旺盛,贮运过程中易出现失水、衰老、腐烂等现象[2-3],严重影响果实的食用品质和商品性。目前,甜椒果实采后的相关研究主要集中在不同保藏方式对甜椒果实保鲜的影响,其内容涉及到货架期[4]、感官品质[5]、抗氧化成分[6-7]、能量代谢产物[8]等。
近年来,果实采后相关的蛋白质组学的研究已经开展起来。Linda等[9]对不同成熟度的草莓进行了蛋白质组学研究,鉴定出8种与成熟相关的蛋白。Yun等[10]研究发现4℃下不同贮藏期的柑橘有56个差异蛋白,其与糖代谢、氨基酸代谢、环境胁迫等有关。Zhang等[11]对桃果实进行热处理实验,其30个差异蛋白主要与胁迫反应和防御、细胞结构、蛋白代谢、能量代谢、成熟衰老相关,还有大概17%为功能未知。利用双向电泳技术将会为果蔬采后生理的研究带来更多的便利,然而原料品种的差异性需要针对性地优化双向电泳体系,以便获得优质的电泳图谱和可靠的实验结果。
目前对于辣椒蛋白质组学的研究仅有植株叶片病害蛋白质变化[12]、果实发育过程辣胎盘的蛋白差异[13]、有色体蛋白组分析[14]及甜椒果实的冷害机制研究[15]等,适用于甜椒果实的双向电泳体系仍有待优化。本研究期望通过甜椒果实总蛋白制备、双向电泳程序、上样量等双向电泳体系优化为后续果实成熟衰老机理和调控机制的深入研究提供技术平台。
1 材料与方法
1.1材料与仪器
实验材料为“红方”甜椒果实,甜椒采后立即运回实验室,充分散去田间热后,选择果形整齐、大小均匀一致、无病虫害、无机械损伤且成熟度一致的果实作为实验材料;固化pH梯度干胶条(IPG)、两性电解质(Bio-Lyte)、碘代乙酰胺(IAA)、四甲基乙二胺(TEMED)等购自美国Bio-Rad公司;二硫苏糖醇(DTT)、丙烯酰胺(Arc)、NN-甲叉双丙烯酰胺(Bis)、二甲氨基丙磺酸(CHAPS)、低熔点琼脂糖(LMP)、考马斯亮蓝G-250、尿素(Urea)、硫脲(Thiourea)、甘氨酸(Glycine)、β-巯基乙醇(β-Me)、十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷(Tris)、矿物油(Mineral oil)、过硫酸铵(Aps)、Tris-平衡酚等购自Sigma公司;三氯乙酸(TCA)、丙酮、甲醇、乙酸铵、硫酸铵、牛血清蛋白(BSA)等购自国药集团化学试剂有限公司,分析纯。
等电聚焦电泳系统Protein I 12 IEF美国伯乐公司;高重复性高通量大型垂直电泳EttanDALT Twelve GE-061-TY7119、Image ScannerⅢ扫描仪28-9076-07美国通用电气公司;DJ300精密电子天平北京赛多利斯仪器系统有限公司;GL-20G-Ⅱ高速冷冻离心机上海安亭科学仪器厂;85-1恒温磁力搅拌器、HH-6数显恒温水浴锅常州国华电器有限公司;Orion86802台面式pH/ISE测试仪上海纳锘仪器有限公司;XW-80A微型旋涡混合仪上海沪西分析仪器厂有限公司;WFJ UV-2802 PC紫外-可见分光光度计尤尼柯(上海)仪器有限公司。
1.2实验方法
1.2.1蛋白质制备方法
1.2.1.1TCA-丙酮法[16]果实样品在进行液氮研磨时加入2%(w/w)PVPP除酚。
1.2.1.2TCA丙酮-SDS法参照张丽等[17]的方法并稍加改进。用液氮研磨果肉时加2%(w/w)PVPP除酚。SDS缓冲液稍有改动(缓冲液中含有33mmol·L-1Tris-HCl(pH7.8),7.5%(w/v)蔗糖,5%(v/v)β-巯基乙醇,2%(w/v)SDS)。
1.2.1.3酚提法结合Shi Y等[18]的方法。果实样品进行液氮研磨是加入2%(w/w)PVPP除酚,蛋白提取液pH7.8。
1.2.1.4TCA丙酮-酚提法根据Wang等[19]的方法加以改进。果实样品在用液氮研磨时加入2%(w/w)PVPP除酚。SDS提取液pH7.8,配方同1.2.1.2。
1.2.2蛋白质的溶解每5g样品所得蛋白干粉加入400μL的蛋白质裂解液(7mol/L urea,2mol/L thiourea,4%(w/v)CHAPS,1%(w/v)DTT和0.5%(v/v)pH3~10IPG Buffer),在4℃下至沉淀完全溶解,4℃下10000×g离心30min,取上清液进行蛋白质定量,其余上清液分离备用。
1.2.3蛋白质含量的测定采用Bradford[20]方法(略有修改)进行蛋白质含量的测定。
标准蛋白质溶液:1mg/mL牛血清蛋白,-20℃分装1mL离心管中,每次使用取一份。
每次定量取10只10mL的试管,每管加入3mL染色剂1~7管中分别加入0~100μL不等的标准蛋白质溶液,另外3个管子分别加入10μL的待测样品,并用超纯水将反应体系补全至3.1mL。避光反应10min,在5~20min内595nm下测定反应液的吸光值。根据前7管的浓度和吸收值的关系绘制标准曲线,R2>0.999。根据标准曲线y=3.3507x2+4.8259x-0.0447计算样品蛋白质含量。
1.2.4双向电泳
1.2.4.1等电聚焦[17]第一向等电聚焦在等电聚焦仪上进行,其上样水化液体积为340μL,泡涨30min之后,每根胶条上覆盖3mL矿物油,50V电压下进行13h的泡涨。泡涨之后设置好等电聚焦程序,开始聚焦。聚焦结束的胶条,立即进行平衡及第二向垂直电泳。
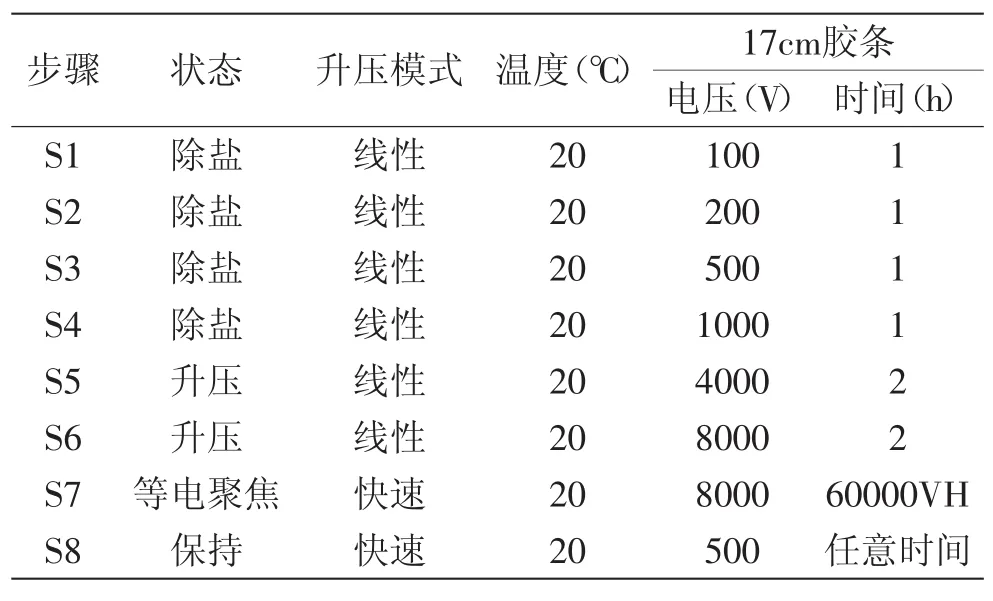
表1 17cm胶条的甜椒果实总蛋白双向电泳等电聚焦程序Table.1 The isoelectric focusing programme of the sweet pepper fruit’s total protein 2-DE with 17cm IPG strips
1.2.4.2IPG胶条的平衡[17]取出IPG胶条,超纯水清洗,滤纸晾干,后置于5mL胶条平衡缓冲液Ⅰ摇晃15min;平衡液Ⅱ进行平衡也是同样的操作。

表2 甜椒果实总蛋白双向电泳等电聚焦优化程序Table.2 The isoelectric focusing programme of the sweet pepper fruit’s total protein 2-DE
1.2.4.3第二向SDS-PAGE平衡结束后,进行第二向SDS-PAGE垂直电泳。胶浓度为12g/dL,电泳方式为恒功率,16℃冷水循环。起始恒功率1W/gel,1h后恒功率15W/gel进行到溴酚蓝指示剂达到底部边缘时即可。
1.2.4.4染色染色方法采用改良胶体考马斯亮蓝G-250染色法。在超纯水清洗后,加入固定液(甲醇∶乙酸∶水=4∶1∶5)固定2h,之后加入染色液(0.12%G-250、10%(v/v)磷酸、10%(w/v)硫酸铵、20%(v/v)甲醇)染色过夜,然后用脱色液(甲醇∶乙酸∶水=1∶1∶8)脱色至蛋白点清晰可见,凝胶背景清晰为止。
1.2.5凝胶图像采集与分析采用美国GE公司凝胶成像系统(Image ScannerⅢ扫描仪)对凝胶进行图像扫描,并用PDQuest 2-DE 8.0分析软件对图像进行分析。
1.2.6数据处理与分析双向电泳实验进行3次重复实验,实验数据采用EXCEL软件进行误差分析,数值表示为平均值±标准误差。
2 结果与分析
2.1不同总蛋白的制备方法对甜椒果实蛋白质2-DE图谱的影响
采用四种蛋白制备方法获取甜椒果实总蛋白,所得果实蛋白质含量如表3所示。从蛋白提取量来看,相对于其他方法,酚提法所得蛋白含量最高,而TCA-丙酮法所得蛋白含量低,无法获得足够的量进行双向电泳实验。
结合图1发现,酚提法所得双向电泳图谱横纹较少,蛋白点分布均匀、清晰且无明显的拖尾现象;TCA丙酮-酚法电泳图谱蛋白点稍有纵向拖尾,整体分离效果略次于酚提取法;TCA丙酮-SDS法电泳图谱蛋白点比较浅,不够清晰,不利于后期进行蛋白差异点的质谱分析。本实验选择酚提法进行甜椒果实总蛋白的制备,这与苹果果实[18]的研究结果相一致,而桃果实[17]和茭白[21]总蛋白所使用的也是酚提法,但其蛋白提取液的成分等与本实验仍有差异。番茄果实[22]的蛋白提取方法又不同于本实验所研究的提取方法。番茄子叶[23]的实验研究则发现,TCA丙酮沉淀法较适用。因此,不同的材料适用的蛋白提取方法是有差别的。本研究的以下实验均以酚提法获得的蛋白进行电泳体系研究。另外,在进行总蛋白提取时,根据样品含有酚类物质的情况考虑适当添加PVPP,用于去除酚类物质,提高总蛋白的纯度。总蛋白提取的缓冲液成分也可以根据材料的特殊性进行适当的修改,例如更换不同的蛋白酶抑制剂从而提高总蛋白的产量及质量。

图1 3种不同提取方法所得甜椒果实双向电泳图谱Fig.1 Comparison of 2-DE maps of sweet pepper fruit with different protein extraction
2.2提取液不同pH条件对甜椒果实蛋白质2-DE图谱的影响
提取液pH对蛋白提取率及后续双向电泳实验均有显著影响,进行材料的总蛋白提取时,提取液pH会因对象不同而有所差异。参考Paloma Sánchez-Bel[15]提取液pH,并结合文献Mariapina Rocco[24]、Cristina Barsan[25]设定蛋白提取液pH梯度7.5、7.8、8.5。实验结果表明,3种蛋白提取液对蛋白得率的影响不大,具体得率分别是(835.41±33.52)、(830.72±11.41)、(882.93±42.00)μg/g。以提取所得蛋白进行双向电泳,pH7.5、7.8、8.5的条件提取的蛋白点分别约521± 33、696±15、622±18(图2)。pH7.8的蛋白提取液所提蛋白进行双向电泳之后所得蛋白点个数最多。提取液的pH为7.8时,其所提蛋白的双向电泳图谱的清晰度及蛋白点的质量均为优良,无明显的横纹和低分子蛋白的纵向拖尾的现象(图2)。选择pH7.8作为甜椒总蛋白提取液的pH,与Sánchez-Bel的研究结果一致[15]。其他的研究发现,番茄果实[22]的蛋白提取液pH为7.5,桃果实[17]为8.35,香蕉果实[26]为9.0,不同材料所选用的较适合的蛋白提取液pH有所差异,具体pH需根据实际实验确定。

图2 提取液不同pH条件对甜椒果实蛋白质2-DE图谱的影响Fig.2 Comparison of 2-DE maps of sweet pepper fruit with different extracts pH conditions

表3 不同制备方法所获总蛋白质产量Table.3 The totel protein output of different protein extraction
2.3不同上样量对甜椒果实蛋白质2-DE图谱的影响
上样量不仅关系到蛋白点的个数、图谱的分辨率和清晰度等,同时也关系到实验结果的可靠性。因植物果实的特殊性,低丰度蛋白不容易在图谱中表现,适当增加上样量有利于低丰度蛋白出现。相反上样量过高则使高丰度蛋白斑点掩盖低丰度蛋白斑点,反而检测到的蛋白点减少[23]。蛋白样品的上样量与胶条的长度及pH范围有一定的联系,本实验所使用的IPG胶条的长度为17cm,根据产品说明书其承载蛋白样品水化液不大于400μL,蛋白样品约含量1000μg。同时参考文献[17,27],本研究设定800、1200、1400μg三个上样量进行双向电泳实验,2-DE图谱分析得三个上样量检出的蛋白点个数分别约706±10、717±17、655±26。图3表明,上样量为1200μg时,蛋白点数目最多、低丰度蛋白点也能被检出,且蛋白点分布均匀、没有明显拖尾现象、图谱最为清晰,能满足后续质谱分析的需要。文献研究发现,桃果实[17]的上样量选定为800μg,苹果果实[18]的上样量是1800μg,不同的物种进行双向电泳实验时,其上样量有所差异,这可能与总蛋白的成分有关。
2.4不同pH范围胶条对甜椒果实蛋白质2-DE图谱的影响
由图4可见,pH3~10的电泳图谱上蛋白点个数约456±27,其蛋白点较为集中,多点重叠,不能尽可能多的将蛋白点检测出来;pH5~8和pH4~7的电泳图谱蛋白点数分别约731±11和720±20。pH梯度为5~8和4~7的IPG胶条比pH梯度3~10的蛋白点增加了60.3%和57.8%。由此可见,窄pH梯度的IPG胶条能大幅度的提高蛋白的分辨率。对pH4~7和pH5~8的双向电泳图谱进一步分析,pH4~7的电泳图谱在pH4~5部分基本无蛋白点,蛋白点在pH5~7部分较为密集,使得一些等电点相近的蛋白难以得到有效的分离;而pH5~8的双向电泳图谱其蛋白点分布均匀,故而pH 5~8更适合用于辣椒的双向电泳。另外,pH4~7和pH5~8的电泳图谱碱性端出现垂直的条纹,这种垂直的条纹是胶条pH范围的限制。当pH>7或8时图谱中黑色垂直条纹是蛋白质被压缩的现象。虽然这会使得一部分蛋白信息丢失,但其图谱的分辨率和灵敏率得到一定的提高。综合以上分析表明,甜椒果实总蛋白在pH5~8的区域有最好的展现,因此选用pH5~8的IPG胶条进行后续的实验分析。本实验结果与黄劲松等[27]在蕨菜总蛋白双向电泳的研究结果相一致,而不同于桃[17]和番茄[22]果实总蛋白双向电泳体系中IPG胶条的选择。

图3 不同上样量对甜椒果实蛋白质2-DE图谱的影响Fig.3 Comparison of 2-DE maps of sweet pepper fruit with different different loading amount
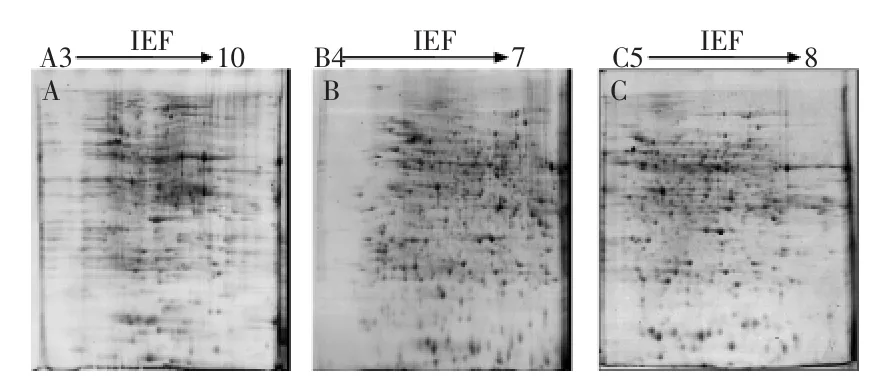
图4 不同pH范围的IPG胶条对甜椒果实总蛋白双向电泳图谱的影响Fig.4 Comparison of 2-DE maps of sweet pepper fruit with three IPG strips with different gradients
2.5不同等电聚焦程序对甜椒果实蛋白质2-DE图谱的影响
第一向的等电聚焦程序是关键步骤,其从胶条进行水化泡涨到快速升压都可以根据样品的实际情况进行分步设定,从而将不同等电点的蛋白较好的分离。等电聚焦电泳是在连续、稳定的pH梯度中进行蛋白质的分离,等电聚焦时间的长短对蛋白质的分离有直接的影响。双向电泳图谱上横向或纵向的条纹,蛋白点形状、图谱的分辨率和重复性等都与之相关。本实验设定了三种聚焦程序,主要研究高压聚焦时间对双向电泳图谱的影响,三种等电聚焦程序所得的双向电泳图谱蛋白点个数分别约Ⅰ617±22、Ⅱ703±17、Ⅲ592±16(表2和图5)。分析图5,聚焦程序Ⅰ的电泳图谱上蛋白点的横向拖尾及横纹略多于程序Ⅱ,Ⅱ和Ⅲ这方面的差异不明显。结合蛋白点个数及图谱的分辨率、清晰程度及实验成本等,发现程序Ⅱ更适合甜椒总蛋白的双向电泳实验。其等电聚焦程序与植物方面的相关研究[28]接近,但因植物的个体特异性具体的程序并不完全一致。相关文献研究发现,Chiara D’Ambrosio等[29]在杏果实的蛋白组学研究中采用52000VH,苹果果实[18]采用60000VH,不同的品种根据其研究选择合适的等电聚焦程序。

图5 不同等电聚焦程序对甜椒果实蛋白质2-DE图谱的影响Fig.5 Comparison of 2-DE maps of sweet pepper fruit with different isoelectro-focusing procedures
3 结论
采用提取液为pH7.8的酚提取法提取甜椒果实总蛋白,在等电聚焦66000VH条件下,用17cm pH5~8的IPG胶条上样1200μg进行等电聚焦电泳。SDSPAGE的凝胶浓度为12g/dL,经过考马斯亮蓝G-250胶体考染后得到电泳图谱。经分析,这种双向电泳条件检测出的蛋白点个数约有703±17,蛋白点分布均匀,无明显拖尾现象,横向和纵向的条纹不明显,背景清晰且分辨率高,重复性较好,能满足后续质谱分析的需要,同时也可以为辣椒蛋白组研究提供借鉴。
[1]李家政,周延文,唐巨颖.甜椒采后生理及保鲜技术研究进展[J].北方园艺,2010,19:214-217.
[2]张会丽.青椒采后生理及贮藏技术研究[D].郑州:河南农业大学,2008.
[3]陈发河,张维一,吴光斌.甜椒果实冷藏方法的研究[J].北方园艺,2000,21(8):53-56.
[4]Fallik E,Grinberg S,Alkalai S,et al.A unique rapid hot water treatment to improve storage quality of sweet pepper[J]. Postharvest Biology and Technology,1999,15(1):25-32.
[5]Eggink P,Maliepaard C,Tikunov Y,et al.A taste of sweet pepper:Volatile and non-volatile chemical composition of fresh sweet pepper(Capsicum annuum)in relation to sensory evaluation of taste[J].Food Chemistry,2012,132(1):301-310.
[6]Cervantes-Paz B,Yahia EM,de Jesús Ornelas-Paz J,et al. Antioxidant activity and content of chlorophylls and carotenoids in raw and heat-processed Jalapeño peppers at intermediate stages of ripening[J].Food Chemistry,2014,146:188-196.
[7]Deepa N,Kaur C,George B,et al.Antioxidant constituents in some sweet pepper(Capsicum annuum L.)genotypes during maturity[J].LWT-Food Science and Technology,2007,40(1):121-129.
[8]Nielsen TH,Skjærbæ HC,Karlsen P.Carbohydrate metabolism during fruit development in sweet pepper(Capsicum annuum)plants[J].Physiologia Plantarum,1991,82(2):311-319.
[9]Bianco L,Lopez L,Scalone AG,et al.Strawberry proteome characterization and its regulation during fruit ripening and in different genotypes[J].Journal of Proteomics,2009,72(4):586-607.
[10]Yun Z,Li W,Pan Z,et al.Comparative proteomics analysis of differentially accumulated proteins in juice sacs of ponkan(Citrus reticulata) fruit during postharvest cold storage[J]. Postharvest Biology and Technology,2010,56(3):189-201.
[11]Zhang L,Yu Z,Jiang L,et al.Effect of post-harvest heat treatment on proteome change of peach fruit during ripening[J]. Journal of Proteomics,2011,74(7):1135-1149.
[12]Pineda M,Sajnani C,Barón M.Changes induced by the Pepper mild mottle tobamovirus on the chloroplast proteome of Nicotiana benthamiana[J].Photosynthesis Research,2010,103(1):31-45.
[13]Lee JM,Kim S,Lee JY,et al.A differentially expressed proteomic analysis in placental tissues in relation to pungency during the pepper fruit development[J].Proteomics,2006,6(19):5248-5259.
[14]Siddique MA,Grossmann J,Gruissem W,et al.Proteome analysis of bell pepper(Capsicum annuum L.)chromoplasts[J]. Plant and Cell Physiology,2006,47(12):1663-1673.
[15]Sánchez-Bel P,Egea I,Sánchez-Ballesta MT,et al. Understanding the mechanisms of chilling injury in bell pepper fruits using the proteomic approach[J].Journal of Proteomics,2012,75(17):5463-5478.
[16]王一鸣,花宝光,王有年,等.桃果实蛋白质双向电泳影响因素的研究[J].园艺学报,2007,34(6):1579-1584.
[17]张丽,姜丽,石韵,等.桃果实总蛋白质双向电泳优化体系的建立[J].食品与生物技术学报,2013(3):250-257.
[18]Shi Y,Jiang L,Zhang L,et al.Dynamic changes in proteins during apple(Malus x domestica)fruit ripening and storage[J]. Horticulture Research,2014,1(6):1-21.
[19]Wang W,Vignani R,Scali M,et al.A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J].Electrophoresis,2006,27(13):2782-2786.
[20]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[21]罗海波,陈伟,周静峰,等.茭白总蛋白质双向电泳技术体系的建立[J].食品与生物技术学报,2013,32(6):581-585.
[22]卢丞文,潘晓琪,田慧琴,等.番茄果实中蛋白质的提取和双向电泳条件的优化[J].食品科技,2010(10):196-200.
[23]黎飞,徐秋芳,臧宪朋,等.番茄子叶总蛋白双向电泳体系的建立[J].园艺学报,2010,37(4):661-668.
[24]Rocco M,D’Ambrosio C,Arena S,et al.Proteomic analysis of tomato fruits from two ecotypes during ripening[J].Proteomics,2006,6(13):3781-3791.
[25]Barsan C,Sanchez-Bel P,Rombaldi C,et al.Characteristics of the tomato chromoplast revealed by proteomic analysis[J]. Journal of Experimental Botany,2010,61(9):2413-2431.
[26]王卓,贾彩虹,金志强,等.香蕉果实高质量总蛋白的提取方法[J].果树学报,2009,26(3):414-417.
[27]黄劲松,姜丽,石韵,等.蕨菜总蛋白质双向电泳技术体系的建立[J].食品与生物技术学报,2013,32(7):762-766.
[28]伍洋,陈清西.红肉蜜柚汁胞蛋白质双向电泳体系优化研究[J].亚热带植物科学,2013,42(3):193-198.
[29]Chiara D,Simona A,Mariapina R,et al.Proteomic analysis of apricot fruit during ripening[J].Journal of Proteomics,2013,78:39-57.
Optimization of two-dimensional electrophoresis conditions for total protein study of sweet pepper fruit(Capsicum annuum L.)
JIANG Lin-hui,JIANG Li,XU Yin,XU Xin,YU Zhi-fang*
(College of Food Science&Technology,Nanjing Agricultural University,Nanjing 210095,China)
A two-dimensional electrophoresis system for total protein from sweet pepper(cv.‘Hongfang’)fruits was established,including optimal conditions of total protein extraction method,pH value of the extract buffer,pH range of IPG strips,loading amount and isoelectric focusing procedure.The results showed that the best image of picture as indicated by protein spot uniformity and background clearness as well as protein point resolution was obtained at pH7.8 for extract buffer and by adopting phenol extraction method,and loading 1200μg protein to 17cm IPG strip of pH5~8 and isoelectric focusing at 66000VH followed by SDS-PAGE,and finally detecting proteins with coomassie brilliant blue G-250 staining.The established two-dimensional electrophoresis system could meet the needs of the subsequent mass spectrometry analysis.The total protein spots in the image of pictures were around 703±17.
sweet pepper fruit;proteomics;two-dimensional electrophoresis
TS255.1
A
1002-0306(2015)04-0084-05
10.13386/j.issn1002-0306.2015.04.009
2014-05-26
蒋林惠(1990-),女,在读硕士研究生,研究方向:采后生物学。
郁志芳(1960-),男,博士,教授,研究方向:果蔬采后生物学与贮藏加工研究。
长三角地区设施蔬菜高产高效生产(2014030232)。
