HPLC法同时测定茶叶中儿茶素类和咖啡因的含量
2015-12-20徐维玲李翠芹
张 琪,徐维玲,李翠芹,*
(1.教育部药用资源与天然药物化学重点实验室,西北濒危药材资源开发国家工程实验室,陕西师范大学生命科学学院,陕西西安710062;2.西安鸿生生物技术有限公司,陕西西安710065)
ZHANG Qi1,XU Wei-ling2,LI Cui-qin1,*
(1.Key Laboratory of the Ministry of Education for Medicinal Resources and Natural Pharmaceutical Chemistry,National Engineering Laboratory for Resource Development of Endangered Crude Drugs in Northwest of China,Shaanxi Normal University,Xi’an 710062,China;2.Xi’an Honson Biotechnology Limited Company,Xi’an 710065,China)
HPLC法同时测定茶叶中儿茶素类和咖啡因的含量
张琪1,徐维玲2,李翠芹1,*
(1.教育部药用资源与天然药物化学重点实验室,西北濒危药材资源开发国家工程实验室,陕西师范大学生命科学学院,陕西西安710062;2.西安鸿生生物技术有限公司,陕西西安710065)
为了建立了一种等度洗脱茶叶中6种儿茶素类没食子儿茶素(GC)、表没食子儿茶素(EGC)、儿茶素(C)、表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)、表儿茶素(EC)及限量成分咖啡因(CAF)的高效液相色谱(HPLC)定量测定的方法,采用汉邦BenetnachTM C18(5μm×4.6mm×250mm)色谱柱,流动相为甲醇∶水∶磷酸(28∶72∶0.1,v/v/v),流速为0.8mL·min-1,UV检测波长为280nm,柱温为30℃。结果表明GC、EGC、C、EGCG、ECG、EC和CAF分别在0.10~1.00、0.16~1.00、0.10~1.00、0.05~0.50、0.10~1.50、0.10~2.00和0.02~1.00mg·mL-1内线性关系良好,相关系数在0.9984~0.9999间;平均加样回收率为100.89%(EGCG),99.07%(CAF);样品分析中,除GC的分离度RS>1外,其他6个成分RS均>2。该方法简单、快速、准确、重现性好,可用于儿茶素类和咖啡因的定量检测。
儿茶素类,表没食子儿茶素没食子酸酯,咖啡因,HPLC
ZHANG Qi1,XU Wei-ling2,LI Cui-qin1,*
(1.Key Laboratory of the Ministry of Education for Medicinal Resources and Natural Pharmaceutical Chemistry,National Engineering Laboratory for Resource Development of Endangered Crude Drugs in Northwest of China,Shaanxi Normal University,Xi’an 710062,China;2.Xi’an Honson Biotechnology Limited Company,Xi’an 710065,China)
茶多酚具有抗氧化、抗肿瘤、抗菌、调血脂和降血糖等药理作用,被广泛应用于食品、医药保健品、功能性饮料和化妆品中[1-3]。茶多酚产品的开发和应用前景十分诱人,是近些年来研究的热点。儿茶素类是茶多酚中的主成分,也是其主要的药理活性物质,占茶多酚含量的60%~80%[4]。其中几种主要儿茶素表儿茶素(EC)、儿茶素(C)、表没食子儿茶素(EGC)、没食子儿茶素(GC)、表没食子儿茶素没食子酸酯(EGCG)和表儿茶素没食子酸酯(ECG)是茶叶品质和茶多酚产品质量控制的重要指标,尤其是含量最高活性最强的指标性成分EGCG[1]。CAF是存在于茶叶中最主要的嘌呤类生物碱,过多摄入会对人体产生诸多不利影响[5-6],控制咖啡因的含量也是质量控制重要指标之一[7]。快速有效的测定儿茶素类和咖啡因的含量已成为茶叶品质认定和茶多酚产品质量控制首当其冲的问题。关于HPLC法分析测定茶多酚中儿茶素类和咖啡因的含量已有很多文献报道,大多采用梯度洗脱[8-17],易出现基线不平、重复性差、分析时间较长和检测设备要求高[11,18-22]等问题。
本研究以绿茶中EC、C、EGC、GC、EGCG、ECG和CAF为研究对象,采用等度洗脱同时测定绿茶中6种主要儿茶素类和咖啡因的含量,建立了一种快速、准确、重复性好且成本低廉的HPLC法分析测定茶叶中儿茶素和咖啡因含量的方法,适合大批样品分析,易于推广使用,为茶多酚产品开发利用和质量控制提供强有力的技术支持。
1 材料与方法
1.1材料与仪器
12种商品绿茶均购自西安轻工茶叶批发市场,所有茶叶样品经陕西师范大学生命科学学院植物学教研组鉴定;对照品C、EC、GC、EGC、EGCG和ECG均购自成都曼斯特生物科技有限公司,批号依次为13050702、13022906、12101105、12092908、12052801、12091603,纯度>98%;对照品CAF购自贵州迪大生物科技有限公司,批号58-08-2,纯度≥99%;甲醇、磷酸均为色谱纯,购自天津市科密欧化学试剂有限公司;超纯水自制。
LC-2010A高效液相色谱仪、UV检测器、日本岛津液相工作站日本岛津公司;Milli-Q Reference超纯水仪美国Millipore公司;万分之一分析天平Sartorius科学仪器北京有限公司;恒温水浴锅金坛市杰瑞尔电器有限公司;TCX-600S型超声波清洗机济宁天宇超声机械设备有限公司;注射器、0.22μm滤头滤膜等。
1.2实验方法
1.2.1对照品的制备分别精密称取对照品C、EC和GC各5.0mg,对照品EGC、EGCG、ECG和CAF各10.0mg,以甲醇为溶剂定容在5mL容量瓶中摇匀,分别制成1.0mg·mL-1和2.0mg·mL-1标准储备液。分别吸取C、EC、GC、EGC和CAF标准储备液400μL,ECG和EGCG标准储备液200μL用甲醇稀释定容于5mL容量瓶中,制成混合对照品溶液。
1.2.2试样的制备精密称取1.00g绿茶粉末(过80目筛)置于锥形瓶中,各加入25mL 70%甲醇,70℃水浴锅中提取30min,抽滤,将滤液定容于100mL容量瓶中,过0.22μm微孔滤膜后进样。
1.2.3色谱条件色谱柱:汉邦BenetnachTM C18色谱柱(5μm×4.6mm×250mm);检测波长:280nm;流动相为甲醇∶水∶磷酸(28∶72∶0.1,v/v);流速:0.8mL·min-1;柱温:30℃;进样量:10μL。
1.2.4线性关系和线性范围的考察将标准储备液分别稀释成一系列浓度梯度的标准工作液,过0.22μm微孔滤膜后依次进样10μL。以对照品含量为横坐标,相对应的峰面积为纵坐标,进行线性回归,得到7种对照品的回归线方程和线性范围。
1.2.5样品含量的测定按照1.2.2项下方法制备样品溶液并适当稀释,按照1.2.3项下方法进样,用外标法计算各物质含量,每个样品重复3次。
2 结果与分析
2.1色谱条件的选择
以甲醇-水-磷酸为流动相,流速为0.8mL·min-1,可快速有效分离EC、C、EGC、GC、EGCG、ECG和CAF,结果见色谱图,图1(a、b)分别为混标色谱图和样品色谱图。儿茶素类含多个酚羟基,水溶液呈酸性,碱性条件易被氧化,加酸不仅能防止拖尾改善峰形,还能抑制其水解和氧化褐变。结果证明目标成分对磷酸选择性良好,该色谱条件下,目标成分与其他杂峰分离良好。

图1 (a)儿茶素类和咖啡因对照品色谱图,(b)西乡绿茶样品色谱图Fig.1 (a)The HPLC chromatogram of the mixture of catechins and CAF standards,(b)the HPLC chromatogram of the sample Xixiang green tea
2.2儿茶素类和咖啡因的线性关系和线性范围
GC、EGC、C、EGCG、ECG、EC和CAF保留时间、回归方程、相关系数和线性范围如表1所示。结果表明,在给定的浓度范围内线性关系良好。
2.3方法学考察
2.3.1精密度实验将混合对照品溶液按照1.2.3项下方法连续进样5次,进样量10μL。考察峰面积的一致性,结果GC、EGC、C、EGCG、ECG、EC和CAF峰面积RSD值分别为0.24%、0.15%、0.22%、0.25%、0.57%、0.11%和0.12%。
2.3.2重复性实验取同一份样品(西乡绿茶)按
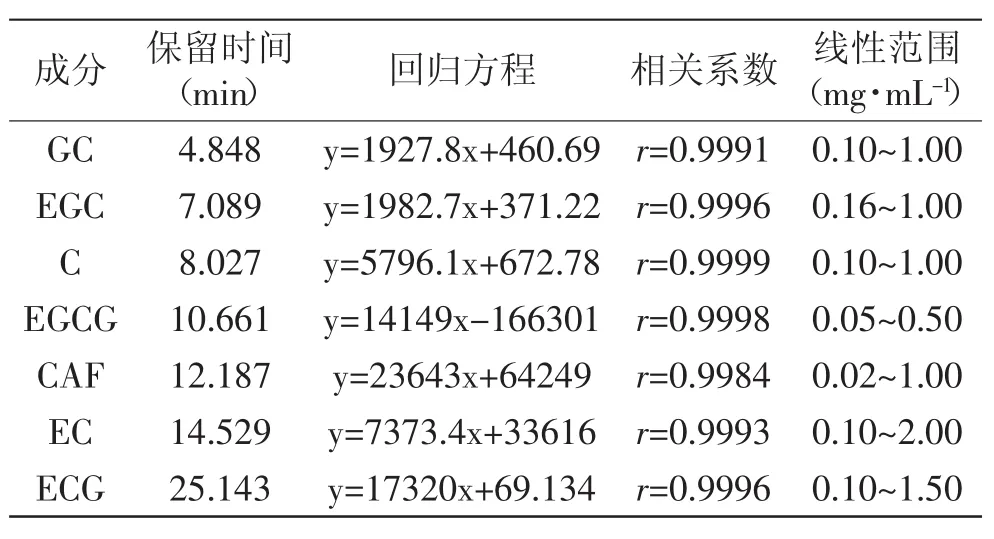
表1 儿茶素类和咖啡因线性关系和线性范围(n=5)Table.1 The calibration curves and linear ranges of catechins and CAF(n=5)
1.2.2项下试样制备方法制5份供试品溶液,按照1.2.3项下方法依次进样,分别考察这7种化合物峰面积变化。GC、EGC、C、EGCG、ECG、EC和CAF峰面积RSD值分别为2.95%、0.68%、2.28%、1.55%、1.61%、2.18%和0.51%
2.3.3稳定性实验取1.2.2项下西乡绿茶供试品按1.2.3项下色谱条件分别在0、4、8、12、24h进样一次。记录各物质峰面积,结果GC、EGC、C、EGCG、ECG、EC和CAF 24h内峰面积RSD值分别为0.49%、2.25%、2.91%、0.74%、0.73%、3.33%和0.52%,表明EGC、C和EC在24h内基本稳定,GC、EGCG、ECG和CAF在24h内稳定性良好,能满足测定要求。
2.3.4加样回收率实验同份供试品溶液按1.2.3项下色谱条件依次进样,测定样品中EGCG和CAF的含量。分别加入EGCG和CAF对照品储备液90μL和50μL,充分混匀后再次进样测定,计算回收率和RSD值。结果见表2,EGCG平均回收率100.89%,RSD值为2.00%;CAF平均回收率99.07%,RSD值为2.37%,表明EGCG和CAF的加样回收率良好。

表2 EGCG和CAF加样回收率实验结果Table.2 The recovery test results of EGCG and CAF

图2 不同茶叶样品色谱叠加图Fig.2 The HPLC chromatogram of various tea samples
表3 茶样中儿茶素类和咖啡因的含量(±SD,n=3)Table.3 The contents of catechins and caffeine in tea samples(±SD,n=3)

表3 茶样中儿茶素类和咖啡因的含量(±SD,n=3)Table.3 The contents of catechins and caffeine in tea samples(±SD,n=3)
注:“ND”表示not detected。
商品绿茶含量(mg·g-1)GC EGC C EGCG CAF EC EGC福建天山绿茶 7.27±0.15 21.14±0.24 ND 26.04±0.20 12.80±0.48 5.49±0.73 5.06±0.79广西绿茶 6.07±0.24 14.19±0.07 ND 25.76±0.01 13.96±0.33 4.78±0.73 7.24±0.96杭州绿茶 9.61±1.17 12.08±0.48 ND 20.53±0.43 14.44±0.43 2.13±0.07 5.15±1.00四川雀舌 16.99±0.35 21.36±0.28 ND 28.65±0.10 21.65±0.03 2.81±0.22 13.18±0.16西乡绿茶 15.08±0.50 20.59±0.67 ND 38.61±0.93 20.02±0.38 4.79±0.33 7.83±1.07浙江有机绿茶 7.38±0.35 17.24±0.61 ND 27.00±0.35 13.69±0.38 4.25±0.25 4.85±0.83紫阳绿茶 15.31±0.67 16.61±0.49 2.24±0.62 38.23±0.24 18.94±0.68 3.98±0.69 8.23±0.82浙江丽水绿茶 13.46±1.87 15.06±0.17 1.97±0.24 31.91±0.33 17.07±0.37 3.72±0.59 6.91±0.77湖北神农绿茶 21.26±0.37 9.35±0.33 2.62±0.10 13.38±0.78 5.67±0.09 3.40±0.64 5.81±0.57福建铁观音 6.04±0.12 20.49±0.33 ND 26.28±0.78 12.08±0.48 5.00±0.50 5.71±0.48有机铁观音 25.90±0.41 18.38±0.50 1.88±0.19 28.79±0.03 13.43±0.67 4.07±0.22 5.99±0.51西湖龙井 18.15±0.59 16.28±0.56 ND 39.58±0.49 18.49±0.34 4.42±0.09 11.22±0.86
2.4样品测定结果
研究中发现,儿茶素类和咖啡因的分离测定对甲醇和水的比例比较敏感,本研究确定的色谱条件分离效果好,方法稳定。图2为不同茶样色谱叠加图,除GC分离度>1,其他5种儿茶素和咖啡因的分离度均>2。尽管12种市售绿茶中所含化合物及其含量各有差异,但在该色谱条件下均能得到很好的分离测定,有力地论证了该法的可靠性。结果显示该方法显著优于刘小乔[12]和刘锦文[23]建立的方法,三种方法都采用甲醇-水-磷酸洗脱剂系统,本文建立的方法不仅采用简单且应用性强的等度洗脱,还改善了刘小乔和刘锦文方法出现的酯型儿茶素严重拖尾的问题。同时,也解决了现行国标方法中EC和EGCG难分离的问题[10,12,24]。
表3为12种样品茶叶中GC、EGC、C、EGCG、CAF、EC和ECG的含量,其中EGCG均为含量最高的组分。该结果表明,不同绿茶中儿茶素类和咖啡因的含量差别很大,6种儿茶素的含量也差别很大,这可能与绿茶的产地、日照、温度、采摘季节,叶子的老嫩及茶树品种的不同有关[25],EGCG为绿茶中含量最高的儿茶素,这一结果也与Bansal等[8,16-18,20,26]研究结果一致。
3 结论
绿茶提取物成分复杂、干扰成分很多,国家标准[7,24]和一些前人相关研究多用梯度洗脱。本文建立的HPLC法,采用常用、低毒、且价格低廉的洗脱剂甲醇-磷酸-水进行等度洗脱,操作简单,重现性好且对检测设备要求低;通过线性实验、精密度实验、重复性实验、稳定性实验、加样回收实验和12种商品绿茶样品含量的测定验证了该方法的可靠性。该方法用时短,在26min内可完成7种成分的分离测定,快速、准确、分离度好,重复性高,可用于儿茶素类成分和咖啡因的分析测定,为茶叶的品质认定和指纹图谱研究,以及茶多酚产品的质量控制提供基础,适合推广使用。
[1]Bansal S,Syan N,Mathur P,et al.Pharmacological profile of green tea and its polyphenols:a review[J].Medicinal Chemistry Research,2012,21(11):3347-3360.
[2]张晓梦,倪艳,李先荣.茶多酚的药理作用研究进展[J].药物评价研究,2013,36(2):157-160.
[3]匿名.茶多酚市场十分诱人[J].国内外香化信息,2003(6):8.
[4]Wang LY,Qin PY,Hu Y.Study on the microwave-assisted extraction of polyphenols from tea[J].Frontiers of Chemical Engineering in China,2010,4(3):307-313.
[5]姚永宏,柴友荣,李中林,等.降低茶叶咖啡碱的研究进展[J].西南农业学报,2009,22(6):1799-1802.
[6]赵卉,杜晓.低咖啡碱茶的研究进展[J].华中农业大学学报,2008,27(4):564-568.
[7]中华人民共和国轻工行业标准.食品添加剂茶多酚[S]. QB2154-1995.
[8]El-Shahawi M S,Hamza A,Bahaffi S O,et al.Analysis of some selected catechins and caffeine in green tea by high performance liquid chromatography[J].Food Chemistry,2012,134(4):2268-2275.
[9]王丽丽,陈键,宋振硕,等.茶叶中茶多酚检测方法研究进展[J].茶叶科学技术,2013(4):6-12.
[10]周顺珍,龚雪,周国兰,等.HPLC法测定茶叶中儿茶素及咖啡碱[J].化学分析计量,2013,22(5):27-29.
[11]郭宇姝,张沂,朱新生.茶多酚的提取分离与含量测定方法进展[J].解放军药学学报,2007,23(2):121-124.
[12]刘小乔,李忠岐,高静,等.茶多酚中儿茶素类的HPLC分析[J].光谱实验室,2012,29(5):2611-2615.
[13]谷勋刚,蔡继宝,张正竹,等.HPLC-DAD分析红茶儿茶素类物质和咖啡因的方法研究[J].安徽农业大学学报,2010,37(1):5-10.
[14]吴白乙拉,包俊杰.用HPLC方法对中国茶叶中茶多酚等成分含量的定量分析[J].内蒙古民族大学学报:自然科学版,2009,24(1):34-37.
[15]邓永亮,冯雷,吕才有.一种快速检测茶叶中儿茶素的HPLC方法[J].西南农业学报,2011,24(3):932-935.
[16]孙晓莉,刘帅华,汪雷,等.高效液相色谱法同时测定五指山绿茶中5种儿茶素类成分[J].植物研究,2011,31(3):377-380.
[17]王增明,郭庆东,谢芳,等.HPLC测定茶多酚中儿茶素类及咖啡因含量[J].中国药学杂志,2011,46(21):1674-1676.
[18]何昱,洪筱坤,王智华.茶多酚中儿茶素类及咖啡因的含量测定[J].中成药,2003,25(10):53-56.
[19]康海宁,陈波,韩超,等.HPLC法测定茶叶水提液中五种儿茶素和咖啡碱及其用于茶叶分类的研究[J].分析测试学报,2007,26(2):211-215.
[20]高俊,夏涛,朱博,等.HPLC-PDA对茶叶中茶氨酸、儿茶素和生物碱的同时分离检测研究[J].安徽农业大学学报,2008,35(3):324-328.
[21]蔡明瑛,倪辉,李利君,等.液相色谱检测乌龙茶水浸提物及其单宁酶水解产物中的儿茶素[J].中国食品学报,2013,13(5):207-215.
[22]张戎睿,王舒雅,王富济,等.HPLC法同时检测茶叶中八种儿茶素[J].黑龙江医药,2011,24(5):681-683.
[23]刘锦文,李红玉,石瑞君,等.高效液相色谱法测定茶多酚中EGCG和ECG的含量[J].食品工业科技,2010,31(11):372-374.
[24]中华人民共和国国家标准.茶叶中茶多酚和儿茶素类含量的检测方法[S].GB/T 8313-2008.
[25]朱红.茶树鲜叶中茶多酚含量变化的研究[J].四川农业大学学报,1998,16(3):59-62.
[26]肖俊松,袁英髦,张爱雪,等.茶叶中茶多酚和生物碱的测定及聚类和线性判别分析[J].食品科学,2010,31(22):343-348.
Simultaneous determination of some selected catechins and caffeine in tea by performance liquid chromatography
The contents of six catechins(GC,EGC,C,EGCG,ECG and EC)and limited composition caffeine were investigated by HPLC method with Hanbon BenetnachTMC18column(5μm×4.6mm×250mm)at 30℃and the UV detection wavelength was 280nm.The mobile phase was methanol-water-phosphorus acid(28∶72∶0.1,v/v/v)isocratic elution system,and the flow rate was 0.8mL·min-1.The results showed that the linear ranges of GC,EGC,C,EGCG,ECG,EC and caffeine were 0.10~1.00,0.16~1.00,0.10~1.00,0.05~0.50,0.10~1.50,0.10~2.00 and 0.02~1.00mg·mL-1respectively,and the correlation coefficients were ranged from 0.9984~0.9999.The average recoveries of the two most abundant compositions EGCG and CAF were 100.89%and 99.07%,respectively.The resolutions of the six object components were more than 2,except GC.The method was simple,rapid,accurate,reproducible and ideal for routine analysis of catechins and caffeine.
catechins;EGCG;caffeine;HPLC
TS201.2
A
1002-0306(2015)04-0053-04
10.13386/j.issn1002-0306.2015.04.002
2014-06-04
张琪(1989-),女,在读硕士研究生,研究方向:中药物质基础分析。
李翠芹(1969-),女,博士,副教授,研究方向:中药物质基础分析和生化分子药理学。
“十二五”国家科技支撑计划项目(2011BA106B06);中央高校基本科研业务费专项资金资助(GK201303009)。
