棉仁生育酚组成及其含量的高效液相色谱测定方法研究
2015-12-20陆智辉祝水金陈进红
阎 君 陆智辉 祝水金 陈进红
(浙江大学农业与生物技术学院/浙江省作物种质资源重点实验室,杭州 310058)
棉仁生育酚组成及其含量的高效液相色谱测定方法研究
阎 君 陆智辉 祝水金 陈进红
(浙江大学农业与生物技术学院/浙江省作物种质资源重点实验室,杭州 310058)
优化并建立了棉仁生育酚含量的快速提取技术及高效液相色谱检测方法。样品用抗坏血酸和乙醇溶液处理后,正己烷超声萃取,以正己烷/异丙醇(100/1)流动相,采用C18色谱柱(ZORBAX©RX-SIL)等度洗脱,流速0.88mL/min,紫外检测器检测并定量(激发波长300 nm,发射波长330 nm)。测得4种生育酚的回归方程R2在0.990~0.999之间,线性关系良好;4种生育酚精密度试验结果的相对标准偏差(RSDs,n=5)均小于1%,加标回收试验的平均回收率范围在90%~105%之间,RSDs(n=3)低于7%;方法检出限范围为0.1~0.2μg/mL,定量限为0.2~0.5μg/mL。该方法作为棉仁生育酚的快速测定方法,准确、快捷、选择性好,具有较强的实用价值。
棉仁 生育酚 高效液相色谱
生育酚是一类含有多甲基化的两亲性酚类有机物,目前认为由α-生育酚(α-VE)、β-生育酚(β-VE)、γ-生育酚(γ-VE)、δ-生育酚(δ-VE)与α-生育三烯酚、β-生育三烯酚、γ-生育三烯酚、δ-生育三烯酚8种构型和理化性质相似、活性不同的异构物组成。棉籽中富含生育酚(VE),而棉仁是棉籽中生育酚的主要贮藏部位,是天然生育酚的一个巨大潜在资源,亟待开展资源评价与开发利用研究。作为评价研究的基础,需要建立准确、快捷的分离与测定方法。吴时敏等[1]研究表明在菜籽油提取过程中,其中的生育酚、α-生育酚含量与α-生育酚占生育酚的比例均降低;花生油等各种植物油在加工过程中VE含量会发生变化[2-3]。棉仁中的各种生育酚异构体以混合物的形式存在,在其皂化、提取、浓缩过程中极易被某些脂肪酸生成的衍生物破坏或在高温环境下氧化而发生损耗,影响测定的准确性。因此,需要优化建立适合棉仁生育酚提取、皂化、浓缩及测定的相应方法。
生育酚的定性与定量方法,主要有比色法[4-5]、光谱法[6-7]、电化学法[8-9]以及色谱法[10-13]等技术。荧光法测定不同的样品前处理步骤不同,程序比较繁琐,且在VE含量少于100μg/mL条件下其荧光强度和浓度间难以建立线性关系;分光光度法可定量测定VE,但测定的结果受样品本身还原剂如VC等的干扰,且试剂空白影响较大,必须校正;双波电压法检测限为20μg/mL,灵敏度稍低;示波法则只能测定总VE,不能将各种单体分开。高效液相色谱技术(HPLC)以其灵敏度高、分离效果显著、重复性好等优点,被广泛应用于生育酚的测定研究中。
目前HPLC法虽然在油菜籽、大豆等作物生育酚的测定应用较多,但不同测定对象,采用的HPLC体系也不尽相同;同时,在棉仁中生育酚含量的HPLC测定研究较为少见,能够明显分离棉仁中α、β、γ和δ4种生育酚的研究更是不多。李跃红等[14]用氢氧化钾、乙醇体系将生育酚皂化后乙醚提取,分离出α-VE和δ-VE,但无法在该色谱条件下将β-VE与γ-VE分开,在γ-VE峰中包含β-VE。彭光华等[15]用正己烷溶剂浸提法,提取并测出油菜籽中生育酚的含量,效果良好。马戎等[16]用饱和抗坏血酸乙醇溶液萃取样品,测定烟草中生育酚的含量。商军等[17]采用 C18反相柱,甲醇∶水 =98∶2为流动相,测定饲料中VE的含量。
本研究从提取工艺、色谱条件改进等方面入手,优化样品处理方法和检测条件,建立快速准确测定棉仁生育酚的HPLC方法,以期为棉仁生育酚资源的评价利用与进一步提高棉副产品的利用率、更好地开展棉花品质育种提供技术支持。
1 材料与方法
1.1 试验材料
棉籽样品来自于统一种植在浙江大学农业试验站2012年的6个棉花种质:TM-1、交力大花、徐州142、徐州142无絮、n2、GZNn2-1以及2013年的3个棉花种质:n2、GZNn2-1、交力大花。其中TM-1种质由浙江大学作物研究所提供,其他种质由中国农科院棉花研究所国家棉花种质中期库提供。
1.2 主要仪器
Agilent1100系列高效液相色谱仪、C18(4.6 mm×250 mm,5μm)色谱柱:美国 Agilent公司;UV-1800型紫外可见分光光度计:日本岛津公司。
1.3 主要试剂
正己烷(AR)、无水乙醇(AR)、抗坏血酸:国药集团化学试剂公司;正己烷(HPLC)、异丙醇(HPLC):天津四友精细化学品有限公司;α-、β-、γ-、δ-生育酚标准品:Sigma试剂公司。
1.4 试验方法
1.4.1 样品处理
剥干燥的棉籽取棉仁,粉碎,在30℃恒温箱中烘干备用。
称取0.100 0 g棉仁粉置于15 mL离心管中,加入0.05 g抗坏血酸和3mL、80%的乙醇溶液,振荡均匀,置于超声波清洗仪中30℃、功率240 W超声10 min,加入6 mL正己烷,振荡均匀,封口膜封口,-20℃温度下静置15 h。取出后超声40 min充分提取,然后6 000 r/min离心15 min,取上清液进行0.45μm微孔抽滤,获得生育酚的提取液,低温避光保存。
1.4.2 生育酚标样储备液的配置和工作曲线
准确称取一定量的α-、β-、γ-、δ-生育酚标准品,正己烷为溶剂,分别配制成10 000、1 000、100、10μg/mL的储备液,避光低温保存。分别以 α-、β-、γ-、δ-生育酚的浓度(μg/mL)为横坐标,峰面积为纵坐标,绘制标准曲线,并计算其回归方程。
1.4.3 色谱条件
色谱柱:ZORBAX© RX-SIL;检测器:紫外检测器,ex=300 nm、em=330 nm;流动相:正己烷∶异丙醇 =100∶1;柱温:23℃;流速:0.88 mL/min;进样量:20μL。
1.5 数据处理
采用Excel软件进行数据处理。
2 结果与讨论
2.1 样品前处理技术
2.1.1 提取溶剂
生育酚呈弱酸性,易溶于乙醇、乙醚、正己烷等有机溶剂。溶剂对样品的稳定性有一定影响,某些溶剂与目标物质形成耦合物,而生育酚在一些溶剂中容易出现结构变异,所以在选择溶剂时,应考虑样品的稳定性、安全性和分离度。
通过对甲醇、乙醇、正己烷等溶液作为溶剂的比较研究发现,生育酚在醇类物质中不稳定,不利于其在色谱柱中的分离,而在正己烷溶液中,样品的稳定性较好、分离度高,且峰形理想(图1)。

图1 4种生育酚的高效液相色谱图
2.1.2 静置处理
在生育酚的提取过程中,不同研究者采用的方式不同。刘敏轩等[18]用2,6-二叔丁基对甲酚、乙醇、抗坏血酸和KOH进行皂化,后用正己烷∶乙酸乙酯 =85∶15提取;张桂云等[19]用无水乙醇、邻苯三酚、NaCl和KOH溶液混匀样品,后加入正己烷∶乙酸乙酯=4∶1提取;接伟光等[20]用乙醇、没食子酸以及KOH溶液皂化后,采用5%NaCl+石油醚提取样品中的生育酚。综合比较,本研究在参照刘焕成等[21]的方法基础上,增加了6 mL正己烷中暗处静置15 h的处理。与未静置组相比,暗处静置15 h后可使生育酚提取更充分,见表1。
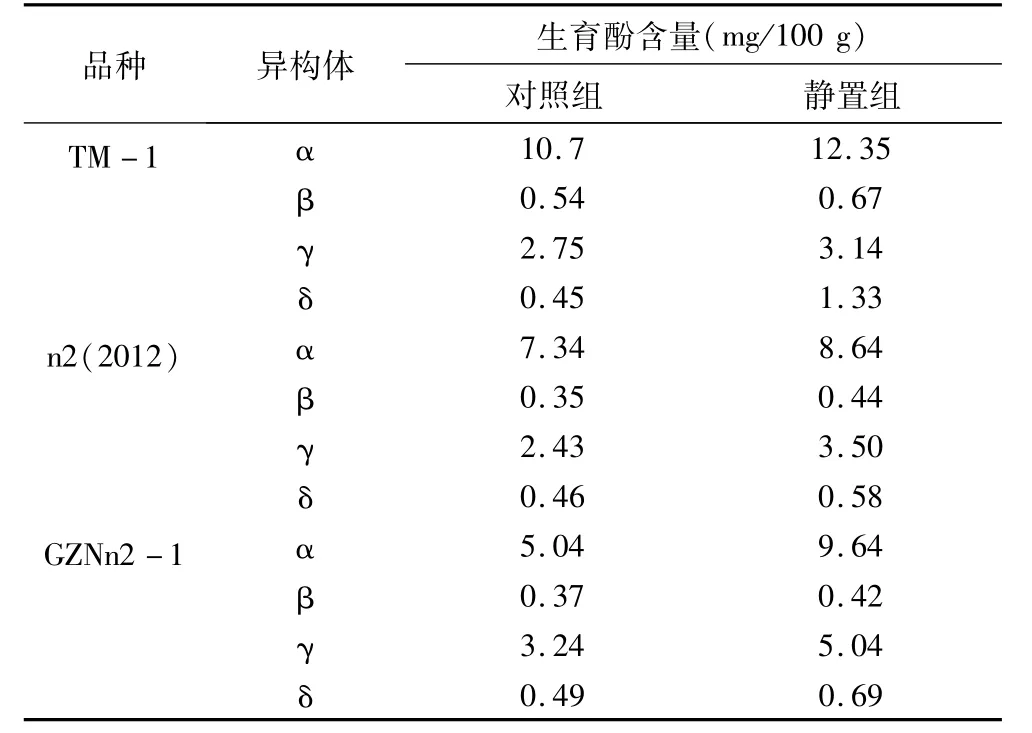
表1 静置15 h处理对测定结果影响
2.1.3 超声时间
称取0.100 0 g棉仁粉样品21份,分成7组,每组平行测定3次,置于15 mL离心管中,加入0.05 g抗坏血酸和3 mL、80%的乙醇溶液,振荡均匀,后置于超声波清洗仪中30℃、功率240 W超声10 min,加入6 mL正己烷,振荡均匀,封口膜封口,放在-20℃温度下静置15 h。取出后置于超声机中再分别超 声 20、25、30、35、40、45、50 min,离 心 机6 000 r/min离心15 min,取上清液进行0.45μm微孔抽滤。测定结果表明:随超声时间增加,棉仁粉中的生育酚逐渐被提取出来,超声时间超过40 min后生育酚含量增加趋势平缓(图2)。综合考虑提取率与低能耗,选择超声提取时间40 min。
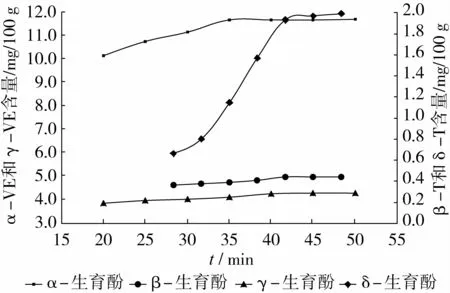
图2 超声时间对不同生育酚测定结果的影响
2.2 检测波长
生育酚的吸收波长在220~400 nm之间。分别利用α-、β-、γ-、δ-生育酚标准品的配制液以及混合溶液在220~400 nm范围内进行紫外扫描,结果表明:不同种生育酚及生育酚标准品混合物均在300 nm附近有最大吸收值(图3)。因此认为,检测波长可采用300 nm。
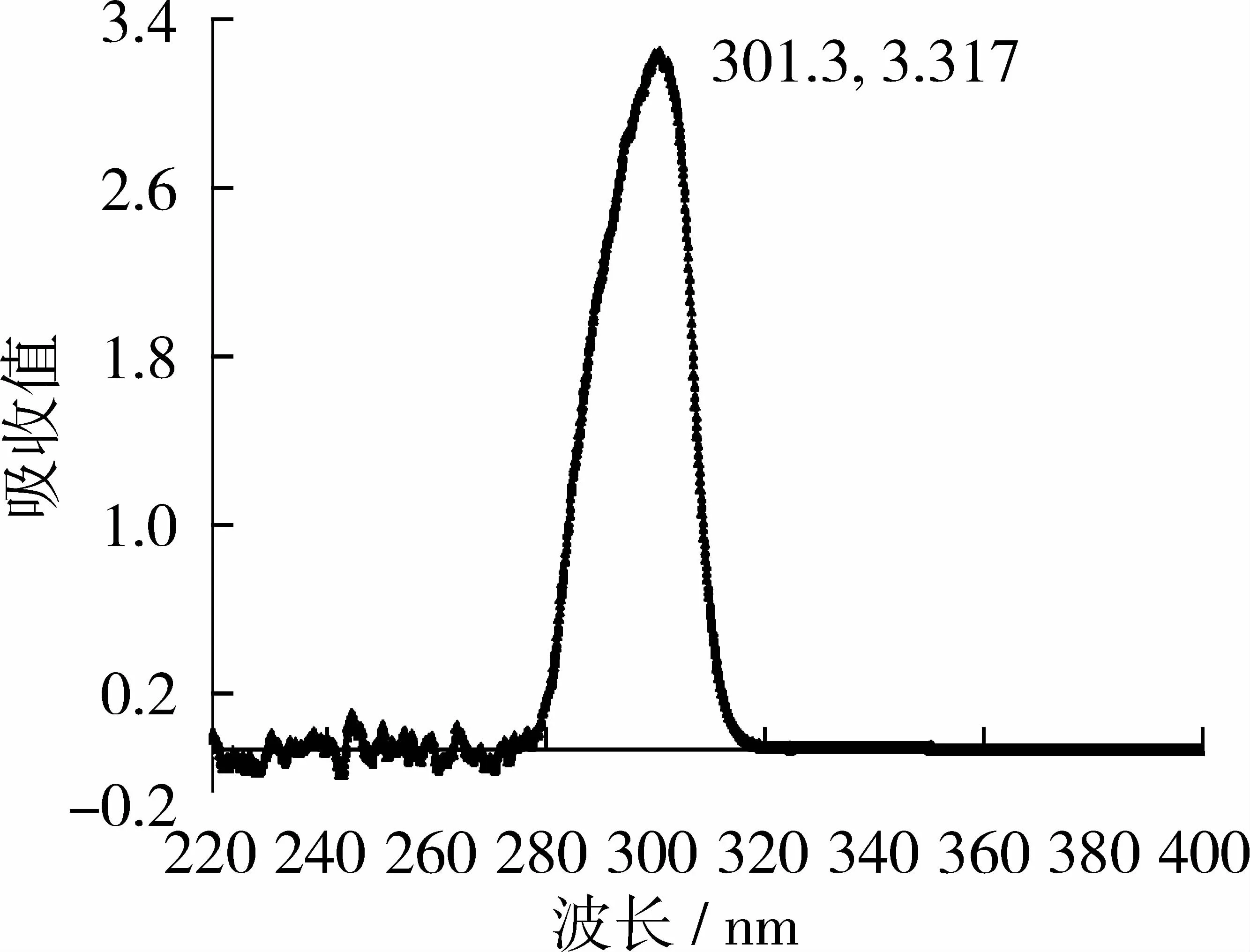
图3 生育酚标准品混合物检测波长
2.3 液相色谱条件
2.3.1 色谱柱
为选择合适的色谱柱,本研究对Agilent ZORBAX SBC18(4.6mm×150mm,5μm)和Agilent ZORBAX RX-SIL C18(4.6 mm×250 mm,5μm)2种色谱柱进行了比较,结果表明ZORBAX SB C18色谱柱分析时间过短,分离效果比ZORBAX RX-SIL C18色谱柱差一些,故选择 Agilent ZORBAX RX-SIL C18(4.6 mm×250 mm,5μm)色谱柱。
2.3.2 流动相
生育酚的洗脱速度随正己烷/异丙醇的比例的增加而减缓,从而保留时间加长。为了找到最佳流动相配比,比较了正己烷∶异丙醇 =98∶1、99∶1、100∶1的3种条件下的测定结果,结果表明以正己烷∶异丙醇=100∶1的配比作为流动相时目的峰与其他杂质峰分离度好,且分析时间也比较适宜(图4)。

图4 不同流动相比例条件的生育酚色谱图
2.3.3 流速
流速会影响分析时间的长短以及目的峰的分离情况。为确定适合的流速,本研究比较了1.2、1.0和0.88 mL/min 3个流速下的样品分离效果,结果表明:当流速为0.88 mL/min时,目的峰分离度好、分析时间适宜(图5)。

图5 不同流速条件的生育酚色谱图
2.4 线性关系
取适量α、β、γ、δ-生育酚储备液配制成(1.0、0.1、0.5、0.1μg/mL),(2.0、0.2、1.0、0.2μg/mL),(5.0、0.4、5.0、0.4μg/mL),(10.0、0.8、10.0、0.8 μg/mL)和(20.0、1.0、20.0、1.0μg/mL)5个梯度的混合标准品,上样分析。以相应质量浓度x(μg/mL)对峰面积y做回归分析。以S/N≥3确定方法的检出限(LOD);以S/N≥10确定方法的定量限。结果见图6,表2说明4种生育酚异构体分别在1.0~20.0、0.1~1.0、0.5~20.0和0.1~1.0μg/mL范围内线性关系良好,检出限范围在0.1~0.2μg/mL,定量限范围是0.2~0.5μg/mL。

图6 4种生育酚的标准曲线
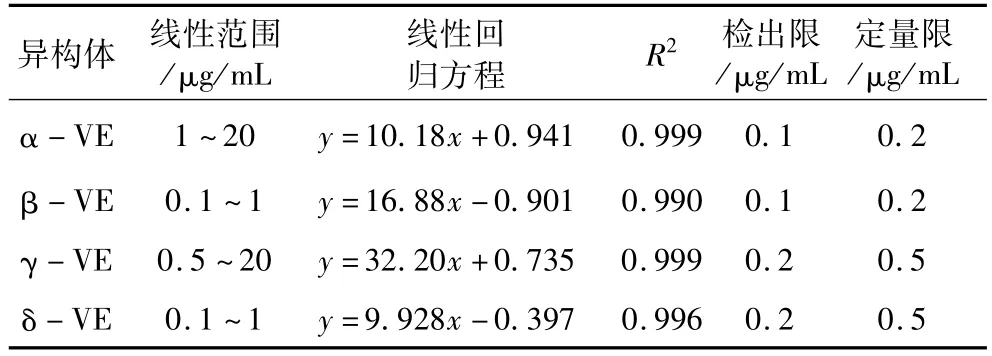
表2 生育酚线性回归方程
2.5 重复性试验
取0.1 g样品5份,按照1.4.1方法进行样品中生育酚的提取。如表3所示,由所得的目的峰面积计算相应样品的α、β、γ、δ-生育酚含量平均值分别为13.38、0.37、4.28和 2.67 mg/100 g,计算其相对标准偏差分别为2.62、4.28、2.53和4.05%,均小于10%,参照ISO 9936-2006中关于重复性检测的说明,经计算得到样品中α、β、γ、δ-生育酚重复性限以及每2次重复性数据的绝对差值,其中α、γ、δ绝对差值均低于重复性限,β的绝对差值虽稍大,但相对标准偏差已符合标准要求,因此,可以认为此方法具有较好的精密度,符合检测要求。
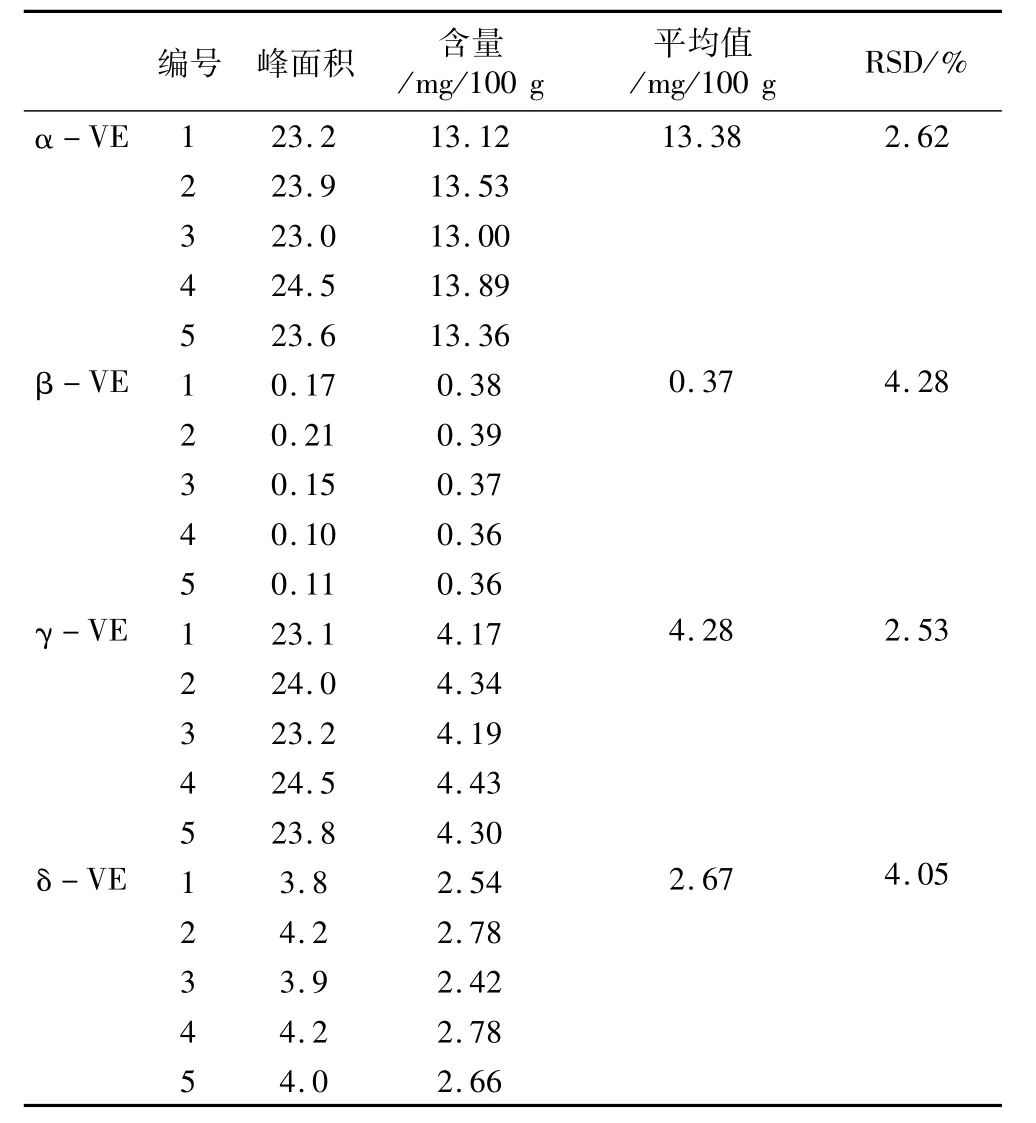
表3 重复性试验数据
2.6 精密度试验
取标准品混合样品连续进样5次,以α-、β-、γ-、δ-生育酚的测定值来考察测定仪器的精密度。从表4可知:5次结果的相对标准偏差分别为0.59%、0.74%、0.9%、0.7%,均小于1%,说明该仪器的重现性好。
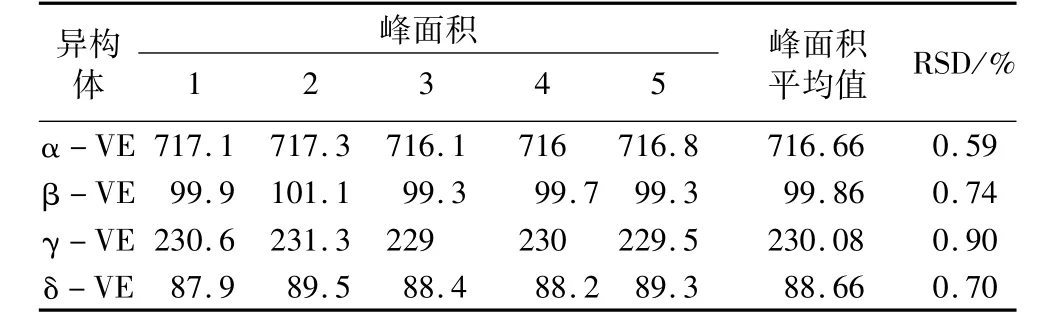
表4 精密度试验数据
2.7 稳定性试验
生育酚是抗氧化剂,在空气中暴露时间太久会氧化分解。为保证生育酚测定的准确性,本研究选取4个不同品种的棉仁粉,在样品提取后的24 h内分时进样测定。结果表明:4个样品在配置后的24 h内,α-、β-、γ-VE的相对标准偏差均小于5%,而δ-T的RSD较大,但也均小于10%(表5)。说明棉籽中生育酚的测定在24 h内是相对稳定可信的。

表5 稳定性试验数据
2.8 回收率试验
参照商军等[17]、彭光华等[15]、马戎[16]等回收率试验的设计方案,称取3份生育酚含量已知的棉仁粉样品0.1 g,每份平行测定3次,按照1.4.1的方法提取生育酚后,取5 mL提取液,设置α-、β-、γ-、δ-生育酚标准品的质量浓度梯度为0.5、0.05、0.1、0.05μg/mL,2.0、0.2、0.5、0.2μg/mL,和 5.0、0.5、2.0、0.5μg/mL。在1.4.3的 HPLC条件下,计算回收率。结果表明:α-、β-、γ-、δ-T的平均回收率均在90%~105%范围内,相对标准偏差在7%之内(表6),说明样品的处理方法得当,回收率高,准确性好。

表6 回收率试验数据/%
2.9 与国际标准法(ISO 9936—2006)的比较
参照国际标准化组织发布的ISO 9936—2006测定方法(以下简称“ISO法”),利用2013年种植获得的3个不同品种的棉仁样品,与本方研究优化建立的方法进行对比研究。结果表明(表7)采用本研究优化建立的方法,3个品种各成份测定值均高于ISO法。可能原因:一是本方法在保证4种生育酚均能检测到的情况下,样品量仅0.1 g,而ISO法的样品量要求为2 g,较多的样品可能容易造成生育酚未被充分提取;二是本方法在添加无水乙醇和还原剂抗坏血酸后振荡离心,反应过程缓慢,且密闭性较好,较好地避免样品中的生育酚被氧化损耗,而ISO法在氮气环境中通入氢氧化钾,样品迅速发生反应,操作过程中容易混入空气氧化部分生育酚,导致测定结果偏低。这说明,采用本研究优化建立的方法对棉仁生育酚含量及组分的测定比较精确。
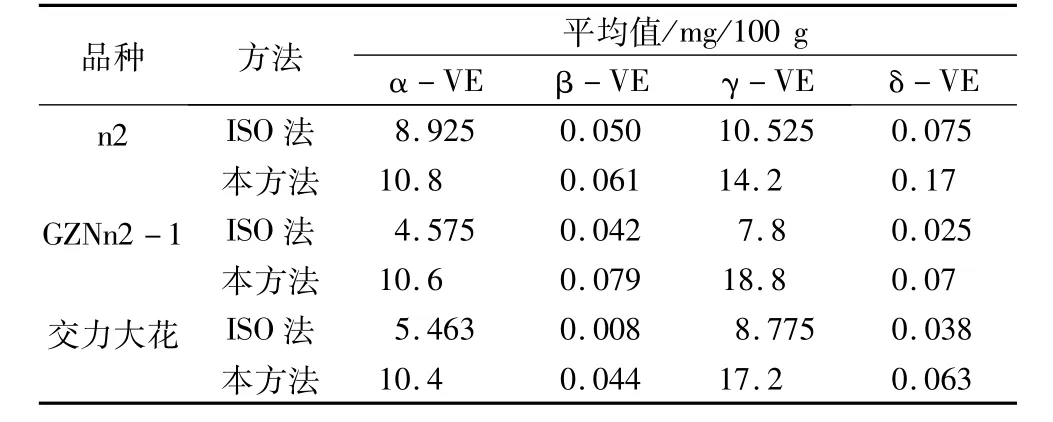
表7 ISO 9936—2006法与本试验方法的测定比较
3 结论
本研究优化并建立了高效液相色谱-紫外检测法快速测定棉仁生育酚的方法,能将生育酚的各成分完全分离并定量。具体方法为:样品用抗坏血酸和乙醇溶液处理后,以正己烷为提取溶剂,暗处静置15 h后超声萃取40 min,离心分离;采用Agilent色谱柱 C18(250 mm×4.6 mm,5μm),以正己烷∶异丙醇 =100∶1为流动相,流速 0.88 mL/min,进样量 20 μL,紫外检测波长300 nm,柱温23℃。检测结果表明,棉仁中4种生育酚的回归曲线R2在0.990~0.999之间,在检测浓度内线性关系良好;各指标的相对标准偏差均在10%以下,平均回收率为90%~105%,检出限范围是 0.1~0.2μg/mL,定量限为0.2~0.5μg/mL。说明该方法作为棉仁生育酚的测定方法,操作简便、准确、快捷、选择性好,具有较强的实用价值。
志谢:本研究的高效液相色谱分析得到浙江大学农业与生物985平台分析测试中心的支持,周希同学参与了样品准备及具体的测试操作等工作,在此特表感谢。
[1]吴时敏,吴谋成,张巧忠.菜籽油精炼过程种生育酚的变化[J].营养学报,2003,25(4):418-420
[2]凌关庭.食品抗氧化剂及其进展(四)[J].粮食与油脂,2001,1:47-48
[3]韩世温.VE在油脂加工和大豆储存过程中的变化分析及分离分析[J].中国油脂,1997,22(5):37-39
[4]Wong ML,Timms REGoh EM.Colorimetric determination of total tocopherols in palm oil,olein and stearin[J].Journal of the American Oils Chemists'Society.1988,65(2):258-261
[5]Whittle KJ,Pennock JF.The examination of tocopherols by two-dimensional thin-layer chromatography and subsequent colorimetric determination[J].Analyst,1967(92):423-430
[6]Mahon JH,Chapman RA.Detection of adulteration of butter with vegetable oils by means of the tocopherol content[J].Analytical Chemistry,1984,26(7):1195-1198
[7]Baxter JC,Robeson CD,Taylor JD,et al.Naturalα-,βandγ-tocopherols and certain esters of physiological interest[J].American Chemical Society,1943(65):918-924
[8]Marcus MF,Hawley MD.Electrochemical studies of the redox behavior ofα-tocopherol[J].Biochimica et Biophysica Acta,1970,201(1):1-8
[9]Svanholm U,Bechgaard K,Parker VD.Electrochemistry in media of intermediate acidity.VIII.Reversible oxidation products of theα-tocopherol model compound,cation radical,cation,and dication[J].Journal of the American Chemical Society,1974,96(8):2409-2413
[10]Grebenstein N,Frank J.Rapid baseline-separation of all eight tocopherols and tocotrienols by reversed-phase liquid-chromatography with a solid-core pentafluorophenyl column and their sensitive quantification in plasma and liver[J].Journal of Chromatography A,2012,1243:39-46
[11]Andrés MPS,Otero J,Vera S.High performance liquid chromatographymethod for the simultaneous determination ofα-,γ-andδ-tocopherol in vegetable oils in presence of hexadecyltrimethylammonium bromide/n-propanol in mobile phase[J].Food Chemistry,2011,126:1470-1474
[12]Schwartz H,Ollilainen V,Piironen V,etal.Tocopherol,tocotrienol and plant sterol contents of vegetable oils and industrial fats[J].Journal of Food Composition,2008(21):152-161
[13]Swigto AG,Sikorska E.Simple reversed-phase liquid chromatographymethod for determination of tocopherols in edible plant oils[J].Journal of Chromatography A.2004,1048:195-198
[14]李跃红.转基因抗虫棉籽油中维生素E含量的检测[J].中国卫生检疫杂志,2006,16(3):318-319
[15]彭光华,王辉,张春雨,等.高效液相色谱法测定油菜籽中维生素 E含量 [J].中国粮油学报,2008,23(4):210-214
[16]马戎.高效液相色谱法测定烟草中的维生素E[J].产业与科技论坛,2013,12(4):99-101
[17]商军,华贤辉,王蓓,等.高效液相色谱法测定维生素E粉含量[J].中国饲料,2006(24):21-28
[18]刘敏轩,陆平.中国谷子育成品种维生素E含量分布规律及其与主要农艺性状和类胡萝卜素的相关性分析[J].作物学报,2013,39(3):398-408
[19]张桂云,刘如如,张鹏,等.转基因水稻中过表达OsHGGT基因提高种子三烯生育酚含量的研究[J].生物技术通报,2012(8):64-70
[20]接伟光,张勇,蔡柏岩,等.磷素对不同大豆品种籽粒维生素 E含量的影响[J].安徽农业科学,2011,39(36):237-239
[21]刘焕成,李文滨,韩英鹏,等.大豆维生素E与主要农艺性状和品质性状的相关性分析[J].大豆科学,2011,30(1):89-91.
Determination Method of Composition and Content of Tocopherol in Cottonseed Kernels by High Performance Liquid Chromatography
Yan Jun Lu Zhihui Zhu Shuijin Chen Jinhong
(College of Agriculture and Biotechnology of Zhejiang University,Zhejiang Province Key Laboratory of Crop Germplasm Resource,Hangzhou 310058)
The rapid extraction technology of tocopherol from cottonseed kernels and the high performance liquid chromatography(HPLC)determination method for tocopherol content are built and optimized in the study.After dissolved in ascorbic acid and ethanol,the analytes were ultrasonically extracted by n-hexane.The four types of tocopherolwere separated by using ZORBAX4® RX-SIL C18 column with themobile phase of n-hexane and isopropanol under isocratic elution,and finally detected and quantified by ultraviolet detector(excitation wavelength=300 nm,emission wavelength=330 nm).Under the optimal conditions,themultiple correlation coefficients(R2)of the four isomers of tocopherolwere among 0.990~0.999.The relative standard deviation(RSDs,n=5)of precision test resultswere lower than 1%,and the average of recovery ratio ranged from 90%to 105%with RSDs(n=3)lowing 7%.The detection limits and quantification limits of the method for four isomers of tocopherol were 0.1~0.2 μg/mL and 0.2~0.5μg/mL respectively.The results demonstrate that the determination method as rapid determination method of totaxin of cottonseed kernelsmentioned above is easy,efficient,accurate and with high practical value.
cottonseed kernels,tocopherol,high performance liquid chromatography
O657.7
A
1003-0174(2015)08-0120-07
转基因生物新品种培育科技专项(2013ZX08005-005)
2014-02-20
阎君,女,1989年出生,硕士,作物品质形成与调控
陈进红,男,1964年出生,副教授,作物品质形成与调控
