牛磺酸对富含淀粉食品中丙烯酰胺的抑制作用
2015-12-20郝瑞芳
郝瑞芳 景 浩
(山西林业职业技术学院园艺系1,太原 030009)(中国农业大学食品科学与营养工程学院2,北京 100083)
牛磺酸对富含淀粉食品中丙烯酰胺的抑制作用
郝瑞芳1景 浩2
(山西林业职业技术学院园艺系1,太原 030009)(中国农业大学食品科学与营养工程学院2,北京 100083)
运用天冬酰胺/葡萄糖模式反应体系研究了牛磺酸对富含淀粉的食品中丙烯酰胺生成的影响及其抑制机理。试验结果显示:牛磺酸能够显著抑制天冬酰胺/葡萄糖反应体系中丙烯酰胺的生成,且抑制率与浓度呈剂量关系。运用LC-QTOF分析得到2种主要的反应产物:丙烯酰胺-牛磺酸加合物和丙烯酰胺二聚体-牛磺酸加合物。此外,牛磺酸与葡萄糖共存于同一体系中加热时,葡萄糖的含量显著下降,说明牛磺酸可与葡萄糖发生反应。通过模式反应体系证明:牛磺酸能够显著降低富含淀粉食品中的丙烯酰胺含量;抑制机理主要是牛磺酸与丙烯酰胺直接发生反应,反应产物为丙烯酰胺-牛磺酸加合物和丙烯酰胺二聚体-牛磺酸加合物,从而除去体系中已经生成的丙烯酰胺。此外,牛磺酸能够与葡萄糖发生美拉德反应,从而与天冬酰胺竞争消耗体系中的葡萄糖,减少了食品中的丙烯酰胺含量。
牛磺酸 富含淀粉食品 丙烯酰胺 抑制机理
2002年瑞典国家食品局和斯德哥尔摩大学的研究结果发现,经长时间油炸的食品(如炸薯条和谷物)中含有一定量的丙烯酰胺(Acrylamide,AA)。AA是一种具有神经毒性和潜在致癌性的物质,已被国际癌症研究总署列为“人类可能的致癌物”(2A类)[1]。AA的形成主要是食品中的氨基酸(主要是天冬酰胺,Asparagine,Asn)和还原糖(如葡萄糖,Glucose,Glc;果糖,Fructose,Fru)在 120℃以上的高温油炸或焙烤条件下,通过美拉德反应而生成,且随着加热温度的升高,AA的生成明显增加[2-3]。多数食品因含一定量的氨基酸、蛋白质和糖,在加热过程发生美拉德反应。
研究表明在模拟体系和谷物、马铃薯等食品体系中添加甘氨酸、赖氨酸和半胱氨酸能够有效地抑制 AA的生成[4-6]。牛磺酸(Taurine,Tau)是一种含硫氨基酸,是动物机体内含量最丰富的自由氨基酸,广泛存在于所有动物的组织、细胞内,特别是神经、肌肉和腺体中的含量较高,以海洋生物中含量为最高[7]。牛磺酸能够参与美拉德反应,有研究表明牛磺酸能通过竞争性消耗葡萄糖来抑制白蛋白的糖基化反应。
本试验以天冬酰胺/葡萄糖(Asn/Glc)体系为模型,利用高效液相色谱法研究牛磺酸对食品体系中AA的生成是否有抑制作用,进一步利用液相-飞行时间质谱法证实了其抑制机理。
1 材料与方法
1.1 仪器与试剂
SPD-20A型高效液相色谱仪:日本Shimadzu公司,配紫外检测器;Thermo Hypersil ODSC18色谱柱(250 mm ×4.6 mm,5μm):美国 Thermo公司;Agilent 1200型液相色谱仪:美国 Agilent公司;Qstar Elite四极杆飞行时间质谱仪:美国Applied Biosystems公司;Sunfire C18色谱柱(150 mm×4.6 mm,5μm):美国Waters公司。
丙烯酰胺标准品,纯度99.5%:德国 Labor Dr.Ehrenstorfer-Schafers公司;牛磺酸:国药集团化学试剂有限公司。
丙烯酰胺储备液浓度1.0 mg/g;磷酸盐缓冲液配制:称取 KH2PO40.20 g,Na2HPO4·12H2O 2.90 g,KCl 0.20 g,NaCl 8.00 g,加 900 mL去离子水溶解,用18%的HCl调pH值至7.4,最后定容至1 L。
1.2 试验方法
1.2.1 模式反应体系的确立
1.2.1.1 Asn/Glc/Tau反应体系
准确称取 Asn 0.15 g,Glc 0.20 g,称取4份,1份做为对照组,其余3份中分别加入100 mg/g的Tau 100、500、1 000μL,分别置于 4个 10 mL的容量瓶中,用PBS(pH 7.4)溶解,调溶液pH为8.0,定容至10 mL,使Asn与Glc的终浓度均为0.1 mol/L,Tau的终浓度分别为1、5、10 mg/g。
1.2.1.2 Tau/Glc反应体系
准确称取 Tau 0.10 g,Glc 0.20 g,置于10 mL的容量瓶中,用PBS(pH 7.4)溶解,调溶液pH为8.0,最后定容至10 mL,终浓度分别为 Tau 10 mg/g,Glc 0.1 mol/L。
1.2.1.3 AA/Tau反应体系
准确称取AA 1.0 mg,Tau 0.10 g,置于10 mL的容量瓶中,用PBS(pH 7.4)溶解,调溶液pH为8.0,最后定容至10 mL,终浓度分别为 AA 100μg/g,Tau 10 mg/g。
将配好的上述反应体系分别加入耐高压玻璃管中,将耐高压玻璃管密闭并置于油浴锅中,分别于150℃下加热0~60 min,反应体系的温度用红外测温仪测量。反应结束后迅速将玻璃管放入冰水混合浴中终止反应。
1.2.2 HPLC-UV分析条件
采用高效液相色谱-紫外检测法(HPLC-UV)测定反应体系中的AA含量,操作条件为:色谱柱Thermo Hypersil ODS C18(250 mm × 4.6 mm,5μm),保护柱 C18(13 mm ×4.0 mm,5μm),流动相甲醇∶水 =3∶97,等浓度洗脱,流速 0.7 mL/min,柱温为室温(25℃),进样量20μL,紫外检测器,波长204 nm。
AA标准曲线的制定:用超纯水稀释AA标准品储备液,分别配制成 1.0、2.0、4.0、8.0、10.0、20.0 μg/g的AA标准溶液,按上述条件进行分析。以浓度为横坐标,峰面积为纵坐标,绘制AA标准曲线。
1.2.3 LC-QTOF分析条件
对AA/Tau反应体系中的产物采用液相-飞行时间质谱(Liquid Chromatography-QSTAR Time of Flight,LC-QTOF)得到的离子碎片进一步确定[8]。液相条件为:Agilent 1200型液相色谱仪,Sunfire C18色谱柱(150 mm ×4.6 mm,5μm),柱温为室温,流动相甲醇∶水 (0.1%甲酸)=10∶90,流速 0.3 mL/min。Turbo电喷雾离子源,正离子模式,扫描的质荷比范围为50~600。质谱参数:离子源电压4 200 V,雾化气(Gas 1)50 V;辅助气 (Gas 2)60 V;帘气 (CUR)20 V;脱溶剂气温度 450℃;解簇电压(DP)50 V;聚焦电压(FP)380 V。监测离子:AA-Tau加合物m/z197,m/z268。AA聚合物m/z143,m/z214。待测反应产物用含0.1%甲酸水溶液稀释10倍,过0.45 μm滤膜,进行分析。
1.2.4 统计分析
每个试验重复3次,每个重复测定3次,结果表示为Means±SD。采用 MINITAB 13.20软件进行One-way ANOVA分析。邓肯氏多重检验用来确定数据间的差异,显著水平为P<0.05。
2 结果与讨论
2.1 反应体系中AA含量测定条件的筛选
2.1.1 检测波长的选择
首先取1.0μg/g的AA标准溶液,用紫外分光光度计在190~300 nm波长范围内扫描,见图1,结果显示AA在204 nm处有最大吸收,因此选择检测波长为204 nm测定反应体系中的AA含量,这与文献报道的研究结果基本一致[9-10]。
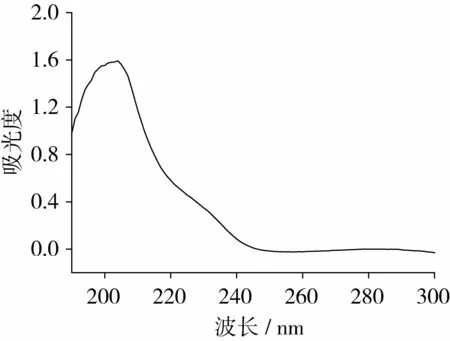
图1 丙烯酰胺标准溶液的紫外光谱扫描图
2.1.2 流动相的选择
采用甲醇和水的混合溶剂作为流动相,筛选不同浓度甲醇和水的配比,将甲醇和水的比例从0∶100、1∶99、2∶98……,一直调到 10∶90,用 HPLCUV检测AA的分离效果和峰形。结果显示:当甲醇和水的比例为3∶97时,AA与反应体系中的其他成分可以达到很好的分离,AA出峰时间为6.944 min,这与文献报道的结果一致[9]。
2.1.3 Asn/Glc反应体系中AA含量的测定
用HPLC-UV法测定 Asn/Glc反应体系中的AA含量。以不同浓度的AA标准品溶液进样,每个浓度测定3次,取平均值,以AA浓度(C)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,线性方程为A=278 512C-15 148,R2=0.998(n=3)表明 AA在0~20μg/g范围内线性关系良好。
为了更好地看出AA标准品和Asn/Glc反应体系中AA的出峰时间、峰形及各反应时间下的AA含量,选择横、纵坐标均相同的几个加热温度和时间下的AA图谱进行比较(见图2)。结果显示:不同加热温度和加热时间下得到的Asn/Glc反应体系中的AA也能够在该色谱条件下进行很好的分离,且反应产物稀释10倍后,产物中的AA浓度恰好在AA标准曲线的线性范围内,因此选择稀释倍数为10倍。


图2 丙烯酰胺标准品和天冬酰胺/葡萄糖反应体系中生成的丙烯酰胺的色谱图
2.2 Tau对Asn/Glc反应体系中AA生成的影响
图3显示了Tau对Asn/Glc反应体系中AA生成的影响。当添加1、5、10 mg/g的 Tau时,体系中AA的生成量分别从117.7μg/g(对照组)降低至97.9、78.4、43.1μg/g,对 AA生成的抑制率分别达到16.8%、33.4%、63.4%。说明高、中、低浓度的Tau均能显著抑制Asn/Glc体系中AA的生成。该结果与甘氨酸的的抑制率接近[11],在 Asn/Glc模式反应体系中添加10 mg/g的甘氨酸,能使体系中AA的含量降低约60%。Shin等[12]研究表明在Asn/Glc水溶液体系中添加0.1%~2.5%的Tau,于150℃加热30 min,Tau显著抑制了体系中AA的生成;土豆片在油炸前预先用0.1%~2.0%的Tau浸泡30 min,结果显示油炸后土豆片中的AA含量显著下降。
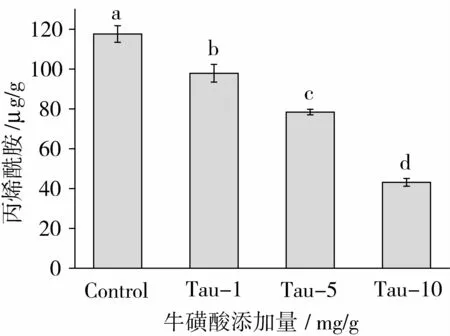
图3 牛磺酸对天冬酰胺/葡萄糖反应体系中丙烯酰胺生成的影响
2.3 Tau抑制AA的机理研究
2.3.1 LC-QTOF分析
利用LC-QTOF MS分析能够进一步确定AA/Tau反应体系中的产物,且四极杆飞行时间质量分析器能够给出物质的精确分子质量。图4给出了AA/Tau体系于150℃反应60 min时体系中各物质的色谱图。反应60 min时,体系中除包含有未反应完的AA和Tau外,新生成的物质有AA-Tau加合物、AA二聚体-Tau加合物、AA二聚体和AA三聚体。m/z197的 [M+H]+是一分子AA(Mr=71)和一分子Tau(Mr=125)形成的 AA-Tau加合物,m/z268的[M+H]+是两分子 AA(Mr=71)和一分子 Tau(Mr=125)形成的AA二聚体-Tau加合物,AA-Tau加合物的含量远远高于AA二聚体-Tau加合物。Tau含有NH2基团,与AA的CH2=CH2不饱和双键易发生麦克尔加成反应,生成的AA-Tau加合物还含有1个亲核基团(NH),可以和另一分子的AA结合形成AA二聚体-Tau加合物,该结合方式与甘氨酸和AA的结合方式类似[11,13]。m/z143的[M+H]+是两分子 AA(Mr=71)聚合形成的 AA二聚体,m/z214的 [M+H]+是三分子 AA(Mr=71)的聚合产物,AA二聚体的含量高于三聚体。Stadler等[14]研究表明AA含有不饱和双键,在高温下很容易发生聚合反应,且反应体系中有盐的存在更容易促进AA的聚合[15]。LC-QTOF结果表明AA-Tau加合物是生成的主要产物,证实了Tau能够与AA直接发生反应,从而消除体系中的AA。
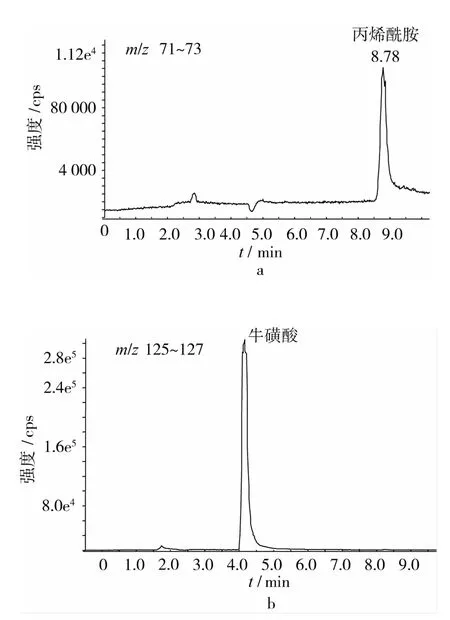
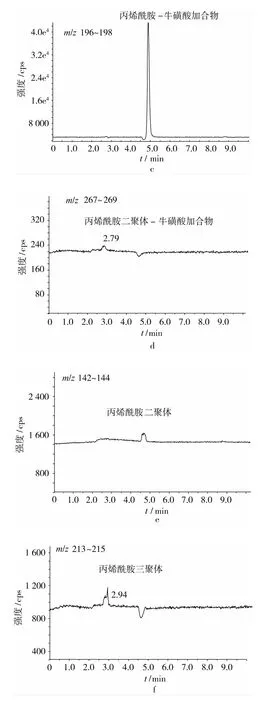
图4 加热60 min后丙烯酰胺/牛磺酸体系中生成物的色谱图
2.3.2 反应体系中Glc含量的变化
Glc在单独加热和Tau/Glc反应体系中的含量变化如表1所示,Glc单独加热时,反应15 min,Glc含量下降了11%,再延长反应时间,Glc含量无明显变化,可能是由于Glc在高温下加热时自身发生降解而使浓度略有下降,该结果与文献报道的一致[10]。当Glc与Tau共存于同一体系中加热时,Glc含量显著下降,说明Tau与Glc发生反应,导致Glc含量下降。早有研究报道Tau和乳糖之间可以发生美拉德反应,生成褐色的产物[16]。而且当把Tau加入到葡萄糖/白蛋白体系中时,Tau能通过竞争性消耗葡萄糖来抑制白蛋白的糖基化反应[17]。

表1 各反应体系加热(150℃)不同时间下的葡萄糖含量的变化
2.3.3 反应体系中Tau含量的变化
如图5所示,Tau单独加热时含量无变化,说明Tau的热稳定性很好,该结果与文献[18]一致。但当Tau与Glc于同一体系中加热时,Tau的含量显著下降,且随着反应时间的延长而显著降低,反应达到60 min时Tau含量降低最大,达到28%,进一步证明了Tau与Glc一起加热时会发生反应。有研究结果表明将Tau与乳酸置于同一缓冲液中加热,Tau的含量下降,体系的褐变程度增加,说明Tau能够与乳酸发生美拉德反应[16]。将Tau添加到葡萄糖-白蛋白的混合溶液中于37℃孵育30 d,Tau能够与白蛋白竞争消耗葡萄糖,从而抑制白蛋白的糖基化反应[17]。

图5 各反应体系加热(150℃)不同时间下的牛磺酸含量的变化
2.3.4 Tau抑制AA的反应机理的提出
根据上述研究结果,本试验提出2条Tau抑制Asn/Glc反应体系中AA的反应途径(图6)。一条是Tau通过与Asn竞争消耗Glc来减少体系中AA的生成,Tau/Glc体系发生的Maillard反应为该途径提供了直接的依据[19]。另一条途径是,Tau与 AA发生Michael亲核加成反应生成AA-Tau加合物,这是反应的主要产物,此外还生成极少量的AA二聚体-Tau加合物。AA还有2个反应位点(共轭双键和氨基),亲电双键能够与Tau的氨基发生亲核加成反应,生成的产物AA-Tau加合物还含有1个亲核基团(NH),可以和另一分子的AA结合形成AA二聚体-Tau加合物[20]。此外,Tau的存在还促进了AA自身发生聚合作用,该结果与NaCl的作用相似[15]。

图6 牛磺酸抑制丙烯酰胺生成的机理
3 结论
利用Asn/Glc模式反应体系证明,添加 Tau(1、5、10 mg/g)能够显著抑制体系中 AA的生成,Tau为10 mg/g时,抑制率最大达71.3%。抑制机理为:Tau既能够与Glc发生美拉德反应,从而与Asn竞争消耗体系中的Glc,减少AA的生成;又能够与AA直接发生亲核加成反应,从而除去体系中已经生成的AA,反应产物为AA-Tau加合物和AA二聚体-Tau加合物,前者生成量高于后者,这是Tau降低Asn/Glc模式体系中AA含量的主要反应途径。同时,Tau还有助于促进AA的聚合反应,生成AA二聚体和AA三聚体,二聚体含量高于三聚体。通过模式反应体系推测证明,牛磺酸能够有效地抑制富含淀粉的油炸、焙烤类食品中丙烯酰胺的含量。
[1]International Agency for Research on Cancer(IARC).Monographs on the Evaluation of Carcinogenic Risks to Humans[M].IARC:Lyon,France,1994,60:398-433
[2]Stadler R H,Blank I,Varga N,et al.Food Chemistry:Acrylamide from Maillard reaction products[J].Nature,2002,419:449-450
[3]Mottram D S,Wedzicha B L,Dodson A T.Food Chemistry:Acrylamide is formed in the Maillard reaction[J].Nature,2002,419:448-449
[4]Rydberg P,Eriksson S,Tareke E,et al.Investigations of factors that influence the acrylamide content of heated foodstuffs[J].Journal of Agricultural and Food Chemistry,2003,51:7012-7018
[5]Kim C T,Hwang E S,Lee H J.Reducing acrylamide in fried snack products by adding amino acids[J].Journal of Food Science,2005,70:C354-C358
[6]Fink M,Andersson R,Rosén J,etal.Effectofadded asparagine and glycine on acrylamide content in yeast-leavened bread[J].Cereal Chemistry,2006,83:218-222
[7]金锋.优质营养素——牛磺酸[J].中国食物与营养,2006(3):53-54
[8]Zeng X H,Kong R PW,Cheng KW,etal.Direct trapping of acrylamide as a keymechanism for niacin's inhibitory activity in carcinogenic acrylamide formation[J].Chemical Research in Toxicology,2010,23:802-807
[9]Yuan Y,Chen F,Zhao G H,et al.A comparative study of Acrylamide formation induced bymicrowave and conventional heating methods[J].Journal of Food Science,2007,72:C212-C216
[10]Arribas-Lorenzo G,Morales F J.Effect of pyridoxamine on acrylamide formation in a glucose/asparaginemodel system[J].Journal of Agricultural and Food Chemistry,2009,57:901-909
[11]刘洁,张海霞,胡小松,等.添加甘氨酸对天冬酰胺/葡萄糖模拟体系中丙烯酰胺形成的抑制作用[J].食品工业科技,2011,32:4-7
[12]Shin D C,Kim C T,Lee Y C,et al.Reduction of acrylamide by taurine in aqueous and potato chip model systems[J].Food Research International,2010,43:1356-1360
[13]Zamora R,Delgado R M,Hidalgo,F J.Model reactions of acrylamide with selected amino compounds[J].Journal of Agricultural and Food Chemistry,2010,58:1708-1713
[14]Stadler R H,Robert F,Riediker S,etal.In-depthmechanistic study on the formation of acrylamide and other vinylogous compounds by the Maillard reaction[J].Journal of Agricultural and Food Chemistry,2004,52:5550-5558
[15]Kolek E,Šimon P,Šimko P.Nonisothermal kinetics of acrylamide elimination and its acceleration by table salts Amodel study[J].Journal of Food Science,2007,72:E341-E344
[16]Saidi B,Warthesen J J.Analysis and heat stability of taurine in milk[J].Journal of Dairy Science,1990,73:1700-1706
[17]Nandhini A T A,Thirunavukkarasu V,Anuradha C V.Stimulation of glucose utilization and inhibition of protein glycation and AGE products by taurine[J].Acta Physiological Scandinavica,2004,181:297-303
[18]凌关庭,唐述潮,陶民强.食品添加剂手册[M].北京:化学工业出版社,2000:77
[19]ClaeysW L,de Vleeschouwer K,Hendrickx M E.Effect of amino acids on acrylamide formation and elimination kinetics[J].Biotechnology Progress,2005,21:1525-1530
[20]Zamora R,Delgado R M,Hidalgo F J.Model reactions of acrylamide with selected amino compounds[J].Journal of Agricultural and Food Chemistry,2010,58:1708-1713.
The Inhibitory Effect of Taurine on Acrylamide Rich in Starch-Enriched Food
Hao Ruifang1Jing Hao2
(Department of horticulture,Shanxi Forestry Vocational Technical College1,Taiyuan 030009)(College of Food Science and Nutritional Engineering,China Agricultural University2,Beijing 100083)
The inhibitory effect and mechanism of taurine(Tau)on acrylamide(AA)formation rich in starch-enriched food,by using asparagine/glucose(Asn/Glc)model system.The results showed that AA formation was effectively inhibited in Asn/Glc model system by taurine.LC-QTOFMS revealed twomain peaks in extracted ion chromatograms[M+H]+atm/z197 andm/z268 when AA was heated with Tau,which were identified as AA-Tau and AA dimmer-Tau adducts,respectively.The results also showed thatGlc contentwas effectively decreased when Glc was heated with Tau in Tau/Glcmodel system,which indicated thatGlc could react directly with Tau in themodel system.These results obtained by the above-mentioned model reaction systems demonstrated that taurine could reduce the content of acrylamide rich in starch-enriched food effectively.The inhibitory effect of Tau on AA formation was not onlymediated through reacting directly with AA to promote formation of AA-Tau and AA dimer-Tau adducts,but also reacting with Glc by Maillard reaction to contest consumption of Glc with Asn.
taurine,starch-enriched food,acrylamide,inhibitorymechanism
TS21
A
1003-0174(2015)08-0105-07
国家自然科学基金(31171676)
2014-02-14
郝瑞芳,女,1978年出生,讲师,食品安全与质量控制
景浩,男,1957年出生,教授,生物活性物质与功能性食品
