超滤精制对芝麻蛋白水解液ACE抑制活性和抗氧化活性的影响
2015-12-20王振斌裴娟娟闫景坤马海乐姜美花
王振斌 裴娟娟 闫景坤 马海乐 王 林 姜美花
(江苏大学食品与生物工程学院,镇江 212013)
超滤精制对芝麻蛋白水解液ACE抑制活性和抗氧化活性的影响
王振斌 裴娟娟 闫景坤 马海乐 王 林 姜美花
(江苏大学食品与生物工程学院,镇江 212013)
以芝麻饼粕为原料,采用超滤技术制备功能多肽,研究超滤对蛋白酶水解肽的氨基酸组成、肽谱、降血压和抗氧化功能特性等影响。结果表明:经截留分子质量为10 ku和3 ku的超滤膜过滤,所得到的3个组分(相对分子质量分布>10 ku、3~10 ku和<3 ku)的必需氨基酸质量分数分别为15.6%、14.9%、15.0%,显著高于未经超滤(12.9%),分子质量分布在3~10 ku组分的总氨基酸质量分数达53.1%,比未经超时提高了7.6%;其中分子质量分布为3~10 ku和<3 ku酶解液的IC50值分别降低了6.6%和7.9%,血管紧张素转化酶(ACE)抑制活性显著提高;分子质量分布为3~10 ku和<3 ku酶解液的DPPH·自由基清除率IC50值与未经超滤时均降低了8.6%,羟自由基清除率分别降低4.20%和26.57%,抗氧化活性显著提高。
超滤 芝麻饼粕 多肽 ACE抑制活性 抗氧化活性
我国芝麻饼粕资源丰富,年产量在50万t以上。芝麻饼粕中含30%~50%的蛋白质,含有人体必需氨基酸,并且氨基酸配比良好。然而,目前芝麻饼粕尚未得到充分的利用,未能体现其应用价值。研究表明,许多植物蛋白酶解后会产生具有降血压功能的活性肽,并且已从多种食用蛋白酶解液中分离出具有生物活性的降血压片段[1]。因此,利用资源丰富、营养价值高的芝麻饼粕蛋白制备功能性多肽具有广阔的应用前景。
多肽的降血压和抗氧化功能备受关注,一方面是由于高血压人群不断增加,而常用的卡托普利等口服降压药品对肝脏、肾脏等人体器官会产生毒副作用;另一方面食品行业中广泛使用的一些人工合成抗氧化剂如 BHA、BHT和 PG等潜在的危害性[2]。因此,近年来利用动植物资源制备抗氧化肽的研究成为热点。为了制备高活性、组分明确的多肽,同时兼顾商业化生产,对多肽进行分离纯化是必要的环节。
超滤(Ultra Filtration,UF)是膜分离技术的一种,以膜两侧的压力差为推动力,溶液的溶剂与部分低分子质量溶质穿过膜上微孔到达膜的另一侧,而高分子溶质或其他乳化胶束团被截留。超滤技术具有其他分离操作不具有的优点,如无相变、无需加热、占地面积小、设备简单等。因此,超滤技术在食品行业中应用越来越广泛,特别是在降血压肽和抗氧化肽的分离纯化中[3]。然而,关于芝麻饼粕蛋白酶解制备活性多肽的研究中,采用膜分离法探讨活性多肽的分子质量分布与其降血压和抗氧化活性之间的关系目前还未见报道。
本试验采用超滤技术对芝麻蛋白水解液进行分离,研究超滤对蛋白酶水解活性多肽的氨基酸组成、肽谱、降血压和抗氧化功能特性的影响,为推动芝麻饼粕深加工,提高其附加值;同时,为降低降血压肽和抗氧化肽的生产成本提供借鉴。
1 材料与仪器
1.1 试验材料及试剂
芝麻蛋白水解液,自制(芝麻饼粕10 g,加入蒸馏水 100 mL,最优酶解条件:pH 8.8,酶解温度46℃,底物浓度8.5%,加酶量2 000 u/g,酶解时间24 min);马尿酰组氨酰亮氨酸(N-Hippuryl-L-histidyl-L-leucine,HHL)、1,1-二苯基 -2-三硝基苯肼(DPPH·):Sigma公司。
1.2 试验仪器及设备
截留分子质量为10 ku和3 ku的Pellicon系列纤维素平板膜:Millipore公司;BT00-300蠕动泵:常州市诚和卫生设备厂;SykamS433D/S433(塞卡姆)氨基酸分析仪:德国Sykam公司;ZORBAX Eclipse XEB-C18柱(4.6 mm×150 mm,5μm):Agilent公司。
2 试验方法
2.1 芝麻蛋白水解液的酶法制备
称取芝麻饼粕850 g,加入蒸馏水10 L,46℃,pH 8.8条件下,添加2 000 u/g碱性蛋白酶,酶解24 min。整个酶解过程中,用1 mol/L的 NaOH保持酶解液pH的稳定。反应结束后,加热煮沸,灭酶15 min。然后于5 000 r/min条件下,离心15 min,取上清液备用。
2.2 芝麻蛋白水解液的超滤分离
如图1所示。将芝麻饼粕酶解液,先经真空抽滤(Φ9 cm)后依次通过截留分子质量为10 ku(一级超滤)和3 ku(二级超滤)的平板膜,将分子质量在10 ku以上、3~10 ku和3 ku以下的产物收集浓缩后冷冻干燥。超滤条件如下:截留分子质量为10 ku的一级超滤时,操作压力为0.5 kg/cm2、酶解液温度为33℃;截留分子质量为3 ku的二级超滤时,操作压力0.8 kg/cm2、酶解液温度为33℃。
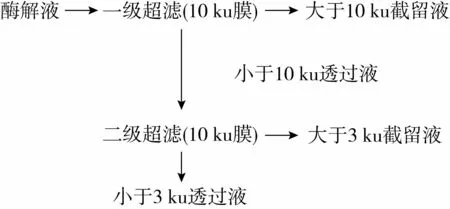
图1 超滤流程示意图
2.3 超滤后芝麻蛋白水解液的肽谱分析
对超滤后所得的4个分子质量段的芝麻蛋白水解液和碱提芝麻蛋白—分子质量(MW)小于3 ku、MW(3~10 ku)、MW>10 ku、碱提芝麻蛋白,用高效液相色谱测定其肽谱。
高效液相色谱测定条件如下:ZORBAX-C18柱(4.6×250 mm,填料粒径5μm);柱温28℃;检测波长215 nm;进样量10μL;洗脱液为超纯水-乙腈(80∶20,各含 0.5‰三氟乙酸);流速为 1 mL/min,洗脱时间为25 min。
2.4 芝麻蛋白水解液氨基酸组成分析
超滤后各组分的氨基酸(Amino acid,AA)组成用氨基酸分析仪进行分析。具体操作如下:称取一定量样品置于水解管中,加入10 mL 6 mol/L HCl,真空封口,于110℃进行蛋白水解24 h,放置冷却,过滤、定容。取0.5 mL滤液蒸干,加少许水,反复蒸干1~2次。加入2 mL样品稀释液,振荡混匀,0.22μm滤膜过滤后,进行氨基酸组成分析。
2.5 芝麻蛋白水解液的半抑制浓度测定
参照吴琼英等[4]的研究方法并稍作修改。准确吸取10μL样品于1.5 mL离心管中,加入25μL ACE(1 u ACE溶于 10 mL的 pH 8.3、0.1 mol/L的硼酸缓冲液中,该缓冲液含0.3 mol/L NaCl),37℃保温5 min,随后加入 6.5 mmol/L HHL 40μL,在 37℃恒温反应30 min,然后加入85μL 1 mol/L HCl终止反应,所得反应液进行HPLC分析。用10μL pH 8.3硼酸缓冲液作空白对照试验。
HPLC条件:ZORBAX-C18柱(4.6×150 mm,填料粒径5μm);检测波长228 nm;进样量8μL;柱温25℃;流动相为超纯水-乙腈(80∶20,各含0.5‰三氟乙酸);流速1.0 mL/min。ACE抑制率计算公式如下:

式中:R为CE抑制率/%;A为空白对照组Hip的峰面积;B为添加芝麻蛋白水解液组Hip的峰面积。
称取一定质量样品配成不同浓度的溶液,以浓度为横坐标,抑制率为纵坐标绘制曲线,计算IC50值。
2.6 超滤后各组分抗氧化活性测定
2.6.1 清除DPPH·自由基
将芝麻蛋白水解液稀释成不同的浓度,分别取2 mL样品,加入 0.04 g/L 1,1-二苯基 -2-三硝基苯肼(DPPH·)无水乙醇溶液2 mL,混匀,反应20 min,离心10 min,取上清液于517 nm波长处测定其吸光值[4]。按下式计算样品对DPPH·自由基的清除率:
样品对DPPH·自由基的清除率=

式中:A1为水解液与DPPH·溶液反应后测得的吸光度;A2为无水乙醇代替水杨酸溶液测得的吸光度;A0为蒸馏水代替水解液测得的吸光度。
同时配制不同浓度的抗坏血酸(VC)溶液,按照上述方法测定VC对DPPH·自由基的清除率。
2.6.2 清除羟自由基
将芝麻蛋白水解液稀释成不同的浓度,分别取2 mL,加2 mL硫酸亚铁溶液(6 mmol/L),2 mL H2O2溶液(6 mmol/L),混匀,静置 10 min,再加 2 mL水杨酸溶液(6 mmol/L),混匀,静置 20 min,3 500 r/min离心10min,取上清液,于510 nm波长处测定其吸光值[5]。按下式计算样品对羟自由基的清除率:

式中:A1为水解液与水杨酸溶液反应后测得的吸光度;A2为蒸馏水代替水杨酸溶液测得的吸光度;A0为蒸馏水代替水解液测得的吸光度。
同时配制不同浓度的抗坏血酸(VC)溶液,按照上述方法测定VC对羟自由基的清除率。
3 结果与分析
3.1 超滤后芝麻蛋白水解液的肽谱分析
高效液相色谱(HPLC)法所得到的肽谱常用于蛋白质或多肽的鉴定以及突变点的检测。芝麻蛋白水解液经分子质量为10 ku和3 ku的超滤膜过滤后所得到的不同分子质量的组分,用高效液相色谱作肽指纹图谱,通过肽谱的变化可以直观地反映芝麻蛋白水解液经过膜滤后的变化情况。

图2 超滤后各各组分的肽谱
从图2可以看出,芝麻饼粕酶解液和碱提芝麻蛋白主要有3个组分峰,并且酶解液的峰面积较碱性蛋白大,尤其是前面2个峰面积是碱性蛋白峰面积的4倍左右。酶解液经过10 ku的膜过滤后,分子质量大于10 ku的芝麻蛋白水解液只有2个组分峰,保留时间为2.09 min的组分峰基本消失。经过3 ku的膜过滤后,分子质量在3~10 ku以及小于3 ku的芝麻蛋白水解液在1.43、1.09 min和1.45、1.91 min出的组分峰面积明显高于未过膜的芝麻蛋白水解液,其中分子质量小于3 ku的组分峰更显著。从肽谱可以看出,经过两级分子质量超滤膜过滤后各分子质量ACE抑制肽的组分有了显著的变化;同时,经过两级超滤之后随着分子质量的减少,分离出更多的肽。这也说明,具有活性的多肽与酶解液中的其他成分混合在一起,未能有效的分离开来。因此,用超滤的方法进行初级纯化多肽产品是有必要的。
3.2 超滤后芝麻蛋白水解液的氨基酸分析
对芝麻蛋白水解液进行氨基酸组成分析,结果如表1所示。由表1可以看出,芝麻蛋白水解液的氨基酸种类丰富,含有17种氨基酸(色氨酸未测),其中8种为人体必需氨基酸。质量分数最高的氨基酸为谷氨酸(Glu),在超滤前后样品中其质量分数分别为11.3%、10.4%、13.6%、12.5%,虽然不是人体必需氨基酸,但对机体代谢和细胞增殖具有重要作用[6]。其次为精氨酸(6.5%、6.0%、6.9%、6.5%)和天冬氨酸(4.0%、4.5%、5.3%、4.1%)。芝麻蛋白水解液中含有的必需氨基酸质量分数符合FAO/WHO推荐模式[7]。对酶解得到的芝麻蛋白水解液采用超滤的方法进行分离,超滤后必需氨基酸质量分数分别为15.6%、14.9%、15.0%,明显高于未经超滤的12.9%。此外,总氨基酸质量分数也有提高,分子质量分布在3~10 ku范围的组分的总氨基酸质量分数最高,达53.1%,提高了7.6%。

表1 不同分子质量芝麻蛋白水解液的氨基酸组成(g/100 g蛋白质)
3.3 超滤对ACE抑制活性的影响
姜瞻梅[8]选用10 ku和3 ku的超滤膜对酪蛋白酶解物进行超滤,发现随着分子质量的减小,超滤物的ACE抑制活性逐渐提高。何荣海等[9]研究条斑紫菜ACE抑制肽时也发现分子质量越小,超滤物的ACE抑制活性越高。然而,Mullally等[10]对乳清蛋白的胰蛋白酶酶水解物进行超滤处理时发现,尽管超滤物的活性比原水解物高,但小于1 ku组分的ACE抑制活性低于小于3 ku组分的抑制活性,这些结果表明较小分子截留量的超滤膜容易造成料液中有效成分的损失。因此,本试验选用10 ku和3 ku 2种超滤膜。经10 ku和3 ku超滤膜后的不同分子质量范围的芝麻蛋白水解液的ACE抑制活性有一定变化,结果见表2。

表2 超滤后各组分ACE抑制活性的IC50值
超滤后,分子质量大于10 ku的组分IC50值大于超滤前的3.03 mg/mL;分子质量在3~10 ku组分的IC50值比超滤前小,说明ACE抑制活性得到了提高;分子质量小于3 ku组分的IC50值最低,从超滤前的3.03 mg/mL下降到 2.79 mg/mL,提高了 ACE抑制活性,说明起降血压作用的多肽多为短肽。
经不同分子质量大小的超滤膜之后,ACE抑制活性发生变化,说明具有ACE抑制活性的多肽分子质量分布广;同时也说明酶解液中混杂着不同分子质量的ACE抑制肽、氨基酸、以及其他杂质,从而使得具有ACE抑制活性的肽片段纯度不高。
3.4 超滤对各组分抗氧化活性的影响
研究发现具有ACE抑制活性的多肽也具有不同程度的抗氧化活性[11]。同时,Gao等[12]、Moure等[13]和 Mamelona等[14]研究发现抗氧化活性肽的抗氧化活性与相对分子质量有很大的关系。Raghavan等[15]和 Tang等[16]认为相对分子质量小的肽段具有更高的抗氧化能力。苏春燕[17]采用超滤、大孔吸附树脂分级、MALDI-TOF-TOF MS法测得抗氧化中主要成分的相对分子质量为951u和1 349 u。任海伟等[18]研究谷朊粉抗氧化肽的活性,也认为抗氧化活性肽主要集中在低相对分子质量范围内。因此,本试验对芝麻ACE降血压肽超滤前后各组分进行了抗氧化活性测定。
3.4.1 清除DPPH·自由基能力
经过超滤后,各组分的DPPH·自由基清除率见表3。芝麻蛋白水解液的 IC50为 0.35 mg/mL,是VCIC50(0.003 4 mg/mL)的 102.85倍。尽管芝麻蛋白水解液对清除DPPH·自由基效果远不如VC,但是本试验得到的芝麻蛋白水解液的IC50比曹辉等[19]制备得到的抗氧化肽(IC50=0.93 g/L)、李丹等[20]制备得到的高纯度大豆低聚肽(IC50=52.85 mg/mL)小,对于后期的研究具有一定的参考价值。

表3 超滤后各组分清除DPPH·自由基的IC50
经3 ku和10 ku超滤膜之后的组分对DPPH·自由基的清除率较超滤前有提高。从表3中可看出分子质量<3 ku的组分效果最好,小于超滤前酶解液的 IC50值(0.35 mg/mL),可见超滤后清除率得到了提高。
3.4.2 清除羟自由基能力
VC和芝麻蛋白水解液超滤前后均表现出较强的清除羟自由基的能力,如表4所示。芝麻蛋白水解液的 IC50为1.43 mg/mL,是 VC IC50(0.30 mg/mL)的4.76倍,且该值低于部分文献报道[21]。由此可知,芝麻蛋白水解液制备ACE抑制肽具有一定的清除羟自由基的能力。

表4 超滤后各组分清除率羟自由基的IC50
4 结论
4.1 经过10 ku和3 ku超滤膜之后,其氨基酸质量分数较未经超滤时的45.50%分别提高到48.00%、53.10%、50.30%,其变化主要是由影响ACE抑制活性的精氨酸、酪氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甘氨酸、苯丙氨酸和脯氨酸等氨基酸引起的。
4.2 分子质量为10 ku和3 ku超滤膜对芝麻蛋白水解液ACE抑制活性有提高作用。分子质量大于10 ku、3~10 ku、小于 3 ku 3个组分 IC50值分别为4.31、2.83和 2.79 mg/mL,同时起降血压作用的多肽多为短肽。
4.3 碱提蛋白、芝麻饼粕酶解物、大于10 ku组分、3~10 ku组分、小于3 ku组分分别出现3、3、2、4、7个峰,随着分子质量的减小,出现的组分峰越多,并且其峰面积也明显变大。因此,用超滤的方法进行初级纯化多肽产品以提高其ACE抑制活性的效果是比较理想的。
4.4 芝麻饼粕酶解液具有一定的体外抗氧化能力,并且分子质量越小,其抗氧化活性越强。酶解液和超滤后各组分清除DPPH·和羟自由基的IC50值分别为0.35和 1.43 mg/mL、0.41和1.75 mg/mL、0.32和1.37 mg/mL、0.32和 1.05 mg/mL。
[1]陈季旺,姚惠源.几种常见植物蛋白生物活性肽的研究概述[J].中国油脂,2003,28(1):37-39
[2]王璋,许时婴,汤坚.食品化学[M].北京:轻工业出版社,2007:312-323
[3]王湛.膜分离技术基础[M].北京:化学工业出版社,2000:207-208
[4]吴琼英,马海乐,骆琳,等。高效液相色谱法测定血管紧张素转化酶抑制剂的活性[J].色谱,2005,23(1):79-81
[5]Li X X,Han L J,Chen L J.In vitro antioxidant activity of protein hydrolysates prepared from corn gluten meal[J].Journal of the Science of Food and Agriculture,2008,88(9):1660-1666
[6]郭宏伟.谷氨酸对神经干细胞增殖作用的实验研究[D].新乡:新乡医学院,2012
[7]FAO/WHO.Energry and protein requirements.Report of a Joint FAO/WHO[M].Rome:Published by FAO and WHO,1973
[8]姜瞻梅.酶解酪蛋白生产ACE抑制肽[D].哈尔滨:东北农业大学,2003
[9]何荣海,马海乐,余筱洁.条斑紫菜ACEI抑制肽的超滤分离与离子交换纯化[J].农业机械学报,2012,43(2):146-150
[10]Mullally M M,Meisel H,FitzGerald R J.Angiotensin-I-converting enzyme inhibitory antivities of gastric and pancreatic proteinase digests of whey proteins[J].International Dairy Journal,1997(7):299-303
[11]Bahareh Sarmadi,Amin Ismail,Muhajir Hamid.Antioxidant and angiotensin converting enzyme(ACE)inhibitory activities of cocoa(Theobroma cacaoL.)autolysates[J].Food Research International,2011,44:290-296
[12]Gao D D,Cao Y S,Li H X.Antioxidant activity of peptide fractions derived from cottonseed protein hydrolysate[J].Journal of the Science of Food and Agriculture,2010,90:1855-1860
[13]Moure A,Dominguez H,Parajo JC.Antioxidant properties of ultrafiltration-recovered soy protein fractions from industrial effluents and their hydrolysates[J].Process Biochemistry,2006,41:447-456
[14]Mamelona J,Saint-Louis R,PelletierÉ.Nutritional composition and antioxidant properties of protein hydrolysates prepared from echinoderm byproducts[J].International Journal of Food Science and Technology,2010,45:147-154
[15]Raghavan S,Kristinsson H G.Antioxidative efficacy of alkali-treated tilapia protein hydrolysates:a comparative study of five enzymes[J].Journal of Agricultural and Food Chemistry,2008,56:1434-1441
[16]Tang X Y,He Z Y,Dai Y F,et al.Peptide fractionation and free radical scavenging activity of zein hydrolysate[J].Journal of Agricultural and Food Chemistry,2010,58:587-593
[17]苏春燕.超声波辅助酶解谷朊粉制备抗氧化肽的研究[D].无锡:江南大学,2010
[18]任海伟,王常青.超滤法分离黑豆抗氧化活性肽[J].食品科学,2009,30(12):123-126
[19]曹辉.大米蛋白酶法制备抗氧化肽的研究[D].镇江:江苏大学,2008
[20]李丹,李晓磊,谭克,等.高纯度大豆和花生低聚肽的体外抗氧化活性[J].食品科技,2008(6):138-141
[21]代春华.黄粉虫幼虫蛋白酶解制备降血压肽的研究[D].无锡:江南大学,2012.
Effects of Ultrafiltration on ACE-Inhibitory and Antioxidant Activities of Sesame Protein Hydrolysates
Wang Zhenbin Pei Juanjuan Yan Jingkun Ma Haile Wang Lin Jiang Meihua
(School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013)
In order to explore the application of ultrasonic andmicrowave technology in sesame cake ACE inhibitory peptide preparation,sesame cakeswere treated with ultrasonic,microwave and ultrasonic-assisted enzymolysis to study the effect of power,time and enzyme dosage on inhibition rate of ACE.The optimal conditions of ultrasonic treatment were power of4W/mL,time of10min and alkaline protease of1 300 u/g,and IC50value of ACE inhibitory peptide was 2.81 mg/mL.The optimal conditions of ultrasonic-assisted enzymolysis were power of 0.5 W/mL and alkaline protease of1 700 u/g for 15 min,and IC50value of ACE inhibitory peptidewas2.96 mg/mL.The optimal conditions ofmicrowave treatmentwere power of1.33W/mL for5 min,and IC50value of ACE inhibitory peptide was 2.81 mg/mL.
ultrafiltration,sesame cake,peptide,ACE inhibitory activity,antioxidant activity
TS229
A
1003-0174(2015)08-0058-06
苏北科技发展计划(BC2012421),江苏高校优势学科建设工程资助项目(苏政办发[2014]37号),江苏省高等学校大学生实践创新训练计划(201310299 019Z),江苏大学大学生科研立项资助项目(12A018)
2014-03-20
王振斌,男,1975年出生,教授,天然产物分离及应用
闫景坤,男,1980年出生,副教授,天然产物分离及应用
