苦荞壳活性组分的鉴定及其DNA损伤保护研究
2015-12-20吕远平
杨 旭 吕远平
(四川大学食品工程系,成都 610065)
苦荞壳活性组分的鉴定及其DNA损伤保护研究
杨 旭 吕远平
(四川大学食品工程系,成都 610065)
苦荞是一种非常重要的食品资源,为了能够对其有效地利用,以DPPH自由基清除活性为指标,通过极性萃取和柱层析的方法对醇提法得到的苦荞壳粗提物进行分离纯化。采用紫外光谱和HPLC-ESI/MS鉴定纯化的苦荞壳活性组分。结果表明,其主要成分为槲皮素,还包括微量的槲皮素-3-鼠李糖苷和山奈酚。琼脂糖凝胶电泳试验中纯化的苦荞壳活性组分显示出良好的DNA损伤保护作用,并表现出了明显的浓度依赖性。DNA损伤保护的定量研究中,当浓度为5~15 mg/mL时,纯化的苦荞壳活性组分对羟自由基和双氧水的清除活性分别为(68.46±0.52)%~(90.32±0.37)%和(72.19±0.42)%~(96.82±0.34)%。因此,纯化的苦荞壳活性组分具有的抗氧化性和DNA损伤保护作用为苦荞壳在食品、医药领域的应用提供了理论参考。
苦荞 DPPH自由基 HPLC-ESI/MS 抗氧化 DNA损伤
苦荞为荞麦属蓼科植物,它的种植和应用与其他谷类相似。2010年全世界荞麦的产量超过了151万t,其主要产地为中国[1]。苦荞作为一种功能性食品被广泛关注是由于它能够预防心脑血管疾病,且长期食用无不良影响[2]。据报道,苦荞能够降低血脂和总胆固醇[3-4]、降血糖[5]、降血压[6],还具有抗氧化活性[7-9]。
近年来,高血脂、高血压、心脏病、动脉硬化、糖尿病等慢性疾病的发病率持续升高,而这些慢性疾病的发生大多是由自由基引发的细胞损伤所引起。自由基也同样会引发DNA损伤,由超氧自由基和过氧化氢产生的羟自由基是最有效的DNA损伤剂,它通过将鸟嘌呤转化为8-羟基鸟嘌呤来实现对DNA的损伤[10]。DNA的氧化损伤是具有致癌性的,它与癌症和衰老等多种病理过程相关[11]。有研究表明抗氧化物质能够控制DNA氧化损伤,并保护DNA免受电离辐射、紫外线以及化学试剂的损害[12]。除此之外,自由基还能引起食品中的脂质过氧化,而这种变化会影响食品最终的可食性、风味、颜色、质地等感官质量。
苦荞中的高黄酮含量和强抗氧化活性已经被报道[13]。然而,对苦荞壳提取物的组成和生物活性却鲜见报道。因此,为了更有效地利用苦荞壳,研究其组成和生物活性尤为重要。
1 材料与方法
1.1 材料与试剂
苦荞:四川西昌。
芦丁标准品:美国Sigma公司;1,1-二苯基 -2-苦肼基:日本TCI公司;pBR322质粒DNA:美国Promega公司;层析硅胶:四川长威医药有限责任公司;Sephadex LH-20填料:美国GE公司;MCICHP 20P填料:日本三菱化学株式会社;其他试剂均为分析纯。
1.2 仪器与设备
UV-2000紫外可见分光光度计:上海Unico公司;LC-6AD岛津高效液相色谱系统:日本岛津公司;TSQ Quantum Ultra高效液相色谱-质谱联用系统:美国Thermafisher公司;MiniBIS Pro凝胶成像系统:DNR-IS公司。
1.3 试验方法
1.3.1 苦荞壳抗氧化组分的提取
将苦荞清洗烘干后粉碎,分离得到苦荞壳。称取60 g放入索氏抽提器中,用960 mL的无水乙醚在60℃下回流6 h以脱脂。脱脂后的原料用70%的乙醇溶液,按1∶15(V/V)的料液比于70℃下回流提取8 h,重复3次[14]。将粗提液过滤,在45℃真空条件下旋转蒸发,浓缩后得到浸膏。
1.3.2 总黄酮含量的测定
取1 mL样品液,加入0.3 mL 5%NaNO2,反应5 min,然后再加入0.3 mL 10%AlCl3,混匀。6 min后加入2 mL 4%NaOH,混合液用甲醇定容至10 mL。反应15 min后,在510 nm下测定吸光度。所有的测定均重复3次。通过与芦丁标准品对照,得到最终的测定结果,以g芦丁当量/100 g干重表示 (g rutin eq./100 g DW)[15]。
1.3.3 DPPH自由基清除活性的测定
苦荞壳中抗氧化组分的活性测定采用DPPH自由基清除活性的测定方法。准确称取5.0mg样品于25 mL容量瓶中,用甲醇定容,即得0.2 mg/mL样品液。将样品液用甲醇分别稀释至0.1 mg/mL,0.05 mg/mL,0.025 mg/mL,0.012 5 mg/mL和 0.006 25 mg/mL。取不同浓度的样品液各2mL于10mL比色管中,分别加入2 mL 0.08 mg/mL DPPH·乙醇溶液和1 mL Tris-HCl缓冲液(pH 7.4)。反应在闭光条件下进行30 min后,于517 nm下测定吸光度[16]。同样条件下,不添加DPPH·作为本底组,不添加样品液作为空白组。DPPH自由基清除活性按以下公式计算:

式中:As为样品组的吸光度值;Ab为本底组的吸光度值;Ac为空白组的吸光度值。
1.3.4 苦荞壳抗氧化组分的分离和纯化
将得到的粗提物浸膏混溶于纯水中,并分别用等体积的石油醚、乙酸乙酯、正丁醇进行极性萃取[17],磁力搅拌30 min后置于分液漏斗中静置30 min,分离。将得到的乙酸乙酯组分上样于硅胶柱,用氯仿 -甲醇溶液(100∶1,98∶2,95∶5,85∶15,50∶50,15∶85,5∶95,2∶98,1∶100,每个组分 500 mL)进行洗脱[1],得到 9个组分(A1-A9)。分别测定9个组分的DPPH自由基清除活性。将组分A4通过Sephadex LH-20层析柱进行分离,用100%甲醇洗脱,将洗脱液每10 mL收集1管,接50管,在350 nm下测定每管的吸光度,绘制洗脱曲线。根据测定结果,将19到32管的洗脱液合并后浓缩。得到的浓缩物再进一步通过MCICHP 20P层析柱进行分离,用甲醇 -水溶液(20∶80,40∶60,60∶40,80∶20,100∶0,每个组分500 mL)进行洗脱,得到5个组分(C1~C5)。将组分C4浓缩后冻干,即为纯化的苦荞壳活性组分(Purified active component of Tartary buckwheat hulls,PAT),并通过高效液相色谱进行分析。
1.3.5 高效液相色谱分析
采用Shimadzu LC-6AD高效液相色谱系统,C18色谱柱(150 mm×2.1 mm i.d.;5μm);进样量20μL;柱温为30℃;流动相A为0.1%的乙酸水溶液,流动相B为甲醇;梯度洗脱程序为:0 min 0%B;10 min 20%B;20 min 40%B;35 min 55%B;50 min 80%B;55min 100%B;60min 100%B;洗脱液流速为1 mL/min;检测波长为254 nm。
1.3.6 紫外可见光谱分析
对PAT进行紫外可见光谱分析,样品溶解于甲醇中,光谱扫描范围为200~400 nm。
1.3.7 HPLC-ESI/MS分析
采用TSQ Quantum Ultra高效液相色谱-质谱联用系统。选用Hypersil Gold-C18色谱柱(150 mm×2.1 mm i.d.;5μm);柱温为30℃;进样量20μL;流动相A为0.1%的乙酸水溶液,流动相B为甲醇,采用与1.3.5中相同的梯度洗脱程序;流速1 mL/min;检测波长为254 nm。使用正离子电喷雾电离方式;色谱柱流出组分进入质谱仪的流速为10μL/min;毛细管电压为3.88 kV,锥孔电压为53 V;离子源温度为120℃,雾化温度为200℃;扫描范围为100~1 500m/z[18]。
1.3.8 DNA损伤保护作用测定
PAT的DNA损伤保护活性测定是以pBR322质粒DNA为研究对象,通过1%的琼脂糖凝胶电泳来进行[11-12]。双氧水在紫外线的照射下产生羟自由基,使质粒DNA被氧化。试验在10μL的微型离心管中进行,反应混合物包括:3μL由5 mmol/L磷酸盐缓冲液(pH 7.4)稀释至172 ng/μL的pBR322质粒DNA,1μL 30%的双氧水,5μL不同浓度的PAT(0,5,10,15 mg/mL),反应在 254 nm紫外照射下诱发,室温下持续10 min。未进行处理和只经过双氧水处理的pBR322质粒DNA为空白对照。然后将反应混合物加入凝胶上样缓冲液(×6),上样于1%的琼脂糖凝胶进行电泳,100 V下持续85 min。电泳结束后,将凝胶浸泡在EB染色液中30 min,在凝胶成像系统下观察并拍照。
为了定量研究PAT对DNA损伤的保护作用,对PAT清除羟自由基和双氧水活性进行了测定。
将 1 mL 9 mmol/L的硫酸亚铁,1 mL 9 mmol/L的水杨酸 -乙醇溶液,1 mL 8.8 mmol/L的 H2O2,和1 mL PAT混合,反应在37℃下持续 30 min,在510 nm下测定其吸光度。在同样条件下,不添加PAT作为空白对照组[7]。羟自由基清除活性公式:

式中:As为样品组的吸光度值;Ab为本底组的吸光度值;Ac为空白组的吸光度值。
在清除双氧水试验中,将2.5 mL溶于0.2 M磷酸盐缓冲液的 H2O2(10 mmol/L)与 2.5 mL PAT混合。反应在37℃下持续10 min,在230 nm下测定其吸光度。同样条件下,不添加 PAT作为空白对照[19]。双氧水清除活性计算如上。
1.3.9 数据分析
所有数据以均值±标注差表示,每次样品的测定均重复3次。采用SPSS19.0进行方差分析和最小显著性差异分析(P<0.05即为差异显著)。
2 结果与分析
2.1 苦荞壳抗氧化组分的提取
苦荞壳中粗提物的提取率为6.08%(6.08 g粗提物/100 g苦荞壳)。以芦丁为标准品,所得到标准曲线的回归方程为y=12.091x-0.007 4,R2=0.999 5,式中:y为吸光度;x为样品浓度。苦荞壳总黄酮含量为(1.48±0.01)g rutin eq./100 g DW。
2.2 抗氧化组分的分离和纯化
粗提物浸膏混溶于纯水中,通过极性萃取得到4个组分:石油醚组分(88.4 mg),乙酸乙酯组分(356.2 mg),正丁醇组分(961.3 mg)和水组分(212.1 mg)。各极性萃取组分DPPH自由基清除活性测定结果如图1所示,乙酸乙酯组分DPPH自由基清除活性最强。当质量浓度为0~200μg/mL时,清除率变化范围为0%~(88.85±0.20)%,IC50为(15.00±0.07)μg/mL。
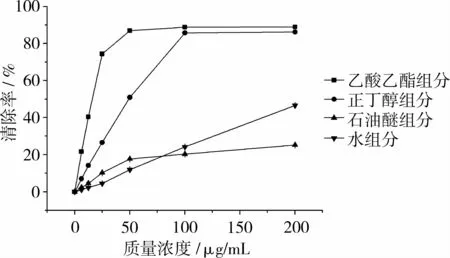
图1 4种极性萃取组分在不同浓度下的DPPH自由基清除活性
乙酸乙酯组分通过硅胶柱层析分离,得到9个组分:A1(22.0 mg),A2(14.0 mg),A3(43.9 mg),A4(93.4 mg),A5(84.4 mg),A6(59.4 mg),A7(12.5 mg),A8(8.5 mg),A9(7.3 mg)。图 2为各组分DPPH自由基清除活性的测定结果,A4组分展现了最强的DPPH自由基清除活性。将组分A4上样于Sephadex LH-20层析柱,用100%甲醇洗脱,得到2个组分:B1(28.0 mg),B2(60.7 mg)。洗脱曲线如图3所示,图3中有2个不同的峰,代表2个不同的组分。如图4所示,B2组分的DPPH自由基清除活性比B1组分强。将B2组分通过MCICHP 20P层析柱洗脱分离,得到5个组分C1-C5,其中组分C4活性最强。
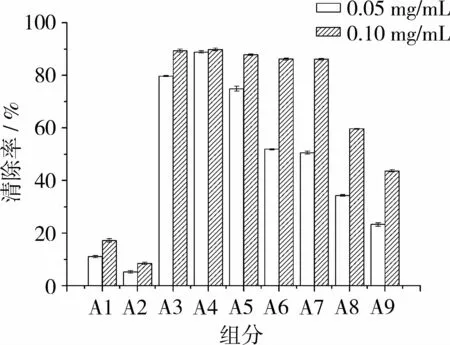
图2 硅胶柱各洗脱组分DPPH自由基清除活性
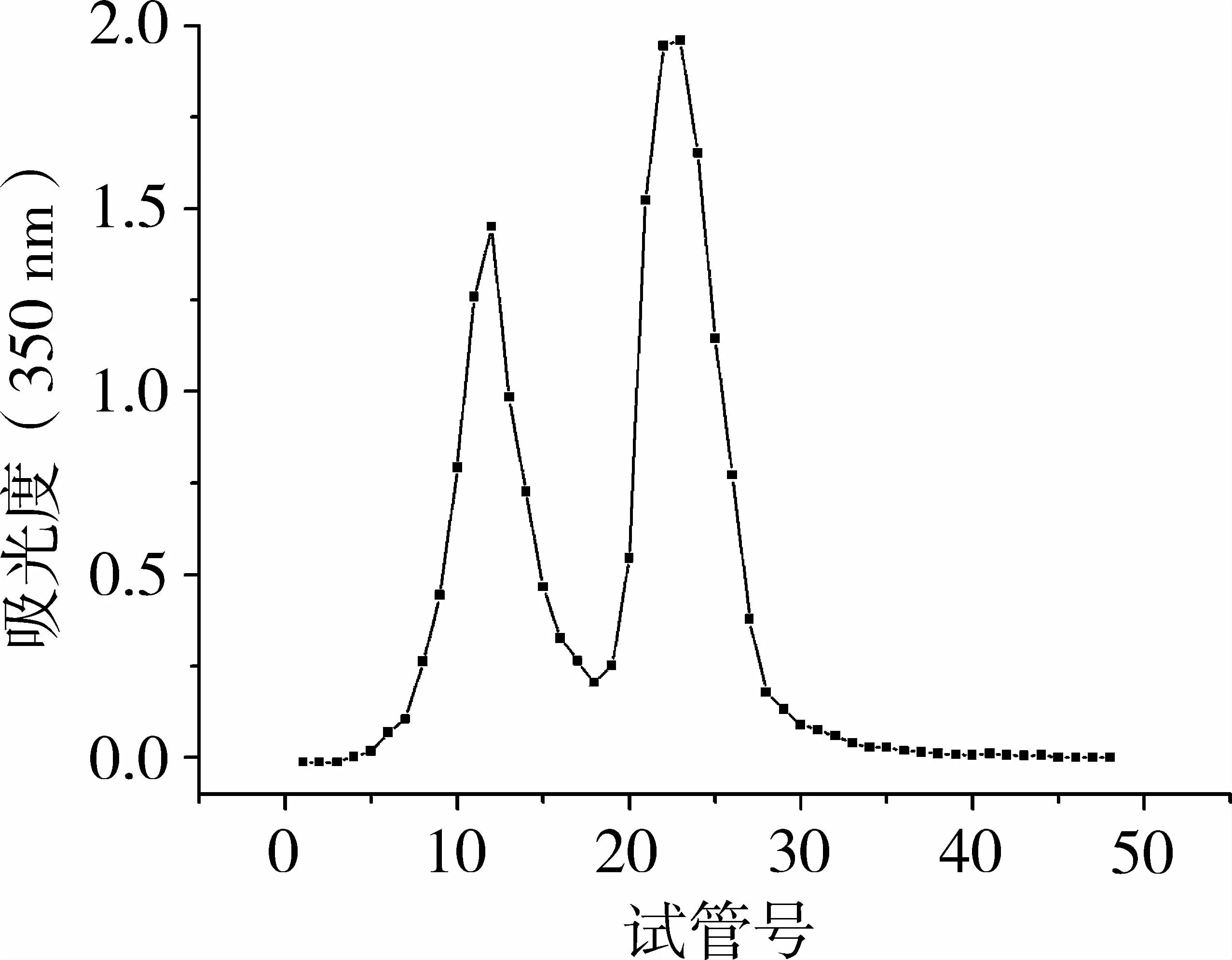
图3 Sephadex LH-20色谱柱洗脱曲线

图4 Sephadex LH-20各洗脱组分DPPH自由基清除活性
图5为经过纯化的苦荞壳提取物在254 nm下的高效液相色谱图。图5中只出现了1个峰,表明得到的活性组分有较高的纯度。

图5 PAT在254nm下的高效液相色谱图
2.3 紫外可见光谱分析
PAT紫外可见光谱中强吸收峰分别为211、255和372 nm,根据与槲皮素标准品的紫外可见光谱图进行比对,推测活性组分的主要化合物可能为槲皮素[20]。
2.4 HPLC-ESI/MS分析
根据HPLC分析,在254 nm下一种主要化合物被检测出,其保留时间为35.43 min(图6b)。图6b中只有1个峰,表明PAT中只含有一种主要物质。图6a为正离子模式下的总离子流图。如图6所示,一些低浓度化合物在15.73,25.38~26.98,59.70 min分别被洗脱出来。

图6 PAT的HPLC图
图7为PAT在正离子模式下的质谱图。图7c中m/z303.02为基峰,在正离子模式下其分子质量为302,根据对比文献,此化合物为槲皮素[21],m/z249.10是由槲皮素失去2个羰基碳环所形成的碎片离子峰。图7a中m/z305.13为槲皮素的特征峰,而m/z448.95和m/z146处的2峰是失去糖基部分产生的碎片离子峰,由此推断此化合物可能为槲皮素-3-鼠李糖苷[22-23]。图 7d中m/z286.01为山奈酚的特征峰,m/z164.5和m/z222.99的碎片离子峰是由山奈酚分别失去羰基碳环和C4H4O4基团所产生。因此,根据保留时间和质谱图推断其为山奈酚[23]。其中,槲皮素-3-鼠李糖苷是第一次在苦荞壳中被检出。然而,还需要对苦荞壳提取物进一步分离纯化才能确定槲皮素-3-鼠李糖苷和山奈酚的存在,以及鉴定出未知化合物(图7b)。
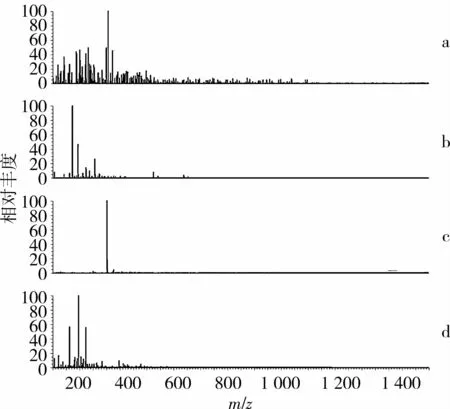
图7 正离子模式下PAT的质谱图
2.5 DNA损伤保护作用测定
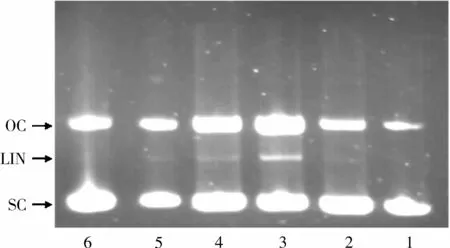
图8 PAT存在下紫外和双氧水处理的pBR322质粒DNA电泳图
图8为PAT存在的情况下,DNA经过紫外照射和双氧水处理后的电泳图谱。pBR322质粒DNA在琼脂糖凝胶电泳中产生2条谱带(lane 1),移动较快的谱带代表超螺旋环状DNA(scDNA),移动较慢的谱带代表开环 DNA(ocDNA)[24]。DNA经过双氧水处理后,ocDNA谱带增宽,说明双氧水能引起scDNA的开环。DNA经过紫外照射和双氧水处理后(lane 3),scDNA开环,并断裂为线状 DNA(linDNA),在琼脂糖凝胶电泳图谱中ocDNA谱带明显增宽,同时出现新的谱带。这说明双氧水在紫外照射条件下产生的羟自由基使DNA发生链的断裂。Lane 4~Lane 6代表的是不同浓度的PAT对DNA氧化损伤的保护作用。与lane 3相比,在5.0 mg/mL PAT存在的条件下,linDNA谱带已有了明显的减弱,但仍然能在琼脂糖凝胶电泳图谱中观察到,而lane 5、lane 6表明在 10、15 mg/mL PAT存在的条件下,scDNA和ocDNA被很好地保护起来,代表linDNA的谱带随着PAT浓度的增加逐渐消失。在测试浓度下,DNA保护作用表现出了明显的浓度依赖性。
羟自由基和双氧水清除活性测定结果如图9所示。当PAT浓度为5~15 mg/mL时,羟自由基清除活性从(68.46±0.52)%增至(90.32±0.37)%,而双氧水清除活性从(72.19±0.42)%增至(96.82±0.34)%。

图9 PAT对羟自由基和双氧水的清除活性
结果表明苦荞壳中的抗氧化组分具有明显的DNA损伤保护作用,可以作为一种潜在的天然DNA保护剂应用于食品、医药等领域。其作用机理是纯化的活性组分与H2O2紫外处理后产生的羟自由基结合,产生了稳定的物质以终止了自由基的链式反应[25]。
3 结论
本试验对苦荞壳中活性组分的分离纯化、鉴定和DNA损伤保护作用进行研究。结果表明,醇提法得到的粗提物的提取率为6.08%,总黄酮含量为(1.48±0.01)g rutin eq./100 g DW。以DPPH自由基清除活性为指标,采用极性萃取和柱层析法得到纯化的活性组分PAT。通过紫外、HPLC-ESI/MS鉴定,其主要化合物为槲皮素,还包括微量的槲皮素-3-鼠李糖苷和山奈酚。在DNA体外损伤保护试验中,PAT具有显著的DNA损伤保护作用,保护scDNA在双氧水和紫外作用下不发生开环和断裂,且在试验浓度下显示出了明显的浓度依赖性。对其进行定量分析,当浓度为5~15mg/mL时,PAT对羟自由基和双氧水的清除活性分别为(68.46±0.52)%~(90.32±0.37)%和(72.19±0.42)%~(96.82±0.34)%。本研究为PAT作为一种天然抗氧化剂和DNA损伤保护剂应用于食品、医药等领域提供了理论依据。
[1]Guo Xudan,Wang Min,Gao Jinming,etal.Bioguided fraction of antioxidant activity of ethanol extract from tartary buckwheat bran[J].Cereal Chemistry,2012,89(6):311-315
[2]Lin Rufa,Zhou Yunning,Wang Rui,et al.A study on the extract of tartary buckwheat I.Toxicological safety of the extract of tartary buckwheat[J].The Proceeding of the 8thISB,2001,8:602-607
[3]Kuwabara T,Han K,Hashimoto N,etal.Tartary buckwheat sprout powder lowers plasma cholesterol level in rats[J].Journal of Nutritional Science and Vitaminology,2007,53(6):501-507
[4]Wang Min,Liu Jiaren,Gao Jinming,et al.Antioxidant activity of tartary buckwheat bran extract and its effect on the lipid profile of hyperlipidemic rats[J].Journal of Agricultural and Food Chemistry,2009,57(11):5106-5112
[5]Kawa JM,Taylor CG,PrzybylskiR.Buckwheat concentrate reduces serum glucose in streptozotocin-diabetic rats[J].Journal of Agricultural and Food Chemistry,2003,51(25):7287-7291
[6]Fabjan N,Rode J,Košir I J,et al.Tartary Buckwheat(Fagopyrum tataricum Gaertn.)as a source of dietary rutin and quercetin[J].Journal of Agricultural and Food Chemistry,2003,51(22):6452-6455
[7]Zhang Min,Chen Haixia,Li Jinlei,et al.Antioxidant properties of tartary buckwheat wheat extracts as affected by different thermal processing methods[J].Food Science and Technology,2010,43(1):181-185
[8]Li Dan,Li Xiaolei,Ding Xiaolin.Composition and antioxidative Properties of the flavonoid rich fractions from tartary buckwheat grains[J].Food Science and Biotechnology,2010,19(3):711-716
[9]Robak J,Gryglewski R J.Bioactivity of flavonoids[J].Polish Journal of Pharmacology,1996,48(6):555-564
[10]Tepe B,Degerli S,Arslan S,etal.Determination of chemical profile,antioxidant,DNA damage protection and anti-amoebic activities ofTeucrium polium and Stachys iberica[J].Fitoterapia,2011,82(2):237-246
[11]Zhao Chenyang,Dodin G,Yuan Chenshan,et al.“In vitro”protection of DNA from Fenton reaction by plant polyphenol verbascoside[J].Biochimica et Biophysica Acta,2005,1723:114-123
[12]Russo A,Acquaviva R,Campisi A,et al.Bioflavonoids as antiradicals,antioxidants and DNA cleavage protectors[J].Cell Biology and Toxicology,2000,16(2):91-98
[13]Rice-Evans C A,Miller N J.Antioxidant activities of flavonoids as bioactive components of food[J].Biochemical Society Transactions,1996,24(3):790-795
[14]Liu Benguo,Zhu Yongyi.Extraction of flavonoids from flavonoid-rich parts in tartary buckwheat and identification of the main flavonoids[J].Journal of Food Engineering,2007,78(2):584-587
[15]Liu Rongrong,Xu Shaohua,Li Jialin,et al.Expression profile of a PAL gene from Astragalus membranaceus var.mongholicus and its crucial role in flux into flavonoid biosynthesis[J].Plant Cell Reports,2006,25(7):705-710
[16]Mensor L L,Menezes F S,Leitão G G,et al.Screening of brazilian plant extracts for antioxidant activity by the use of DPPH free radical method[J].Phytotherapy Research,2001,15(2):127-130
[17]Xi Zhongxin,Chen Wansheng,Wu Zhijun,et al.Anticomplementary activity of flavonoids from Gnaphalium affine D.Don[J].Food Chemistry,2012,130(1):165-170
[18]徐宝才,肖刚,丁宵霖,等.液质联用分析测定苦荞黄酮[J].食品科学,2003,24(6):113-117
[19]杨宏志,李静.亚麻木酚素的抗氧化性能[J].食品科学,2011,32(3):27-29
[20]Ducrey B,Wolfender J L,Marston A,et al.Analysis of flavonol glycosides of thirteen Epilobium species(onagraceae)by LC-UV and thermospray LC-MS[J].Phytochemistry,1995,38(1):129-137
[21]MullenW,Yokota T,Lean M E J,etal.Analysis ofellagitannins and conjugates of ellagic acid and quercetin in raspberry fruits by LC-MS[J].Phytochemistry,2003,64(2):617-624
[22]Ryan D,Robards K,Lavee S.Determination of phenolic compounds in olives by reversed-phase chromatography and mass spectrometry[J].Journal of Chromatography A,1999,832:87-96
[23]Papp I,Apati P,Andrasek V,et al.LC-MS analysis of antioxidant plant phenoloids[J].Chromatographia,2004,60:93-100
[24]柳艳,李磊,刘王莹,等.丹酚酸抗氧化活性及其对DNA损伤保护作用[J].中国公共卫生,2007,23(4):448-449
[25]张艳淑,阎立成,姚林.茶多酚对DNA损伤保护作用的机制[J].华北煤炭医学院学报,2005,7(3):320-321.
Research on DNA Damage Protection and Identification of Active Components from Tartary Buckwheat Hulls
Yang Xu LüYuanping
(Department of Food Engineering,Sichuan University,Chengdu 610065)
Tartary buckwheat is an important food source.In order to utilize tartary buckwheat effectively,we used amethod for isolating and purifying antioxidantswith strongestactivity by a guided strategy with DPPH free radical.The purified active component of Tartary buckwheat hullswas obtained by polar-solvent extraction and column chromatography and was identified by ultraviolet-visible spectrometry(UV)and high-performance liquid chromatography with electrospray ionisationmass spectrometry(HPLC-ESI/MS).The results indicated that themain componentwas quercetin,includingmicro quercetin-3-rhamnoside and kaempferol.Agarose gel electrophoresis revealed the potential of the purified active component of Tartary buckwheat hulls as an in vitro protectant against DNA damage,and its does-dependent damage protection was observed at all tested concentrations.At5~15mg/mL,hydroxyl radical inhibition was(68.46±0.52)%to(90.32±0.37)%and the H2O2scavenging activity was(72.19±0.42)%to(96.82±0.34)%in quantitative research.Therefore,ourwork aboutantioxidantand DNA damage protection of Tartary buckwheat hulls provides a theoretical basis for application of tartary buckwheat hulls in food and medicine field.
tartary buckwheat,DPPH radical,HPLC-ESI/MS,antioxidant,DNA damage
TS201.2
A
1003-0174(2015)08-0042-06
2014-03-12
杨旭,女,1989年出生,硕士,食品科学与工程
吕远平,女,1971年出生,副教授,博士,食品科学与工程
