改性大豆分离蛋白与肌原纤维蛋白共混体系乳化性及凝胶性研究
2015-12-20王中江李秋慧江连洲
梁 婧 王中江 李 丹 李 杨 李秋慧 江连洲
(东北农业大学食品学院,哈尔滨 150030)
改性大豆分离蛋白与肌原纤维蛋白共混体系乳化性及凝胶性研究
梁 婧 王中江 李 丹 李 杨 李秋慧 江连洲
(东北农业大学食品学院,哈尔滨 150030)
采用热改性、碱改性、超声改性及辐照改性4种方法将大豆分离蛋白进行改性处理,并建立改性大豆分离蛋白与肌原纤维蛋白共混体系,对其乳化性及凝胶性进行研究。结果表明经热改性的大豆分离蛋白与肌原纤维蛋白共混体系的乳化性及凝胶性有显著提高,其中乳化活性提高了12.6 m2/g,硬度和弹性分别增加了18.58 g和0.16 mm,持水性增加了22.14%。经碱改性的SPI对混合体系的乳化性和凝胶性影响次之,而经超声和辐照改性的大豆分离蛋白,只对共混体系的持水性和乳化稳定性有影响,对质构性和乳化活性影响不显著。
肌原纤维蛋白 改性大豆分离蛋白 亚基解离 乳化性 凝胶性
大豆分离蛋白(SPI)是一种优质的植物性蛋白,其胆固醇含量低,营养价值高,备受消费者的青睐。近几年来,随着大豆蛋白经济价值与功能特性研究的不断深入,以及消费者对肉制品健康需求的增加,大豆分离蛋白已广泛应用于肉制品(午餐肉、乳化香肠、火腿肠等)中。蛋白受热聚集形成凝胶是肠类制品必要的加工过程。肌原纤维蛋白(MP)是热加工肉制品中形成凝胶最主要的成分[1],其占肉蛋白的50%~55%。大豆蛋白能直接与肉蛋白作用,占据凝胶基质或凝胶的细胞间隙[2]。大豆分离蛋白与肌原纤维蛋白的交互作用能改变肉蛋白的结构,引起肉制品功能特性的改变。
然而,有研究表明低变性大豆分离蛋白由于其变性温度比低温肉制品常规加热温度低,不利于SPI与肌肉蛋白之间的交互作用,并且难以发挥SPI对肌肉蛋白凝胶性能的辅助与提高的积极作用[3-4]。还有一些研究表明大豆蛋白能改善肌原纤维蛋白的凝胶性,取决于大豆蛋白的特性[5]。因此,为促进肌原纤维蛋白与大豆分离蛋白的交互作用,本试验将大豆分离蛋白进行改性(热改性、碱改性,机械处理、辐照处理),以制备改性大豆分离蛋白与肌原纤维蛋白共混体系,比较研究混合蛋白的功能性及其凝胶性,进一步提高大豆分离蛋白在肉制品工业中的应用潜能,实现大豆分离蛋白功能性的综合应用。
1 材料与方法
1.1 材料与试剂
新鲜猪里脊肉:市售;商业 SPI:黑龙江省哈尔滨高科技(集团)股份有限公司;葵花籽油:山东鲁花集团有限公司;氯化钠、磷酸氢二钠、磷酸二氢钠、氯化镁、EGTA等:均为分析纯,哈尔滨市四叶草生物药品公司。
1.2 仪器与设备
高速匀浆机:Ultra Turrax T25 BASIS;台式低速离心机:LDZ5-2型,上海安亭科学仪器厂;超声细胞破碎仪:JY92-ⅡN,北京泰亚赛福科技发展有限责任公司;微波炉:格兰仕 G80W23ESL-V9;pHS-25型酸度计:上海伟业仪器厂。
1.3 试验方法
1.3.1 肌原纤维蛋白的提取
根据Xiong等[6]的方法,猪里脊肉切碎称重,4倍体积的分离缓冲液(0.1 mol/LNaCl,10mmol/L磷酸盐缓冲液,2 mmol/L MgCl2,1 mmol/L EGTA,pH 7.0),在组织捣碎机中充分斩拌混匀;500mL离心管3 500 g,4℃条件下离心15 min,得到肌原纤维沉淀,用相同的缓冲液重复2遍,然后用 0.1 mol/L NaCl溶液再重复2遍,即得到肌原纤维蛋白分离物,4℃保存,48 h内使用。
1.3.2 大豆分离蛋白的改性
热改性:天然大豆分离蛋白[SPI(N)]用10倍体积的水复溶,pH调节到7,95℃加热30 min,冷冻干燥,得到热改性大豆分离蛋白[SPI(95℃)]。
碱改性:天然大豆分离蛋白用10倍体积的水复溶,pH调节到10,搅拌60 min,冷冻干燥,得到碱改性大豆分离蛋白[SPI(pH10)]。
超声改性:天然大豆分离蛋白用10倍体积的水复溶,pH调节到7,超声处理(400 W,20 min),冷冻干燥,得到超声改性大豆分离蛋白[SPI(U)]。
辐照改性:天然大豆分离蛋白,经辐照处理(8剂量),得到辐照改性大豆分离蛋白[SPI(I)]。
1.3.3 共混体系及其凝胶制备
MP∶SPI=4∶1,溶解在 0.6 mol/L NaCl,50 mmol/L磷酸盐缓冲溶液中,总蛋白浓度为40 mg/mL,磁力搅拌30 min,即得共混体系。共混体系于80℃水浴加热30 min制备凝胶,4℃隔夜。
1.3.4 质构性测定
使用质构仪测定混合蛋白凝胶的硬度及弹性。设定主要参数:探头类型为P/0.5,测前速度为1.0 mm/s,测定速度为 0.5 mm/s,测后速度为 1.0 mm/s,测定距离为5.0 mm,触发力为5 g,触发类型为自动,数据获得速度为200 pps。
1.3.5 流变性测定
利用流变仪,对混合蛋白样品进行温度扫描。主要参数为:平板夹具直径40 mm,最大应变力为0.01,单频频率为0.1 Hz,狭缝为1 mm,以1℃ /min的速率从20℃升至80℃,每个温度点的平衡时间为20 s。滴加几滴硅油并盖好保护盖,防止水分蒸发。测量升温过程中G′随温度变化。
1.3.6 持水性(WHC)测定
制备的混合蛋白凝胶在4℃冰箱中过夜后,将凝胶块转移至50 mL的离心管中,在3 500 r/min 4℃条件下离心30 min。倒掉离出的水,将离心管倒置于铺有吸水毛巾的桌面上,15 min后称重。
WHC=离心后凝胶净重/离心前凝胶净重×100%
1.3.7 乳化性测定
用pH值7.0,0.1mol/L的磷酸盐缓冲溶液配制100 mL质量浓度0.1 g/mL的混合蛋白悬浮液,取30 mL蛋白液于高速匀浆机中,加入10 mL葵花籽油,20 000 r/min均质以形成乳浊液,均质后,分别在0 min与10 min时从底部吸取100μL分散于10 mL质量浓度0.1 g/mL的SDS溶液中,于波长500 nm处测定吸光度(测定3次取平均值),乳化性的计算公式为:
乳化活性(EAI)=A0×100%
乳化稳定性(ESI)=(A10/A0)×100%
式中:A0为0 min的吸光值;A10为10 min的吸光值。
1.3.8 扫描电镜
混合蛋白凝胶样品用2.5%的戊二醛固定2 h,乙醇梯度脱水,冷冻干燥,喷10 nm的金。通过扫描电镜进行观察,加速电压为10 kV,每个样品观察8个区域[7]。
2 结果与分析
2.1 改性SPI与MP共混体系乳化性
经不同方式改性的SPI与MP混合体系的乳化性结果见图1。由图1可知改性的SPI与MP共混体系的乳化活性及乳化稳定性较未改性样品[MP-SPI(N)]都有升高趋势,且经热改性(95℃,30 min)和碱改性(pH 10)的SPI与肌原纤维蛋白共混体系的乳化活性和乳化稳定性比其他样品都有明显提高,其中样品MP-SPI(95℃)和 MP-SPI(pH10)的乳化活性分别增加 12.6 m2/g和 11.7 m2/g。
SPI经加热能够使蛋白分子从天然的卷曲状态解折叠,7S和11S的亚基解离,并形成一定量的可溶性聚集体,增强蛋白质-水的相互作用;加热还能使SPI卷曲结构内部的一些疏水基团暴露[8],有效改善蛋白质-蛋白质的相互作用,导致乳化活性的提高。SPI经碱处理(pH 10)能够破坏蛋白分子的聚集体内静电作用,促进蛋白微粒进一步解离,另外蛋白微粒的极性吸湿点增多,导致与水结合能力增强;此外,pH处理能够使SPI更容易解聚和解离,增强蛋白质的溶解性[9],使SPI能够与肌原纤维蛋白更加充分的混合,增加乳化活性。样品MP-SPI(U)和MP-SPI(I)的乳化活性分别为 8.5 m2/g和 8.2 m2/g,与 MP-SPI(N)相比,经超声和辐照改性的SPI对共混体系的乳化活性影响不显著。这可能是因为经超声和辐照处理的SPI不能有效改善共混体系中蛋白之-水的相互作用。但经改性的SPI与肌原纤维蛋白共混体系的乳化稳定性都有明显改善,这可能是因为改性的SPI能够降低MP-SPI共混体系中水-油、水-空气的界面张力,并使共混体系的自由能降低,从而形成更加稳定的乳化状态。

图1 MP-SPI共混体系乳化性。
2.2 改性SPI与MP共混体系流变性
改性SPI与MP共混体系热凝胶过程中,储能模量(G′)在20~80℃间的变化如图2所示。所有样品的G′都在大约40℃左右开始升高,表明在凝胶形成初期,形成了有弹性的蛋白网状结构,并在大约45℃时达到最大值。进一步加热,G′值显著降低并达到最小值,这是因为肌球蛋白轻链变性导致流动性增加[10-11]。G′在55℃左右第2次增加,这是由于形成了永不可逆的稳定的三维网状结构,这种结构与二硫键和疏水作用密切相关。
热处理及碱处理能够使SPI的氨基酸侧链展开,疏水氨基酸暴露,在凝胶形成过程中,疏水交互作用增强,改善SPI与MP之间的作用,形成了富有弹性更加强大的凝胶结构。而经超声及辐照处理的SPI,只是破坏了蛋白质的三、四级结构,改善SPI的溶解性[12],使其能与肌原纤维蛋白作用更加充分,导致G′值增加,但其形成的凝胶没有样品 MP-SPI(95℃)和MP-SPI(pH 10)形成的凝胶稳固。

图2 MP-SPI共混体系凝胶化过程中储能模量的变化
2.3 改性SPI与MP共混体系质构性
硬度和弹性是衡量凝胶样品质构特性的重要指标。硬度是指样品被压缩所需的最大力;弹性是指样品第一次被压缩后恢复的距离。经不同方式改性的SPI与MP共混体系的硬度及弹性如图3所示。SPI经改性能够改善SPI-MP共混体系的硬度和弹性,其中经热处理和碱处理的SPI对硬度及弹性提高显著,分别提高 18.58 g,0.16 mm及 14.64 g,0.13 mm。这与二硫键及疏水氨基酸含量密切相关。蛋白质疏水氨基酸含量高,易形成更加稳定的网络结构;大量的巯基和二硫键的存在,能够使分子间的网络得到加强[13]。SPI经热处理和碱处理不但能够促进疏水基团暴露,而且能使内部的巯基暴露,促进二硫键的形成及交换。大量的疏水性氨基酸及二硫键的存在,有利于大豆蛋白与肉蛋白之间的交互作用,形成稳固的凝胶。95℃加热及pH 10处理还能够使11S亚基解离,肌球蛋白能够与解离的碱性亚基通过疏水相互作用聚集,改善硬度和弹性。而超声和辐照只能通过空化和极化作用改变大豆蛋白的高级结构,使产生小分子亚基,对MP-SPI共混体系的硬度及弹性影响不大。
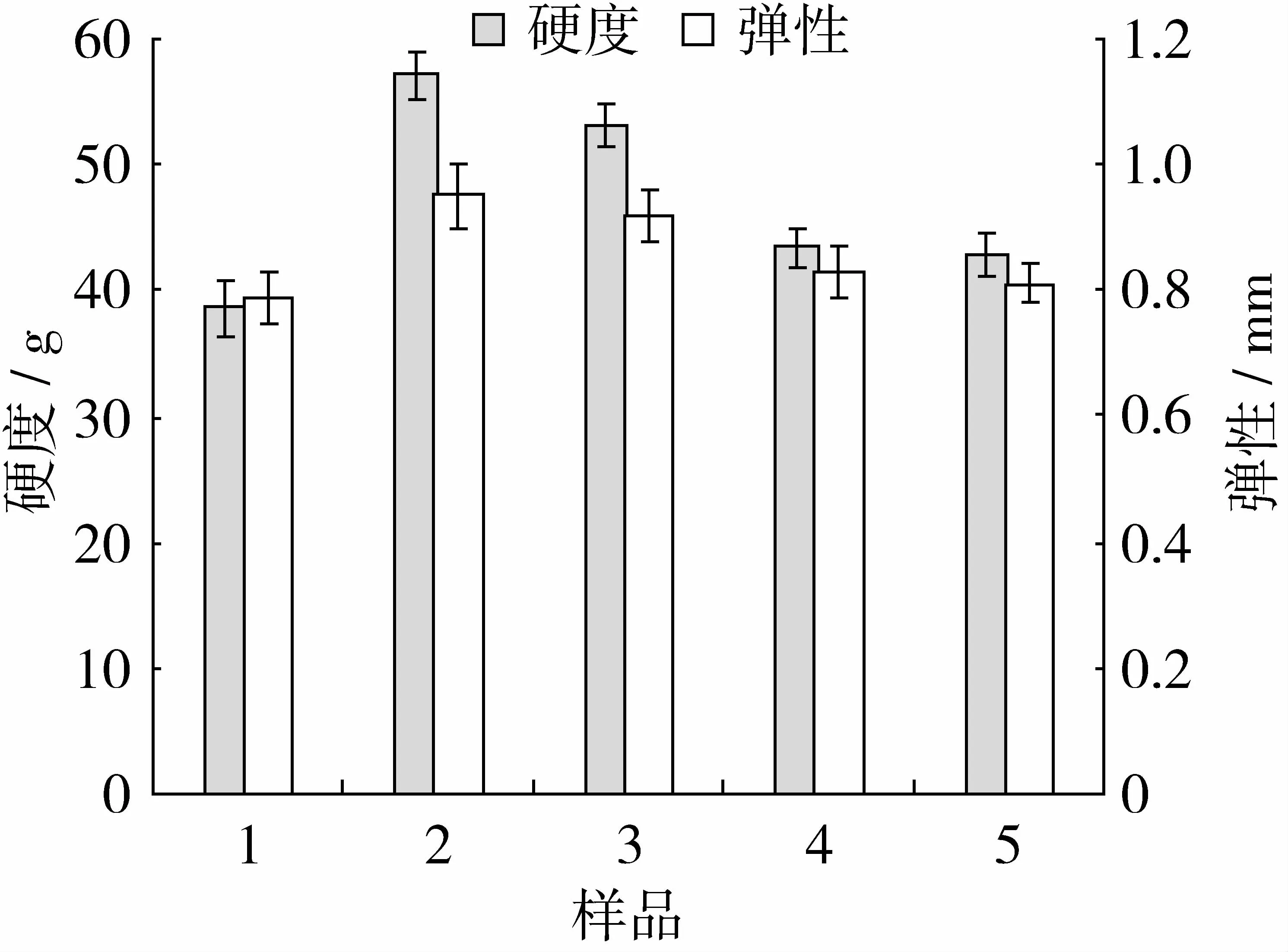
图3 MP-SPI共混体系硬度及弹性
2.4 改性SPI与MP共混体系持水性
持水性能够影响肉制品的多汁性、嫩度、香、味等感官品质。MP-SPI共混体系持水性结果如图4所示,结果表明改性SPI对共混体系的持水性有显著影响。肌肉保存水的能力,主要依靠蛋白质分子所带的静电负荷以及氢键的作用[14-15]。大豆蛋白分子以不同方式进行改性,能够以不同程度破坏分子内部的氢键,在与肌原纤维蛋白混合加热形成凝胶过程中使得蛋白质-蛋白质及蛋白质-水的作用加强,凝胶样品4℃保存过程中能够促进新的氢键的形成,提高保水性。SPI在95℃加热还能够使11S的酸性亚基和碱性亚基解离,增加蛋白质的静电负荷,使MP-SPI(95℃)复合体系保水性提高最大;而SPI在pH 10的溶液中通过改变氨基酸侧链电荷的分布,提高MP-SPI(pH 10)的保水性。
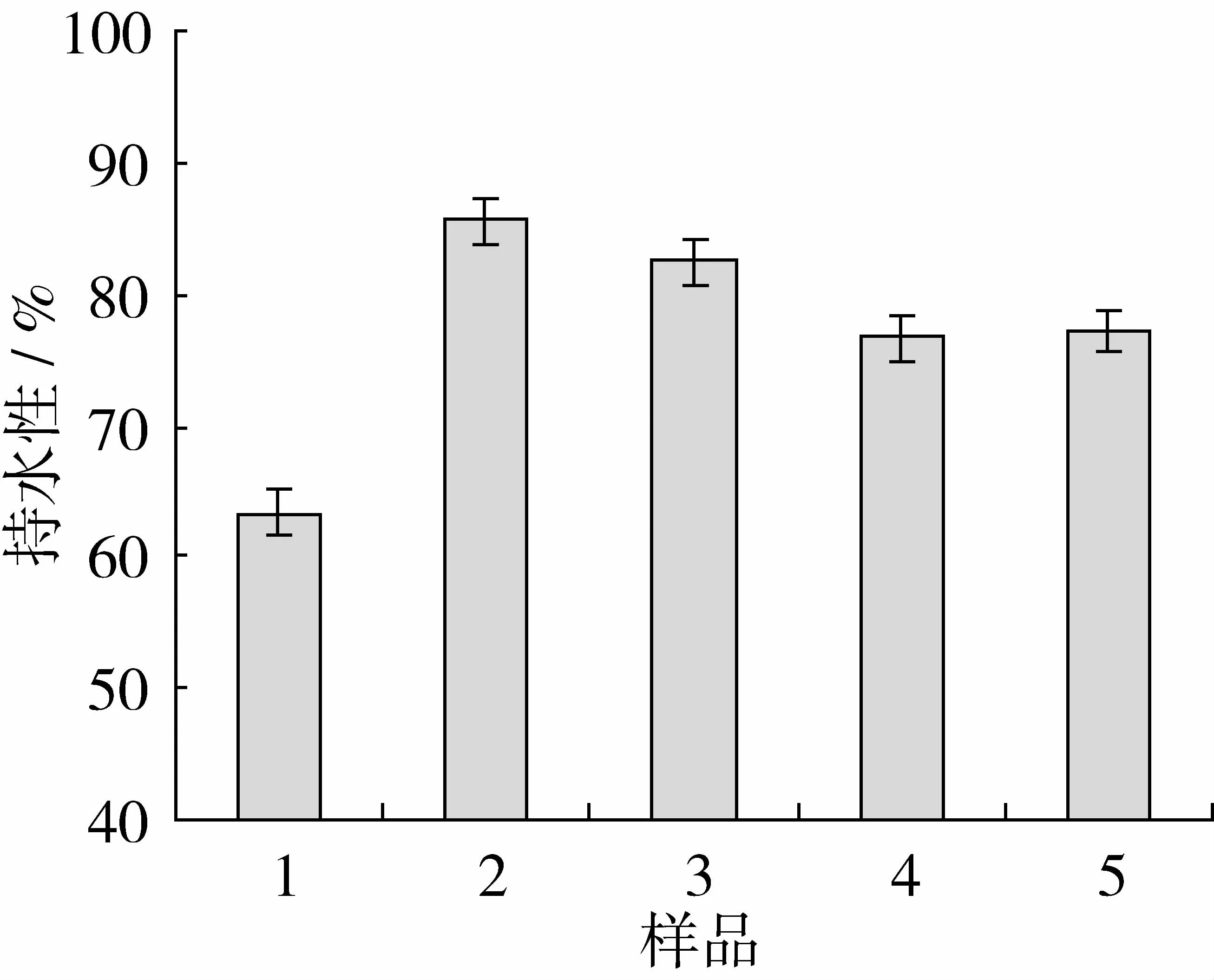
图4 MP-SPI共混体系持水性
2.5 改性SPI与MP混合凝胶微观结构观察
凝胶的微观结构与蛋白质的凝胶特性密切相关。混合蛋白凝胶的微观结构如图5所示,通过对MP-SPI混合蛋白凝胶电镜图观察发现,MP-SPI(N)的蛋白质排列杂乱,凝胶表面有不规则空洞形成,并且网络结构粗糙,有明显的断层感;MP-SPI(95℃)结构比较规则,无明显空洞,网络结构致密均匀,网格细小;MP-SPI(pH10)结构均匀,无明显的断层感,蛋白质交联程度大;而 MP-SPI(U)和MP-SPI(I)凝胶与 MP-SPI(N)相比结构均匀程度增大,蛋白质间形成交联。

图5 MP-SPI凝胶微观结构
3 结论
SPI经加热和碱处理能够使疏水性氨基酸暴露,蛋白质亚基解离,增加其与MP的作用,提高混合体系的乳化性、质构性及持水性。经4种改性的SPI制成的MP-SPI混合体系中,经热改性的SPI对混合体系的乳化性和凝胶性影响最大,其中MP-SPI(95℃)的乳化活性提高了12.6 m2/g,硬度和弹性分别增加了18.58 g和0.16 mm,持水性增加了22.14%。经碱改性的SPI对混合体系的乳化性和凝胶性影响次之,乳化活性提高了11.7 m2/g,硬度和弹性分别提高了14.64 g,0.13mm。而超声和辐照机械改性,是通过空化和极化作用影响SPI的高级结构,且对共混体系的持水性和乳化稳定性有影响,对质构性和乳化活性影响不显著。综上所述,可知经热改性的SPI对MP-SPI共混体系乳化性及凝胶性影响最显著。
[1]Doerscher D R,Briggs J L,Lonergan SM.Effects of pork collagen on thermal and viscoelastic properties of purified porcinemyofibrillar protein gels[J].Meat Science,2004,66(1):181-188
[2]Pietrasik Z,Jarmoluk A,Shand P J.Effect of non-meat proteins on hydration and textural properties of porkmeatgels enhanced with microbial transglutaminase[J].LWT-Food Science and Technology,2007,40(5):915-920
[3]Feng J,Xiong Y L.Interaction ofmyofibrillar and preheated soy proteins[J].Journal of Food Science,2002,67(8):2851-2856
[4]简华君.大豆分离蛋白对肌原纤维蛋白凝胶性质的影响[D].无锡:江南大学,2009
[5]Herrero AM,Carmona P,Cofrades S,etal.Raman spectroscopic determination of structural changes inmeat batters upon soy protein addition and heat treatment[J].Food Research International,2008,41(7):765-772
[6]Xiong Y L,Brekke C J.Gelation properties of chickenmyofibrils treated with calcium and magnesiumchlorides[J].Journal of Muscle Foods,1991,2(1):21-36
[7]Jiang J,Xiong Y L.Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat Science,2013,93(3):469-476
[8]张春岭,潘思轶.化学改性对大豆分离蛋白表面疏水性的影响[J].中国粮油学报,2009,24(6):26-30.
[9]华欲飞,黄友如,孙华.醇变性大豆蛋白在物理改性条件下的溶出行为和机理[J].食品与发酵工业,2004,30(8):125-128.
[10]Brenner T,Johannsson R,Nicolai T.Characterisation and thermo-reversible gelation of cod muscle protein isolates[J].Food Chemistry,2009,115(1):26-31
[11]Choi Y M,Kim B C.Muscle fiber characteristics,myofibrillar protein isoforms,and meat quality[J].Livestock Science,2009,122(2):105-118
[12]孙燕婷,黄国清,肖军霞,等.超声处理对大豆分离蛋白溶解性和乳化活性的影响[J].中国粮油学报,2012,26(7):22-26
[13]王苑.不同处理方式对肌原纤维蛋白和大豆分离蛋白混合凝胶特性的影响[D].南京:南京农业大学,2007
[14]彭增起.肌肉盐溶蛋白质溶解性和凝胶特性研究[J].南京:南京农业大学,2005
[15]Cheftel JC,Culioli J.Effects of high pressure on meat:a review[J].Meat Science,1997,46(3):211-236.
The Emulsibility and Gel Properties of the Mixed System Between Modified Soy Protein Isolates and Myofibrillar Protein
Liang Jing1Wang Zhongjiang1Li Dan1Li Yang1Li Qiuhui1Jiang Lianzhou1
(Department of Food Science,Northeast Agricultural University1,Haerbin 150030)
Soy protein isolates have been modified by preheating,alkaline-treatment,ultrasound and irradiation in the paper.A mixed system between modified soy protein isolates and myofibrillar protein were made to research the emulsibility and gel properties.The results indicated that the emulsibility and gel propertieswere enhanced significantly in themixed system of soy protein isolates produced by the thermalmedication and myofibrillar protein,in which the emulsion ability,hardness springiness and water-holding capacity increased respectively by 12.6 m2/g,18.58 g,0.16 mm and 22.14%respectively Soy protein isolates by alkaline-treatment had secondary effects on emulsibility aswell as gel properties of themixed system.Modified soy protein isolates by ultrasound and irradiation have effect on water holding capacity and emulsifying stability,but without significant effect on texture property and emulsifying activity.
myofibrillar protein,modified soy protein isolates,subunits dissociation,emulsibility,gel properties
TS214.2
A
1003-0174(2015)08-0037-05
2014-03-18
梁婧,女,1988年出生,硕士,粮食、油脂与植物蛋白工程
江连洲,男,1960年出生,教授,粮食、油脂与植物蛋白工程
