樟叶越桔糖基转移酶VdUGT1基因克隆及序列分析
2015-12-20朱东阳刘小烛
宋 健,熊 宏,朱东阳,赵 平,杜 维,刘小烛,丁 勇
(1. 西南林业大学生命科学学院,云南 昆明 650224;2. 西南林业大学 西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224)
樟叶越桔糖基转移酶VdUGT1基因克隆及序列分析
宋 健1,熊 宏1,朱东阳2,赵 平2,杜 维1,刘小烛1,丁 勇1
(1. 西南林业大学生命科学学院,云南 昆明 650224;2. 西南林业大学 西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224)
根据樟叶越桔Vaccinium dunalianum叶芽转录组测序实验获得的糖基转移酶VdUGT1基因部分cDNA序列设计引物,采用RACE-PCR技术克隆了全长1 620 bp cDNA序列的VdUGT1基因,包括1 398 bp cDNA序列的完整开放阅读框,推测编码由465个氨基酸残基组成、相对分子质量为50.89 kD的糖基转移酶VdUGT1。序列分析表明,VdUGT1理论等电点为5.53,负电荷残基(Asp+Glu)总数为53个,正电荷残基(Arg+Lys)总数为41个,不稳定系数为48.38,属于不稳定蛋白;其二级结构的主要构件为α-螺旋和随机卷曲,无跨膜结构域,属于亲水性蛋白质。VdUGT1位于C末端含有尿嘧啶核苷二磷酸糖基转移酶所特有UDPGT功能域,推测与尿嘧啶核苷二磷酸糖的结合有关。该研究为后期VdUGT1的异源表达和功能研究奠定了基础。
樟叶越桔;尿嘧啶核苷二磷酸糖基转移酶;RACE;基因克隆;序列分析
糖基转移酶(glycosyltransferases,GTs;EC 2.4.x.y)是所有生物有机体中存在的专门负责催化糖基化反应的酶,它能将活性糖基从供体分子转移到受体分子上[1]。植物中常见的糖基供体是尿嘧啶核苷二磷酸(Uridine diphosphate,UDP)糖(葡萄糖、半乳糖、木糖和鼠李糖等)[2-5],因此GTs也被称为尿嘧啶核苷二磷酸糖基转移酶(UDP-glycosyltransferases,UGTs)。糖基化受体包括次级代谢产物、激素、病原菌侵染物、以及内外源毒性物质等植物小分子化合物[4-5]。糖基化是植物小分子化合物较普遍的一种修饰反应,可以改变受体分子的化学稳定性、亲水性、转运性、亚细胞定位,有助于其在细胞内和生物体内的运输和贮藏[6]。UGTs具有多种生物活性与功能,可催化多种底物,其在植物生长发育、代谢调节、解除内外源毒素毒性、以及次生代谢产物合成与贮存等方面发挥重要功能[7]。
樟叶越桔Vaccinium dunalianum为杜鹃花科Ericaceae越桔属Vaccinium植物。Zhao[8]等发现云南省野生樟叶越桔是一种富含熊果苷(arbutin,对-羟基苯-β-D-吡喃葡萄糖苷)及其衍生物的特殊资源植物。天然熊果苷是植物体内的对苯二酚和UDP葡萄糖在UGTs成员之一熊果苷合成酶(arbutin synthase)(EC2.4.1.-)的催化下生物合成而来。推测樟叶越桔中存在高活性表达的糖基转移酶VdUGT家族,并提示酶基因及其表达产物在该植物生长发育中具有某种重要的、不可或缺的生物学功能。
UGTs在拟南芥Arabidopsis thaliana[6]、蛇根木Rauwolf i a serpentina[9]、小立碗藓Physcomitrella patens和 江 南 卷 柏Selaginella moellendorff i i[10]、山葡萄Vitis amurensis[11]、水稻Oryza sativassp.Japonica[12]、以及鹰嘴豆Cicer arietinum[13]等物种中都有一定的研究,所对应的基因均已被克隆并测序。但目前尚无樟叶越桔糖基转移酶及其基因的相关报道。本研究根据前期樟叶越桔叶芽转录组测序实验得到的VdUGT1基因部分cDNA序列设计引物,结合RACE-PCR技术克隆了VdUGT1基因全长cDNA序列,并对VdUGT1蛋白特性进行了分析。
1 试验材料与方法
1.1 试验材料与试剂
供试樟叶越桔Vaccinium dunalianumWight叶芽材料采自云南省楚雄彝族自治州武定县高桥镇唐家村(海拔2 100 m,北纬25°57′、东经102°24′)。取樟叶越桔新鲜叶芽置于液氮中速冻,带回实验室后保存于–80℃冰箱中备用。
植物总RNA提取试剂盒购自Omega公司,RACE-PCR试剂盒购自Clontech公司,逆转录试剂和pMD18-T载体购自宝生物工程有限公司,胶回收试剂盒购自天根生化科技有限公司,其他相关试剂购自昆明滇工科技有限公司,大肠杆菌DH5α为本实验室保存菌种。
1.2 试验方法
1.2.1 总RNA提取与检测
参照朱东阳等[14]方法提取樟叶越桔叶芽总RNA,分别用紫外分光光度计法和1.2%琼脂糖凝胶电泳法检测总RNA样品的纯度和完整性。
1.2.2 樟叶越桔VdUGT1基因全长cDNA克隆
根据本课题组前期樟叶越桔叶芽转录组测序获得的VdUGT1基因部分cDNA序列设计RACE引物,引物合成由上海生物工程有限公司完成。3′-RACE引物包括反转录引物Adaptor-Oligo(dT)17:5′-CCAGTGAGCAGAGTGACGAGGACTCGA GCTCAAGC(dT)17-3′,接头外侧和内侧引物分别为 AP-Outer:5′-CCAGTGAGCAGAGTGACG-3′和 AP-Inner:5′-GAGGACTCGAGCTCAAGC-3′,特异性外侧和内侧引物分别为3′-GS-Outer:5′-GCCCTTCTACCAAGTCCAG-3′和 3′-GSInner:5′-CACCCTCACCGTAAATCGC-3′,第一链cDNA合成按照RNA反转录试剂盒说明书进行操作。二轮PCR反应程序为:94℃预变性3 min;94℃变性30 s,53℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。
根据VdUGT1基因已知EST和3′RACEPCR克 隆 的3′末 端cDNA序 列, 设 计5′-RACE 特 异 性 巢 式 引 物 5′-GS-Outer:5′-CAAGAACCCGCCCGTACCCGT-3′和 5′-GSInner:5′-GAGGGTAGTTTGGGTATTGGACGG-3′,按照RACE试剂盒说明书进行操作。第一轮Touchdown-PCR反应程序为:94℃预变性3 min,94℃变性30 s,78℃退火30 s,72℃延伸 2 min,8个循环,每个循环退火温度降低1℃;94℃变性30 s,70℃退火30 s,72℃延伸2 min,30个循环。第二轮PCR反应程序为:94℃预变性3 min;94℃变性30 s,70℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。
1.2.3 PCR产物检测、回收、T/A克隆与测序
PCR产物在1.2%的琼脂糖凝胶上电泳检测,回收目的片段并连接到pMD18-T载体上,将重组子转化大肠杆菌DH5α感受态细胞,随机筛选白色菌落,由上海生工生物工程技术服务有限公司完成阳性克隆测序。
1.2.4 VdUGT1的生物信息学分析
采用NCBI提供的ORF fi nder程序分析基因开放阅读框;DNAMAN构建ORF核苷酸序列并推导其氨基酸序列;利用ExPASy ProtParam程序分析氨基酸的残基数目与组成、相对分子质量、理论等电点和稳定性;利用NCBI Blast程序对推导的蛋白质进行相似性比较,Clustalx2和Jalview软件对同源性高的序列进行多序列比对,MEGA4.1分子进化遗传分析软件通过邻位相连法(Neighbor-joining)构建系统发生树,系统树每个统计学显著性分析以自展法(Boot-strp)进行检验,重复1 000次[15];使用 Siganal V4.0 (http://www.cbs. dtu.dk/services/SignalP-2.0/)分析蛋白信号肽;使 用 TMHMM(http://www.cbs. dtu.dk/services/TMHMM) 和 Proscale(http://www.expasy.org/cgibin/protscale.pl)分别检测其跨膜结构和亲水/疏水性特性;利用SOPMA程序(http://npsapbil.ibcp.fr/cgi-bin/npsa_automat.pl? page=/NPSA/ npsa_sopma.html)预测蛋白质序列的二级结构;使用NCBI提供 的 Conserved Domain Search (CD-Search) 服务 器(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白功能域分析。
2 结果与分析
2.1 樟叶越桔VdUGT1基因cDNA全长克隆
本实验获得的樟叶越桔叶芽总RNA的28S和18S rRNA条带清晰完整,亮度比约为2∶1,无弥散拖尾且点样孔无污染,总RNA的A260/A280值处于1.8~2.0之间。以提取的总RNA反转录合成的第一链cDNA为模板进行RACE-PCR扩增,得到樟叶越桔VdUGT1基因3′末端cDNA和5′末端cDNA(图1),经回收主条带、TA克隆测序长度分别为1 315 bp和242 bp,最终拼接得到樟叶越桔VdUGT1基因全长cDNA序列为1 620 bp。
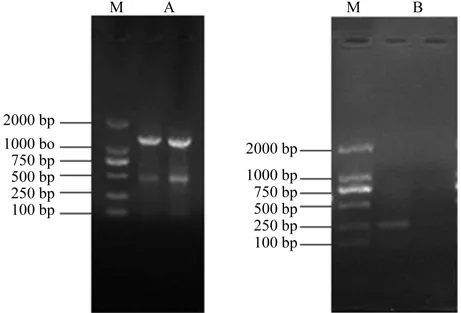
图1 樟叶越桔VdUGT1基因3’RACE(A)和5’ RACE(B)PCR产物琼脂糖凝胶电泳图Fig.1 Agrose gel electrophoresis analysis of VdUGT1 3’RACE (A) and 5’ RACE (B) PCR products
2.2 序列分析
克隆的樟叶越桔VdUGT1基因mRNA序列长 1 620 bp,包括 57 bp 5′UTR、1 398 bp ORF 和165 bp 3′UTR,推测编码由465个氨基酸组成的VdUGT1蛋白。VdUGT1基因ORF序列及其推导的蛋白序列如图2所示。蛋白质理化性质分析结果显示VdUGT1蛋白相对分子质量为50.89 kD,氨基酸总数为465个,理论等电点为5.53,负电荷残基(Asp+Glu)总数为53个,正电荷残基(Arg+Lys)总数为41个,不稳定系数为48.38,推测VdUGT1属于不稳定蛋白质。

图2 VdUGT1 ORF核苷酸序列及其推导的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of VdUGT1 ORF
同源性分析结果显示VdUGT1与枸杞Lycium barbarum(LbUGT,AB360632.1)、 蛇 根 木R.Serpentine(RsUGT,AJ310148.1)、番茄Solanum lycopersicum(SlUGT,XM_004231159.1)等的糖基转移酶之间具有48%~64%的序列同源性,其中与枸杞LbUGT和蛇根木RsUGT同源性分别高达64%和63%。类似于其他物种的糖基转移酶,樟叶越桔VdUGT1位于C末端含有尿嘧啶核苷二磷酸糖基转移酶所特有UDPGT功能结构域PSPG box(图3)。对图3中显示的不同物种的GTs进行系统发生分析,结果显示樟叶越桔VdUGT1与 罗 汉 果SgUGT2(HQ259621.1) 和SgUGT3(HQ259622.1)聚为一分支(图4)。
信号肽是分泌性蛋白N端的一段氨基酸序列,是指导分泌性蛋白合成的最重要因素,一般有16~26个氨基酸残基,在完成自己的功能后被切除[16]。VdUGT1蛋白信号肽分析结果显示,最大C值(原始剪切位点的分值)为0.144,位于第51个氨基酸残基;最大Y值(综合剪切位点的分值)为0.058,位于第46个氨基酸残基;最大S值(信号肽的分值)为0.217,位于第10个氨基酸残基;平均S值为0.102,位于第1~45位氨基酸残基之间;综合计算信号肽存在的可能性值为0.009,信号锚定的可能性值为0.001,第17~18位氨基酸残基之间的剪切的值为0.004。推测樟叶越桔VdUGT1为非分泌性蛋白。蛋白质跨膜结构域预测结果(图5)显示VdUGT1肽链不存在蛋白质跨膜结构域,位于细胞膜外。

图3 VdUGT1和其他植物GTs的氨基酸序列比对Fig.3 Alignment of deduced amino acid sequences of VdUGT1 and GTs gene from other plants
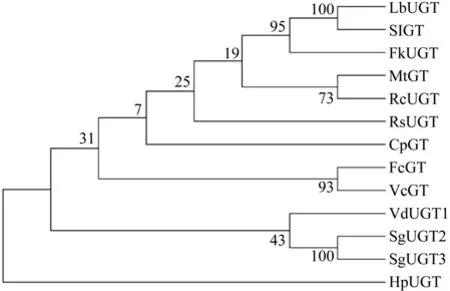
图4 VdUGT1和其他植物GTs的进化树分析Fig.4 Phylogenetic analysis of VdUGT1 and other plant GTs
疏水性一方面可以为二级结构预测结果提供参考,另一方面还可以为结构域以及功能域的划分提供依据[17]。通过疏水性分析樟叶越桔VdUGT1蛋白质中疏水性最大值是2.286, 位于第115位氨基酸残基处;亲水性最大值是-2.264,位于第189位氨基酸残基处;综合分析其亲水性氨基酸均匀分布在整个肽链中,没有明显的疏水区域(图6)。结合蛋白质性质和跨膜结构域分析结果,推测樟叶越桔VdUGT1为非分泌性的可溶性蛋白质,其在细胞质中合成后不经运转,直接分布在细胞质特定部位发挥其功能。

图5 VdUGT1蛋白跨膜结构域预测Fig.5 Prediction of transmembrane regions of VdUGT1
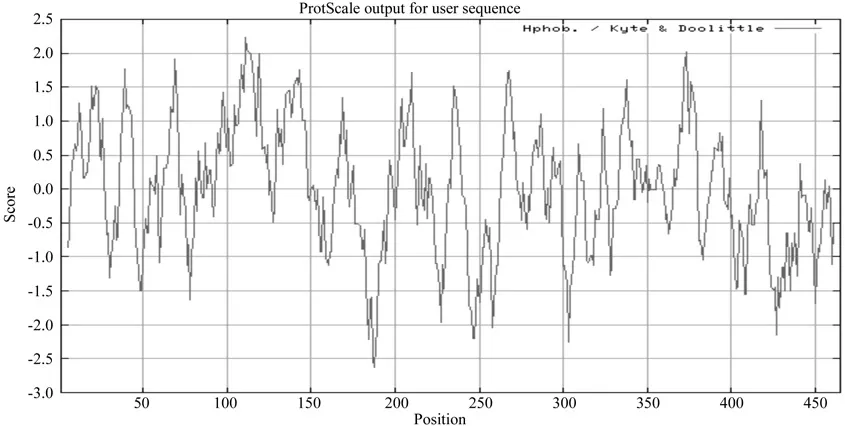
图6 VdUGT1蛋白质疏水性和亲水性分析Fig.6 Prediction of VdUGT1 protein hydroPhobicity and hydroPhilicity prof i le
蛋白质分子的多肽链通常折叠和盘曲成比较稳定的空间结构,形成比较稳定的二级结构,进一步才能完成活性功能域构象的构建,以完成特定的生命活动。VdUGT1蛋白质二级结构预测结果(图7)显示其由43.01%的α-螺旋、5.81%的β-转角、14.19%的β-折叠和36.99%的随机卷曲组成。可见α-螺旋和随机卷曲构成了VdUGT1蛋白的主要二级结构。VdUGT1蛋白结构功能域分析结果表明其含有PLN00164、PLN03015、UDPGT、MGT和COG1819等多种功能域,其中位于C末端含有尿嘧啶核苷二磷酸糖基转移酶所特有UDPGT功能域,推测与尿嘧啶核苷二磷酸糖(UDP-sugar)的结合有关[18]。
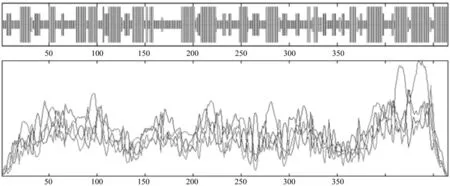
图7 VdUGT1蛋白二级结构预测Fig.7 Secondary structure prediction of deduced VdUGT1 protein
3 结 论
GTs为高度分歧的多源基因家族,根据蛋白酶的催化特性、氨基酸序列相似性、以及有无保守结构/功能域,目前已将其分为96个家族[19-20]。其中,糖基转移酶家族1(GT1),又称UGTs,是GTs中的最大家族[4-5],可催化激素、类黄酮、以及像杀虫剂和除草剂等外源物质等次生代谢产物的糖基化[13]。目前已在拟南芥Arabidopsis thaliana中发现有120个UGTs基因[6],在江南卷柏Selaginella moellendorff i i和小立碗藓Physcomitrella patens中分别发现有142个和21个UGTs基因[10],在‘黑比诺’Pinot Noir葡萄Vitis vinifera中发现有99个UGTs基因[21],在水稻Oryza sativassp. Japonica中发现有213个UGTs基因[12],在鹰嘴豆Cicer arietinum中发现有96个UGTs基因[13],所对应的基因全序列或部分序列已被克隆并测序。本课题组前期工作开展了樟叶越桔叶芽转录组测序分析研究,通过COG功能分类分析获得了至少53条樟叶越桔糖基转移酶基因EST序列。本研究通过RACE-PCR技术克隆了一个全长1 620 bp mRNA序列的樟叶越桔糖基转移酶基因,命名为VdUGT1,具有真核生物mRNA典型的Poly(A)尾巴结构和完整的ORF区域。
氨基酸序列分析发现来自不同植物的已知UGTs在C末端均具有1个由44个氨基酸残基组成的与底物供体UDP-sugar结合密切相关的高保守性的特征模体(signature motif),称为PSPG模 体(Plant Secondary Product Glycosyltransferase Motif),推测与UDP-sugar的结合有关[19-20]。本研究克隆获得的VdUGT1基因推测编码的由465个氨基酸残基组成的樟叶越桔糖基转移酶VdUGT1在381-384位氨基酸残基间同样具有UGTs特征模体—PSPG模体(图3),保守序列为WAPQIEVLSHGSTGGFLSHCGWNSTIESVVH GVPIIAWPLYA EQ,决定了糖基供体结合位点的微环境。另外,在VdUGT1蛋白的N-末端结构域(N-Terminal Domain,NTD)第18位(图3)有1个保守的组氨酸残基,推测与存在于其他植物UGTs的NTD中的保守的组氨酸残基一样,可提供碱性微环境(如OH和NH等),对糖基供体和受体分子之间的结合起催化作用,有助于糖基受体去质子化,接受来自于糖基供体分子上的末端异构中心的亲核攻击,这也是UGTs催化糖基转移反应的基础[13,22]。
UGTs的亚细胞定位研究表明,UGTs一般为可溶性蛋白质[3]。在植物细胞中不同组分的UGTs活性反应实验证明,绝大多数UGTs是在细胞质基质中才表现出活性[23-24]。本研究根据蛋白质信号肽预测和跨膜结构域分析结果推测樟叶越桔VdUGT1为非分泌性的可溶性蛋白质,其在细胞质中合成后不经运转,直接分布在细胞基质特定部位发挥其功能。不同种类的UGTs可能定位于不同细胞或同一细胞的不同细胞器,以催化不同底物的糖基转移反应[22]。Hefner等[9]研究表明在74种天然或合成化合物中,有45个化合物可以被蛇根木糖基转移酶RsUGT糖基化,表明UGTs的底物专一性较低。UDPG和对苯二酚在植物体内可被UGTs成员之一熊果苷合成酶催化生成熊果苷,因其能够竞争性抑制酪氨酸酶活性从而抑制黑色素的形成,熊果苷被国际公认为21世纪天然、低毒、高效的皮肤美白剂,是皮肤美白化妆品中理想的活性添加成分。本课题组Zhao等[8]研究发现在樟叶越桔幼嫩叶芽中熊果苷衍生物含量占植物材料干重的22%,推测在樟叶越桔中存在高活性表达的UGTs。本研究成功从樟叶越桔中分离得到糖基转移酶基因家族中的VdUGT1基因全长cDNA序列,推导的糖基转移酶VdUGT1属于UGTs家族的一个新成员。VdUGT1是否具有与其他UGTs类似的多底物接受特性,则需要开展异源表达和功能验证等深入研究。
[1] Campbell JA, Davies GJ, Bulone V,et al.A classification of nucleotide-diphospho-sugar glycosyltransferases based on amino acid sequence similarities[J]. Biochem J, 1997, 326 (3): 929-939.
[2] Martin RC, Mok MC, Mok DW. A gene encoding the cytokinin enzyme zeatin O-xylosyltransferase of Phaseolus vulgaris[J].Plant Physiol, 1980, 120 (2): 553-558.
[3] Vogt T, Jones P. Glycosyltransferases in plant natural product synthesis: characterization of a supergene family[J]. Trends Plant Sci, 2000, 5 (9): 380-386.
[4] Jones P, Messner B, Nakajima J,et al.UGT73C6 and UGT78D1,glycosyltransferases involved in fl avonol glycoside biosynthesis in Arabidopsis thaliana[J]. J Biol Chem, 2003, 278 (45): 43910-43918.
[5] Sawada S, Suzuki H, Ichimaida F,et al. UDP-glucuronic acid: anthocyanin glucuronosyltransferase from red daisy(Bellis perennis) flowers. Enzymology and phylogenetics of a novel glucuronosyltransferase involved in flower pigment biosynthesis[J]. J Biol Chem, 2005, 280 (2): 899-906.
[6] Li Y, Baldauf S, Lim EK,et al.Phylogenetic analysis of the UDP-glycosyl- transferase multigene family of Arabidopsis thaliana[J]. J Biol Chem, 2001, 276 (6): 4338-4343.
[7] Lim EK, Bowles DJ. A class of plant glycosyltransferases involved in cellular homeostasis[J]. EMBO J, 2004, 23 (15):2915-2922.
[8] Zhao P, Tanaka T, Hirabayashi K,et al.Caffeoyl arbutin and related compounds from the buds of Vaccinium dunalianum[J].Phytochemistry, 2008, 69 (18): 3087-3094.
[9] Hefner T, Arend J, Warzecha H,et al. Arbutin synthase, a novel member of the NRD1β glycosyltransferase family, is a unique multifunctional enzyme converting various natural products and xenobiotics[J]. Bioorg Med Chem, 2002, 10 (6): 1731-1741.
[10] Cao PJ, Bartley LE, Jung KH,et al.Construction of a rice glycosyltransferase phylogenomic database and identif i cation of ricediverged glycosyltransferases[J]. Mol Plant, 2008, 1(5): 858-877.
[11] 刘海峰, 杨成君, 于 淼, 等. 山葡萄UDP-葡萄糖: 类黄酮-3-O-葡萄糖基转移酶基因(3GT)cDNA的克隆和分析[J]. 植物生理学通讯, 2009, 45 (8): 748-752.
[12] Yonekura-Sakakibara K, Hanada K. An evolutionary view of functional diversity in family 1 glycosyltransferases[J]. Plant J,2011, 66 (1): 182-193.
[13] Sharma R, Rawat V, Suresh CG. Genome-wide identif i cation and tissue-specif i c expression analysis of UDP-glycosyltransferases genes confirm their abundance in Cicer arietinum (chickpea)genome[J]. PLoS One, 2014, 9(10): e109715. doi:10.1371/journal. pone. 0109715.
[14] 朱东阳, 尹继庭, 丁 勇, 等. 樟叶越桔叶芽总RNA提取方法比较研究[J]. 西部林业科学, 2013, 42 (1): 81-85.
[15] Kumar S, Tamura K, Nei M. MEGA: Molecular evolutionary genetics analysis software for microcomputers[J]. Comput Appl Biosci, 1994, 10 (2): 189-191.
[16] 王汉屏. 不同植物防御素的生物信息学分析[J]. 植物生理学通讯, 2008, 44 (1): 25-32.
[17] 丁 勇, 陈庆波, 徐春雷, 等. 油菜油体钙蛋白基因BnClo1的克隆和表达[J]. 作物学报, 2008, 34 (11): 1921-1928.
[18] Paquette S, Moller BL, Bak S. On the origin of family 1 plant glycosyltransferases[J]. Phytochemistry, 2003, 62(3): 399-413.
[19] Noguchi A, Saito A, Homma Y,et al. A UDP-Glucose: isof l avone 7-O-glucosyltransferase from the roots of soybean (Glycine max) seedlings. Purif i cation, gene cloning, phylogenetics, and an implication for an alternative strategy of enzyme catalysis[J]. J Biol Chem, 2007, 282 (32): 23581-23590.
[20] Wang X. Structure, mechanism and engineering of plant natural product glycosyltrans- ferases[J]. FEBS Lett, 2009, 583 (20):3303-3309.
[21] 王 军, 于 淼. 葡萄次生代谢UDP-糖基转移酶研究进展[J]. 园艺学报, 2010, 37 (1): 141-150.
[22] Offen W, Martinez-Fleites C, Yang M,et al. Structure of a fl avonoid glucosyltransferase reveals the basis for plant natural product modif i cation[J]. EMBO J, 2006, 25 (6): 1396-1405.
[23] Oba K, Conn EE, Canut H,et al.Subcellular localization of 2-(b-D- glucosyloxy)- cinnamic acids and the related b-glucosidase in leaves of Melilotus alba Desr[J]. Plant Physiol, 1981, 68 (6):1359-1363.
[24] Anhalt S, Weissenböck G. Subcellular localization of luteolin glucuronides and related enzymes in rye mesophyll[J]. Planta,1992, 187 (1): 83-88.
Cloning and sequence analysis of Glycosyltransferase geneVdUGT1 inVaccinium dunalianum
SONG Jian1, XIONG Hong1, ZHU Dong-yang2, ZHAO Ping2, DU Wei1, LIU Xiao-zhi1, DING Yong1
(1. College of Life Sciences, Southwest Forestry University, Kunming 650224, China; 2. Key Lab. for Forest Resources Conservation and Use in Southwest Mountains of China, Ministry of Education, Southwest Forestry University, Kunming 650224, China)
Based on the partial cDNA of geneVdUGT1 isolated by transcriptome sequencing fromV. dunalianumin previous study,the full-length cDNA comprised 1 620 nucleotides consisting of an open reading frame of 1398 nucleotides was cloned by RACE-PCR fromV. dunalianum. The open reading frame encoded a putative VdUGT1 comprising 465 amino acid residues with molecular weight of 50.89 kD and isoelectric point of 5.53. The sequence analysis showed that the total numbers of negative charged residues (Asp+Glu) and charged residues (Arg+Lys) in VdUGT1 were 53 and 41, respectively. VdUGT1 with unstable coeff i cient 48.38 belongs to the unstable protein. It was predictive VdUGT1 had no signal peptide and transmembrane structure. The main parts of predicted secondary structures of VdUGT1 were α-helices and random coils. UDPGT domain, a characteristic functional domain of UDP-glycosyl- transferases existing in the near C-terminus of VdUGT1 plays an important role in combining with UDP-sugar. The results established a foundation for the heterologous expression and functional analysis of VdUGT1in the later period.
Vaccinium dunalianum; UDP-glycosyltransferase; RACE; gene cloning; sequence analysis
S759.95;S663.9
A
1673-923X(2015)06-0080-07
10.14067/j.cnki.1673-923x.2015.06.015
2014-12-03
云南省高校林下生物资源保护及利用科技创新团队项目;云南省优势特色重点学科生物学一级学科建设项目(50097505);国家自然科学基金(21462040, 31460076)
宋 健,硕士研究生 通讯作者:丁 勇,高级实验师,硕士生导师,E-mail:dingyong@swfu.edu.cn
宋 健,熊 宏,朱东阳,等. 樟叶越桔糖基转移酶VdUGT1基因克隆及序列分析[J].中南林业科技大学学报, 2015, 35(6):80-86.
[本文编校:吴 彬]
