响应面优化无患子皂苷超声辅助提取工艺
2015-12-20但汉龙叶红莲王连春
但汉龙,李 娜,叶红莲,刘 云,王连春,赵 平
(1. 西南林业大学 西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224;2. 西南林业大学 林学院, 云南 昆明 650224 )
响应面优化无患子皂苷超声辅助提取工艺
但汉龙1,2,李 娜1,2,叶红莲2,刘 云2,王连春2,赵 平1,2
(1. 西南林业大学 西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224;2. 西南林业大学 林学院, 云南 昆明 650224 )
采用超声辅助提取法从无患子果皮中提取无患子皂苷,通过单因素试验考察了乙醇浓度、提取时间、料液比以及提取次数4个因素对无患子皂苷得率的影响,并采用响应面法确定无患子皂苷的最佳提取工艺条件为:乙醇体积分数82.2%、提取时间33.75 min、料液比1:28.9、提取次数4次,在此优化条件下无患子皂苷的理论提取率可达到21.52%。依实际试验情况,将其修正为乙醇体积分数82%、提取时间34 min、料液比1:29、提取次数4次,经验证此条件下无患子皂苷提取率为21.48%,与理论值较为接近,表明采用响应面法分析优化无患子皂苷超声辅助提取工艺的方法可行。
无患子;无患子皂苷;超声辅助提取;响应面法
无患子Sapindus mukorossi又名肥皂树、油患子、菩提子等,是无患子科Sapindaceae无患子属Sapindus落叶乔木,原产我国长江流域以南及中南半岛、印度和日本等各地,我国广东、福建、广西、江西、浙江、云南等地均有栽培,为低山丘陵及石灰岩山地常见树种[1]。无患子皂苷是无患子果皮的主要有效成分[2],具有抑制肿瘤细胞增殖[3]、抗炎[4]、抗菌[5]、抗真菌[6]、保肝[7]、抗血小板凝集[8]、降血压[9]、降血糖和降血脂[10]、杀虫[11]和灭螺[12]等多种药理活性,且具良好的去污、起泡效果[13],被广泛应用于医药、农药、日用品和化妆品等行业[14]。
近年来,国内学者采用单因素试验或正交试验法对无患子皂苷提取工艺开展了一些研究,主要包括水或醇提法[15-17]、微波辅助提取法[18-20]、超声辅助提取法[21-23]和纤维素酶法[24]等。金秋等[25]比较了回流提取、索氏提取、微波辅助提取和超声辅助提取等不同提取方式,发现超声辅助提取法的提取效率明显优于其他方法。与传统的正交试验法相比较,响应面法目前已成为工艺条件等目标优化的一种有效的设计分析方法,在医药、食品、农业、生物等领域得到了广泛应用[26-29]。本研究以滇产无患子果皮为原料,采用超声辅助法提取无患子皂苷,在单因素试验基础上选取乙醇体积分数、液料比、超声时间和提取次数4个因素进行中心组合设计,采用响应面法优化无患子皂苷的超声辅助提取工艺,以期为云南省无患子植物资源的进一步开发利用提供参考。
1 试验材料与方法
1.1 试验材料与试剂
无患子采自云南省建水县李浩寨乡,其果皮自然晾干后经粉碎过40目筛后备用。齐墩果酸对照品购自中国药品生物制品检验所,香草醛、冰醋酸、高氯酸、乙醇、甲醇和丙酮均为分析纯,水为重蒸馏水。
1.2 试验仪器
UV-1000 紫外分光光度计(北京莱伯泰科仪器有限公司)、四两装高速中药粉碎机(浙江瑞安市永历制药机械有限公司)、N-1100 旋转蒸发仪(日本东京理化器械公司)、CP224C型电子天平(奥豪斯仪器有限公司)、LU10AT型超声波仪(FUNGILABS. B)、HH-2数显恒温水浴锅(国华电器有限公司)。
1.3 试验方法
1.3.1 标准曲线的制备
参照毛得奖等[30]的方法,精密称取齐墩果酸对照品3.0 mg,配成0.3 mg/mL的甲醇溶液。分别取0,0.2,0.4,0.6,1.2,1.4 mL标准溶液,挥干试剂后加入5%香草醛/冰醋酸0.2 mL(现配现用)、高氯酸0.8 mL混匀,60℃水浴加热15 min,取出后立刻用流水冷却,加5 mL冰醋酸稀释混匀,以空白试管中溶液作为空白对照,测550 nm处的吸光度值,重复三次。计算回归方程为y=38.243x+0.016 3(R2= 0.999 0),线性范围11.8~82.6 μg/mL,线性关系良好。
1.3.2 样品皂苷含量测定及其提取率计算
精密称取1.000 g无患子果皮粉末,在不同条件下进行超声提取,所得提取液经适当倍数稀释、定容于25 mL容量瓶中,然后从中取0.5 mL溶液于干净试管中,减压浓缩挥干试剂后按1.3.1所示方法进行操作,将测得的样品吸光度值带入上述回归方程,并结合稀释倍数求得提取液中的皂苷质量(g),按下式计算样品在不同提取条件下的皂苷提取率:皂苷提取率/%= [皂苷含量(g)/无患子质量(g)] × 100%。
1.3.3 提取溶剂选择
精密称取1.000 g 无患子果皮粉末,以料液比1∶20分别加入体积分数为20%、40%、60%、80%和100%的甲醇、乙醇和丙酮超声提取1次,时间40 min,所得各提取液按1.3.2方法测定并计算皂苷提取率,以确定最佳提取溶剂。
1.3.4 单因素试验
精密称取1.000 g 无患子果皮粉末,利用超声波辅助乙醇提取法,分别考察不同超声提取时间(20、30、40、50、60 min)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、提取次数(1、2、3、4、5次)和乙醇体积分数(20%、40%、60%、80%、100%)对皂苷提取率的影响,每组试验重复三次,以确定各因素的恰当范围。
1.3.5 响应曲面试验
根据单因素试验结果,选取超声时间、液料比、提取次数、乙醇体积分数4个因素,利用Design-Expert V 8.0.6软件,按照中心组合试验设计原理,以皂苷提取率为响应值,设计4因素3水平共30个试验点的响应面分析试验,每组重复三次。使用上述软件进行数据分析,求出数学模型,以确定无患子皂苷的最佳提取工艺条件。
1.3.6 验证试验
根据实际试验操作需要,对1.3.5响应面实验所得的最佳理论提取工艺条件进行适当修正后,精密称取1.000 g 无患子果皮粉末进行三次重复验证试验,通过实际所得的皂苷提取率与回归方程优化所得的理论预测值进行比较,以验证响应面法所得的试验参数是否准确可靠。
2 结果与分析
2.1 提取溶剂选择
不同体积分数的甲醇、乙醇和丙酮作为提取溶剂对无患子皂苷提取率的影响结果见图1。由图1可知,体积分数较低的丙酮提取所得的皂苷提取率高于相同体积分数的乙醇和甲醇所得的提取率,60%和80%的丙酮和乙醇所得的提取率较高且较为接近,但高体积分数丙酮的提取率明显低于乙醇和甲醇。综合考虑溶剂成本和毒性等因素,选择80%乙醇作为本实验的提取溶剂。
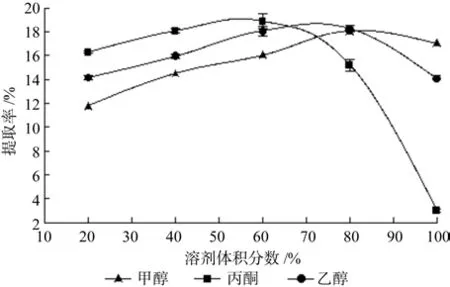
图1 不同提取溶剂对无患子皂苷提取率的影响Fig.1 Effects of different extraction agents on extraction rate of sapindus-saponin
2.2 单因素试验
不同超声提取时间、料液比、提取次数和乙醇体积分数等因素对无患子皂苷提取率的影响结果见图2。
由图2a可知,提取时间在30 min时,无患子皂苷提取率达到最高,之后皂苷提取率随提取时间的延长而逐渐下降,这可能是由于超声时间的延长增加了超声波的作用强度,导致样品中的皂苷受到破坏所致[31]。因此,确定最佳的超声提取时间为30 min。
由图2b可知,液料比在1∶10~1∶30区间内,皂苷提取率随液料比的增加而上升。当液料比在1∶30时,皂苷提取率达到最高。当液料比大于1∶30后,皂苷提取率呈下降趋势,这可能是因为溶剂量过大导致皂苷浓度下降而不利于协同浸提,从而导致提取率下降[32]。因此,液料比确定为1∶30。
由图2c可知,提取次数在1~3次之间,皂苷提取率随提取次数的增加而显著上升,提取次数超过3次后,皂苷提取率的上升幅度趋于相对平缓。考虑到节约成本等因素,确定提取次数为3次。
由图2d可知,随着乙醇体积分数的增加,皂苷提取率呈先升后降的趋势,当乙醇体积分数达到80%时,提取率达到最高,因此选择乙醇体积分数为80%。
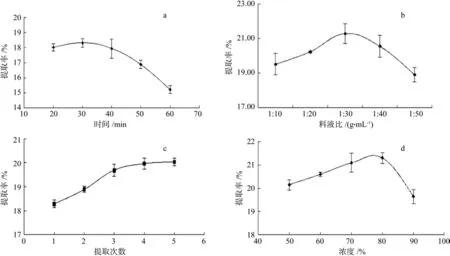
图2 提取时间(a)、料液比(b)、提取次数(c)和乙醇体积分数(d)对无患子皂苷提取率的影响Fig. 2 Effects of extraction time (a), solid-liquid ratio (b), extraction times (c) and concentration of ethanol (d) on extraction rate of sapindus-saponin
2.3 响应面试验
2.3.1 响应曲面试验设计及结果
在单因素试验结果基础上,根据中心组合试验设计原理,以无患子皂苷提取率为响应值,乙醇体积分数(A)、料液比(B)、超声时间(C)和提取次数(D)4因素为自变量,每个因素取3个水平以(-1,0,1)编码,4因素的3水平分别选取见表1所示。
中心组合试验设计方案及结果见表2所示,本次试验共30有个试验点,6个中心点,总计25个分析因子,各个试验点以随机顺序进行,每个点重复试验3次,取平均值作为结果。

表1 响应曲面条件优化试验因素水平Table 1 Factors and levels for response surface optimization test
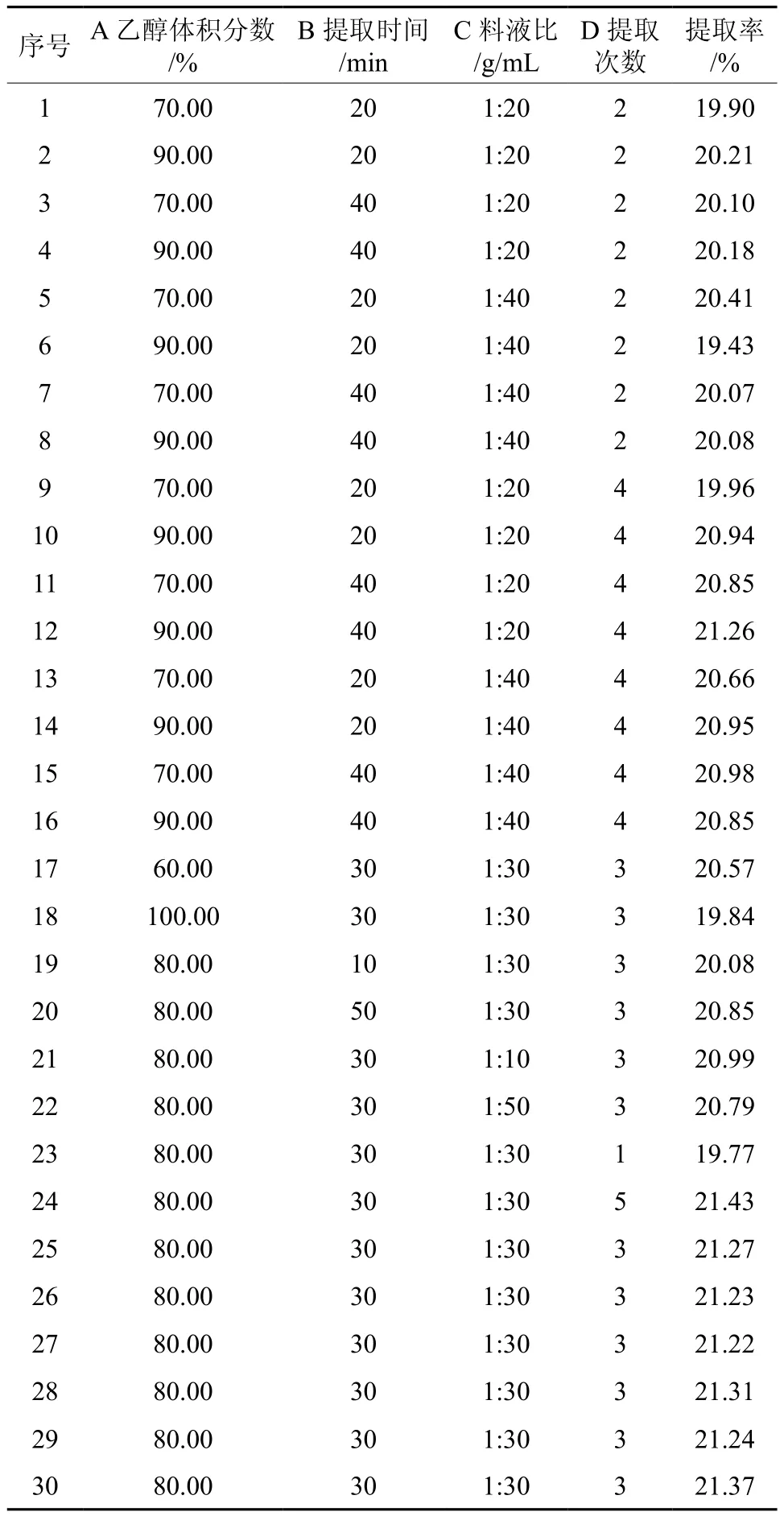
表2 中心组合试验方案及结果Table 2 Central composite design matrix and experimental results
2.3.2 回归模型的建立及显著性检测
经回归拟合后,回归模型方差分析结果见表3,实验因子对响应值的影响可用回归方程表示:提取率/%=-3.30781+0.462 06A+0.155 02B+ 0.194 77C+0.091 875D-1.437 5x10-4AB-1.618 75x10-3AC+0.013 313AD-5.312 5x104BC+5.937 5x10-3BD+5.187 5x10-3CD-2.819 79x103A2-2.182 29x103B2-1.107 29x103C2-0.183 23D2。
由表3方差分析结果可知,回归模型的回归效果极显著(p<0.0001),线性系数较好(R2=0.9048),说明建立的数学模型能很好地描述试验结果,且可用于分析和预测响应值。表3中的P值大小可判断各因素对响应值的影响,结果表明:乙醇体积分数(A)、提取时间(B)、料液比(C)、提取次数(D)四个因素对响应值的影响大小顺序为D>B>A>C;同时,AC、AD、A2、B2、C2、D2的P值均在0.05以下,其中AC、AD、C2对皂苷提取率影响显著,A2、B2、D2对提取皂苷影响高度显著。
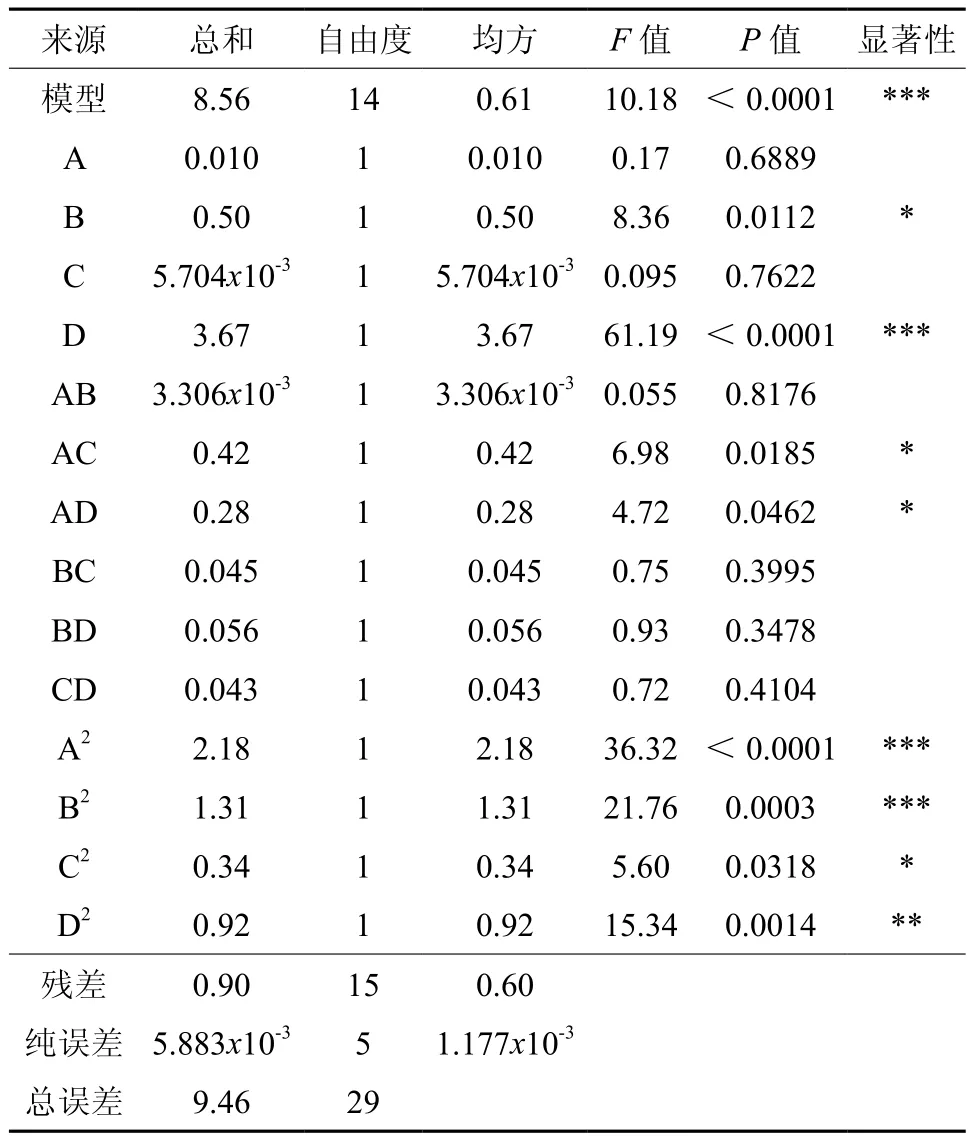
表3 回归模型方差分析结果†Table 3 Results of variance analysis of regression model
2.3.3 响应面分析
利用Design-expert V 8.0.6统计软件,对表3中响应面试验中无患子皂苷提取率数据进行二次多元回归拟合,获得二次回归方程的响应面3D图如图 3所示。由图3响应面3D图剖面曲线的陡峭程度结合表3中的P值大小,可反映两因素交互作用对无患子皂苷提取率的影响。
由表3可知PAB>PCD>PBC>PBD>PAD>PAC,这说明乙醇体积分数与提取时间的交互作用对无患子皂苷提取率最小,乙醇体积分数与料液比的交互作用对无患子皂苷提取率最大。由图3a可知,无患子皂苷提取率随着乙醇体积分数的增加变化不大,提取时间对皂苷提取率影响也较缓慢(PAB>0.05),说明二者交互作用不明显。由图3b可知,皂苷提取率随着乙醇体积分数的增加变化很大,随着料液比数的增加变化也较大(PAC<0.05),表明二者交互作用明显。由图3c可看出,皂苷提取率随着乙醇体积分数的增大变化缓慢,而随提取次数的增加快速上升(PAD<0.05),说明二者交互作用明显。由图3d可知,皂苷提取率随着液料比的增加上升缓慢,而随着超声时间的增加总体变化不大(PBC>0.05),表明二者交互作用不明显。由图3e可看出,皂苷提取率随着提取次数变化很大,而随着提取时间的增大变化缓慢(PBD>0.05),二者交互作用不明显。由图3f可知,料液比不变时,皂苷提取率随着提取次数的增加变化较大,而当提取次数不变时,皂苷提取率随着料液比的增加缓慢(PBD>0.05),说明二者交互作用不明显。

图3 无患子皂苷提取率的响应面立体分析图和等高线图Fig. 3 Response surface and contour for interactive effects of different factors on extraction rate of sapindus-saponin
2.3.4 最佳工艺条件的确定及验证
通过Design-Expert V 8.0.6软件对回归方程的优化计算,得到超声辅助提取无患子皂苷的最佳工艺条件为:乙醇体积分数82.2%、提取时间33.75 min、料液比1∶28.9、提取次数4次。在此优化条件下,无患子皂苷提取率的理论预测值为21.52%。
为检验响应面法优化无患子皂苷提取工艺的可靠性,根据实际试验情况,将上述优化条件修正为乙醇体积分数82%、提取时间34 min、料液比1∶29、提取次数4次,在此条件下提取无患子皂苷,并做三组重复试验,得到平均实际提取率为21.48%,与理论预测值较为接近(仅相差0.04%),表明运用响应面分析法优化得到的模型参数准确可靠。
3 结 论
本研究通过单因素试验和响应面分析,确定了影响超声辅助提取无患子皂苷4个因素的主次关系为:提取次数> 提取时间> 乙醇浓度>料液比,其最佳的理论工艺条件为:乙醇体积分数82.2%、料液比1∶28.9、提取时间33.75 min、提取次数4次。在此优化条件下,无患子皂苷提取率的理论预测值可达到21.52%。根据实际实验操作需要,将工艺条件修正为:乙醇体积分数82%、料液比1:29、提取时间34 min、提取次数4次。经验证在此条件下无患子皂苷的实际提取率为21.48%,与理论预测值较为接近,表明采用响应面法分析优化无患子皂苷超声辅助提取工艺的方法可行,研究结果将为云南省无患子植物资源进一步的开发利用提供参考[33]。
[1] 中国植物志编辑委员会. 中国植物志: 第47卷(第1分册)[M]. 北京: 科学出版社, 1998.
[2] Tanaka O, Tamura Y, Masuda H,et al.Application of saponins in food and cosmetics: saponins ofMohova YuccaandSapindus mukorossiGaertn, saponins used in food and agriculture[M].Eds, Waller GR and Yamasaki K, New York: Plenum Press, 1996,1-11.
[3] 长尾常敦. 关于肿瘤细胞增殖抑制成分的研究: 无患子果皮中活性成分[J]. 国外医学——中医中药分册,2002,4(24):246-247.
[4] Takagi K, Park EH, Kato H. Anti-inflammatory activities of hederagenin and crude saponin isolated fromSapindus mukorossiGaertn[J]. Chem Pharm Bull, 1980, 28(4): 1183-1188.
[5] Ibrahim M, Khan AA, Tiwari SK,et a1. Antimicrobial activity ofSapindus mukorossiandRheum emodiextracts against H pylori:In vitro and in vivo studies[J]. World J Gastroenterol, 2006,12(44): 7136-7142.
[6] Saha S, Walia S, Kumar J,et al.Structure-biological activity relationships in triterpenic saponins: the relative activity of protobassic acid and its derivatives against plant pathogenic fungi[J]. Pest Manag Sci, 2010, 66(8): 825-831.
[7] Ibrahim M, Khaja MN, Aara A,et al. Hepatoprotective activity ofSapindus mukorossiand Rheum emodi extracts: in vitro and in vivo studies[J]. World J Gastroenterol, 2008, 14(16): 2566-2571.
[8] Huang HC, Tsai WJ, Liaw CC,et al.Anti-platelet aggregation triterpene saponins from the galls ofSapindus mukorossi[J].Chem Pharm Bull, 2007, 55(9): 1412-1415.
[9] Wang WS, Long ZJ, Zhang L,et al. Effect of sapindoside on blood pressure and vasoactive substance in renovascular hypertension rat[J]. China J Chin Mater Med, 2007,32:1703-1705.
[10] Verma N, Amresh G, Sahu PK,et al.Antihyperglycemic activity, antihyperlipedemic activity, haematological effects and histopathological analysis ofSapindus mukorossiGaerten fruits in streptozotocin induced diabetic rats[J]. Asian Pac J Trop Med,2012, 5(7): 518-22.
[11] Lu LP, Sun CD, Yang ML,et al.Insecticidal activity of crude extract of saponins isolated formSapindus miukurossiGatren[J].Plant Diseases and Pests, 2010, 1(3): 55-56, 62.
[12] Huang HC, Liao SC, Chang FR,et al. Molluscicidal saponins fromSapindus mukorossi, inhibitory agents of golden apple snails,Pomacea canaliculata[J]. J Agric Food Chem, 2003,51(17): 4916-4919.
[13] 孙洁如, 陈孔常, 周鸣方, 等. 无患子表面活性物及其复配体系的性质研究[J]. 日用化学工业, 2002, 32(4): 16-18.
[14] 张 勤, 彭求闲, 蔡红兵, 等. 无患子的研究进展[J]. 医药导报, 2012, 31(9): 1171-1173.
[15] 饶厚曾, 郭隆华. 无患子皂苷提取工艺研究[J]. 江西科学,2002, 20 (1): 55-58.
[16] 黄素梅, 王敬文, 杜孟浩, 等. 无患子总皂苷的提取工艺研究[J]. 安徽农业科学, 2010, 38 (1): 354-356.
[17] 张 翠, 沈丽金, 汪何雅, 等. 无患子皂苷提取工艺研究[J].天然产物研究与开发, 2011, 23 (1): 140-143.
[18] 郑秀玉, 吴海华, 陈 赘. 微波辅助法提取无患子皂苷的工艺优化[J]. 湖北农业科学, 2013, 20 (52): 5026-5028.
[19] 郑秀玉, 吴海华, 陈 赘. 微波法水提无患子皂苷的工艺[J].试验室研究与探索, 2013, 7 (32): 14-16.
[20] 饶厚曾, 桑成涛. 微波萃取法提取无患子皂苷工艺[J]. 辽宁石油化工大学学报, 2006, 26 (4): 70-72.
[21] 杨安平, 蔡小连. 超声波提取无患子总皂苷工艺的优选研究[J]. 中医药导报, 2012, 4 (18): 74-75.
[22] 赵丹青, 苏肇秦, 张卫明, 等. 超声辅助低水比提取无患子皂素工艺过程研究[J]. 中国野生植物资源, 2012, 31 (4): 18-22.
[23] 覃勇荣, 刘 欣, 黄光兵, 等. 无患子总皂苷提取工艺条件优化及天然洗涤剂研究[J]. 北方园艺, 2013, (16): 143-148.
[24] 杨安平, 蔡小连. 纤维素酶提取无患子皂苷的正交设计试验优选[J]. 中医药报, 2012, 3 (18): 73-74.
[25] 金 秋, 奚立民, 张昕欣, 等. 无患子总皂苷提取工艺对比[J]. 浙江农业科学, 2013, (6): 683-686.
[26] Xia YG, Yang BY, Liang J,et al. Optimization of simultaneous ultrasonic-assisted extraction of water-soluble and fat-soluble characteristic constituents from Forsythiae Fructus using response surface methodology and high-performance liquid chromatography[J]. Pharmacogn Mag, 2014, 10 (39): 292-303.
[27] Kong W, Liu N, Zhang J,et al. Optimization of ultrasoundassisted extraction parameters of chlorophyll fromChlorella vulgarisresidue after lipid separation using response surface methodology[J]. J Food Sci Technol, 2014, 51 (9): 2006-2013.
[28] Gan C-Y, Latiff AA. Optimisation of the solvent extraction of bioactive compounds fromParkia speciosapod using response surface methodology[J]. Food Chem, 2011, 124 (3): 1277-1283.
[29] 余小翠, 刘高峰. 响应面分析法在中药提取和制备工艺中的应用[J]. 中药材, 2010, 33 (10): 1651-1655.
[30] 毛得奖, 朱亚玲, 庞海强, 等. 垂序商陆浆果红色素提取及总皂苷含量测定研究[J]. 中国调味品: 食品添加剂版, 2012, 12(37): 99-102.
[31] 刘 露,张 雁,张名位,等. 响应面法优化超声波辅助提取山药低聚糖的工艺研究[J]. 广东农业科学,2014,(11):100-105.
[32] 贾学静,李 乐,丁春邦,等. 响应面法优化微波辅助提取成熟叶老鹰茶总黄酮及其抗氧化研究[J]. 林产化学与工业,2014, 34(3): 85-91.
[33] 范辉华,张天宇,姚湘明,等. 高产油脂无患子优树的选择[J]. 中南林业科技大学学报, 2014, 34(5): 4-8.
Optimization of ultrasound-assisted extraction of sapindus-saponin by using response surface methodology
DAN Han-long1,2, LI Na1,2, YE Hong-lian2, LIU Yun2, WANG Lian-chun2, ZHAO Ping1,2
(1. Key Laboratory for Forest Resources Conservation and Use in the Southwest Mountains of China, Ministry of Education, Southwest Forestry University, Kunming 650224, Yunnan, China; 2. College of Forestry, Southwest Forestry University, Kunming 650224, China)
The ultrasound-assisted extraction of sapindus-saponin from the pericarps ofSapindus mukorossiwas carried out. The effects of ethanol concentration, material-liquid ratio, extraction times and extraction numbers on the extraction rate of saponins were investigated by single factor experiment, and the extraction process were optimized by using response surface methodology. The optimal extraction conditions were: 82.2% of ethanol concentration, 1:28.9 of material-liquid ratio, 33.75 minutes of extraction time, and 4 times of extraction number. Under this optimal condition, the theoretic extraction rate of sapindus-saponin reached 21.52%. According to the actual experiments, the optimum theoretic parameters were modif i ed as: ethanol concentration 82%, material-liquid ratio 1:29, extraction time 34 minutes and extraction number 4 times, and the actual extraction rate of sapindus-saponin was 21.48% , that is close to the theoretic value. The results show that the response surface method to optimize the ultrasonic-assisted extraction of sapindus-saponin is feasible.
Sapindus mukorossi; sapindus-saponin; ultrasound-assisted extraction; response surface methodology
S789
A
1673-923X(2015)06-0107-07
10.14067/j.cnki.1673-923x.2015.06.020
2014-10-11
国家自然科学基金(31260163);西南林业大学科技创新基金项目(C1457)
但汉龙,硕士研究生 通讯作者:赵 平,研究员,博士生导师;E-mail:hypzhao@yahoo.com
但汉龙, 李 娜, 叶红莲,等. 响应面优化无患子皂苷超声辅助提取工艺[J].中南林业科技大学学报,2015,35(6):107-113.
[本文编校:吴 彬]
