超声波辅助提取菠萝皮中黄酮及其抗氧化性研究
2015-12-19
(琼州学院 理工学院,海南 三亚572022)
0 引言
黄酮类化合物是一类存在于自然界的、具有2-苯基色原酮结构的化合物.黄酮类化合物有广泛的药用价值,具有抗氧化、清除氧自由基、调节心血管系统作用[1-3].并且具有抗菌、抗癌的作用以及降血糖的活性[4-5].
菠萝是世界名果之一,具有良好的营养价值和保健功效.菠萝皮渣是菠萝加工产生的副产物,占总重量的50%~60%,其中菠萝皮约占30%[6].如果不加以处理,将会对环境造成严重污染,也会对资源造成极大浪费.相关研究表明菠萝皮中富含黄酮等抗氧化活性物质[7],如果对其加以提取,在提高菠萝废弃物价值的同时,也增加了黄酮的来源途径.
在黄酮类化合物的提取中,超声提取技术、微波提取法和超临界流体萃取技术等[8]是近年来文献报道的一些广泛应用的现代生物学技术.超声波提取技术提取速度、提取率比传统提取方法更快更高,且不受成分极性因素、分子量大小因素的限制;还具有操作简单、所提取料液杂质含量少、有效成分容易分离和纯化等特点[9].Hromadkova[10]等人对比了传统碱法和超声辅助提取荞麦中半纤维素的产率,证明经短时超声波处理后产率相比于传统方法分别提高了1.2-1.5 倍.刘平怀等[11]利用循环超声波技术提取废弃菠萝皮中的色素,其提取时间大为缩短,色价和提取率都有较大幅度提高.
本文采用超声波辅助提取菠萝皮中黄酮类化合物,确定了最佳提取工艺,并研究了菠萝皮黄酮的抗氧化性.充分开发利用我省的菠萝皮渣废弃物资源,提高其利用率.
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料与试剂
菠萝皮渣:收集市场新鲜菠萝皮,处理后作为实验原料.
无水乙醇、芦丁标准品、氢氧化钠、硝酸铝、亚硝酸钠、磷酸氢二钠、磷酸二氢钠、氯化亚铁、硫氰酸铵,均为分析纯.
1.1.2 主要仪器和设备
电热恒温鼓风干燥箱(金坛市盛蓝仪器制造有限公司);UV-2550 紫外可见分光光度计(岛津制作所);TDL-80-2B 离心机(金坛市盛蓝仪器制造有限公司);JU-6224 调节型超声发生器(上海杰恩超声设备有限公司)等.
1.2 实验方法
1.2.1 菠萝皮黄酮类物质的提取工艺流程
菠萝皮渣→清洗→沸水热烫灭酶10 min→60℃烘干→粉碎→过40 目筛→超声辅助浸提→离心→上清→黄酮粗品.
1.2.2 菠萝皮黄酮含量的测定
1.2.2.1 标准溶液的配制
准确称取芦丁0.0200 g 用60%乙醇配制成0.2000 mg/ml 标准溶液,备用.
1.2.2.2 最大吸收波长的确定
准确称取1.0000 g 菠萝皮渣干粉于锥形瓶中,加入60 %乙醇,摇匀并盖上塞子,超声辅助提取,功率为600W,时间为30 min.提取结束后抽滤,取滤液以3000 r/min 离心10 min.取3.0 mL 上清液,依次加入2.0 mL 5%的NaNO2溶液、2.0 mL 10% Al(NO3)3溶液,摇匀放置6 min,最后加入10 mL 4% NaOH 溶液,定容至50 mL,静置20 min 后测量,芦丁标准溶液也经相同的处理,分别在200-700 nm 进行光谱扫描.
1.2.2.3 芦丁标准曲线的制作
分别准确吸取芦丁标准液0、2.0、4.0、6.0、8.0、10.0ml,同1.2.2.2 的方法在最大波长344 nm 处测吸光值,得到的标准曲线回归方程为:y=28.774x+0.0272,R2=0.9969.
1.2.2.4 黄酮含量的计算
取3 mL 待测液于50 mL 容量瓶中,同1.2.2.2 方法,在最大波长处测吸光值.将测得的吸光值代入回归方程,通过下面公式计算样品中黄酮类物质的提取率.
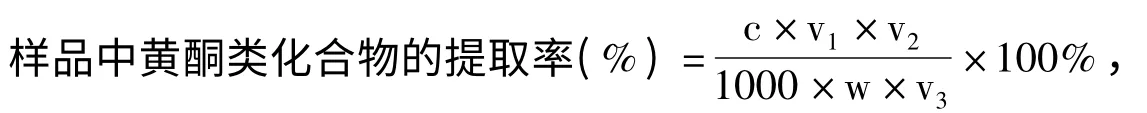
式中:c—样品中黄酮化合物的浓度,mg/mL;
v1—黄酮粗提液总体积,mL;
v2—显色反应定容体积,mL;
v3—测定取样体积,mL;
w—样品质量,g.
1.2.3 超声辅助提取黄酮类物质的单因素实验
1.2.3.1 超声波功率对菠萝皮黄酮提取率的影响
乙醇体积分数40%,料液比1∶50,分别于360、480、600、720、840W 功率下超声25 min.
1.2.3.2 超声时间对菠萝皮黄酮提取率的影响
乙醇体积分数40%,料液比1∶50,于600 W 功率下分别超声15、20、25、30、35、40 min.
1.2.3.3 提取剂浓度对菠萝皮黄酮提取率的影响
料液比为1∶50,分别选用20%、30%、40%、50%、60%、70%体积分数的乙醇作提取剂,在600 W 功率下超声25 min.
1.2.3.4 料液比对菠萝皮黄酮提取率的影响
乙醇体积分数40%,分别选用1∶30、1∶40、1∶50、1∶60、1∶70、1∶80 的料液比,在600 W 功率下超声25 min.
1.2.4 超声辅助提取黄酮类物质正交实验
在单因素实验研究的基础上,选择影响黄酮得率的四个主要因素,即:超声功率(A)、超声时间(B)、乙醇浓度(C)和料液比(D),每个因素各选取三个适宜的水平,按照L9(34)设计正交实验,见表1.

表1 菠萝皮黄酮超声波提取工艺正交实验因素和水平表
1.2.5 菠萝皮中黄酮类化合物的抗氧化性研究
参照俞坚[12]的方法,分别取4.00 mL 黄酮含量为24.93 mg/g 的待测样品溶液置20 mL 具塞试管中,依次加入4.10 mL 亚油酸,、8.00 mL 磷酸缓冲液(0.05 mol/L,pH7.0)和3.90 mL 蒸馏水,混匀,在40℃放置30 min 后,取0.10 mL 上述反应液,依次加入9.70 mL 75%乙醇、0.10 mL 30%硫氰酸铵和0.10 mL 0.02 mol/L氯化亚铁,混匀,准确反应3 min 后,测定500 nm 处的吸光值.以后每隔1 天取0.10mL 上述反应液,按同样的方法测定500 nm 处的吸光值,直到空白对照组的吸光值达到最大.
2 结果与分析
2.1 菠萝皮黄酮类物质紫外可见吸收光谱

图1 芦丁标准品和菠萝皮黄酮的吸收光谱图
菠萝皮黄酮类物质和芦丁标准品在200-700 nm 处扫描紫外—可见吸收光谱于图1.由图1可知,菠萝皮黄酮类物质主要吸收峰集中在330-370 nm 之间,与芦丁标准品的紫外吸收光谱相似,后续研究以最大吸收峰值的波长344 nm 为检测波长.
2.2 单因素实验结果和分析
2.2.1 超声波功率对菠萝皮黄酮提取率的影响
由图2可知,超声功率在360-600 W 之间时,随着超声功率的增大,黄酮的提取率明显增加;功率大于600 W 时,黄酮含量明显下降,这可能是因为超声功率过高,提取温度会发生较大波动,过大的能量产生的瞬间高温往往会使热不稳定类黄酮类化合物分解或部分分解.因此超声功率选用600 W 为宜.
2.2.2 超声时间对菠萝皮黄酮提取率的影响

图2 超声波功率对菠萝皮黄酮提取率的影响
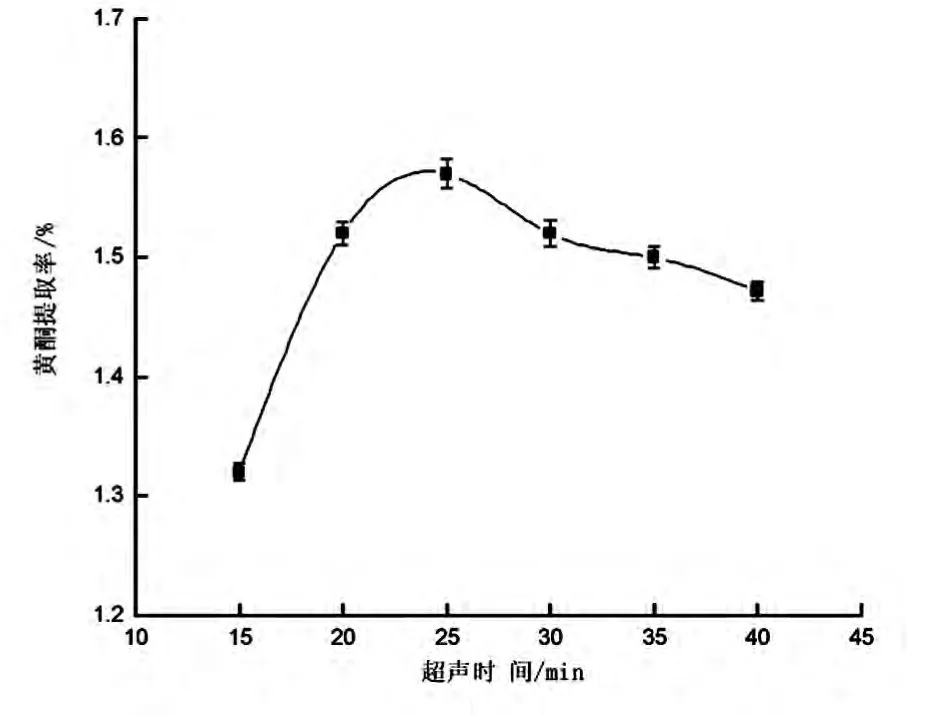
图3 超声时间对菠萝皮黄酮提取率的影响
由图3可知,超声时间在10-15 min 范围内,随着提取时间的延长,菠萝皮黄酮类化合物提取率呈线性增长,当提取时间达到25 min 时,黄酮得率最高,继续延长提取时间,黄酮类物质的提取率呈下降趋势,这可能是因为提取时间过长,超声波的热效应影响了黄酮类物质的化学结构;同时,提取时间过长会使杂质的溶出量增加,影响黄酮的提取率[13].因此,提取时间选择25 min 合适.
2.2.3 提取剂浓度对菠萝皮黄酮提取率的影响
由图4可知,在乙醇浓度为20-30%范围内,随着乙醇浓度升高,菠萝皮黄酮提取率缓慢增加,在30-40%范围内,菠萝皮黄酮提取率呈线性增长,再增大提取剂浓度,提取率反而下降.因为低浓度乙醇,提取不充分,而且水溶性杂质易溶出,给后续的分离纯化带来困难.高浓度乙醇,提取过程中挥发严重,并且醇溶性杂质也增多,影响菠萝皮黄酮的提取效果.
2.2.4 料液比对菠萝皮黄酮提取率的影响

图4 乙醇浓度对菠萝皮黄酮提取率的影响

图5 料液比对菠萝皮黄酮提取率的影响
在相同超声波提取条件下,随着料液比的增加,菠萝皮黄酮类化合物提取得率也不断的提高,当料液比达到1:50 后,黄酮类化合物提取得率几乎不再增加,料液比继续增大后,黄酮提取率呈下降趋势.初步推断是因为料液比达到一定值后,黄酮类物质达到溶解平衡,同时杂质溶出量有所增加.
2.3 正交实验结果与分析
按照表1安排试验,正交实验结果见表2
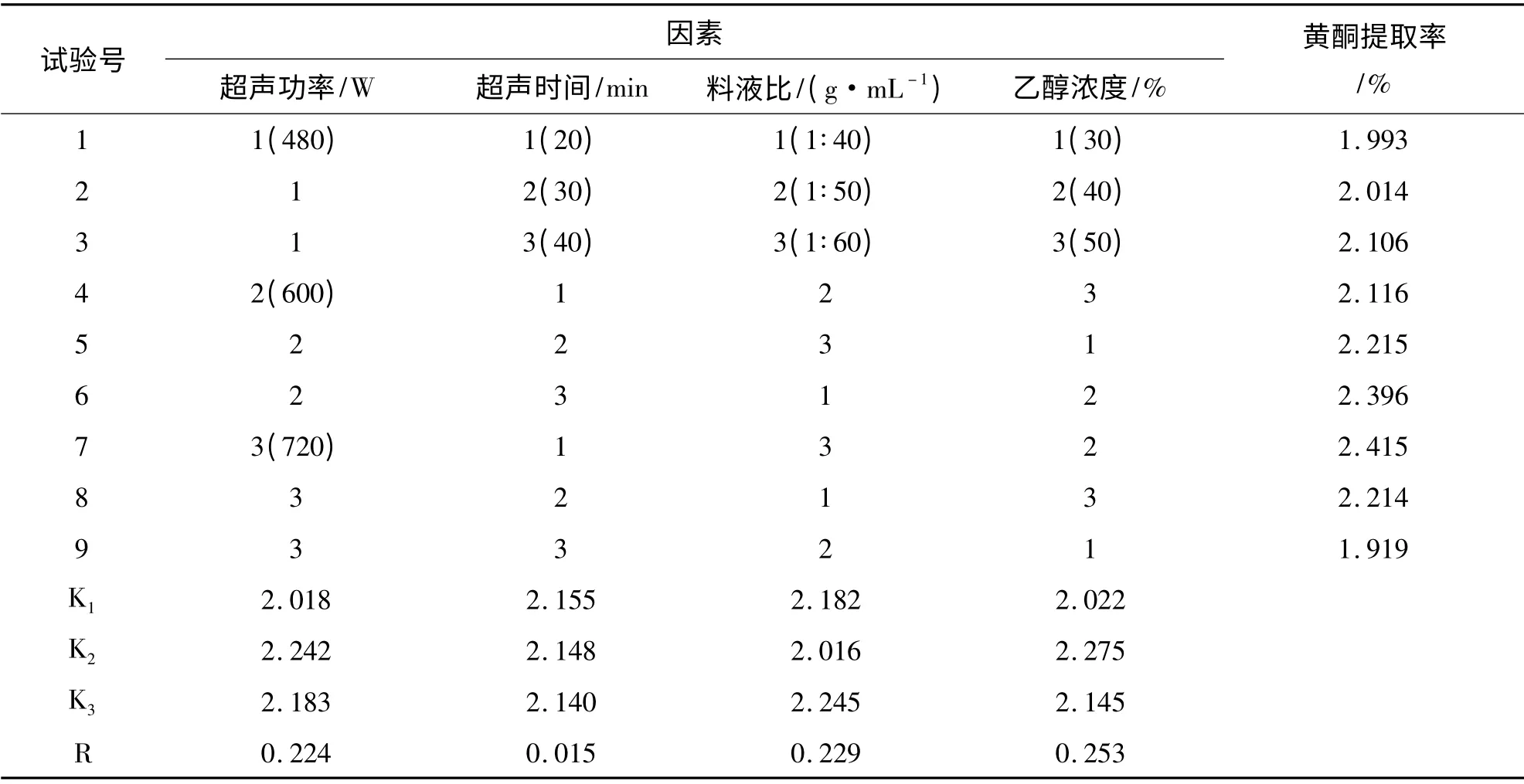
表2 正交实验结果
通过表2的方差分析可知,在对菠萝皮黄酮提取率影响较大的四个因素中,乙醇浓度的影响最大,其次是料液比,再次是超声波功率,最后是超声时间.最佳的提取工艺为A2B1C3D2,即超声功率600 W,超声时间20 min,料液比为1:60,乙醇浓度为40 %.在此条件下,菠萝皮黄酮提取率可高达2.493%.
2.4 菠萝皮黄酮类化合物抗亚油酸氧化能力
抗亚油酸氧化法是评价抗氧化能力的常用方法.脂质氧化的生成物主要是过氧化物,在酸性条件下,过氧化物把二价铁离子氧化成三价铁离子,三价铁离子和硫氰酸根形成红色的硫氰酸铁,该络合物在500 nm处附近有强的特征吸收,通过比色即可测出过氧化物的含量.吸光值越高表明亚油酸氧化程度越高[14].从图6可以看出菠萝皮黄酮类化合物抑制了亚油酸氧化,可能是因为加入的黄酮醇及其苷能够很好的抑制亚油酸过氧化物的形成,降低了过氧化物的形成速率.
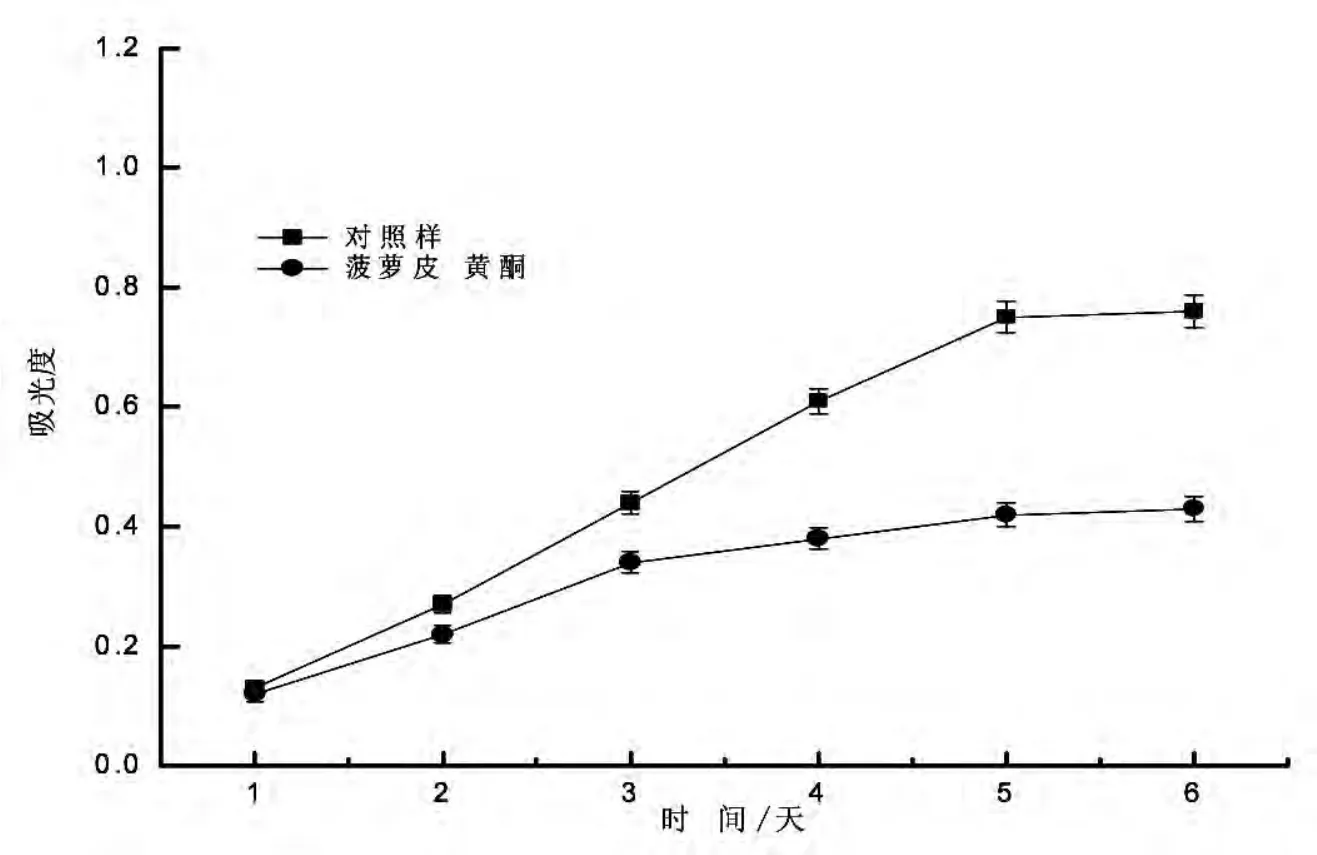
图6 菠萝皮黄酮类化合物抗亚油酸氧化能力
3 结论
超声波辅助提取菠萝皮中黄酮类物质的最优工艺条件为:超声功率600 W,超声时间20 min,料液比为1∶60,乙醇浓度为40%.在此条件下,菠萝皮黄酮提取率可高达2.493%.黄酮类化合物具有抗氧化的生物活性,从菠萝皮中提取的黄酮类化合物具有抗亚油酸氧化能力.
[1]彭程程,王青山,赵国祥.黄酮类化合物的研究进展[J].农产品加工(学刊),2010(5):38-41.
[2]王威.黄酮类食用天然色素抗氧化活性的研究[J].食品科学,2001,22(15):26-28.
[3]李巧玲,陈学武.微波条件下提取天然色素的研究[J].食品工业科技,2002,23(6):28-31.
[4]张德权,台建祥,付勤.生物类黄酮的研究及应用概况[J].食品与发酵工业,2003,5(6):52-58.
[5]李荣,李俊.黄酮类化合物药理活性以及构效关系研究进展川[J].安徽医药,2005,9(7):481-483.
[6]刘明绶.菠萝皮中色素、果胶的提取纯化及性质研究[D].厦门:集美大学,2010.
[7]张文华.菠萝皮黄酮类化合物的结构分析及其生理活性性研究[D].湛江:广东海洋大学,2012.
[8]刘晨.桑黄黄酮研究[D].长春:吉林大学,2011.
[9]马亚琴,叶兴乾,吴厚玖,等.超声波辅助提取植物活性成分的研究进展[J].食品科学,2010,(21):459-463.
[10]Hromadkova Z,Ebringerova A.Ultrasonic extraction of plant materials-investigation of hemicellulose release from buckwheat hulls[J].Ultrasonics Sonochemistry,2003,10:127-133.
[11]刘平怀,刘洋洋,时杰,等.废弃菠萝皮中色素的循环超声波提取及其抗过敏活性[J].精细化工,2010,27(2):165-169.
[12]俞坚.桑叶黄酮类化合物提取、分离鉴定及其抗氧化活性的研究[D].杭州:浙江工商大学,2007.
[13]王芳,高瑜珑,石建雯.菠萝皮黄酮的提取及其稳定性、抗氧化性研究[J].山西农业科学,2014,42(7):672-677,685.
[14]彭长连,陈少薇,林植芳,等.用清除有机自由基DPPH 法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658-661.
