米渣发泡蛋白的理化性质及形态结构
2015-12-19刘珊珊陈季旺
刘珊珊 陈季旺,2 陈 露 高 俊
(武汉轻工大学食品科学与工程学院1,武汉 430023)(农产品加工湖北省协同创新中心2,武汉 430023)
米渣发泡蛋白的理化性质及形态结构
刘珊珊1陈季旺1,2陈 露1高 俊1
(武汉轻工大学食品科学与工程学院1,武汉 430023)(农产品加工湖北省协同创新中心2,武汉 430023)
比较并分析了米渣蛋白(RDP)、脱酰胺米渣蛋白(RDDP)、米渣发泡蛋白(RDFP)的理化性质及形态结构。结果表明在pH 2~12,RDP的溶解度较低,RDDP的溶解度在pH 2~4.5减小,在pH 4.5~12则增加,RDFP的溶解度均高于90%。与RDP相比,RDDP与RDFP的起泡力在pH 8~10分别增加39%与126%以上,且在pH 9.5时分别达到最高值56%和196%。RDP的乳化性稳定,RDDP先减小后增大,RDFP则一直增大。RDDP与RDFP的必需氨基酸总量分别比RDP减少8.29%与7.7%,疏水值分别增加9.14%与30%。RDP、RDDP、RDFP均存在糖蛋白和α-螺旋、β-折叠片等二级结构,且数量依次减少。RDP结构紧密,聚集呈球状,RDDP分裂为相对较小的块状聚集体,RDFP为大块片层结构。RDFP具有良好的发泡性,可以作为一种蛋白质发泡粉用于食品工业。
米渣蛋白 脱酰胺米渣蛋白 米渣发泡蛋白 理化性质 形态结构
蛋白质发泡粉是改善食品起泡性、持泡性的辅料[1],除具有其他发泡粉起泡、增白、乳化的作用,它还具有人体所需的氨基酸,提升了食品感官品质和营养价值[2]。目前国内对蛋白质发泡粉的年需求量为 4 000 t,但每年可提供量仅为 1 000 t[3]。蛋清蛋白和乳清蛋白等是蛋白质发泡粉的主要生产原料,但动物蛋白价格昂贵,生产成本高[4],在应用中受到了一定的限制。米渣是大米制糖、发酵工业中的副产物,含有大米中的大部分蛋白质。我国每年加工大米1.3~1.4亿t,其中,生产淀粉糖等会产生副产品米渣3 000多万t。长期以来米渣仅作为饲料供给养殖业使用,其经济价值未能充分利用,因此将廉价的米渣开发为一种性质优良的蛋白质发泡粉具有现实意义。
米渣中含蛋白质为35%~40%[5],大米制糖过程中高温液化引起的美拉德反应以及蛋白质中高含量的天冬酰胺和谷氨酰胺通过氢键等结合均会使蛋白质聚集、沉淀,导致其溶解度较低[6],限制了米渣蛋白(Rice dreg protein,RDP)的开发利用。目前主要采用化学法[7-9]和生物酶法[10]对 RDP脱酰胺改性以增加其溶解性,使交联的谷氨酰胺和天冬酰胺中的酰胺基转变成羧酸,通过羧化作用减少分子内氢键,增加分子上的负电荷,增强静电排斥作用,提高RDP的溶解度[6]。周小玲等[6]发现大米谷蛋白去酰胺度为52.29%时在中性溶液中溶解度高达96.99%。蛋白酶水解能提高RDP的起泡力和持泡力[11-12],多种蛋白酶组合的复合酶水解能较大程度地使蛋白质分子的疏水性氨基酸暴露,从而提高蛋白质的发泡性[13]。Anderson等[14]用蛋白酶水解大米分离蛋白,发现蛋白质溶液表观黏度显著下降,发泡力和持泡力则增加。吴雨静等[12]用中性蛋白酶水解脱脂脱糖米渣,制备出发泡性能良好的蛋白质发泡粉。潘敏尧[15]研究发现碱性蛋白酶水解RDP制得的蛋白质发泡粉的泡沫特性更好。本研究采用柠檬酸法对RDP脱酰胺制备脱酰胺米渣蛋白(RDDP)及复合酶水解RDDP制备米渣发泡蛋白(RDFP)的条件进行了优化。研究发现蛋白质的泡沫性能与表面疏水性[16]、分子形态结构[17]等紧密相关。
国内外有关米渣蛋白生产发泡粉的研究主要集中在如何提高米渣蛋白的溶解度[7-9]、乳化性[7-9]等,周小玲等[6]研究发现酶法脱酰胺影响了米谷蛋白的二级结构,但有关米渣蛋白的理化性质与形态结构关系的研究,目前还鲜见报道。本研究通过比较分析RDP、RDDP、RDFP的溶解性、发泡性、持泡性和乳化性等理化性质及形态结构,探讨RDFP的理化性质与结构的关系,拟为利用RDP开发蛋白质发泡粉及RDFP在食品工业中的应用提供理论依据。
1 材料与方法
1.1 试验材料与试剂
米渣(蛋白质 59.04%、水分 11.88%、灰分2.64%、脂肪10.27%、糖16.17%):合肥锦泰糖业有限公司;碱性蛋白酶(Alcalase,2.4 AU/g)、复合蛋白酶(Protamex,1.5 AU/g):丹麦诺维信公司;高温α-淀粉酶(α-Amylase,18 700 U/mL):锐阳生物科技有限公司。
1.2 试验仪器
SYC智能超级恒温水浴锅:巩义市英峪予华仪器厂;LCJ.Ⅱ型离心机:上海医用分析仪器厂;TGL-16C台式离心机:上海安亭科学仪器厂制造;FD-1冷冻干燥机:天津仪器公司;LD5-10型离心机:北京医用离心机厂;Delta320精密pH计:梅特勒-托利多仪器(上海)有限公司;L-8900型氨基酸分析仪:日本日立公司;UV-2100紫外可见分光光度计:上海尤尼柯仪器有限公司;SX-40扫描电子显微镜:日本明石公司;红外光谱仪(Nexus):美国 Thermo Nicolet公司。
1.3 试验方法
1.3.1 制备RDP、RDDP和RDFP
米渣按料液比1∶10配成悬浮液,pH调至6.0,加入α-淀粉酶(加酶量 11.7 U/g),60℃水解2.5 h,80℃水洗3次,3 000 r/min离心,喷雾干燥制得RDP(蛋白质71.32%,可溶性氮3.23%,水分7.58%,灰分2.45%,脂肪4.39%,糖14.07%)。
取适量RDP置于酶解罐中,按料液比6∶100加入pH 1.5的柠檬酸溶液,80℃反应3 h,迅速冷却反应液,4 000 r/min离心10 min,上清液经截留相对分子质量为3 000的膜超滤及喷雾干燥即得RDDP(蛋白质 80.92%,可溶性氮 29.74%,水分8.53%,灰分2.85%,脂肪2.13%,糖5.39%);称取0.5 g RDDP样品,加5 mL 2 mol/L盐酸,抽真空封于硬质玻璃管中,在115~125℃下水解3 h,水解完毕取出,待冷后打开玻璃管,20 g/L的硼酸吸收氮并测定酰胺氮含量,计算脱酰胺度(脱酰胺度58.49%)。
配制10%的RDDP溶液,将pH调至8.0,取适量置于酶解罐中,边搅拌边加入碱性蛋白酶(加酶量24 AU/kg),40℃反应100 min,加入同等体积的复合蛋白酶(加酶量15 AU/kg),40℃反应80 min,在反应过程中不断加入酸或碱,维持pH 8.0±0.1,至反应结束。沸水浴20 min,灭酶,4 000 r/min离心15 min,得上清液即为RDFP(蛋白质84.15%,可溶性氮96.43%,水分7.63%,灰分2.28%,脂肪1.14%,糖4.72%)。
1.3.2 溶解度的测定
准确称量1.000 g样品溶于100 mL水中,在磁力搅拌器上以300 r/min的转速搅拌,用1.0 mol/L HCl或NaOH迅速调至预定pH,搅拌30 min使样品充分溶解。搅拌结束后4 000 r/min离心15 min,吸取上清液,采用半微量凯氏定氮法测定上清液中氮含量,计算溶出的蛋白质含量。分别测定RDP、RDDP、RDFP的溶解度,分析溶解度的变化。
1.3.3 起泡力及持泡力的测定
配制1%质量浓度蛋白溶液100 mL(V0),用2 000 r/min的速度搅拌10 min,停止搅拌并迅速倒入1 L量筒记录液体和气泡的总体积(V1),30 min后再次记录溶液和气泡的总体积(V2),起泡力、持泡力的计算见式(1)、式(2)。

1.3.4 乳化性的测定
配置5%蛋白质溶液15 mL,加入15 mL食用油,10 000 r/min均质1 min,移至50 mL带刻度离心管中,于2 000 r/min的转速下离心5min,测量离心管中液体的乳化层高度。乳化性计算见式(3)。
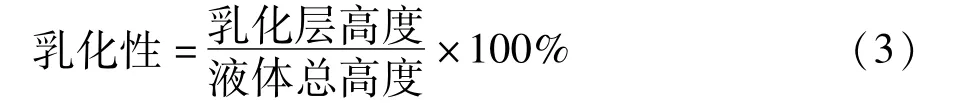
1.3.5 氨基酸组成的分析
准确称取1.000 g样品,移入玻璃试管中,加入15 mL 6 mol/L HCl,然后将试管抽真空充氮气封管,放在108℃恒温干燥箱内水解22 h,待冷却后,定容至25 mL,吸取滤液100μL于40℃真空干燥器中进行干燥,用0.2 mol/L HCl定容至1 mL。采用氨基酸分析仪测定氨基酸含量。
1.3.6 疏水值的计算
根据各氨基酸的疏水值、RDP、RDDP、RDFP的氨基酸组成和含量,计算出RDP、RDDP、RDFP的平均疏水性值,计算公式见式(4)、式(5)。

式中:AAi为100 g蛋白质中每种氨基酸的质量/g;Mi为各种氨基酸的摩尔质量/g/mol;∑AAi/Mi为100 g蛋白质中氨基酸的总摩尔数/mol;Δfti为氨基酸侧链疏水值/kJ/mol;Q为蛋白质的疏水值。
1.3.7 红外光谱
用无水酒精将研钵、镊子、压片等用具擦试干净,置红外灯下照射以使酒精快速挥发干燥。在研钵中加入适量KBr粉末,按照约1∶10的比例分别加入RDP、RDDP、RDFP样品,充分研磨混匀,压片,压片尽量薄而透明,以保证较高的透光率。用傅立叶变换红外光谱仪测定红外吸收光谱图,以KBr粉末作为空白背景,设定分辨率4 cm-1,扫描次数为16次,全波长(4 000~500 cm-1)扫描。
1.3.8 扫描电子显微镜
对RDP、RDDP和RDFP进行干燥预处理,采用扫描电子显微镜观察RDP、RDDP、RDFP的表面微观形态。剪取适当大小静电双面胶置于扫描电镜载物台,挑取少量样品均匀洒在双面胶带上,用洗耳球吹去多余的粉末。将电镜载物台放入镀金器中进行高温喷碳镀金,设定电子枪加速为15 kV,扫描样品表面结构,选择合适的放大倍数扫描拍照。
2 结果与分析
2.1 溶解性
对RDP、RDDP和RDFP在 pH 2~12范围内的溶解度进行测定,结果见图1。由图1可以看出,在pH 2~12范围内,RDP的溶解度较小且随pH变化不明显,当pH大于10.0时,溶解度略有增加,这是因为RDP中的部分谷蛋白溶于碱性溶液;RDDP的溶解度随着pH的增加先减小后增加,在pH 4.5左右达到最低值18.7%,可能是因为pH 4.5是大米谷蛋白的等电点,此时相对分子质量较大的谷蛋白发生聚沉;RDFP的溶解度高于90%且随pH变化不大,说明RDFP具有较好溶解性,且受pH影响较小。在同一pH条件下,RDP、RDDP和RDFP的溶解度依次增加,RDDP的溶解度增加是RDP脱酰胺反应中酰胺键因羧化作用减少了分子内氢键,增加分子上的负电荷,增强了静电排斥作用等[6];RDFP的溶解度进一步提高可能是复合蛋白酶将部分RDDP降解成小分子寡肽。
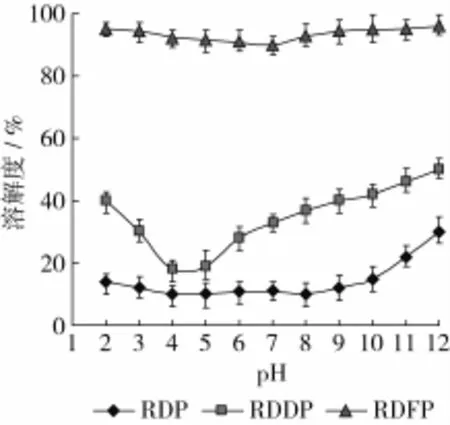
图1 RDP、RDDP和RDFP的溶解度
2.2 起泡力和持泡力
不同pH条件下RDP、RDDP和RDFP的起泡力和持泡力变化分别见图2和图3。由图2和图3可知,在pH 8~10范围内,随着pH的增大,RDP、RDDP和RDFP的起泡力逐渐增加,持泡力略有减小。与RDP相比,RDDP与RDFP的起泡力在pH 8~10范围内分别增加39%与126%以上,且在pH 9.5时最高分别达到56%和196%,可能是pH既影响蛋白质的溶解度,同时又影响了蛋白质的柔性和表面疏水性,pH越大分子所带静电荷越多,起泡力增大[13];在同一pH条件下,RDP、RDDP和RDFP的起泡力和持泡力均依次增高,可能与蛋白质的溶解度有关。蛋白质的起泡力是指蛋白质溶液形成气-液界面薄膜并包容大量气泡的能力。当一定浓度的蛋白质溶液受到急速搅拌时,气泡混入形成大量的气-液界面,吸附到界面的蛋白质分子降低了界面张力,进一步促进界面的形成,同时蛋白质肽链间的相互作用形成的二维网络加强了界面膜,有利于泡沫的形成和稳定[13],因此在pH 8~10范围内,蛋白质溶解度越大起泡力和持泡力越大。

图2 pH对RDP、RDDP、RDFP起泡力的影响

图3 pH对RDP、RDDP、RDFP持泡力的影响
2.3 乳化性
不同pH条件下RDP、RDDP和RDFP的乳化性变化见图4。由图4可以看出,在pH 2~12范围内,随着pH增加,RDP的乳化性变化不明显且均小于20%;RDDP的乳化性先减小后增大,在pH 4附近达到最低值37%;RDFP的乳化性则一直增加,当pH大于4时,RDFP乳化性最大。蛋白质乳化性取决于溶解度和疏水值[18],结合图1分析,pH 4.5是大米谷蛋白的等电点,其溶解度最小,因而RDP和RDDP的乳化性均在此时达到最低值。当pH>4.5,蛋白质乳化性随着pH的增加而增大,可能是脱酰胺作用使得大量基团(包括亲水基团和疏水基团)暴露出来从而增加了蛋白质的溶解度和表面疏水性,使得蛋白质的亲水性-疏水性达到乳化平衡从而提高其乳化性[19]。在相同pH条件下,RDFP的乳化性最好,这是因为在脱酰胺的基础上进一步酶解蛋白,使得蛋白质空间结构发生变化,分子链被水解变短,亲油性随着油水界面可利用的寡肽含量增加而增加[19],同时,蛋白质分子表面电荷数量增多,阻止了油滴的相互靠近,总体表现为乳化性提高。

图4 pH对RDP、RDDP和RDFP乳化性的影响
2.4 氨基酸组成和疏水值
RDP、RDDP和RDFP的氨基酸组成、含量和疏水值见表1。由表1可以看出RDP、RDDP和RDFP的氨基酸含量略有不同。RDDP的必需氨基酸较RDP减少8.29%,RDFP较RDDP增加0.65%。与RDP相比,RDDP、RDFP的疏水性氨基酸含量分别增加0.21%和减少0.13%,疏水性氨基酸含量基本不变。RDP、RDDP和RDFP中,能够赋予产品可口味道的香味氨基酸(包括天冬氨酸和谷氨酸)[20]含量均较高,其中RDFP中天冬氨酸和谷氨酸分别占11.7%和20.0%,这一特征使得RDFP更好的应用于食品工业。
RDP经脱酰胺、酶解,RDP、RDDP、RDFP的疏水值分别为 3.50、3.82、4.55 kJ/mol;与 RDP相比,RDDP、RDFP的疏水值分别增加9.14%与30.00%。这是因为脱酰胺和酶解破坏了蛋白分子致密的空间结构,包埋在分子内部的疏水基团部分暴露出来,引起蛋白质的疏水性增加。结合2.1、2.2和2.3分析结果发现,米渣蛋白的带电氨基酸含量、疏水性及其溶解度均增加,可能是脱酰胺和酶解增加了蛋白质的表面电荷数量和疏水性,当蛋白质的亲水性-疏水性达到乳化平衡时[21-22],米渣蛋白发泡性能最佳。
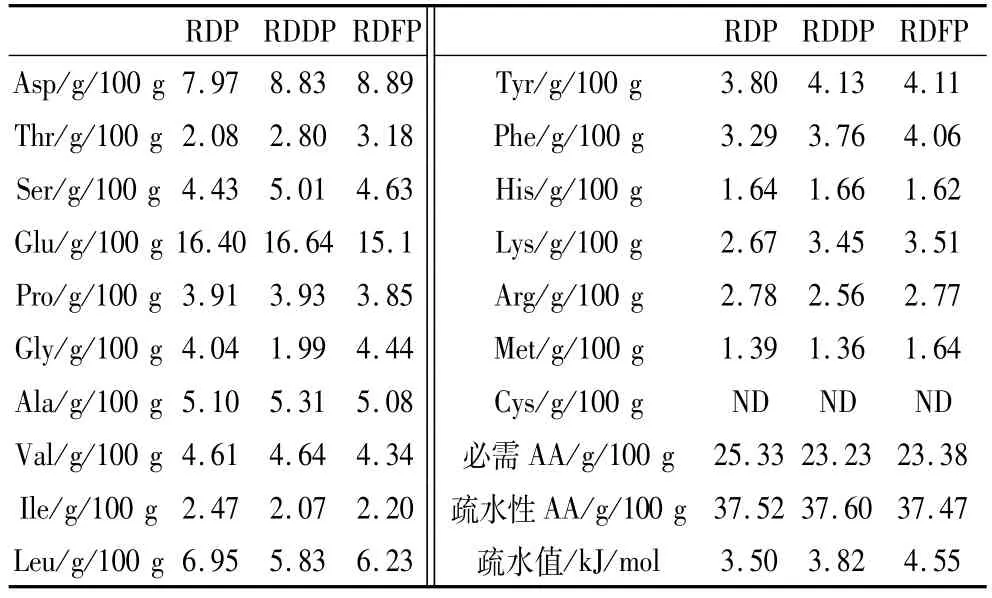
表1 RDP、RDDP和RDFP的氨基酸组成、含量和疏水值
2.5 红外光谱
利用傅里叶变换红外光谱分析仪分析RDP、RDDP、RDFP的二级结构,结果见图5。当蛋白质与糖分子通过共价结合后会出现羟基增加的典型特征,即在红外图谱的3 700~3 200 cm-1范围内出现较宽的吸收峰,在1 260~1 000 cm-1范围内也会出现吸收[23]。RDP的FTIR图谱中有波数为3 293.83 cm-1和1 655.73 cm-1的糖环特征吸收峰,分别由糖分子内或分子间氢键及醛基、酰氨基团中的C==O伸缩振动或—NH2中的 N—H变角振动所引起[18]。另外,图5中波数为1 079.43 cm-1的吸收峰是糖分子中C—O—C基团的伸缩振动引起,也是糖环存在的特征吸收峰。RDDP和 RDFP分别在3 415.40和3 385.23 cm-1有吸收峰,且强度略高于 RDP,表明RDDP和RDFP均存在糖分子内或分子间氢键;RDDP和RDFP分别在1 641.47和1 654.65 cm-1有吸收峰[24],进一步说明糖环存在;RDDP、RDFP分别在1 048.10和1 047.26 cm-1有吸收峰,但各峰均弱于RDP,说明RDDP、RDFP中存在糖环基团但糖含量均低于RDP,因此脱酰胺和酶解作用在一定程度上破坏了糖与蛋白质的结合,降低了含糖量。米渣蛋白的溶解性增加伴随着糖含量的减少,糖蛋白含量影响了米渣蛋白的溶解性。
根据表2对酰胺Ⅰ带的谱峰进行分析,波数在1 650~1 658 cm-1范围处为α-螺旋,在1 610~1 640 cm-1范围处为β-折叠片,其中峰面积代表其含量;酰胺Ⅲ带振动区域:1 290~1 340 cm-1为α-螺旋,1 255~1 288 cm-1范围处为无规卷曲,1 181~1 248 cm-1范围处为 β-折叠片[25]。图 5中显示RDP、RDDP和RDFP在1 650~1 658 cm-1范围有强吸收峰、1 610~1 640 cm-1范围无吸收峰、1 181~1 248 cm-1范围有弱吸收峰,且RDP、RDDP和RDFP峰面积逐渐减小,表明柠檬酸脱酰胺和复合酶水解减少米渣蛋白的二级结构数量,α-螺旋、β-折叠片等二级结构数量的变化影响了米渣蛋白的理化性质。

表2 蛋白质酰胺的红外吸收特征频率表
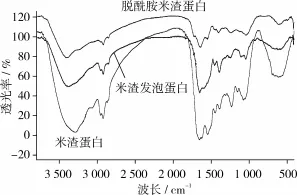
图5 RDP、RDDP和RDFP的傅里叶变红外光谱
2.6 扫描电子显微镜
采用扫描电子显微镜观察RDP、RDDP、RDFP的形态结构,结果见图6。从图6中可以看出,RDP结构紧密,形成聚集球状(图6a);经过脱酰胺处理后球状结构开始分裂形成相对较小的块状,仍部分保留有蛋白质分子聚集状态(RDDP,图6b);RDDP经过复合酶组合酶解后聚集状态彻底破坏,形成大块片层结构(RDFP,图 6c),这与 Miwa等[26]研究脱酰胺处理脱脂牛奶后蛋白质分子结构变化类似。蛋白质分子结构和聚集状态的改变影响了RDP、RDDP和RDFP理化性质。

图6 RDP、RDDP和RDFP的扫描电子显微镜外观图
3 结论
本研究比较了RDP和脱酰胺及2种蛋白酶分步水解制备的RDDP、RDFP的理化性质及形态结构,结果表明RDFP易溶,起泡力、持泡力高,乳化性强,带电氨基酸含量及疏水性增加,可以作为一种良好的蛋白质发泡粉开发利用。FTIR和SEM试验结果表明糖蛋白含量影响米渣蛋白的溶解性,柠檬酸脱酰胺和复合酶水解减少了米渣蛋白的α-螺旋、β-折叠片等二级结构数量,二级结构数量及形态的变化影响了RDP、RDDP和RDFP理化性质。
[1]李和平,李梦琴.新型食品添加剂玉米蛋白发泡粉的研制[J].郑州粮食学院学报,1998,19(1):33-37
[2]吴亚梅,陈健,李维锋.玉米蛋白粉深加工应用的新进展[J].现代食品科技,2007,23(4):97-100,88
[3]吴雨静.米渣发泡蛋白制备工艺的研究[D].合肥:安徽农业大学,2012
[4]夏剑秋,王敏.大豆蛋白发泡粉的酶法提取工艺技术[J].中国油脂,2007,32(11):47-48
[5]王亚林,陶兴无.应用纤维素酶解和酸洗法从米渣中提取蛋白质的研究[J].中国酿造,2003,2:24-25
[6]周小玲,刘永乐,李向红,等.蛋白质谷氨酰胺酶对米谷蛋白的分子结构及功能性质的影响[J].中国食品学报,2010,10(5):98-105
[7]Qiu C,Sun W,Cui C,et al.Effect of citric acid deamidation on in vitro digestibility and antioxidant properties of wheat gluten[J].Food Chemistry,2013,141(3):2772-2778
[8]Liao L,Qiu C,Liu T,et al.Susceptibility of wheat gluten to enzymatic hydrolysis following deamidation with acetic acid and sensory characteristics of the resultant hydrolysates[J].Journal of Cereal Science,2010,52(3):395-403
[9]Liao L,Liu T,Zhao M,et al.Functional,nutritional and conformational changes from deamidation of wheat gluten with succinic acid and citric acid[J].Food Chemistry,2010,123(1):123-130
[10]李向红,周小玲,刘永乐,等.蛋白质谷氨酰胺酶对米谷蛋白功能性质的影响[J].食品科学,2010,17:192-196
[11]纪崴.酶法及美拉德反应改进大米蛋白功能性质的研究[D].无锡:江南大学,2009
[12]吴雨静,杜先锋.响应面法优化米渣发泡蛋白制备工艺的研究[J].中国粮油学报,2012,27(9):96-101
[13]王章存,姚惠源.米渣蛋白的制备及其酶法水解研究[D].无锡:江南大学,2005
[14]Anderson A,Hettiarachchy N,Ju Z Y.Physicochemical properties of pronase treated rice glutelin[J].Journal of the American Oil Chemists'Society,2001,78(1):1-6
[15]潘敏尧.大米浓缩蛋白的研制及蛋白质改性的研究[D].杭州:浙江大学,2006
[16]Báez G D,Moro A,Ballerini G A,et al.Comparison between structural changes of heat-treated and transglutaminase cross-linked beta-lactoglobulin and their effects on foaming properties[J].Food Hydrocolloids,2011,25(7):1758-1765
[17]Talansier E,Loisel C,Dellavalle D,et al.Optimization of dry heat treatment of egg white in relation to foam and interfacial properties[J].LWT-Food Science and Technology,2009,42(2):496-503
[18]Zhao Q,Selomulya C,Xiong H,et al.Comparison of functional and structural properties of native and industrial process-modified proteins from long-grain indica rice[J].Journal of Cereal Science,2012,56(3):568-575
[19]Mirmoghtadaie L,Kadivar M,Shahedi M.Effects of succinylation and deamidation on functional properties of oat protein isolate[J].Food Chemistry,2009,114(1):127-131
[20]Zhao Q,Xiong H,Selomulya C,et al.Enzymatic hydrolysis of rice dreg protein:effects of enzyme type on the functional properties and antioxidant activities of recovered proteins[J].Food Chemistry,2012,134(3):1360-1367
[21]高育哲,徐红华,黄占权.定位酶解与蛋白质表面性质及结构特性关系研究进展[J].粮食与油脂,2008(2):7-9
[22]Paraman I,Hettiarachchy N S,Schaefer C,et al.Glycosylation and deamidation of rice endosperm protein for improved solubility and emulsifying properties[J].Cereal Chemistry,2007,84(6):593-599
[23]Makri E A,Doxastakis G I.Surface tension of phaseolus vulgaris and coccineus proteins and effect of polysaccharides on their foaming properties[J].Food Chemistry,2007,101(1):37-48
[24]刘斌,马海乐,李树君,等.超声波处理对脱脂麦胚分离蛋白结构的变化研究[J].光谱学与光谱分析,2011,31(8):2220-2225
[25]阎隆飞,等.蛋白质分子结构[M].北京:清华大学出版社,1999
[26]Miwa N,Yokoyama K,Wakabayashi H,et al.Effect of deamidation by protein-glutaminase on physicochemical and functional properties of skim milk[J].International Dairy Journal,2010,20(6):393-399.
Physicochemical Properties and Morpological Structure of Rice Dreg Foaming Protein
Liu Shanshan1Chen Jiwang1,2Chen Lu1Gao Jun1
(College of Food Science and Engineering,Wuhan Polytechnic University1,Wuhan 430023)(Hubei Collaborative Innovation Center for Processing of Agricultural Products2,Wuhan 430023)
Physicochemical properties and morphological structure of rice dreg protein(RDP),rice dreg decarboxamidation protein(RDDP)and rice dreg foaming protein(RDFP)had been investigated.Solubility of RDP was low and stable at pH 2~12,solubility of RDDPdecreased at pH 2~4.5 then increased at pH 4.5~12 and solubility of RDFP was more than 90%.Compared to RDP,foaming force of RDDP and RDFP increased of more than 39%and 126%at pH 8~10 respectively and reached the maximum56%and 196%at pH 9.5 respectively.Emulsibility of RDP was stable and emulsibility of RDDPfirstly decreased and then increased,while that of RDFP increased.Total amount of essential amino acid of RDDP and RDFP decreased 8.29%and 7.7%respectively and the hydrophobicity increased 9.14%and 30%respectively.There was some glycoprotein and secondary structure for-helix and-strand in RDP,RDDP,and RDFP,meanwhile the quantity decreased successively.RDP presented closely as aggregate ball,RDDPbecame much smaller clumpy aggregations,and RDFPbecame a large piece of layer structure.The results indicated that RDFP might be used as a promising protein foam powder ingredient in food industry for its excellent physicochemical properties.
rice dreg protein,rice dreg decarboxamidation protein,rice dreg foaming protein,physicochemical properties,morphological structure
TS209
A
1003-0174(2015)04-0033-06
湖北省教育厅优秀中青年人才项目(Q20091808),武汉工业学院2001年研究生创新基金(2011CX012)
2013-12-19
刘珊珊,女,1988年出生,硕士,粮食、油脂及植物蛋白工程
陈季旺,男,1970年出生,教授,粮食、油脂及植物蛋白工程
