溶剂萃取耦合FTIR技术快速分析食用油中微量水分的研究
2015-12-19杨志成叶建晨孟祥河
杨志成 叶建晨 叶 沁 孟祥河
(杭州粮油中心检验监测站1,杭州 310009)(温州市药品检验所2,温州 325028)(浙江工业大学海洋学院3,杭州 310018)
溶剂萃取耦合FTIR技术快速分析食用油中微量水分的研究
杨志成1叶建晨2,3叶 沁3孟祥河3
(杭州粮油中心检验监测站1,杭州 310009)(温州市药品检验所2,温州 325028)(浙江工业大学海洋学院3,杭州 310018)
研究应用溶剂萃取耦合傅里叶红外光谱(FTIR)技术建立快速分析食用油中微量水分的方法。数据显示乙腈是最佳萃取溶剂,其起始含水量<300μg/g时对乙腈的萃取能力无明显影响。乙腈/油脂比例为1.5~2∶1效果较佳,定量基于差谱的二阶导数明显优于差谱,对于萃取水分的乙腈波谱中HOH弯曲振动1 631 cm-1最优,灵敏度高于OH伸缩振动3 630 cm-1和3 541 cm-1。对所有测试样品,FTIR法的结果与标准卡尔费休法高度一致,并表现出优良的准确性和精确性(标准差~30,变异系数3%)。研究表明溶剂萃取耦合FTIR快速分析食用油中微量水分切实可行。
微量水分分析 傅里叶红外光谱 溶剂萃取 乙腈 食用植物油
水分是油脂的重要品质参数,不仅影响油脂的精炼,而且与储藏稳定性密切相关。通常油脂中含水量为0.05%~0.3%,但从油脂加工方面考虑含水量应低于0.1%,通常为0.05%[1]。较高的水分易引起油脂水解产生脂肪酸,不仅易于氧化,且有利于微生物生长繁殖,进一步造成烟点降低、异味及小分子酸、醛产生等问题[2]。
关于食用油含水量分析,AOCS有一系列标准方法,但各有利弊。如干燥法简单但不精确,共沸蒸馏法较准确,但灵敏度不足,不适合分析含水量小于0.05%的样品[3]。目前最权威的含水量分析方法是卡尔·费休法,适合于含水量1~25 000μg/g的样品。其缺点是水分以外潜在的成分会消耗滴定试剂产生水分,影响滴定终点及准确定量。此外,由于KF试剂多样性和仪器差异性,尽管在标准条件同一实验室内KF法重现性很好,但不同实验室间的结果差异性显著,使得检测结果难以比较[4-5]。
FTIR光谱法具有高效、快速、准确及环境友好的特点,作为传统化学法的替代,目前已用于食用油酸价、碘价、过氧化物值的自动分析[6-8]。Chen-Man等[9]基于3 600~3 200 cm-1OH伸缩振动吸收带,采用衰减全反射(ATR)技术分析了原棕榈油的含水量,并尝试应用于棕榈油来源皂中含水量分析。Van等[10]在润滑油中添加二甲氧丙烷使水分定量生成丙酮,采用FTIR透射光谱技术测定生成丙酮的V(CO)吸收,间接地反映含水量。Filgueiras等[11]采用FTIR/ATR结合 PLS在3 200、3 650 cm-1、1 650 cm-1附近和900 cm-1以下波数测定石油中的含水量。FTIR光谱法虽然研究已较多,但仍然存在问题:1)研究样品含水量仍相对较高,存在基质吸收问题;2)检测精密度高的方法较少,且只适合成分单一的矿物基润滑油;3)建立精确定量模型需要大的样本容量。基于这些问题及国内油脂工业的需求,建立一个高效、快速、准确的食用油微量水分分析方法十分必要。本研究以大宗植物油代表精炼大豆油、卡诺拉油为研究对象,以乙腈、二甲亚砜、甲醇、乙醇为萃取溶剂,采用有机溶剂萃取耦合FTIR光谱分析技术,研究其在快速分析食用油中微量水分的能力,以期为食用油的精炼、加工、贮藏技术的改进及品质提升提供一定的参考和技术保证。
1 材料与方法
1.1 试验材料与仪器
精炼大豆油,卡诺拉油:市售;光谱级乙腈、二噁烷、二甲亚砜、乙醇、甲醇:美国Sigma-Aldrich公司;4Å分子筛:上海化学试剂有限公司,开封后加入经280℃预干燥5 h,于干燥环境下保藏;FTIR光谱仪:加拿大Bomem公司;光程1 000μm CaF2,311μm的ZnSe流动透射样品池:美国加菲尔德国际晶体实验室;卡尔费休滴定仪:上海雷磁KLS-411型微量水分分析仪。
1.2 方法
1.2.1 标准含水量油脂的制备
取适量精炼大豆油、菜籽油,添加20%的4Å分子筛(经280℃预干燥5 h)密封干燥至少15 d,得到“干”油。然后以“干”油为基础,定量添加纯水得到一系列准确含水量的标准品。为使添加的水分能均匀分散于食用油中,试验采用能与油/水均互溶且波谱简单不干扰水分特征峰的二噁烷作为介质。饱和油脂的制备采用外加过量水与食用油剧烈混合,静置2周,3 000 r/min离心10 min,取上相密封保藏备用。
1.2.2 标准曲线的制备
分别取Sigma光谱级乙腈,二甲亚砜,甲醇,乙醇等纯溶剂,采用1 055μm CaF2样品池,记录原始波谱S_0,扫描次数32,分辨率0.5 cm-1,波谱范围4 000~400 cm-1。同时分别取各种溶剂适量,添加纯水得到20、50、100、200、500、1 000、1 500、2 000μg/g的相应溶剂的水溶液,记录系列标准样品的波谱S_std,然后做波谱减法运算即S_std-S_0得到差谱系列S_dif,接着对差谱进行二阶求导(5,5差分法),并放大10 000倍,得到差谱的二阶导数图谱S_2ndder。分别测量系列差谱S_dif和系列二阶导数图谱S_2ndder 1 590~1 700 cm-1间最大吸收峰的强度(H-O-H弯曲振动),将其与含水量相关,得到相应萃取溶剂的水分标准曲线。
1.2.3 卡尔费休法(KF)水分分析
参见文献[12]。
1.2.4 FTIR分析样品含水量方法及操作流程图
分别准确移取10 mL标准含水量的油脂或样品油于30 mL具塞玻璃管中,称重(准确至0.000 1 g),添加20 mL萃取溶剂,记录溶剂的质量(准确至0.000 1 g),密封,剧烈混合萃取 1 min,静置 30~60 min或4 000 r/min离心10min,取上相(溶剂层),采用1 055μm CaF2样品池记录4 000~400 cm-1红外光谱S3。另外同样记录萃取“干”油的溶剂光谱S2,操作流程如图1所示。然后对差谱 S4进行二阶求导(5,5差分法),并放大10 000倍,得到差谱的二阶导数图谱S_2ndder。测量系列二阶导数图谱S_2ndder 1 590~1 670 cm-1间最大吸收峰的强度,带入标准曲线,再结合稀释倍数即可换算出原始样品中的含水量。
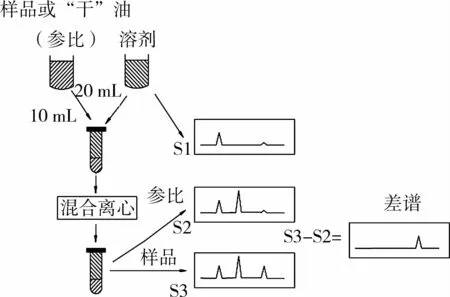
图1 溶剂萃取/FTIR分析食用油中水分流程图
1.2.5 方法精确性和重现性的评价
分析方法的精确性分别采用2个水平标准含水量的菜籽油和大豆油评价,每个样品做5个平行样,对比FTIR法水分测量值与标准添加值。精确性以所有测定油间的标准差和相对标准差表示。重现性以每隔1 d(共5次)水饱和大豆油含水量的标准差和相对标准差表示。
2 结果与讨论
2.1 红外谱图的分析
图2a为典型的乙腈及萃取油脂水分后乙腈的光谱图。乙腈中水分的吸收峰主要集中在2个区域,吸收强度较强的OH伸缩振动3 616、3 652及3 541 cm-1及吸收强度较弱的HOH弯曲振动1 631 cm-1(局部放大见图2b),当含水量较高时,由于氢键的作用,3 616、3 652 cm-1两峰合并为 3 630 cm-1。纯的萃取溶剂乙腈在这些区域没有明显的吸收,2 070 cm-1是乙腈C-N吸收的倍频峰。萃取油脂水分的乙腈的波谱除特征峰外,1 739 cm-1处亦有一定吸收,波谱鉴定表明该吸收峰为γ(CO),说明有少量的甘油三酯被萃取进入萃取相(由于精炼油中游离脂肪酸较少(<0.05%),加之1 702 cm-1处(-COO)没有明显的吸收,因此来自游离脂肪酸的可能性很小)。当基于2 070 cm-1作波谱减(S2-S1)得到减波谱S4(图2c)。S4中2 070 cm-1处吸收消失,可以判断萃取剂乙腈及其起始水分的波谱贡献已被扣除,而1 739 cm-1处油脂吸收也接近基线,表明因油脂共萃取带来的波谱贡献也基本消除。因此可以认为1 631 cm-1处的吸收基本来自样品的水分。根据减波谱或其二阶导数波谱(S5,图2c)可方便地得到乙腈萃取前后的含水量变化,进而求得原始样品的含水量。这里值得一提的是,二阶导数波谱中相邻水分伸展峰拆分更清晰,峰形尖锐,峰宽变窄容易测量,而且一定程度消除了因碳氢链吸收引起的基质吸收,因此可明显改善分析的准确度。
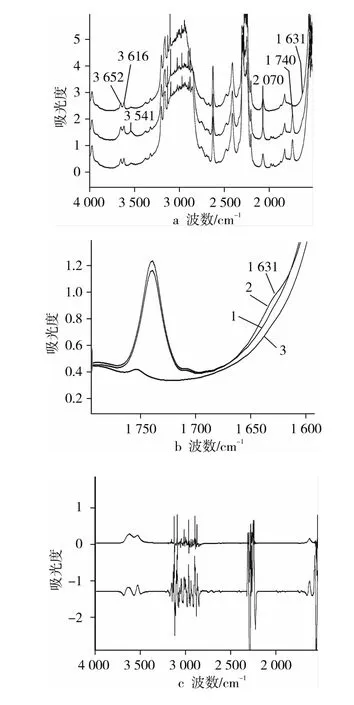
图2 乙腈萃取FTIR分析大豆油中水分的典型红外图谱及解释
2.2 基于不同溶剂的水分标准曲线的建立
符合适宜的溶剂的条件,首先应该能与水混溶,对水分有充足的萃取力(强极性)以保障水分的完全萃取,同时对萃取油脂的溶解度尽量低,以减少波谱干扰。此外在水分定量特征峰处应无干扰,溶剂中水分吸收强度应适中,满足比尔定律的范围。据此比较了表1中所列的4种极性溶剂。
由于在1 055μm样品池下,二甲亚砜、甲醇、乙醇水分吸收过强,信号与浓度不成比例,故改为311 μm样品池。分析结果表明这4种溶剂的水分标准曲线均表现出优良的线性关系,但考虑到乙腈可使用长光程的样品池(1 055μm光程长,光谱灵敏度高),而且基本不受氢键影响(或影响较小),因此认为其为较佳的溶剂。对于定量用的波谱来讲,基于二阶导数图谱的标准曲线精密度明显优于差谱(甲醇除外),二阶导数可使峰锐化,利于峰拆分,此外还可部分消除基质吸收,因此表现出较高的分析精密度。以乙腈为萃取剂时的水分标准曲线,不论基于3 541、3 620 cm-1处 OH伸展振动还是 1 631 cm-1弯曲振动峰定量,其方差均小于10,表现出优良的精密度,尤其测定二阶导数图谱1 631 cm-1弯曲振动峰所得标准曲线的标准差仅为3.3,故后续试验均采用标准曲线“H2O(μg/g)=15.04Abs+4.10”。
2.3 不同萃取比例对分析准确度的影响
以不同比例乙腈萃取分析含水量分别为285.02 μg/g及1 005μg/g的大豆油,相关结果列于表2。在乙腈萃取能力充分的前提下,萃取比例通常不会影响分析的准确性。对于高含水量的大豆油(1 005 μg/g),萃取比例对分析结果影响较小,乙腈/大豆油体积比从0.5∶1提高到10∶1,测得的含水量均在可接受的误差范围内。而对于低含水量的样品,虽萃取比例增加,结果的误差逐渐增大,这可能是因为本方法是根据萃取溶剂萃取前后含水量之差计算样品的含水量,当萃取比例增大时即萃取溶剂的质量相对于被萃取的油脂样品非常大,而样品中含水量又很低,这时萃取的水分不会显著改变萃取溶剂的水分浓度,因此萃取溶剂微小的变化就会造成分析结果较大的误差。综合考虑乙腈、油脂的比例以1.5∶1~2∶1为宜。
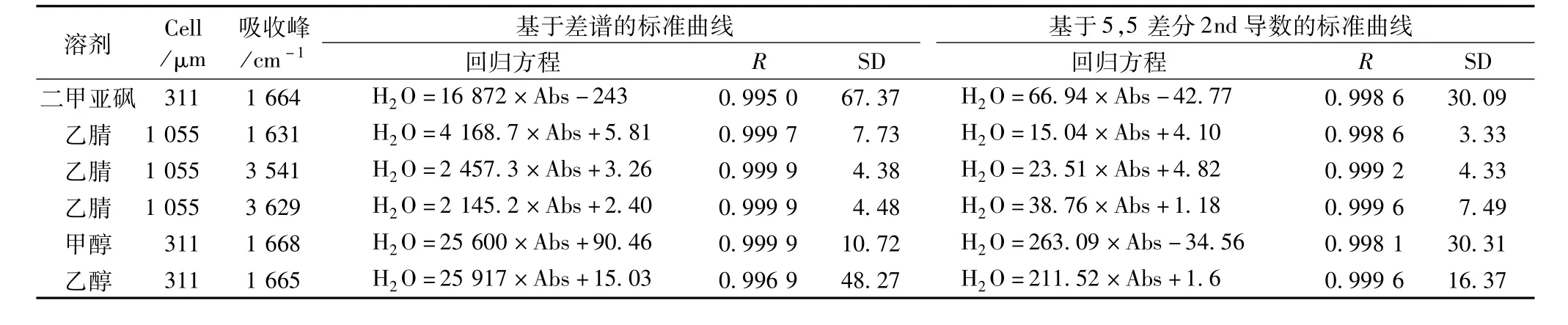
表1 基于不同溶剂萃取及不同波谱处理的标准曲线
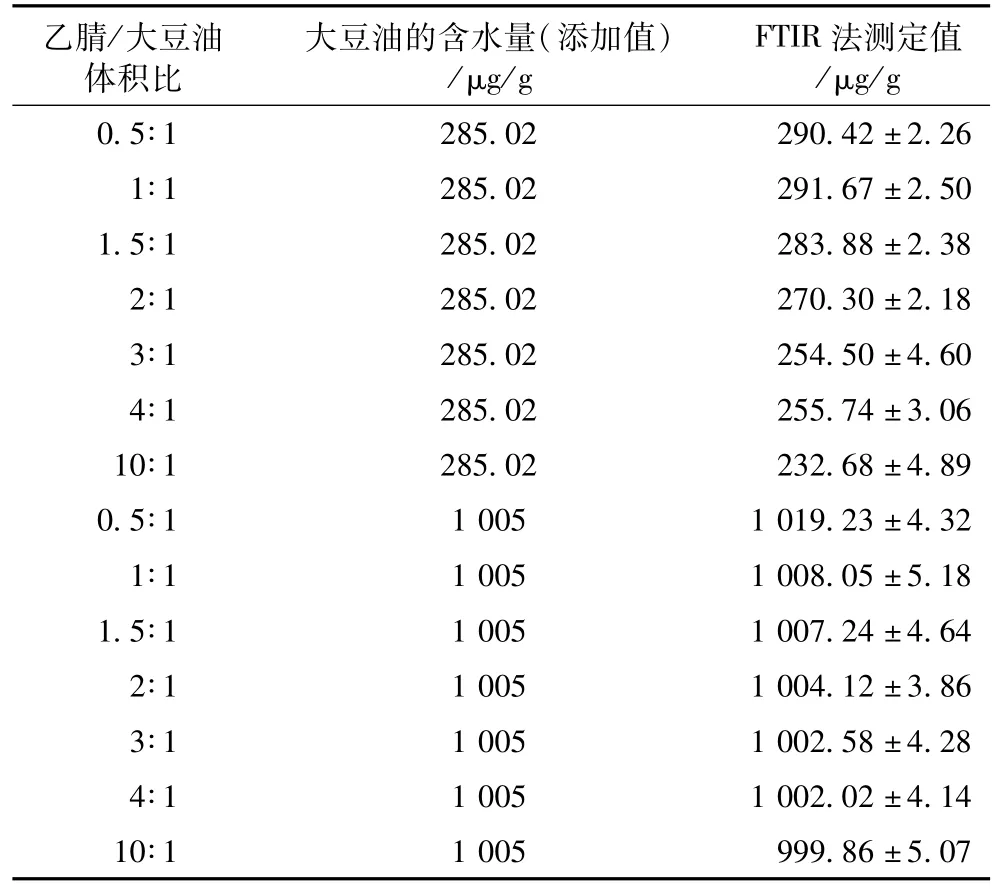
表2 萃取比例的影响
2.4 乙腈起始含水量的影响
以不同起始含水量的乙腈萃取分析含水量分别为40.6μg/g及1 005μg/g的大豆油,考察其萃取能力。乙腈/大豆油体积比2∶1,每个样品独立分析3次,试验结果如表3所示。
结果表明,萃取剂乙腈的起始含水量在25~250 μg/g之间,对其萃取能力及分析的准确性没有明显的影响。商业上的色谱级乙腈水分一般在100μg/g左右,采用密闭干燥措施很容易保持其湿度,因此可完全满足作为水分萃取剂使用。

表3 萃取剂乙腈起始含水量的影响/μg/g
2.5 FTIR法的准确性及精确性研究及其与卡尔费修法的比较
试验以食用油市场上大宗的大豆油和菜籽油为例,考察了乙腈萃取结合FTIR分析方法的有效性并与经典的卡尔费休法做对比,结果分别列于表4、表5中。对不同含水量的大豆油、菜籽油5次独立分析的结果表明,不论菜籽油、大豆油,低水分样品还是高水分样品,FTIR法和KF法的测定结果均表现出良好的一致性,同时与标准值亦十分接近,显示出良好的准确性及可重复性。这不仅说明光谱测量的优良稳定性,还表明乙腈萃取及波谱减运算高度的精确性和可重复性。FTIR法较小的标准差(<10)和相对标准差(3%),表明FTIR法的精密度要略优于卡尔费休法(标准差11.68~32.12,相对标准差2.85~5.6%),尤其测量低含水量样品时,FTIR优势明显。
对水饱和样品(浓度未知)分析的时间重现性表明,FTIR法分析结果较为稳定,其相对标准差分别为3.23和3.08,略低于KF组,显示出优良的重现性。
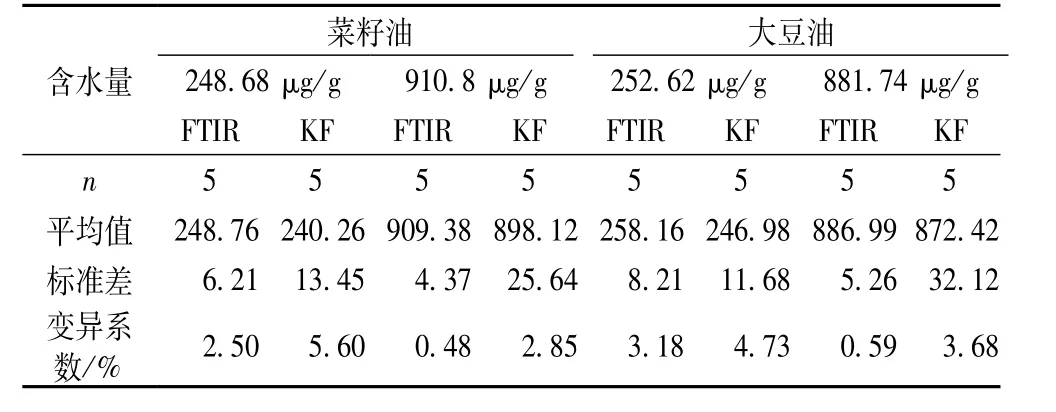
表4 FTIR方法分析食用油水分的准确性
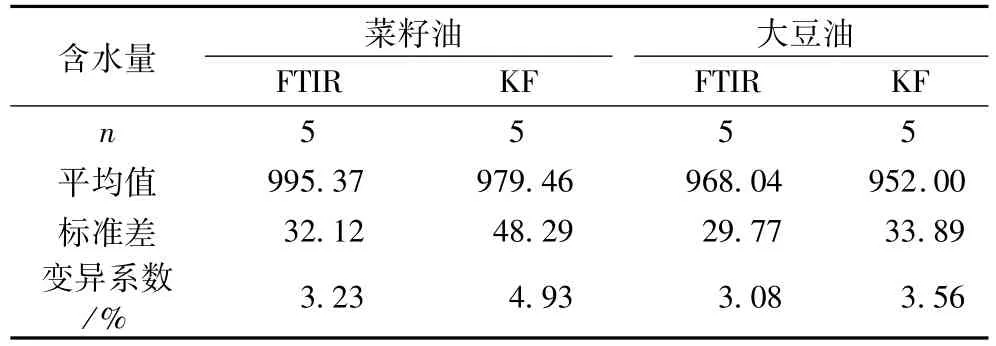
表5 FTIR方法分析水饱和食用油含水量的重现性(不同时间)
3 结论
通过研究溶剂萃取然后FTIR分析的油脂微量水分快速分析技术,结果表明溶剂萃取水分同时,绝大部分油脂留在萃余相中,基质吸收干扰少,分析精密度高,准确度好,而且黏度低,可连续进样,通量高。此外定量分析是基于差谱(样品与参比的差谱)二阶导数,明显改善了基线吸收问题增强了峰拆分,实现了食用油中微量水分的精确分析。
[1]O'brien R D.Fats and oils:formulating and processing for applications[M].CRC press,2010
[2]张继东,张凯,杨勇,等.动植物油脂中水分测定方法的研究[J].中国油脂,2010(10):74-77
[3]AOCSOfficialMethods and Recommended Practices of the A-merican Oil Chemists’Society[S].Campaign,IL:AOCS Press,1998,4th ed
[4]Margolis S A.Amperometric measurement of moisture in transformer oil using Karl Fischer reagents[J].Analytical Chemistry,1995,67(23):4239-4246
[5]Margolis SA.Effect of hydrocarbon composition on themeasurement of water in oils by coulometric and volumetric Karl Fischermethods[J].Analytical Chemistry,1998,70(20):4264-4270
[6]Pizarro C,Esteban-Díez I,Rodríguez-Tecedor S,et al.Determination of the peroxide value in extra virgin olive oils through the application of the stepwise orthogonalisation of predictors tomid-infrared spectra[J].Food Control,2013,34(1):158-167
[7]Rao Y,Xiang B,Zhou X,et al.Quantitative and qualitative determination of acid value of peanut oil using near-infrared spectrometry[J].Journal of Food Engineering,2009,93(2):249-252
[8]Hendl O,Howell J A,Lowery J,et al.A rapid and simple method for the determination of iodine values using derivative Fourier transform infraredmeasurements[J].Analytica Chimica Acta,2001,427(1):75-81
[9]Rohman A,Man Y B.Analysis of water content in soap formulation using Fourier transform infrared(FTIR)spectroscopy[J].Journal of Applied Sciences Research,2009,5(7):717-721
[10]Van De Voort FR,Sedman J,Yaylayan V,etal.Quantitative determination ofmoisture in lubricants by Fourier transform infrared spectroscopy[J].Applied Spectroscopy,2004,58(2):193-198
[11]Filgueiras P R,Sad C,Loureiro A R,et al.Determination of APIgravity,kinematic viscosity and water content in petroleum by ATR-FTIR spectroscopy andmultivariate calibration[J].Fuel,2014,116:123-130
[12]Moisture Karl Fisher Regent AOCS officialmethod Ca 2e-84[S],AOCSPress,5th Edition,Chsmpaign,Illinois,1997.
Establishment and Application of Solvent Extraction Coupled with FTIR Spectroscopy Method for Trace Water in Oil Analysis
Yang Zhicheng1Ye Jianchen2,3Ye Qin3Meng Xianghe3
(Hangzhou Grain and Oil Center Inspection Station1,Hangzhou 310009)(Wenzhou Institute for Drug Control2,Wenzhou 325028)(Ocean College,Zhejiang University of Technology3,Hangzhou 310018)
FTIR analysis ofmoisture in edible oils coupled with solvent extraction has been examined in the paper.The results suggested that acetonitrilewas the optimal extraction solvent.On condition being less than 300μg/g,initialmoisture in acetonitrile had no significant effect on extraction capability.The acetonitrile to edible oil ratio of 1.5~2∶1 was fit.When based on gap-segment2ndderivative processed spectra,quantitative analysis could bemore accuracy than that being based on differential spectra.It had a higher sensitivity in the 1 640 cm-1as opposed to 3 630 cm-1and 3 541 cm-1.On optimal conditions,the SD of calibration curve could be 3.3μg/g.For all the tested samples,FTIR results could wellmatch those determined by Karl Fishermethod,and showed fine accuracy and precision(with a SD of30 and relative standard deviation of3%).Itwas proved that the analysis ofmoisture in edible oil by FTIR combined with solvent extraction was feasible.
trace water analysis,FTIR,extraction,acetonitrile,edible vegetable oil
TQ646.4
A
1003-0174(2015)10-0107-05
国家自然科学基金(31271887),浙江省科技厅公益项目(2014C32003)
2014-04-26
杨志成,男,1965年出生,工程师,粮油分析检测
孟祥河,男,1974年出生,教授,粮油食品安全
