不同调强技术在宫颈癌骨髓保护根治性放疗中的应用
2015-12-17林柏翰吴丽丽张基永
林柏翰吴丽丽张基永
不同调强技术在宫颈癌骨髓保护根治性放疗中的应用
林柏翰①吴丽丽①张基永①
目的:分析比较固定野调强技术和不同弧数的旋转容积调强在宫颈癌骨髓保护根治性全盆腔放射治疗的剂量学特点,寻找更优的治疗方案。方法:选取在汕头大学医学院附属肿瘤医院接受根治性放疗的ⅡA~ⅢB期宫颈癌患者9例,针对每例患者分别设计九野固定野调强(FF-IMRT)计划、双弧、三弧和四弧旋转容积调强(2A-VMAT、3A-VMAT、4VMAT)计划,比较四者靶区、骨盆骨髓,其他危及器官的剂量学差异和加速器跳数和照射时间。结果:IMRT、2A-VMAT、3A-VMAT和4A-VMAT四组计划均具有良好的靶区覆盖率,靶区适形度和均匀性以及骨盆骨髓受照剂量和受照体积(V10,V20,V40)无差异。三组VMAT计划在危及器官的保护上无差异。VMAT计划的小肠均略低于FF-IMRT计划(P<0.008),在直肠的保护上,FFIMRT计划略优于3弧VMAT计划(P<0.008)。IMRT、2A-VMAT、3A-VMAT和4A-VMAT计划的加速器跳数分别为(1850.3±227.8)MU、(848.4±58.8)MU、(835.0±76.2)MU和(910.8±43.3)MU,照射时间分别为(353.2±25.1)s、(136.2±3.6)s、(211.2±3.5)s和(286.2±3.4)s。各组的加速器跳数和照射时间比较差异有统计学意义,调强计划的跳数和照射时间最多,两弧VMAT最少。结论:综合考虑各种物理和生物因素,在宫颈癌骨髓保护根治性放疗计划中,双弧VMAT技术照射为最优选择。
宫颈癌; 骨髓; 放射治疗; 固定野调强; 容积调强
宫颈癌是妇科最常见的恶性肿瘤[1]。目前同步放化疗是晚期宫颈癌新的治疗标准[2]。然而同步放化疗模式下,宫颈癌骨髓抑制(血液毒性)显著增加,严重的血液毒性可延迟甚至中断放化疗计划,降低疗效。固定野调强放疗技术(Fix-field Intensity-Modulated Radiation Therapy, FF-IMRT)是目前治疗肿瘤的主要放疗技术[3-4]。Mell等[5]报道相对传统放疗技术,在宫颈癌术后患者调强计划中给予盆腔骨髓以更严格的剂量体积限制,可以显著降低骨髓的受照剂量和体积,预期骨髓抑制毒性会进一步下降。虽然固定野调强放疗较传统放疗有剂量学上的优势,但是增加了计划的机器跳数(Monitor Units, MUs),同时延长了照射时间。旋转容积调强(Volumetirc Modulated Arc Radiation Therapy, VMAT)是近年来出现的先进放疗技术,具有与IMRT相似的剂量分布,同时显著减少MUs和照射时间[6]。目前在宫颈癌根治性放疗中,尚未见FFIMRT技术和VMAT技术在骨髓保护方面的前瞻性报道。为此本研究将在物理技术层面探讨FF-IMRT、双弧VMAT、三弧VMAT和四弧VMAT等技术在宫颈癌根治性放疗的剂量学特点,为临床提供多个治疗选择,探讨并寻找更优的治疗方案。
1 资料与方法
1.1 一般资料 本研究入组患者为2012年6月-2013年3月在汕头大学医学院附属肿瘤医院接受根治性放射治疗的9例初治宫颈癌患者。采用患者CT影像进行放疗计划设计研究。入组患者均有病理确诊且无远处及盆腔、腹主动脉旁淋巴结转移。Figo分期情况为Ⅱa期1例,Ⅱb期5例,Ⅲb期3例。
1.2 CT模拟定位 CT模拟定位前患者口服造影剂及静脉注射造影,采用仰卧体位,双手互握肘关节置头顶,双腿自然平放,真空袋固定。采用Philips Brilliance 85 cm大孔径CT模拟机进行盆腔CT定位增强扫描,层厚及层间距均为3 mm,扫描范围从膈顶至坐骨结节下缘3 cm。最后将患者CT影像资料通过DICOM 3.0传送至Eclipse 10.0计划系统进行靶区勾画和计划设计。
1.3 放疗计划设计系统 Eclipse 10.0放射治疗计划设计系统是美国瓦里安公司产品,该系统可实现FFIMRT技术和VMAT技术的计划设计,采用DVO算法(Dose Volume Optimizer)优化模块优化IMRT计划和PRO算法(Progressive Resolution Optimizer)优化模块优化VMAT计划,最后采用各向异性分析算法(anisotropic analytical algorithm,AAA)进行IMRT和 VMAT计划的剂量计算。
1.4 靶区勾画及危及器官的勾画 GTV包括宫颈局部肿物(GTV1)及盆腔淋巴结(GTV2),本研究入组患者已剔除有盆腔及腹膜后淋巴结者,故本研究中无需勾画GTV2。CTV分为原发灶CTV(CTV1)和淋巴引流区CTV(CTV2)。CTV1包括宫颈局部肿块、整个子宫、宫旁组织和部分阴道。对于阴道有侵犯者,包括肿瘤下极向下3 cm的正常阴道;对于阴道无侵犯的病例,CTV1常规包括阴道上段1/2。CTV2包括宫旁、闭孔、骶骨前、左右髂总血管、髂内、髂外的淋巴结引流区,具体勾画标准参考最新版的RTOG勾画指南[7]。CTV1外放1.5 cm为PTV1,CTV2外放0.5 cm为PTV2。PTV1和PTV2合并即为最终的PTV。盆骨骨髓勾画包括L4下缘至坐骨结节下缘所有骨性结构,包括,L4、L5腰椎、骶椎、髂骨、耻骨、坐骨,近端股骨的骨髓[8]。勾画整个骨性结构代表骨盆骨髓,其他危及器官(Organ At Risk, OARS),包括直肠、小肠、膀胱的具体勾画标准参考最新版的RTOG勾画指南[9]。
1.5 放疗计划的设计 使用瓦里安Eclipse计划治疗系统和直线加速器TrueBeam的6 MV光子线进行计划设计,靶区处方剂量为46Gy/2Gy/23f,每个患者分别设计4种方案:(1)九野均分调强放射治疗计划(IMRT),射野角度分别为200°、240°、280°、320°、0°、40°、80°、120°、160°;(2)双弧旋转容积调强放射治疗计划(2A-VMAT),射野角度分别为顺时针181°~179°和逆时针179°~181°;(3)三弧旋转容积调强放射治疗计划(3A-VMAT),射野角度分别为弧1:顺时针181°~179°,弧2:逆时针179°~181°,以及弧3:顺时针181°~179°;(4)四弧旋转容积调强放射治疗计划(4A-VMAT),射野角度分别为弧1:顺时针181°~179°,弧2:逆时针179°~181°,弧3:顺时针181°~179°,和弧4:逆时针179°~181°。
1.6 计划评价指标
1.6.1 靶区评价指标 V100%,D2%,D50%,D98%,靶区适形指数CI(Conformity Index)和均匀指数HI(Homogeneity Index)。V100%是100%处方剂量线包含的靶区体积,近似最大剂量D2%,近似最小剂量D98%,和近似平均剂量D50%,分别为2%,98%和50%的靶区体积的最大受照剂量。
1.6.2 危及器官评价指标 骨盆骨髓的V10、V20和V40(V10为接受≥10 Gy体积占总体积的百分比,V20,V40,V45等类推),直肠的V40、D2%、Dmean,小肠的V40、V45、D2%和Dmean;膀胱的V45、D2%和Dmean。
1.6.3 计划机器跳数(MUs)和照射时间。
1.7 统计学处理 使用SPSS l9.0统计软件进行分析,计量资料以(±s)表示,对四组计划先行Page’test(cite Higgins))检验,如果统计分析有差异,再采用Wilcoxon signed rank test进行配对检验,P<0.05认为差异有统计学意义。
2 结果
2.1 不同计划的PTV、机器跳数和照射时间 四组计划的靶区覆盖率,近似最大剂量D2%,近似最小剂量D98%,近似平均值D50%,适形指数CI和均匀性指数HI相似,无差异。VMAT计划的机器跳数和照射时间比FF-IMRT计划明显减少,比较差异有统计学意义。随着VMAT计划弧数的增加,机器跳数和照射时间相应增加,见表1。
表1 不同计划PTV、机器跳数和照射时间的比较(±s)
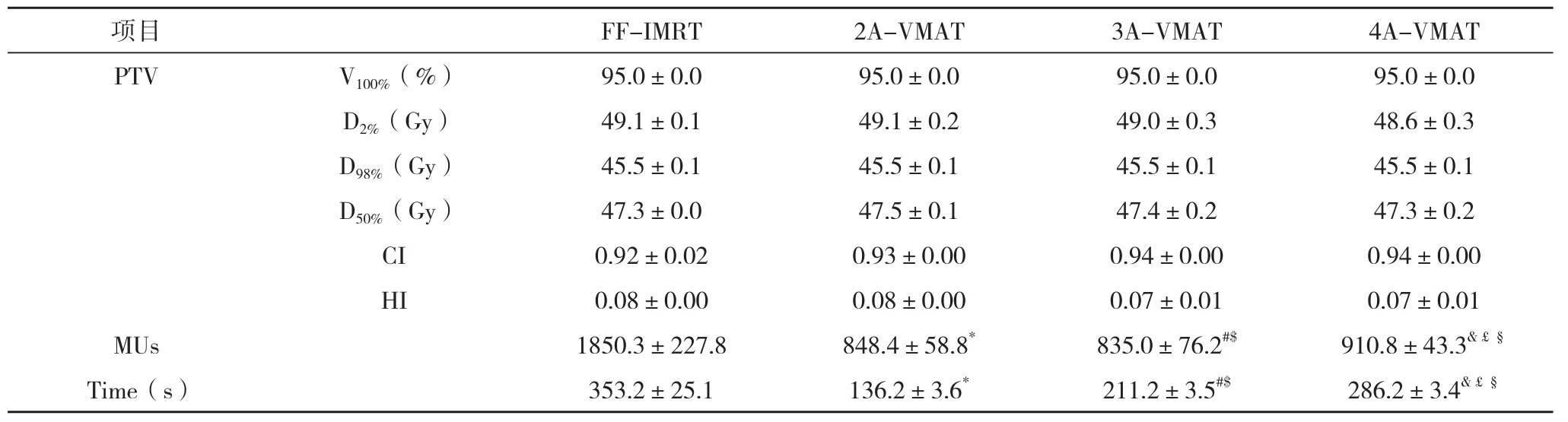
表1 不同计划PTV、机器跳数和照射时间的比较(±s)
注:PTV为计划靶体积,V100%=100%处方剂量线包含的靶区体积,近似最大剂量D2%为2%靶区体积的最大受照剂量,近似最小剂量D98%、近似平均剂量D50%等类推;CI=conformal index,适形度指数;HI=homogeneity index,均匀性指数;MUs=monitor units,机器跳数;*表示FF-IMRT VS. 2A-ARC差异有统计学意义;#表示FF-IMRT VS. 3A-AR差异有统计学意义;&表示FF-IMRT VS. 4A-AR差异有统计学意义;$表示2A-ARC VS. 3A-AR差异有统计学意义;£表示2A-ARC VS. 4A-AR差异有统计学意义;§表示3A-ARC VS. 4A-AR差异有统计学意义
项目FF-IMRT2A-VMAT3A-VMAT4A-VMAT PTVV100%(%)95.0±0.095.0±0.095.0±0.095.0±0.0 D2%(Gy)49.1±0.149.1±0.249.0±0.348.6±0.3 D98%(Gy)45.5±0.145.5±0.145.5±0.145.5±0.1 D50%(Gy)47.3±0.047.5±0.147.4±0.247.3±0.2 CI0.92±0.020.93±0.000.94±0.000.94±0.00 HI0.08±0.000.08±0.000.07±0.010.07±0.01 MUs1850.3±227.8848.4±58.8*835.0±76.2#$910.8±43.3&£§Time(s)353.2±25.1136.2±3.6*211.2±3.5#$286.2±3.4&£§
2.2 骨盆骨髓受到剂量和体积评价 四个计划均有效减低骨髓受照剂量;相对FF-IMRT计划,随着VMAT计划弧数的增加,骨盆骨髓受照体积下降1%~2%。见表2。
2.3 直肠、小肠、膀胱受照剂量和体积评价 IMRT计划的直肠V45比3A-VMAT计划高,比较差异有统计学意义;而VMAT计划能有效减少小肠V45,随着VMAT计划弧数的增加,小肠V45略有降低(P<0.008);4A-VMAT比FF-IMRT和2A-VMAT降低了小肠V45,比较差异有统计学意义。见表3。
表 2 不同计划计划骨盆骨髓剂量参数的比较(±s)

表 2 不同计划计划骨盆骨髓剂量参数的比较(±s)
注:V10为接受≥10 Gy体积占总体积的百分比,V20、V40类推
?
表3 不同计划直肠、小肠和膀胱剂量参数的比较(±s)
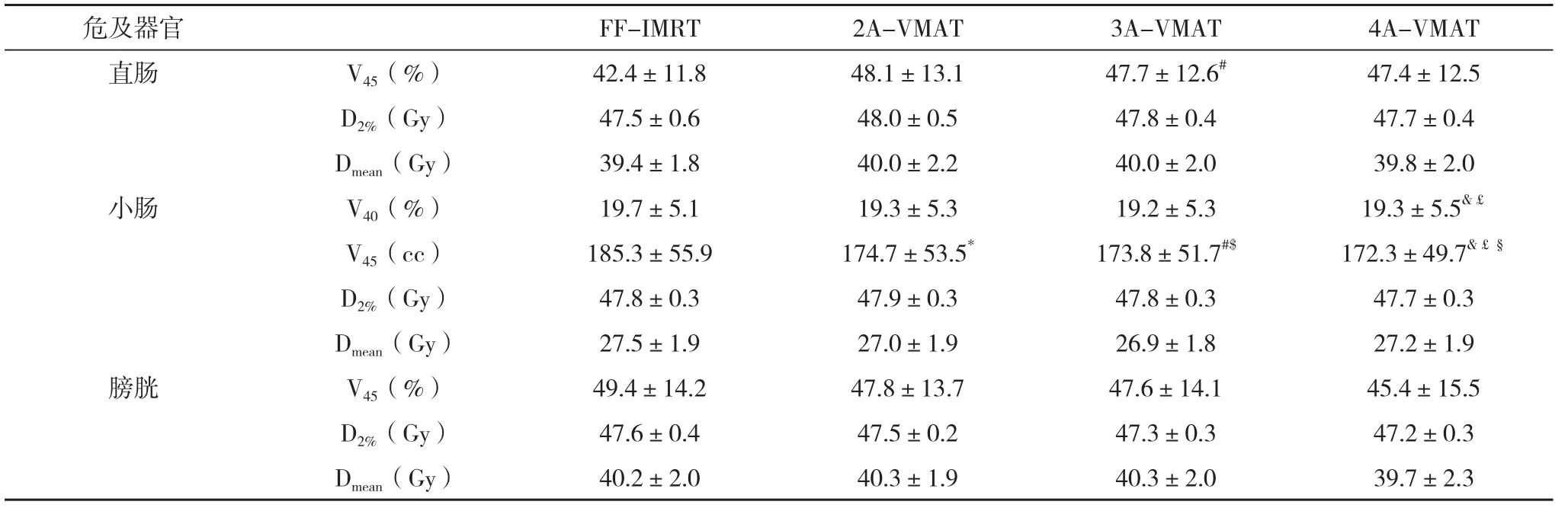
表3 不同计划直肠、小肠和膀胱剂量参数的比较(±s)
注:V45为接受≥40 Gy体积占总体积的百分比或绝对体积,V40等类推;Dmean为平均剂量;近似最大剂量D2%为2%靶区体积的最大受照剂量;*表示FF-IMRT VS. 2A-ARC差异有统计学意义;#表示FF-IMRT VS. 3A-AR差异有统计学意义;&表示FF-IMRT VS. 4A-AR差异有统计学意义;$表示2A-ARC VS. 3A-AR差异有统计学意义;£表示2A-ARC VS. 4A-AR差异有统计学意义;§表示3A-ARC VS. 4A-AR差异有统计学意义
危及器官FF-IMRT2A-VMAT3A-VMAT4A-VMAT直肠V45(%)42.4±11.848.1±13.147.7±12.6#47.4±12.5 D2%(Gy)47.5±0.648.0±0.547.8±0.447.7±0.4 Dmean(Gy)39.4±1.840.0±2.240.0±2.039.8±2.0小肠V40(%)19.7±5.119.3±5.319.2±5.319.3±5.5&£V45(cc)185.3±55.9174.7±53.5*173.8±51.7#$172.3±49.7&£§D2%(Gy)47.8±0.347.9±0.347.8±0.347.7±0.3 Dmean(Gy)27.5±1.927.0±1.926.9±1.827.2±1.9膀胱V45(%)49.4±14.247.8±13.747.6±14.145.4±15.5 D2%(Gy)47.6±0.447.5±0.247.3±0.347.2±0.3 Dmean(Gy)40.2±2.040.3±1.940.3±2.039.7±2.3
3 讨论
目前同步放化疗是局部晚期宫颈癌的标准治疗方法,然而同步放化疗比单纯放疗明显增加了骨髓抑制不良反应[12]。Kirwan等[13]分析19个宫颈癌临床试验结果,发现同步放化疗明显增加患者2级骨髓抑制的发生率。另一方面多个临床研究表明,对于接受同步放疗化的患者,骨盆骨髓受照剂量V10、V20、V40与骨髓抑制显著正相关,多个学者研究发现在宫颈癌同步放化疗中,控制患者骨盆骨髓受照剂量V10≤90%,V20≤76%,V40≤40%,可能有效降低骨髓抑制发生率[8,14-15]。
近年来已有少量针对宫颈癌骨髓保护放疗技术的研究,Brixey等[16]的回顾性研究表明未限定骨髓剂量的IMRT计划相比三维适形计划仍然能减低骨盆骨髓剂量。随后多个研究针对宫颈癌患者骨髓进行限量。Lujan等[17]发现严格控制骨髓受照剂量的宫颈癌IMRT计划比未限制骨髓受量的传统IMRT计划在各个剂量水平显著减少骨盆骨髓受照剂量。
本研究的限制骨髓剂量的FF-IMRT放疗计划和三组VMAT计划的骨髓受量均满足上述研究建议的剂量限制,具有良好的骨髓保护作用,可以推测四组计划均可能降低同步放化疗宫颈癌患者的骨髓抑制不良反应,得到临床获益。
IMRT放疗虽然比传统放疗技术具有更好的剂量分布,并减低骨髓受照剂量,但是显著增加了计划MUs和治疗时间。VMAT放疗是近年来出现的全新放疗技术,其最大的特点在于:具有IMRT相似的计划剂量分布,与传统放疗相似的治疗时间和MUs,弥补了IMRT技术照射时间长,MUs多的缺点[6]。
本课题中三组VMAT计划和IMRT计划具有相似的肿瘤靶区覆盖率,适形度和均匀性,并且很好的保护了危及器官和,VMAT计划随着弧数的增加,略微减少部分小肠的受量,骨髓受量无差异,另一方面却明显增加照射时间,增加一条弧大约增加75 s的照射时间。计划MUs也略有增加,3条弧的VMAT与2条弧VMAT的MUs差别较小,但是增加到4条弧,计划MUs明显增加。虽然如此,但是VMAT计划仍然比IMRT计划显著减少MUs。
综上所述,VMAT计划可达到IMRT相似的靶区覆盖率和骨髓保护作用,并且显著降低了治疗机器跳数和治疗时间。但是VMAT计划弧数的增加没有明显改善靶区剂量分布,骨盆骨髓和其他危及器官的照射剂量,反而显著增加了机器跳数,照射时间和弧内小野剂量产生的不确定度。综合考虑到适形度和均匀性和骨盆骨髓放射受照剂量等各项指标,建议对宫颈癌骨髓保护根治性放射治疗尽量选用2弧VMAT照射。
弧形照射野数目的多少与所使用的优化算法和照射技术有关,本研究结果是在笔者所使用的计划系统的提供算法的基础上提出的,设计计划时还需对所使用的计划系统反复试验比较来获取经验。同时本文仅针对骨髓保护放疗技术进行研究,该技术降低的患者骨髓受量与患者血液毒性反应的联系仍然需要长期的前瞻性临床实验进行验证。
[1] Jemal A, Bray F, Center M M, et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[2] Pearcey R, Miao Q, Kong W, et al. Impact of adoption of chemoradiotherapy on the outcome of cervical cancer in Ontario:results of a population-based cohort study[J]. J Clin Oncol,2007,25(17):2383-2388.
[3]吴丽丽,陆佳扬,陈志坚.鼻咽癌静态调强放疗计划中采用非分裂射野的研究[J].中国肿瘤,2010,19(8):507-510.
[4]胡健,徐利明,胡伟国,等.颈胸段脊椎骨转移癌三维适形与调强放疗剂量学比较的研究[J].中国医学物理学杂志,2010,27(1):1588-1591.
[5] Mell L K, Tiryaki H, Ahn K H, et al. Dosimetric comparison of bone marrow-sparing intensity-modulated radiotherapy versus conventional techniques for treatment of cervical cancer[J]. Int J Radiat Oncol Biol Phys,2008,71(5):1504-1510.
[6] Otto K. Volumetric modulated arc therapy: IMRT in a single gantry arc[J]. Med Phys,2008,35(1):310-317.
[7] Lim K, Small W, Jr. Portelance L, et al. Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy for the definitive treatment of cervix cancer[J]. Int J Radiat Oncol Biol Phys,2011,79(2):348-355.
[8] Rose B S, Aydogan B, Liang Y, et al. Normal tissue complication probability modeling of acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys,2011,79(3):800-807.
[9] Gay H A, Barthold H J, O'Meara E, et al. Pelvic normal tissue contouring guidelines for radiation therapy: a Radiation Therapy Oncology Group consensus panel atlas[J]. Int J Radiat Oncol Biol Phys,2012,83(3):e353-362.
[10] van't Riet A, Mak A C, Moerland M A, et al. A conformation number to quantify the degree of conformality in brachytherapy and external beam irradiation: application to the prostate[J]. Int J Radiat Oncol Biol Phys,1997,37(3):731-736.
[11] Heinrich Ebert. Prescribing, Recording, and Reporting Photon-Beam Intensity-Modulated Radiation Therapy (IMRT): Contents[J]. J ICRU,2010,10(1):NP.
[12] Duenas-gonzalez A, Cetina-perez L, Lopez-graniel C, et al. Pathologic response and toxicity assessment of chemoradiotherapy with cisplatin versus cisplatin plus gemcitabine in cervical cancer: a randomized Phase Ⅱ study[J]. Int J Radiat Oncol Biol Phys,2005,61(3):817-823.
[13] Kirwan J M, Symonds P, Green J A, et al. A systematic review of acute and late toxicity of concomitant chemoradiation for cervical cancer[J]. Radiother Oncol,2003,68(3):217-226.
[14] Mahantshetty U, Krishnatry R, Chaudhari S, et al. Comparison of 2 contouring methods of bone marrow on CT and correlation with hematological toxicities in non-bone marrow-sparing pelvic intensitymodulated radiotherapy with concurrent cisplatin for cervical cancer[J]. Int J Gynecol Cancer,2012,22(8):1427-1434.
[15] Albuquerque K, Giangreco D, Morrison C, et al. Radiation-related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow-sparing pelvic IMRT[J]. Int J Radiat Oncol Biol Phys,2011,79(4):1043-1047.
[16] Brixey C J, Roeske J C, Lujan A E, et al. Impact of intensitymodulated radiotherapy on acute hematologic toxicity in women with gynecologic malignancies[J]. Int J Radiat Oncol Biol Phys,2002,54(5):1388-1396.
[17] Lujan A E, Mundt A J, Yamada S D, et al. Intensity-modulated radiotherapy as a means of reducing dose to bone marrow in gynecologic patients receiving whole pelvic radiotherapy[J]. Int J Radiat Oncol Biol Phys,2003,57(2):516-521.
Various Techniques of Bone Marrow-Sparing Intensity Modulated Radiation Therapy in Cervical Cancer Treated with Definitive Radiotherapy/
LIN Bai-han, WU Li-li, ZHANG J i-yong.//Medical Innovation of China,2015,12(10):041-045
Objective: To compare static intensity-modulated radiation therapy (IMRT) technique with various arcs of volumetric-modulated arc radiation therapy (VMAT) techniques in patients with cervical cancer treated with definitive bone morrow-sparing whole pelvic radiotherapy, and to explore a better treatment management. Method:9 CT image sets of staged ⅡA-ⅢB cervical cancer patients, treated in Cancer Hospital of Shantou University Medical College, were included. Nine fixed-field IMRT (FF-IMRT) plans and two arcs, three arcs, four arcs VMAT plans (2AVMAT, 3A-VMAT, 4A-VMAT) were created and compared for each patient. Plans were evaluated on parameters of tumor target volume, pelvic bone marrow (PBM), other pelvic organs, plan MUs and delivery time. Result: Four groups of 2A-VMAT, 3A-VMAT, 4A-VMAT and IMRT plans provide equivalent tumor target volume coverage, conformity,homogeneity and sparing of PBM respected to V10,V20,V40. Three VMAT plans demonstrate the similar organs sparing. VMAT was slightly superior to FF-IMRT with the sparing of bowel. However, FF-IMRT showed better rectum sparing than that of 3A-VMAT. The monitor units of IMRT, 2A-VMAT, 3A-VMAT and 4A-VMAT were (1850.3±227.8)MU,(848.4±58.8)MU, (835.0±76.2)MU and (910.8±43.3)MU, respectively, while delivery time were (353.2±25.1)s, (136.2±3.6)s, (211.2±3.5)s and (286.2±3.4)s, respectively. There were significant differences of monitor units(MUs) and treatment time among four plans. IMRT plan had more MUs and treatment time than that of VMAT plans, and two arcs VMAT plan had the least MUs and treatment time. Conclusion: Considering the physical factors and biological effects during the cervical cancer definitive radiotherapy with pelvic bone marrow-sparing, 2 arcs VMAT plan would be the best choice for the treatment planning.
Cervical cancer; Bone marrow; Radiotherapy; Static intensity-modulated radiation therapy;Volumetric-modulated arc radiation therapy
10.3969/j.issn.1674-4985.2015.10.014
2014-12-04) (本文编辑:王宇)
①汕头大学医学院附属肿瘤医院 广东 汕头 515031
吴丽丽
First-author’s address: Cancer Hospital of Shantou University Medical College, Shantou 515031, China
