超声场中L-抗坏血酸亚油酸酯的酶法合成及其抗氧化性研究*
2015-12-16江晨刘柳李卓李存芝晏日安
江晨,刘柳,李卓,李存芝,晏日安
1(暨南大学理工学院,食品科学与工程系,广东广州,510632)
2(华润怡宝饮料(中国)有限公司,广东 深圳,518000)
L-抗坏血酸(L-ascorbyl linoleate,L-AA)广泛存在于自然界中,是维持机体正常生理功能的重要维生素之一,同时它也作为水溶性天然抗氧化剂在加工领域被广泛应用。但其亲水特性使其在某些疏水环境如油脂和化妆品中的应用受到很大限制。近年来,在L-AA结构中植入脂肪酸链合成L-抗坏血酸脂肪酸酯,已成为L-AA改性研究的热点,因为酯化不仅不会破坏其抗氧化结构还可增强其脂溶性,其中L-抗坏血酸棕榈酸酯(L-ascorbyl palmitate,L-AP)和L-抗坏血酸硬脂酸酯已商业化生产,被广泛应用于食品和化妆品中[1],且LAP是我国唯一可以用于婴幼儿奶粉的抗氧化剂[2]。
L-抗坏血酸脂肪酸酯的制备方法分为化学法和酶法[3]。化学法一般使用浓H2SO4、HF等作为催化剂和溶剂,是工业生产中使用的主要方法,但缺点是反应时间长,腐蚀性强且污染严重。酶法合成不仅可以避免这些不利因素,且具有特异性强、反应条件温和、无废酸排放等优点。超声波的高频振动不仅可以促进底物的快速溶解,而且可以使其均匀分散在溶剂中,通过提高底物与催化剂的有效碰撞次数,加速反应的进行[4]。本文采用超声-酶法协同的方法合成L-抗坏血酸脂肪酸酯,旨在缩短反应时间,获得较高产率。
国内外关于L-抗坏血酸脂肪酸酯的研究主要集中于L-抗坏血酸饱和脂肪酸酯的合成及其性质,但有文献报道,相比饱和脂肪酸,不饱和脂肪酸被认为对人体健康更有好处[5],所以本文在L-AA上引入不饱和脂肪酸亚油酸,酯化生成L-抗坏血酸亚油酸酯(L-AL)(图1),希望在增加脂溶性的基础上也能提高其营养性。亚油酸学名为顺式十八碳-9,12-二烯酸,是一种人体必需的不饱和脂肪酸,具有降低血浆胆固醇、调节免疫、促进生长发育等重要作用[6],目前国内外对L-AL的合成以及性质的研究较少,华东理工大学主要比较了不同来源的酶的催化效应以及L-AL对细胞氧化的保护作用[7-8],但对L-AL的清除自由基能力、油脂抗氧化性能评价等并没有涉及[9]。本文通过条件优化确定了其超声-酶法合成的最佳条件,通过红外、质谱及碳谱分析对L-AL结构进行了鉴定,另外从清除羟基自由基和DPPH自由基、还原能力以及油脂抗氧化方面对其进行了抗氧化能力测试,并与抗氧化剂LAP、L-AA和VE的抗氧化能力进行比较,旨在得到一种新型的兼具抗氧化性和营养性的食品添加剂,并为其工业生产和应用提供理论基础。
1 材料与方法
1.1 材料与仪器

图1 L-抗坏血酸亚油酸酯(L-AL)的结构Fig.1 Structure of L-ascorbyl linoleate(L-AL)
L-AA、邻二氮菲,天津市天新精细化工开发中心;亚油酸,阿拉丁试剂网;L-AP,东莞市感恩食品科技有限公司;叔戊醇、乙酸乙酯、硅胶、分子筛,天津市富宇精细化工有限公司;硫酸亚铁、三氯化铁、三氯乙酸,DPPH,阿法埃莎(天津)化学有限公司;天津市福晨化学试剂厂;脂肪酶Novozym®435,诺维信(中国)生物技术有限公司;葵花籽油、花生油,金龙鱼股份有限公司。
RE-52 AAB型旋转蒸发器,上海嘉鹏科技有限公司;DZF-6030A真空干燥箱,上海一恒科学技术有限公司;SB25-12DTDN超声波处理机,宁波新芝生物科技有限公司;2XZ型旋片式真空泵,上海仪器供销公司;B-260恒温水浴锅,上海亚荣生化仪器厂;743型Rancimat氧化稳定性测试仪,瑞士万通中国有限公司;KDC-1044低速离心机,科大创新股份有限公司。
1.2 实验方法
1.2.1 L-AL的合成
将 L-AA 10 mmol,亚油酸 30 mmol,分子筛 5 g,叔戊醇50 mL,固定化脂肪酶(Novozym®435)0.44 g置于避光容器中,于设定温度55℃的超声仪中反应6 h。
反应液经固液分离分出固定化脂肪酶、分子筛和未反应的L-AA后,所得滤液经旋蒸蒸出溶剂叔戊醇,得到的粗产物用乙酸乙酯溶解,再经水洗除去LAA,分液后经旋蒸蒸出乙酸乙酯,得到的产物用硅胶柱进行分离,收集后蒸出溶剂,真空干燥后得油状淡黄色产物1.53 g,产率35%。
1.2.2 羟自由基清除能力的测定
采用Fenton反应对羟基自由基清除能力进行测定。将2 mL 0.2 mmol/L磷酸盐缓冲液(pH 7.4)与1 mL 0.75 mmol/L邻二氮菲无水乙醇溶液混合于试管中,然后加入1 mL不同质量浓度(100,150,200,250,300 μg/mL)的L-AL 与1 mL 0.75 mmol/L FeSO2溶液为处理样,对照样加入2 mL蒸馏水补充体积。最后加入1 mL 0.01%H2O2,空白对照以蒸馏水补充体积。在37℃保温1 h后,用紫外分光光度计测定在536 nm处的不同浓度样品溶液的吸光度值[9]。同时按相同方法测定L-AP、L-AA和VE的羟自由基清除能力。样品对羟自由基的清除率计算见式(1):

1.2.3 DPPH自由基清除能力测定
首先,配制浓度为0.2 mmol/L的DPPH乙醇溶液。然后将2 mL不同质量浓度(10,20,40,80,100 μg/mL)的L-AL与2 mL 0.2 mmol/L的DPPH乙醇溶液混合,摇匀后放置在黑暗处30 min,用无水乙醇调零,用紫外分光光度计测定不同浓度样品溶液在517 nm处的吸光值A样品,再测定2 mL DPPH溶液与2 mL乙醇在517 nm处的吸光值ADPPH[10]。同时按相同方法测定L-AP、L-AA和VE的DPPH自由基清除能力。计算样品对DPPH清除率[式(2)]:

1.2.4 还原能力测定
将 0.5 mL 不同质量浓度(10,20,40,80,100 μg/mL)的L-AL溶液与2.5 mL 0.2 mol/L的磷酸缓冲溶液(pH 6.6)和2.5 mL 1%的K3Fe(CN)6混合,50℃水浴20 min后快速冷却。然后加入2.5 mL 10%的三氯乙酸溶液,2 000 r/min离心15 min。取上清液2.5 mL与2.5 mL蒸馏水、0.5 mL 0.1%的FeCl3溶液混合均匀,混合液静置15 min后用紫外分光光度计测定不同浓度样品溶液在700 nm处的吸光值[11]。同时按相同方法测定L-AP、L-AA和VE的还原能力。
1.2.5 油脂中抗氧化性测定
在Rancimat仪上测定各油样的氧化诱导时间,油样葵花籽油和花生油添加量为3.00 g,L-AL添加比例为200 mg/kg,空气流速为10 mL/min,实验温度为120℃[12]。同时按相同方法测定 L-AP、L-AA和VE在油脂中的抗氧化能力。
1.3 HPLC分析
通过高效液相色谱对产物进行测定,色谱条件为:Synthesis C18色谱柱(250 mm ×4.6 mm,5 μm);流动相:V(甲醇)∶V(水)=85∶15,;检测器:岛津 SPD-10A 紫外检测器,流速1 mL/min,进样量15 μL,检测波长280 nm,柱温:40℃。
1.4 数据处理
每组数据均平行测定3次后取平均值。数据采用Origin 8.0软件处理。
2 结果与讨论
2.1 L-AL合成工艺优化
2.1.1 溶剂对产率的影响
溶剂的极性是否合适对脂肪酶的催化效率有很大影响,而反应物L-AA和亚油酸在溶剂中的溶解性好坏,也决定着酯化反应是否能顺利高效进行。本文以溶剂为变量,保持其他条件恒定:L-AA 10 mmol、亚油酸30 mmol、分子筛5 g、脂肪酶0.44 g、超声反应温度55℃、反应时间6 h。选用叔戊醇、叔丁醇、丙酮和正己烷作为溶剂,得到产率结果如图2所示。叔戊醇、叔丁醇和丙酮都可以作为反应的溶剂,而以正己烷为反应溶剂时几乎没有产物生成,因为原料L-AA在正己烷中不能溶解,所以不能参与酯化。其中叔戊醇作为溶剂时产率最高,因此选择叔戊醇作为反应溶剂。

图2 溶剂种类对L-AL产率的影响Fig.2 Effect of solvent on yield of L-AL
2.1.2 反应时间对产率的影响
底物L-AA在溶剂中的溶解度有限,随着反应进行,L-AA在溶剂中逐渐溶解参与反应,且酯化反应需要一定的时间才达到平衡,所以反应时间也是影响产率的一个重要因素。本文以反应时间为变量,保持其他条件恒定:L-AA 10 mmol、亚油酸30 mmol、分子筛5 g、叔戊醇50 mL、脂肪酶0.44 g、超声反应温度55℃,分别反应 2、4、6、8、10 h,以探究反应时间对产率的影响。
当反应时间由2 h变化至10 h时L-AL的产率变化结果如图3所示。当反应时间小于6 h时,产率随着时间的增加逐渐升高,超过6 h,产率趋于平稳不再明显升高,这说明这时反应已达到平衡,再延长反应时间对提高产率作用不大。因此,最佳反应时间可以确定为6 h。
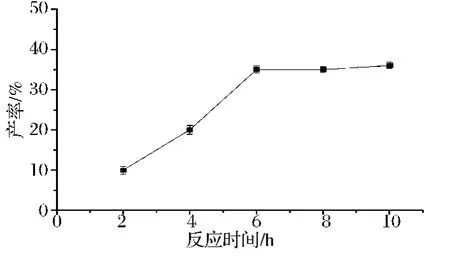
图3 反应时间对L-AL产率的影响Fig.3 Effect of reaction time on yield of L-AL
2.1.3 反应温度对产率的影响
酶催化需要在合适的温度下才能进行,所以温度是影响酶催化效率的一个重要因素,本文以超声反应温度为变量,保持其他条件恒定:L-AA 10 mmol、亚油酸30 mmol、分子筛5 g、叔戊醇50 mL、脂肪酶0.44 g、反应时间6 h,设定40、45、50、55、60 ℃五个温度梯度来探究固定化脂肪酶(Novozym®435)的最适催化温度。
如图4所示,反应温度为40~55℃时L-AL的产率随着温度的升高而提高,但在55℃达到最大值之后开始下降,这是因为温度过高会使固定化酶的催化活性受到限制。此外,过高的温度可能破坏L-AL结构内的连烯二醇结构和双键。因此,反应温度选为55℃最合适。

图4 反应温度对L-AL产率的影响Fig.4 Effect of temperature on yield of L-AL
2.1.4 酶使用量对产率的影响
固定化酶的价格比较昂贵,而且过量使用对提高产率影响不大,出于效率和成本考虑,本文以酶使用量为变量,其他条件保持恒定:L-AA 10 mmol、亚油酸30 mmol、分子筛5 g、叔戊醇50 mL、超声反应温度55℃、反应时间6 h,探究不同酶使用量(与L-AA的质量百分比)10%,15%,20%,25%,30%对产率的影响。
如图5所示,随着酶用量的增大L-AL的产率不断提高,但酶使用量大于25%后,产率几乎不再升高,这是因为在酶催化反应中,酶使用量越大,酶的催化活化中心也就越多,酶催化效果也就更好,但酶用量一旦饱和,再增加酶用量几乎对产率没有影响,所以选取酶使用量为L-AA质量的25%最合适。
2.1.5 亚油酸和L-AA摩尔比对产率的影响
酯化反应是可逆反应,可通过使其中一种底物过量从而平衡右移来达到提高产率的效果,所以本文以反应物摩尔比为变量,保持其他条件恒定:分子筛5 g、叔戊醇50 mL、脂肪酶0.44 g、超声反应温度55℃、反应时间6 h,探究不同底物摩尔比(亚油酸∶L-抗坏血酸)0.5、1、2、3、4 对产率的影响。

图5 酶使用量对L-AL产率的影响Fig.5 Effect of amount of lipase on yield of L-AL
如图6所示,当亚油酸和L-AA摩尔比小于3∶1时,产率随底物摩尔比的增大而升高,且在摩尔比为3∶1时达到最大后几乎不再升高。且当L-AA过量时,L-AL产率很低,只有10%左右,这是因为L-AA在叔戊醇中的溶解度不高,所以L-AA过量对产率的提高影响不大,而亚油酸过量则可以不断消耗溶剂中的L-AA,使未溶解的L-AA不断补充溶解,从而提高L-AA的转化率达到提高产率的效果。因此,本反应底物亚油酸与L-AA的最佳摩尔比可确定为3∶1。
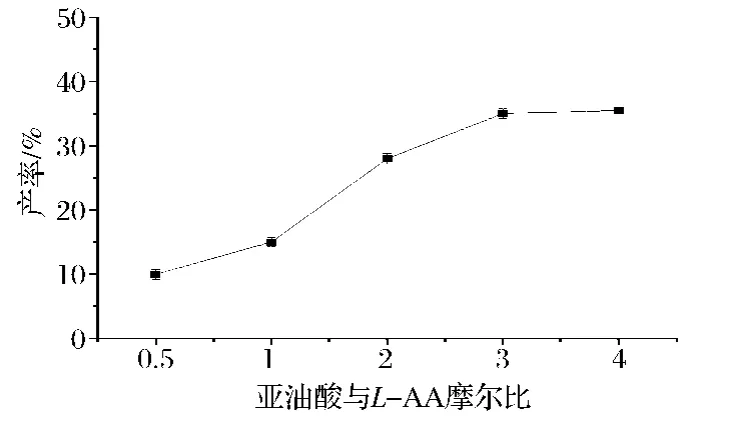
图6 底物摩尔比对L-AL产率的影响Fig.6 Effect of substrate molar ratio on yield of L-AL
2.2 L-AL结构的鉴定
2.2.1 L-AL红外表征
L-AL红外扫描图谱如图7所示。3 380.20 cm-1处为—OH的吸收峰;2 923.83 cm-1及 2 854.22 cm-1处的吸收峰为烷烃饱和CH伸缩振动的特征吸收;1 736.65 cm-1处的吸收峰是酯的特征吸收峰;1 135.16 cm-1处为酯基中C—O伸缩振动吸收峰;1 687.93和3 009.28 cm-1为双键特征吸收峰。
2.2.2 L-AL ESI质谱分析
图8中出现的437.5、473.6、483.6峰分别为[MH]-、[M+Cl]-、[M+HCOO]-质谱信号峰。所对应的M值与L-AL的分子量438.5相符合,证实了所得产物为L-AL。
2.2.3 L-AL核磁分析
如图 9所示,L-AL的13C-NMR(126 MHz,CDCl3)分析如下:14.07(C18),20.59-34.06(C2-C8,C11,C14-C17),64.05(C6’),67.32(C5’),76.14(C4’),118.58(C3’),127.90-130.23(C9,C10,C12,C13,C=C),153.51(C2’),172.65(C1,C=O);174.17(C1,C=O),其中化学位移为76.78-77.29的峰为CDCl3的溶剂峰。
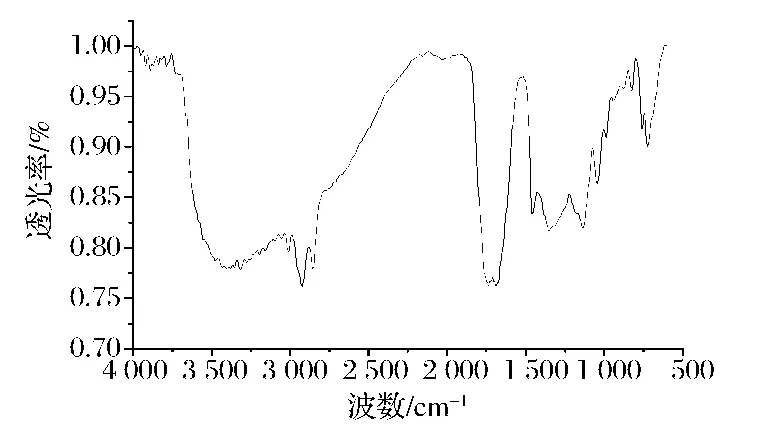
图7 L-AL的红外谱图Fig.7 Infrared spectrum of L-AL
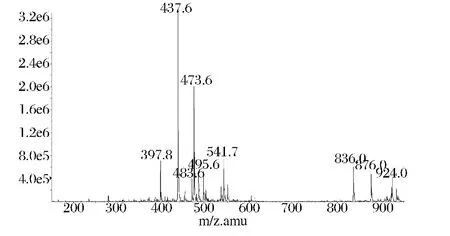
图8 L-AL的ESI质谱图Fig.8 Mass spectrum of L-AL

图9 L-AL的13C-NMR谱图Fig.9 13C-NMR of L-AL
2.2.4 L-AL HPLC分析
L-AL的HPLC分析如图10所示,在波长280 nm下L-AL的保留时间为3.79 min。
2.3 L-AL抗氧化能力的测定
2.3.1 羟自由基清除能力的测定
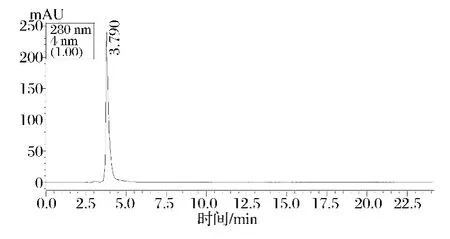
图10 L-AL的HPLC图谱Fig.10 HPLC graph of L-AL
邻二氮菲溶液与Fe2+形成的红色络合物,在536 nm处有最大吸收,加入H2O2后,Fe2+被·OH氧化为Fe3+,从而使吸收减弱,所以若加入的抗氧化剂清除·OH能力越强,则Fe2+越多,其溶液在536 nm处的吸光值也就越高。如图11所示,L-AA、L-AP、L-AL和VE这4种抗氧化剂对羟自由基都有比较好的清除能力,且在试验的质量浓度范围内,4者的清除能力都随着浓度的增加而增强,其中L-AA和L-AP的羟自由基清除能力最强,在质量浓度为300 μg/mL时,清除率分别为95%和78%,而相同质量浓度下L-AL的清除率为59%,VE的清除率则最弱,为38%。综上,4种抗氧化剂在相同的质量浓度下,羟自由基清除能力大小为:L-AA>L-AP>L-AL>VE。

图11 L-AA、L-AP、L-AL和VE清除羟自由基能力测定Fig.11 The hydroxyl radical scavening capacity of L-AA,L-AP,L-AL and VE
2.3.2 DPPH自由基清除能力测定
DPPH自由基在乙醇溶液中是一种稳定的自由基,在517 nm处有强吸收,抗氧化剂可使DPPH自由基被还原成DPPH,进而使其在517 nm处的吸收减弱或消失,所以可用517 nm处的吸光度值来评价抗氧化剂的抗氧化能力。如图12所示,在试验的质量浓度范围内,L-AA、L-AP、L-AL和VE这4种抗氧化剂都显示出良好的清除DPPH自由基的能力,且4者的清除能力都随着浓度的增加而增强。且当质量浓度大于40 μg/mL时,L-AA与L-AP的DPPH自由基清除能力非常接近,清除率都在90%左右,而在质量浓度为100 μg/mL时,L-AL的DPPH自由基清除率也达到了70%以上,这说明L-AL有较好的DPPH自由基清除能力。另外,相较而言,VE的DPPH自由基清除能力则最弱。综上,4种抗氧化剂在相同的质量浓度下清除DPPH自由基的能力大小为:L-AA>L-AP>L-AL>VE。
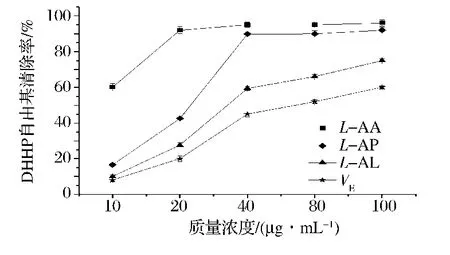
图12L-AA、L-AP、L-AL和VE清除DPPH自由基能力测定Fig.12 The DPPH radical scavening capacity of L-AA,L-AP,L-AL and VE
2.3.3 还原能力测定
如图13所示,L-AA、L-AP、L-AL和 VE这4种抗氧化剂的还原力都随着质量浓度的增加而增强。当质量浓度为 10、20、40 μg/mL 时,L-AA、L-AP、L-AL三者的还原能力比较接近,吸光度值都在0.2~0.3,但随着质量浓度的增加,L-AA逐渐表现出更强的还原能力,在质量浓度为100 μg/mL,L-AA的吸光度值达到了0.55,而L-AP和L-AL的吸光度值都在0.3左右,这说明在相同质量浓度下L-AL与L-AP的还原能力相当,而VE在质量浓度为100 μg/mL时的吸光度值仅为0.16,显示出较弱的还原能力。综上可知,这4种抗氧化剂相同质量浓度的还原能力大小为:L-AA>L-AP>L-AL>VE。
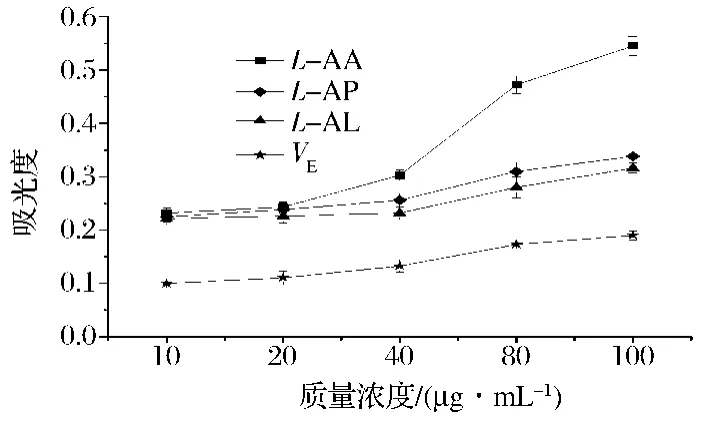
图13 L-AA、L-AP、L-AL和VE还原能力的测定Fig.13 The reducing power of L-AA,L-AP,L-AL and VE
2.3.4 油脂中抗氧化能力的测定
油脂抗氧化测定的原理为仪器通入热空气促使油脂加速氧化,从而产生挥发性物质如醇、酸、醛等,这些物质被吸收后会引起吸收液电导的变化。通过测定吸收液的电导变化,可以得知油脂的氧化稳定性,其表示方法为氧化诱导时间[13],诱导时间越长,说明其抗氧化性越好。L-AA、L-AP、L-AL和VE的油脂抗氧化结果如图14所示,与空白对照相比,L-AA、L-AP、L-AL和VE均表现出一定的油脂抗氧化作用,且相比葵花籽油,在花生油中的抗氧化作用更明显。另外,从图中还可以得出,同一油脂试验中L-AA的油脂抗氧化作用比L-AP、L-AL和VE要弱,这是因为L-AA的油溶性没有其他3种抗氧化剂好,故没有起到很好的抗氧化作用。此外,L-AL作为L-抗坏血酸不饱和脂肪酸酯其油脂抗氧化效果不如作为L-抗坏血酸饱和脂肪酸酯的L-AP,推测其原因是由于其侧链带有不饱和双键,易被通入的热空气氧化,而氧化分解产生的挥发性物质使得氧化诱导时间缩短,故导致抗氧化效果不佳。综上,4种抗氧化剂在葵花籽油和花生油中的氧化诱导时间为:L-AP>L-AL>VE>L-AA。
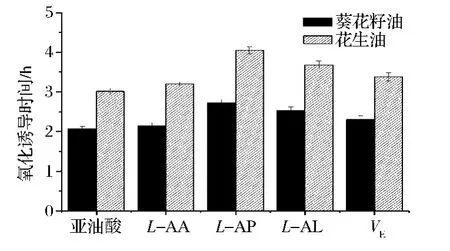
图14L-AA、L-AP、L-AL和VE在油脂中的抗氧化性能测定Fig.14 The effect on induction time of L-AA,L-AP,L-AL and VE
3 结论
本文以L-AA和亚油酸为原料,通过超声-酶法协同法合成L-AL,并通过条件优化得到了其最佳合成条件,结果表明,相较常规酶催化合成方法[7-8],超声-酶法协同合成方法具有反应时间短,产率高等优点。采用红外、质谱及核磁共振碳谱确定了其结构,并通过与抗氧化剂L-AA、L-AP、L-AL和VE的抗氧化对比实验,评价了其抗氧化能力。结果表明,相同质量浓度下L-AL与L-AP的还原能力相当;L-AL相较VE具有较好的还原能力以及清除羟基自由基和DPPH自由基的能力,但相较L-AA和L-AP,其能力较弱,这是因为在相同质量浓度的情况下,L-AL分子由于被键入的脂肪酸长链相对分子量更大,结果导致结构内的抗氧化结构所占比重比L-AA和L-AP要小[14],故使得其抗氧化效果稍弱,但由于L-AL油溶性更好,因此其在油脂中的抗氧化能力要强于L-AA。由以上结论可知,L-AL具有较好的清除羟基自由基、DPPH自由基的能力以及还原能力,并且对油脂有一定的抗氧化能力,是一种新型的、富有潜力的营养型抗氧化剂,有一定的应用潜力和商业价值。
[1] Kuwabra K,Watanabe Y,Adachi S,et al.Stability of saturated acyl L-ascorbates in aqueous solution[J].Journal of Food Science,2005,70(1):7-11.
[2] 林富强,陈永恒,何松.L-抗坏血酸棕榈酸酯在配方乳品中的应用[J].现代食品科技,2010(10):1 114-1 116.
[3] 李红,陶静,姚小娟.L-抗坏血酸棕榈酸酯的化学合成工艺优化[J].中国食品添加剂,2010(5):144-148.
[4] Micol V,Caturla N L,Perez-Fons V,et al.The olive leaf extract exhibits antiviral activity against viral haemorrhagic septicaemia rhabdovirus(VHSV)[J].Antiviral Research,2005,66(2/3):129-136.
[5] LU Yu-yun,YAN Ri-an,MA Xiang,et al.Synthesis and characterization of raffinose fatty acid monoesters under ultrasonic irradiation[J].European Food Research Technology,2013,237(2):237-244.
[6] 李明.红花籽油中亚油酸的分离及微胶囊化[D].无锡:江南大学,2006.
[7] 赵莹.非水相中酶法合成L-抗坏血酸亚油酸酯的初步研究[D].上海:华东理工大学,2005.
[8] 宋庆训.抗坏血酸油酸酯和抗坏血酸亚油酸酯的生物催化合成及抗氧化活性研究[D].上海:华东理工大学,2004.
[9] SONG Qing-xun,ZHAO Ying,XU Wei-qin,et al.Enzymatic synthesis of L-ascorbyl linoleate in organic media[J].Bioprocess and Biosystems Engineering,2006,28(4):211-215.
[10] Oloyede G K,Willie I E,Adeeko O O.Synthesis of Mannich bases:2-(3-Phenylami-nopropionyloxy)-benzoic acid and 3-Phenylamino-1-(2,4,6-trimethoxy-phenyl)-propan-1-one,their toxicity,ionization constant,antimicrobial and antioxidant activities[J].Food Chemistry,2014,165(20):515-521.
[11] GAO Jie,ZHANG Ting,JIN Zheng-yu,et al.Structural characterisation,physicochemical properties and antioxidant activity of polysaccharide from Lilium lancifolium Thunb[J].Food Chemistry,2015,169:430-438.
[12] A gˇirtas M S,Karatas C,Özdemir S.Synthesis of some metallophthalocyanines with dimethyl 5-(phenoxy)-isophthalate substituents and evaluation of their antioxidant-antibacterial activities[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2015,135(11):20-24.
[13] 李卓,晏日安,曾永青.超声波强化酶法合成L-抗坏血酸癸酸酯及其抗氧化性研究[J].食品工业科技,2013,34(2):204-209.
[14] Kharrat N,Aissa I,Sghaier M,et al.Lipophilization of ascorbic acid:a monolayer study and biological and antileishmanial activities[J].Agricultural and Food Chemistry,2014,62(37):9 118-9 127.
