低强度微波处理对猕猴桃细胞壁降解酶活性的影响
2015-12-16李明霞韩建群王琦何雨婷郭艳明董明
李明霞,韩建群,王琦,何雨婷,郭艳明,董明,2
1(安徽农业大学茶与食品科技学院,安徽合肥,230036)
2(合肥市农产品加工研究院,安徽 合肥,230036)
猕猴桃(Actinidia chinensis)属于猕猴桃科猕猴桃属多年生落叶藤本植物,果肉质地细嫩,气味清香,酸甜可口,且具有很高的营养价值和药用价值。近年来,猕猴桃产量逐年提高,但是猕猴桃果实不耐贮运,易于软化腐烂,从而制约市场的销售和生产发展。果肉软化是猕猴桃成熟衰老的主要特征之一,防止果实软化可延长水果的寿命和货架期。猕猴桃果实软化的原因是细胞壁内部结构的破坏,通过细胞壁物质的降解作用引起[1-2],与细胞壁降解有关的酶主要是多聚半乳糖醛酸酶[3-5]、果胶甲酯酶[6-7]、纤维素酶[8]和β-半乳糖苷酶[9]等。
近年来,微波在食品加工方面的应用,主要是利用微波激发水分子的运动产生的热效应来体现的,可用于食品加热或杀菌[10],同时微波存在的非热效应未能引起足够的重视,相关研究甚少。微波的非热效应是指微波作用对温度没有明显变化的情况下,对生物体产生的影响。有研究表明,弱微波照射可使生物体的理化性质,功能特性发生变化[11],使其生理活性物质发生变异而丧失活力或死亡[12]。同时,微波的电场会使细胞的膜功能发生变异,从而使细胞的正常代谢功能及生理功能受到相应的破坏,这样可以使微生物的生长受到抑制或死亡[13],进而使细胞的DNA和RNA分子结构发生变化,但是微波的非热生物效应在果蔬保鲜方面研究报道甚少,目前仅有戴美娟等[14]、费莉娟等[15]对猕猴桃、草莓开展微波保鲜的相关研究报道。
本试验通过研究低强度微波处理猕猴桃果实在其贮存过程中的细胞壁降解相关酶——多聚半乳糖醛酸酶(PG)、果胶甲酯酶(PME)、纤维酶(Cx)和β-半乳糖苷酶(β-Gal)活性的变化,结合果实品质指标分析,初步探讨了低强度微波对猕猴桃果实软化和保鲜的影响,为进一步开发安全、简便、快捷的果实贮藏保鲜新技术提供理论依据。
1 材料与方法
1.1 试验材料及样品处理
1.1.1 试验材料
供试猕猴桃品种为安徽农业大学选育的“皖翠”猕猴桃果实,于2014年10月20日采自安徽省霍邱县皖西猕猴桃研究所。采收当日运回农产品加工与贮藏实验室,在0~1℃的冷库预冷10 h左右。挑选表面保持完好,无机械损伤,无病虫害,无腐烂,大小、成熟度一致的猕猴桃果实作为样品。
1.1.2 样品处理
将预冷猕猴桃分11组进行微波连续照射处理,微波输出功率为32.5 W 时,设置 3、5、7、9、11 min;65 W时设置2、3、4、5、6 min,另设对照 1 组。每组微波处理前后实测果心温度,处理后在常温下放置2 h后,用PE保鲜袋包装装箱,转入0~1℃的冷库中贮藏,每15天随机取样1次进行各项指标的测定,重复3次。
1.2 仪器与设备
SAM-255型微波系统,美国CEM公司;LR20-A高速冷冻离心机,北京雷勃尔冷冻离心机有限公司;PHB-4雷磁牌数字型pH计,上海精密雷磁公司;UV-5800PC型紫外分光光度计,上海元析仪器有限公司;GY-4数显台式水果硬度计,浙江托普仪器有限公司。
1.3 指标测定
1.3.1 品质指标的测定
可溶性糖含量采用硫酸蒽酮试剂法;可滴定酸含量采用酸碱滴定法;Vc含量的测定采用2,6-二氯酚靛酚滴定法。
1.3.2 果肉硬度的测定
用GY-4数显式水果硬度计测定其果实的硬度,每个处理随机取8个果实,单个果实从不同的部位测4次,测定时削去果皮的面积为1 cm2,取平均值。
1.3.3 细胞壁酶活性的测定
酶液的提取参考 Lohani等[16]和 Deng 等[17]的方法进行相应改进,取果肉组织4 g,样品放于冷冻过的研钵,将研钵放于碎冰上,加入40 mL,50 mmol/L pH 7的 Tris-HCl缓冲液(含有 20 mol/L NaCl、10 mmol/L EDTA和5 g/L PVPP),冰浴上研磨匀浆,然后再低温4℃ 12 000×g离心30 min,上清液即为粗酶提取液,置于4℃冰箱保存备用。PG和Cx活性的测定用DNS比色法,PME活性测定采用NaOH滴定法[18],β-Gal活性的测定使用 Na2CO3法。
1.4 数据的统计与分析
采用Excel软件进行数据统计,所有数据均为3次重复试验的平均值。采用SPSS软件中的LSD法和Duncan法进行相关指标的差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 低强度微波处理后猕猴桃果实的温度变化趋势
低强度的微波也就是利用微波的非热效应,通过温度和功率的强度变化来作用于物体,其果实温度没有明显的变化,或者是温度处于亚致死的情况下,温度控制在20℃以下,这样既可以产生很强的生物反应,可以使果蔬的理化性质,功能特性发生变化,也可以使其生理活性物质发生变异而丧失活力或死亡。如图1显示的是经过低强度的微波处理后猕猴桃果实的果实温度变化趋势,随着功率和时间的增加温度呈上升趋势。
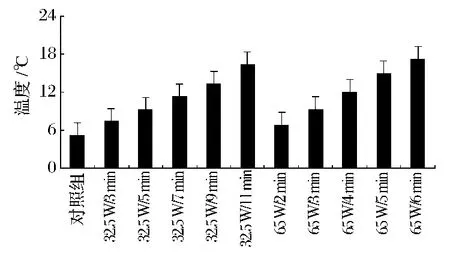
图1 低强度微波处理皖翠猕猴桃的温度变化趋势Fig.1 Changing temperature trend of low intensity microwave treatments of“Wancui”kiwifruit
2.2 低功率微波处理对猕猴桃品质的影响
2.2.1 对猕猴桃可溶性糖含量的影响
可溶性糖主要是指能溶于水的葡萄糖、果糖和蔗糖这3种糖,随着果实的成熟,其含量在不断地增加,在果实成熟过程中主要是通过果糖来表现,且果糖的甜度主要也是通过果糖来体现的。由表1可知,猕猴桃果实在贮藏过程中,可溶性糖呈上升趋势,贮藏45 d时,每个处理组在不同的阶段表现出了显著差异(P<0.05),仅有少数差异不显著(P>0.05),例如65 W/3 min和32.5 W/7 min;32.5 W/3 min和32.5 W/11 min,且可以看出,适当的微波处理,如用32.5 W/5 min和65 W/3 min可以抑制可溶性糖的上升,增加果实的品质,提高的果实的实用价值和经济效益。
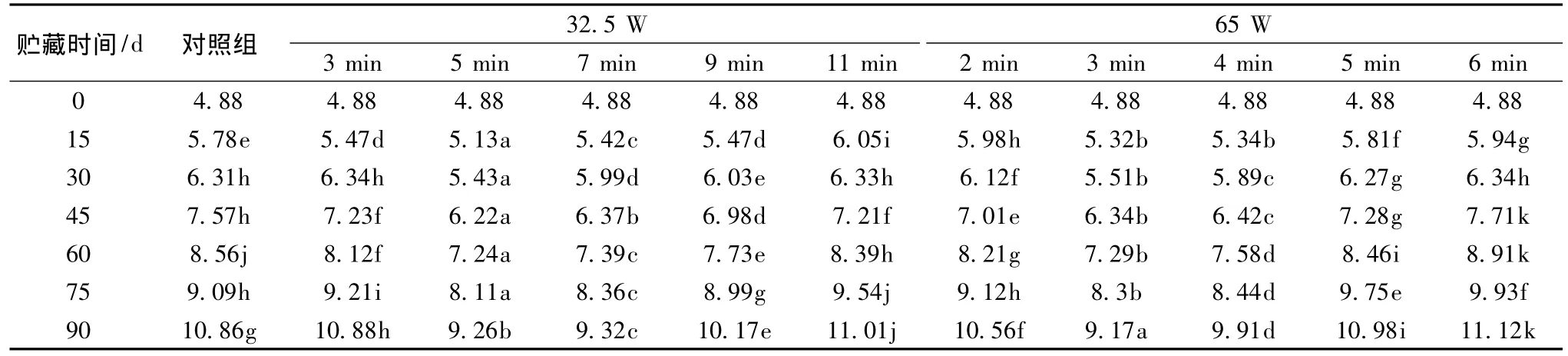
表1 低功率微波处理对猕猴桃可溶性糖含量的影响/%Table 1 Effect of low-power microwave treatment soluble sugar content of kiwifruit
2.2.2 对猕猴桃可滴定酸含量的影响
可滴定酸含量的多少对于猕猴桃的口感、风味、pH值及贮藏性都有很大影响。如表2所示,猕猴桃的可滴定酸含量变化大体趋势一致,都随着贮藏时间的增加而不断减少。从贮藏开始到最后,经过不同的处理后果实的可滴定酸含量有着不同的变化,部分微波处理促进了可滴定酸含量的下降,且处理间与对照差异不显著(P>0.05)例如,贮藏30 d时,对照组与32.5 W/3 min和32.5 W/11min差异不显著,但是有些处理与对照存在明显的差异(P<0.05),尤其是用32.5 W/5 min、65 W/3 min、32.5 W/7 min 和65 W/4 min处理的果实与对照组存在显著差异。由此可见,适当的低功率微波处理猕猴桃能够抑制可滴定酸含量的下降,提高其果实的品质下降。

表2 低功率微波处理对猕猴桃可滴定酸含量的影响/%Table 2 Effect of low-power microwave treatment titratable acid content of kiwifruit
2.2.3 对猕猴桃Vc含量的影响
猕猴桃果实具有较高的Vc,且果实本身在发育早期就含一定的Vc,在脱离母体后的绿熟期,Vc的合成仍会少量地进行,但由于呼吸作用消耗使得有机物逐渐减少,合成Vc的底物不足,以及Vc的不稳定性,容易分解,使果实的Vc含量在贮藏过程中逐渐减少。由表3可知,猕猴桃果实的Vc含量呈逐渐降低趋势,但是15 d时,明显呈上升趋势。经过不同的处理后,不同的处理在每个阶段都有明显的差异(P<0.05),32.5 W/5 min和65 W/3 min处理的果实与对照显著差异(P<0.05),因此恰当的低功率微波可以抑制Vc含量的降解,控制水果的营养价值不被损失,延长了其水果品质。

表3 低功率微波处理对猕猴桃Vc含量的影响 单位:mg/100gTable 3 Effect of low-power microwave treatment Vc content of kiwifruit
2.2.4 对猕猴桃硬度的影响
硬度是指果实抗压力的强弱,也是衡量果实品质的重要指标,也是果实软化的直观表现。从表4可知,猕猴桃果实的硬度随贮藏时间的延长呈下降趋势,贮藏前60 d果实下降速度缓慢,下降范围为2~3.5 N,其每个阶段差异显著(P<0.05),但有些处理差异不显著(P>0.05),例如15d时32.5 W/3 min和32.5 W/9 min;65 W/3 min和65 W/4 min等,但在贮藏后期,猕猴桃果实的硬度急速下降,尤其在75 d时,每个处理组差异极显著(P<0.05),其硬度下降速度由慢到快的顺序依次为32.5 W/5 min<65 W/3 min<32.5 W/7 min<65 W/2 min<65 W/4 min<65 W/5 min<32.5 W/9 min<32.5 W/11 min<32.5 W/3 min<对照组<65 W/6 min,说明在皖翠猕猴桃在贮藏过程中,适当的温度和时间组合的微波的非热效应可以减缓果实硬度下降的速度,尤其是用32.5 W/5 min和65 W/3 min处理的果实与对照显著差异(P<0.05),对其硬度的保护作用更加明显,明显可以抑制果实的软化。

表4 低功率微波处理对猕猴桃硬度的影响 单位:kg/cm2Table 4 Effect of low-power microwave treatment firmness of kiwifruit
2.3 低功率微波处理对猕猴桃多聚半乳糖醛酸酶(PG)活性的影响
多聚半乳糖醛酸酶(Polygalacturonase,PG,EC,3.1.1.15)是一类重要的水解酶,一度被认为是控制果实软化的关键酶,其主要功能是水解果实细胞壁中果胶酸的α-(1→4)-D-半乳糖苷酶,生成一些低聚的半乳糖醛酸或半乳糖醛酸,导致细胞壁解体,最终果实软化[19-20]。由表5可知,猕猴桃果实在贮藏过程中呈先下降后上升的趋势,贮藏0~15 d时,果实的PG酶活性下降,15 d以后,猕猴桃果实随着果实的硬度逐渐下降,其PG的活性呈现缓慢上升的趋势,直到贮藏值第75天时,PG活性上升的范围为425.35~767.23 μg/(g·min),且在这个贮藏时间,各处理间的差异性相当显著(P<0.05),且PG活性上升速度由慢到快为32.5 W/5 min<65 W/3 min<65 W/2 min<32.5W/7 min<32.5W/11 min<65 W/5 min<65 W/4 min<32.5 W/9 min<65W/6 min<对照组<32.5 W/3 min,说明在皖翠猕猴桃贮藏过程中,适当低强度的微波可以抑制PG酶活性的上升,根据分析,尤其是32.5 W/5 min和65 W/3 min处理的猕猴桃果实,可以维持猕猴桃果实的PG活性相对于对照低,降低细胞壁的破损,从而抑制了果实软化的速度。

表5 低功率微波处理对猕猴桃多聚半乳糖醛酸酶活性的影响 单位:μg/(g·min)Table 5 Effect of low-power microwave treatment polygalacturonase activity of kiwifruit
2.4 低功率微波处理对猕猴桃果胶甲酯酶(PME)活性的影响
果胶甲酯酶(Pectinmethylesterase,PME,EC.3.1.1.11)广泛存在于许多高等植物组织中,参与细胞壁果胶物质的脱甲基化,在果胶甲酯酶的作用下,高分子质量果胶中的半乳糖醛酸残基的C6移除,留下了大量的自由的羧基群,细胞壁的pH值改变,通过钙离子连接成凝胶结构,使多聚糖更容易被PG降解。此外,PME能从细胞壁的果胶中去除甲基基团,从而加速了细胞壁的降解,而PME的脱甲基产物又是PG作用的基质,因此,PME的作用可能是加速果实的成熟软化。从表6可以看出,果胶甲酯酶的活性为先下降后上升的趋势,其中部分微波处理的果实的果胶甲酯酶活性明显上升速度缓慢,贮藏15 d之前,酶活性缓慢下降,15 d~75 d时呈缓慢上升,75 d后酶活性急剧上升,加快了果实软化的速度,但是在75 d时,每组处理间差异性相当显著(P<0.05),且各处理间酶活性上升的速度由慢到快依次为65 W/3 min<32.5 W/5 min<65 W/4 min<32.5 W/7 min<32.5 W/3 min<65 W/2 min<32.5 W/9 min<对照组<65 W/6 min<32.5 W/11 min<65 W/5 min,说明微波的非热效应对猕猴桃果实贮藏有一定的抑制作用,可以抑制PME活性的上升,延缓果实的软化,提高了果实的货架期。
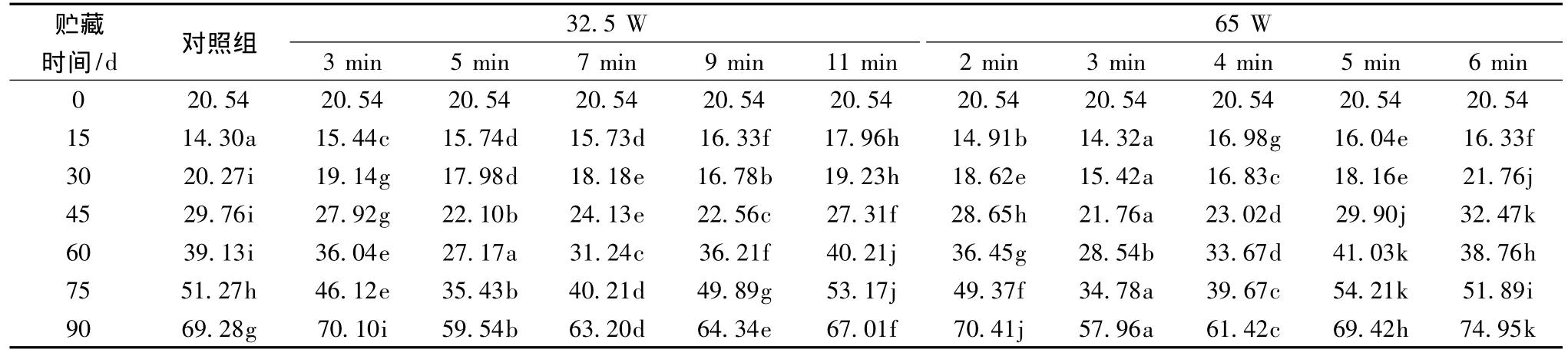
表6 低功率微波处理对猕猴桃果胶甲酯酶活性的影响Table 6 Effect of low-power microwave treatment pectinmethylesterase activity of kiwifruit
2.5 低功率微波处理对猕猴桃纤维素酶(Cx)活性的影响
纤维素酶(Cellulase,Cx,EC3.2.1.4)作为细胞壁的骨架物质,在细胞壁降解过程中起了非常重要作用的一种细胞壁酶。它的主要功能是分解含1,4-β-葡萄糖基链的半纤维素的多糖,在不同的组织中,它们针对不同的多糖底物起作用。从表7可以看出,0~15 d果实的纤维素酶急剧下降,抑制了果实细胞壁的降解,15 d后,酶活性呈现上升趋势,但在75 d时每组处理果实的酶活性之间存在着明显的差异(P<0.05),其酶活性由慢到快的变为32.5 W/5 min<32.5 W/7 min<65 W/3 min<65 W/2 min<32.5 W/3 min<32.5 W/9 min<对照组<65 W/4 min<32.5 W/11 min<65 W/5 min<65 W/6 min,根据其酶活性变化程度可知,适当的微波时间和功率的组合,在一定程度上抑制了细胞壁的降解,降低了果实软化的速度。
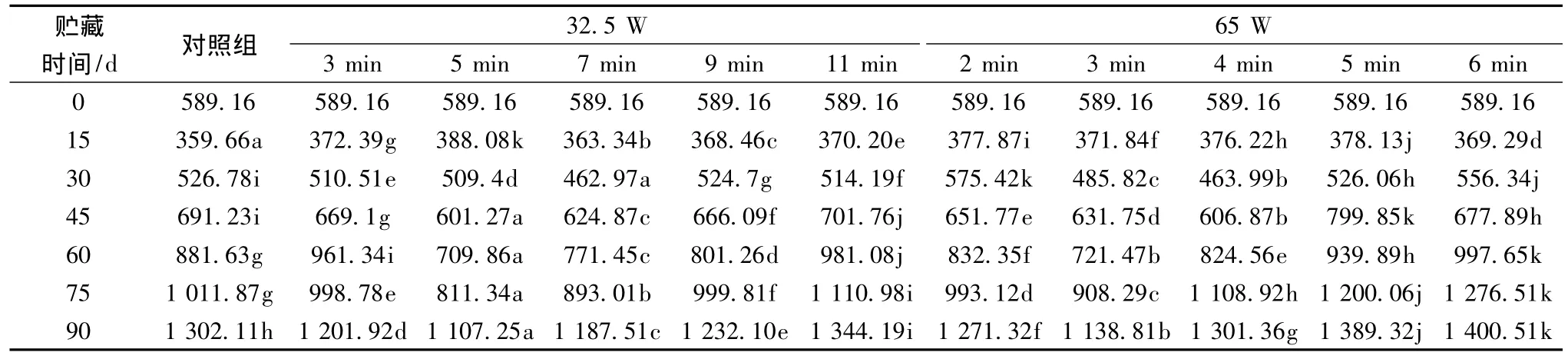
表7 低功率微波处理对猕猴桃纤维素酶活性的影响 单位:μg/(g·min)Table 7 Effect of low-power microwave treatment cellulase activity of kiwifruit
2.6 低功率微波处理对猕猴桃 β-半乳糖苷酶(β-Gal)活性的影响
β-半乳糖苷酶(β-Galactosidase,β-Gal,)也作为一种细胞壁降解相关的酶,它可以使细胞壁的一些组分变得不稳定,主要作用于鼠李半乳聚糖骨架的支链残基,降解果胶聚合体,破坏细胞壁结构,从而使果实软化[21]。从表8可知,β-Gal活性呈现先下降后上升趋势,0~15 d酶活性急剧下降,15~30 d时急剧上升,30 d之后,酶活性呈缓慢上升趋势,在75 d时,32.5 W/5 min和32.5 W/7 min;65 W/2 min和65 W/6 min;32.5 W/3 min和65 W/5 min差异性不显著(P>0.05),与其他处理组之间差异性显著(P<0.05),其酶活性变化的程度由慢到快的趋势为65 W/3 min<(32.5 W/5 min和32.5 W/7 min)<65 W/4 min<(65 W/2 min和65 W/6 min)<(32.5 W/3 min和32.5 W/5 min)<32.5 W/11 min<32.5 W/9 min<对照组,因此适当的微波的非热效应对果实酶活性的上升有一定的抑制作用,防止了果实的软化,从而延长其货架期。
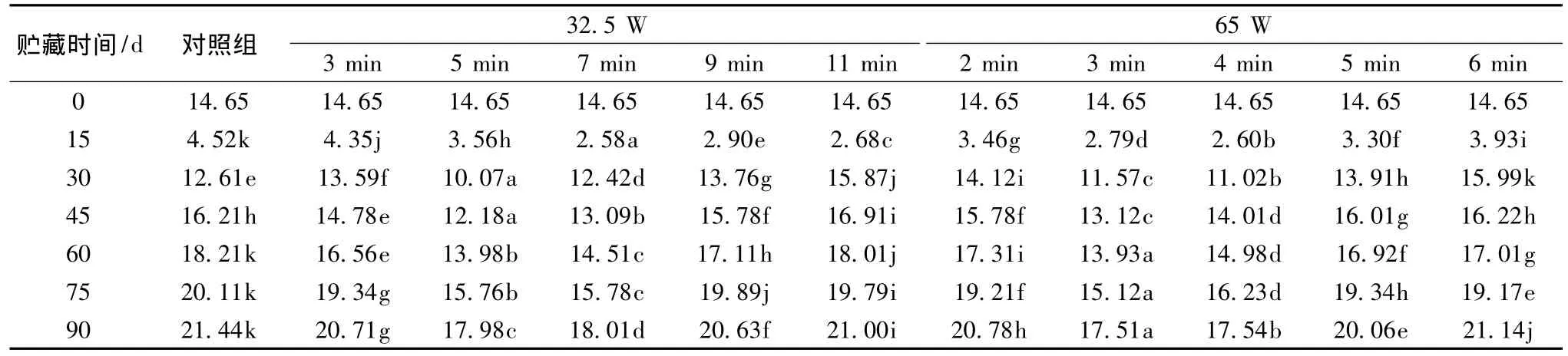
表8 低功率微波处理对猕猴桃β-半乳糖苷酶活性的影响 单位:μg/(g·min)Table 8 Effect of low-power microwave treatment β-Galactosidase activity of kiwifruit
3 讨论与结论
果实软化是果实成熟的重要特征之一,果肉的软化与果实的硬度以及细胞壁降解的酶有密切的关系。因果实在贮藏过程中,随果实的软化,果实的硬度下降,Vc含量随着果实的成熟降解,滴定酸含量下降,可溶性糖会上升,细胞壁降解酶活性发生变化与硬度呈现负相关。研究结果表明,32.5 W/5 min和65 W/3 min的低强度微波功率和时间选择,对果实的软化有很好的保护作用,由此说明,只有恰当的功率和时间的变化才会很好地抑制细胞壁的降解,保证果实的品质不会下降,延长其果实的货架期,提高了果实的营养价值。果实贮存75 d之前,果实的硬度缓慢下降,变化幅度比较小,PG和PME活性呈现先下降后上升的趋势,且PG和PME活性上升的速度是果实的硬度下降的区域,表现出PG活性和PME与果实硬度呈明显的负相关。周培根等[22]的研究结果也表明,随着桃果实的成熟,PG活性呈上升趋势,果实的硬度下降;陆胜明等[23]的研究结果证明,PME在青梅果实的软化中发挥着重大的作用。Cx和β-Gal活性呈现出先急剧下降后上升的趋势,其变化程度也和果实硬度的下降呈负相关。前人已经在苹果、番木瓜、青梅等果实方面进行了研究,结果表明果实的硬度下降与 Cx和 β-Gal活性有密切的关系。因此,32.5 W/5 min和65 W/3 min微波功率与时间的组合可以对皖翠猕猴桃果实软化有抑制作用,延缓了果实的可溶性糖含量的上升和果实硬度、可滴定酸含量和Vc含量的下降,抑制了细胞壁酶降解的速度,保持了果实的商品价值。有关微波处理对果实细胞壁降解酶的机理已从分子方面进行深入研究。
[1] Huber D J.The Role of cell wall hydrolases in fruit softening[J].Horticultural Reviews,1983,5:169-219.
[2] Hinton D M,Pressey.Cellulase activity in peaches during ripening[J].J.Food Sci,1974,39(4):783-785.
[3] ZHANG C,SHI J Y,ZHU L Q,et al.Cooperative effects of hydrogen sulfide and nitric oxide on delaying softening and decay of strawberry[J].Agricultural and Biological Engineering,2014,7(6):114-122.
[4] Gayathri T,Nair A S.Isolation,purification and characterisation of polygalacturonase from ripened banana[J].Food Science and Technology,2014,49(2):429-434.
[5] BU J W,YU Y C,Aisikaer G,et al.Postharvest UV-C irradiation inhibits the production of ethylene and the activity of cell wall-degrading enzymes during softening of tomato(Lycopersicon esculentum L.)fruit[J].Postharvest Biology and Technology,2013,86(3):337-345.
[6] Rastegar S,Rahemi M,Baghizadeh A,et al.Enzyme activity and biochemical changes of three date palm cultivars with different softening pattern during ripening[J].Food Chemistry,2012,134(3):1 279-1 286.
[7] Kao M W S,Brecht J K,Williamson J G,et al.Ripening development and quality of melting and non-melting flesh peach cultivars[J].Hort Science,2012,47(7):879-885.
[8] Rangel D M,Valenzuela B E,Cepeda J S,et al.Effect of 1-MEethylcyclopropene(1-MCP)and edible coating on enzyme activity and postharvesy quality of mango'ATAULFO'[J].Revista Fitotecnia Mexicana,2009,32(1):53-60.
[9] Pinto L K D,Martins M L L,de Resende E D,et al.Activity of pectinmethyylesterase and beta-galactosidase during the ripening of papaya fruits[J].Revista Bresileira De Fruticulture,2011,33(3):713-722.
[10] 杭锋,陈卫,龚广予,等.微波杀菌机理与生物学效应[J].食品工业科技,2009,30(1):333-337.
[11] Jocelyn A L,Peter W F,Robyn A L,et al.Biological effects of electromagnetic fields and mechanisms for the effects of Pulsed microwave radiation on protein conformation[J].Journal of Theory Biology.2000,206(2):291-298.
[12] 武杰.食品微波加工工艺与配方[M].北京:科学技术文献出版社,2003:131.
[13] Saeed M A,Gilbert P.Influence of low intensity 2450MHz microwave radiation upon the growth of various microorganisms and their sensitivity towards chemical inactivation[J].Microbios,1981,32(129-130):135-142.
[14] 戴美娟,董明,费莉娟,等.不同功率的微波处理对猕猴桃贮藏特性的影响[J].食品工业科技,2014,35(3):326-330.
[15] 费莉娟,吴玲,季月月,等.低功率微波处理佐贺清香草莓的生物效应[J].食品与发酵工业,2014,40(4):200-204.
[16] Lohani S,Trivedi P K,Nath P.Changes in activities of cell wall hydrolases during ethylene induced ripening in banana:effect of 1-MCP,ABA and lAA [J].Postharvest Biology and Technology,2004,31(2):119-126.
[17] DENG Y,WU Y,LI T F,et al.Studies of postharvest berry abscission of`Kyoho'table grapes during cold storage and high oxygen atmospheres[J].Postharvest Biology and Technology,2007,43(1):95-101.
[18] LIN T P,LIU C C,CHEN S W,Wanget al.Purification and characterization of pectinmethylesterase from Ficus awkeotsang Makino achenes[J].Plant Physiology,1989,91(4):1 445-1 453.
[19] 张进献,李冬杰,李宏杰.果实软化过程中细胞壁结构和组分及细胞壁酶的变化[J].河北林果研究,2007,22(2):180-186.
[20] Brummell D A,Dal Cin V,Crisosto C H,et al.Cell wall metabolism during maturation,ripening and senescence of peach fruit[J].Journal of Experimental Botany,2004,55(405):2 029-2 039.
[21] Nakamura A,Maeda H,Mizuno M.β-Galactosidase and significance in ripening of“Saijyo”Japanese Persimmon Fruit[J].Biosci Biotechol Biochem,2003,67(1):68-76.
[22] 周培根,罗祖友,戚小玉,等.桃成熟期间果实软化与果胶及有关酶的关系[J].南京农业大学学报,1991,14(2):33-37.
[23] 陆胜明,席玙芳,张耀洲.梅果采后软化与细胞壁组分及其降解酶活性的变化[J].中国农业科学,2003,36(5):595-598.
