丙酮丁醇发酵过程关键酶活性研究*
2015-12-16王风芹张瑞谢瑶嬛谢慧宋安东
王风芹,张瑞,谢瑶嬛,谢慧,宋安东
(河南农业大学生命科学学院,农业部农业微生物酶工程重点实验室,河南郑州,450002)
在当下全球能源危机、石化燃料供应不足、急需提高能源安全与多元化的背景下,丁醇作为一种极具竞争力的可再生生物燃料,快速引起了公众与科学界的高度重视[1]。丁醇的4-C结构使其比乙醇具有更高的辛烷值和热值[2],可以有效提供更强劲的动力。丁醇还具有良好的抗爆性、安全性、融合性,被认为是最具有代替石化燃料潜在能力的新型燃料[3]。
丁醇发酵是利用梭状芽胞杆菌属微生物及其基因突变菌株在专性厌氧环境下,以淀粉、糖蜜、木质纤维素生物质水解产物、甘油、藻类生物质以及无机物作为基质发酵生产[1,4]。丁醇严格厌氧发酵存在菌株对氧气敏感、菌体生长代谢缓慢、发酵工艺苛刻且繁琐等不利因素,所以寻找新的可以在兼性厌氧条件下进行丁醇发酵的微生物菌株成为促进丁醇发酵产业化的有效途径之一。本课题组从种植怀地黄的土壤中分离筛选到1株可以产丁醇的兼性厌氧芽孢杆菌(Bacillus sp.)C2菌株,其代谢产物主要包括丙酮、乙醇和丁醇,还有少量的甲酸、乙酸和丁酸。研究发现,Bacillus sp.C2可以在微氧环境下有效利用葡萄糖、淀粉和木质纤维素水解液发酵生产丁醇。本文对比研究了Bacillus sp.C2在严格厌氧和兼性厌氧条件下的丙酮丁醇发酵情况,并对两种发酵条件下代谢途径中关键酶活性变化进行检测、对比分析。
1 材料与方法
1.1 材料
菌种:Bacillus sp.C2由本课题组从种植怀地黄土壤中分离、纯化得到,于-80℃甘油管中保存;酶活性测定所需试剂购自Sigma公司。
1.2 培养基与缓冲液
活化培养基(5%玉米醪):100 mL水中加入5 g玉米粉调至呈糊状,煮沸加热5~8 min,并不断搅拌,将制成的糊状玉米醪液倒入试管中(9 mL/支),121℃灭菌20 min。
发酵培养基(P2半合成培养基)(g/L):葡萄糖50.0,酵母提取物1.0,115℃灭菌20 min,冷却后加入10 mL/L经0.22 μm微孔膜过滤的贮备溶液。贮备溶液(g/L):KH2PO450.0,K2HPO450.0,乙酸铵220.0;对氨基苯甲酸 0.1,VB10.1,VH0.001;MgSO4·7H2O 20.0,MnSO4·H2O 1.0,FeSO4·7H2O 1.0,NaCl 1.0[8]。
TE 25Suc缓冲液(L):102.7 g蔗糖,25mL 1mol/L Tris-HCl缓冲液(pH 8.0),50mL 0.5 mol/L EDTA,NaOH调pH 8.0后定容至1 L待用。
1.3 丙酮丁醇发酵
1.3.1 菌种活化
以体积比为10%的接种量,将菌种接种到5% 的已灭菌玉米醪液体培养基试管中,在100℃沸水中热激80 s后迅速放入凉水冷却,37℃静置培养48 h。
种子液制备:将已经充分活化后的菌种以体积比10%的接种量接种到300 mL三角瓶(含有200 mL P2培养基)中,放入普通恒温培养箱37℃静置培养24 h。
丁醇发酵:将制备好的种子液以体积比10% 的接种量接种到灭菌后的300 mL三角瓶/血清瓶(装液量为270 mL,血清瓶中N2吹扫液面2 min去除氧气后灭菌)中,恒温培养箱中37℃静置培养,每隔12 h取样1次至发酵结束。
1.3.2 生物量、pH、溶解氧及溶剂的测定
菌体生物量:使用UV-722S分光光度计在600 nm处检测其吸光值(OD);发酵液的pH值:PHS-4C酸度计室温下测定;发酵液中溶解氧:重铬酸钾-三氯化钛方法测定[9]。发酵产物乙醇、丙酮和丁醇利用Agilent 7890A气相色谱仪进行检测,色谱柱 HPFFAP(30 m × 0.32 mm × 1 μm);检测器 FID(250℃);进样量0.2 μL,进样器温度200℃;载气N21.5 mL/min,H230 mL/min,空气 350 mL/min。葡萄糖和有机酸利用Dionex P680高效液相色谱仪,离子排斥色谱柱Aminex HPX-87H,示差折光检测器进行检测。流动相0.005 mol/L H2SO4(pH2.0),流速0.6 mL/min,柱温55℃。
1.3.3 蛋白质提取
取样发酵液2 mL,4℃、8 000 r/min离心10 min,弃上清液;0.1mol/L Tris-HCl缓冲液清洗菌体2~3次,离心条件如上述;之后加入200 μL TE 25Suc缓冲液将菌体悬浮(缓冲液中菌OD600值>1.5),加入50 μL溶菌酶缓冲液(10 mg/mL);放入37℃水浴中进行细胞破碎12~24 h,12 h后补加50 μL溶菌酶液;最后4℃、8 000 r/min离心10 min,上清液即为酶粗提液。利用核酸蛋白检测仪(Thermo Scientific,Nanoprop1000)测定蛋白含量。
1.3.4 酶活性检测
前期研究发现,Bacillussp.C2具有类似丙酮丁醇梭菌的丁醇代谢途径[10],因此研究了Bacillus sp.C2丁醇发酵过程中6种关键酶酶活性变化情况。包括乙醇脱氢酶(ethanol dehydrogenase)利用依赖NAD+/NADH将乙醛还原为乙醇的活性进行检测[11];丁醛脱氢酶(butylaldehyde dehydrogenase),依据丁酰辅酶A还原为丁醛反应中NAD+的还原活性检测和丁醇脱氢酶(butanol dehydrogenase),依据丁醛还原为丁醇反应中NADP+(NAD+)的还原活性检测[12];乙酸激酶(acetate kinase,AK),利用酶串联分析法检测ADP和异羟肟酸的形成,随后进行 Fe3+着色反应来检测 AK 酶活性[13];丁酸激酶(butyrate kinase,BK),利用丁酰磷酸和ATP在过量的羟胺环境中可以合成羟肟酸,然后用 Fe3+着色可以形成脱氢酶混合体来检测BK活性[14];乙酰乙酰辅酶A:乙酸/丁酸:辅酶A转移酶(acetoacetyl-CoA transferase,ACT),利用在ε310处检测乙酰乙酰辅酶 A底物消失变化来测定CoA-T 活性[15]。
2 结果与分析
2.1 Bacillus sp.C2不同溶氧环境下生物量及pH值变化
Bacillus sp.C2在严格厌氧和兼性厌氧培养基中生长及pH值的变化见图1。在三角瓶中进行兼性厌氧(facultative anaerobic,FA)发酵,其发酵液溶氧浓度(desovled oxygen,DO)由最初的4.6 mg/L降低到0.64 mg/L;血清瓶中进行严格厌氧(strictly anaerobic,SA)发酵,其发酵液DO含量从1.44 mg/L下降到0.24 mg/L。发酵前期(0~24 h),严格厌氧条件下菌体生长速率略高于兼性厌氧条件,然而兼性厌氧条件下发酵液OD600最大值为2.945高于严格厌氧条件下的2.793。发酵前期(0~24 h),专性厌氧条件下发酵液pH值下降速率显著高于兼性厌氧,发酵36 h后pH缓慢回升。
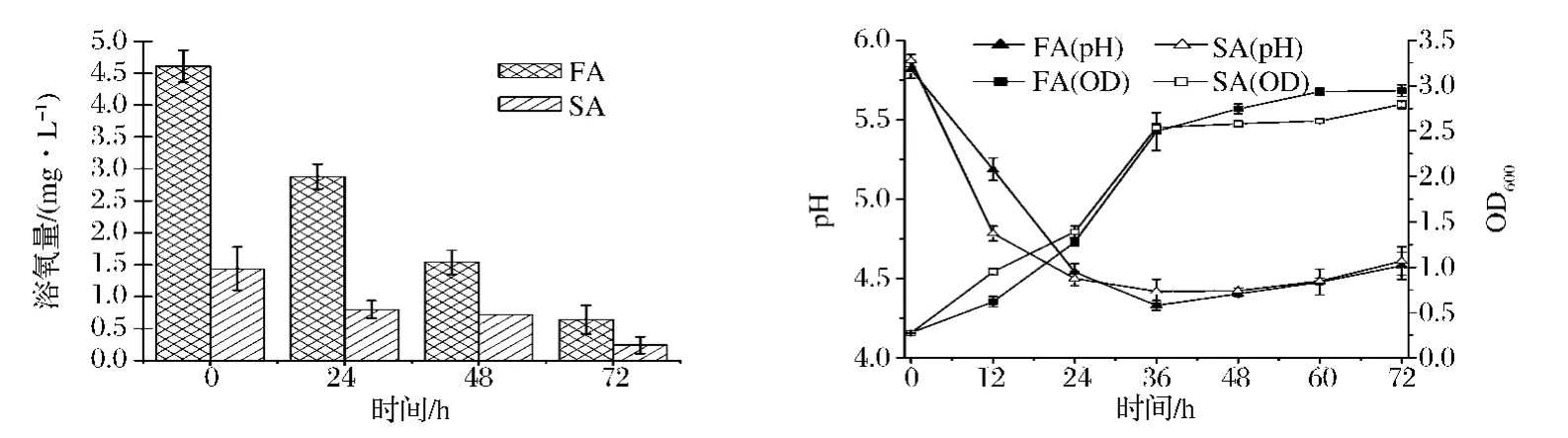
图1 不同条件下培养基中pH值、生物量及溶解氧变化Fig.1 Changes of biomass,pH value and dissolved oxygenin different condition medium
2.2 Bacillus sp.C2发酵结果
Bacillus sp.C2在兼性厌氧与专性厌氧条件下葡萄糖利用速率及产溶剂和有机酸结果如图2所示。葡萄糖初始浓度为47.3 g/L,发酵84 h之后葡萄糖完全利用,发酵前期(72 h)专性厌氧条件下葡萄糖利用速率高于兼性厌氧,而发酵后期兼性厌氧葡萄糖利用速率高于专性厌氧。发酵96 h总溶剂产生进入稳定期,丁醇、丙酮、乙醇在兼性厌氧和严格厌氧条件下最高产量分别为 9.50、2.63、0.89 g/L 和8.52、2.48、0.74 g/L,其丁醇得率分别为0.201和0.180 g/g。丁醇产量在兼性厌氧比严格厌氧条件下高11.50%,总溶剂产量高9.01%(图2A,2B)。

图2 兼性厌氧(A,C)和专性厌氧(B,D)条件下溶剂、酸的产量及葡萄糖质量浓度Fig.2 Concentration of butanol,acetone,ethanol,acids and glucose consumed under facultative anaerobic(A,C)and strictly anaerobic(B,D)condition
乙酸、丁酸作为丁醇代谢途径中的重要中间产物,对丁醇的产生有巨大的影响。Clostridium acetobutylicum丁醇发酵过程产酸阶段未解离酸类物质累积过快将导致发生“Acid Crash”现象,其中甲酸是引起该现象最主要的原因[16-17]。Bacillus sp.C2在兼性厌氧和严格厌氧条件下发酵产生酸类物质的变化情况如图(2C、2D)。兼性厌氧发酵时甲酸、乙酸、丁酸在0~12 h阶段急剧增加,最大值分别为0.288、2.398和2.295 g/L;之后由产酸阶段转入产溶剂阶段,甲酸、丁酸含量逐渐下降,乙酸含量维持2.4 g/L左右。严格厌氧条件发酵显示甲酸、乙酸和丁酸分别在12、36和24 h达到最大值0.137 9、3.142和2.521 g/L。结果对比发现严格厌氧比兼性厌氧条件下发酵产酸阶段时间延长,丁酸和乙酸含量分别高出9.69%和31.02%。总体来说,Bacillus sp.C2在兼性厌氧比之严格厌氧条件下发酵产生的溶剂量高出9.01%,酸类的总含量却低10.99%。
2.3 关键酶活性分析
丁醇发酵过程中12~72 h细胞内关键酶酶活性变化检测结果如图3所示。乙醇脱氢酶是乙醇途径中依赖NAD+将乙醛氧化还原为乙醇的关键酶,其酶活性在严格厌氧和兼性厌氧条件下存在显著差异(图3A)。在发酵初期12 h产酸阶段,严格厌氧条件下的菌体胞内乙醇脱氢酶活性已经达到最高值1.766 U/mg,比兼性厌氧条件下的菌体胞内酶活性高21.29%,之后严格厌氧条件下的乙醇脱氢酶酶活性开始下降,兼性厌氧条件乙醇脱氢酶活性逐渐上升,并在36 h达到最大值1.752 U/mg。整个酶活性变化过程分析可知,发酵36 h之前严格厌氧发酵菌体胞内乙醇脱氢酶活性由大到小的变化,而兼性厌氧发酵胞内酶活性由小到大的变化,导致严格厌氧发酵初期乙醇的产生速率高于兼性厌氧发酵;但是从36 h后兼性厌氧发酵菌体胞内乙醇脱氢酶酶活性高于严格厌氧发酵乙醇脱氢酶活性,并且兼性厌氧条件下胞内乙醇脱氢酶酶活性维持时间长、下降速率小;这期间乙醇产生速率加快,最后乙醇产量兼性厌氧比严格厌氧发酵高出18.99%。
丁醇脱氢酶和丁醛脱氢酶是丁醇产生途径的关键酶,丁醛脱氢酶依赖NAD+作用于丁酰辅酶A转化为丁醛,然后丁醇脱氢酶依赖于NADP+作用于丁醛使其转化为丁醇。此二者酶活性的高低、酶活性保持时间的长短直接影响到丁醇的产量。如图3B、3C所示,发酵初期12 h,严格厌氧条件二者酶活性分别1.169和0.131 U/mg,分别高出兼性厌氧条件下丁醇脱氢酶和丁醛脱氢酶4.09%和18.01%,此后两种酶活性随发酵时间的延长逐渐降低。发酵12 h后兼性厌氧条件下的丁醇脱氢酶和丁醛脱氢酶酶活性开始增长,并在36 h达到最高值,酶活性分别为1.272和0.132 U/mg,比严格厌氧分别高 12.4%和12.8%。此现象与乙醇脱氢酶活性变化规律一致。发酵结束后测得丁醇产量数据显示,兼性厌氧发酵比严格厌氧发酵丁醇产量提高11.50%(图3B、3C)。

图3 Bacillus sp.C2在兼性厌氧与严格厌氧条件下6种关键酶活性变化Fig.3 Changes of Bacillus sp.C2 about six kinds of key enzyme activity under facultative anaerobic and strictly anaerobic condition
辅酶A转移酶是丙酮支路的关键酶,也是乙酸逆向生成乙酰辅酶A和丁酸逆向代谢生成丁酰辅酶A过程中的关键酶。当发酵液中乙酸盐、丙酸盐和丁酸盐累积生成并作为基质的时候,CoA T的活性开始增长至最大值[18-19]。若是菌体细胞内缺乏CoA T表达活性,将导致溶剂丁醇产量的降低或者没有丁醇产生,CoA T活性缺乏的菌株大多数伴随着丁醇脱氢酶活性的缺乏[15]。如图3 D中严格厌氧发酵菌体胞内CoA T的活性在12 h达到最高值2.47 U/mg,随后逐渐下降;兼性厌氧发酵菌体胞内CoA T的活性在整个检测范围内先升高后降低,最高点在36 h的2.48 U/mg。兼性厌氧条件下CoA T的活性明显比严格厌氧条件下酶活性保持时间久,直接导致兼性厌氧条件丙酮产量高于严格厌氧条件丙酮产量6.1%。分析乙酸和丁酸产量变化(图2C、2D)发现丁酸存在逆向重复吸收利用的现象,可以推测CoA T活性高低是丙酮合成与酸类物质逆向转化吸收重要的因素之一,特别是在丁酸逆向转化为丁酰辅酶A后再经过丁醇脱氢酶/丁醛脱氢酶转化生成丁醇途径起到的作用更加明显。
乙酸激酶和丁酸激酶分别作用于乙酰磷酸去磷酸化和丁酰磷酸去磷酸化产生乙酸和丁酸,同时产生能量ATP[20]。乙酸和丁酸的累积会通过上述CoA T的作用进行重复吸收分别转化为乙酰辅酶A和丁酰辅酶A,它们分别是乙醇和丁醇合成途径中重要的中间代谢物。图3E、图3F分别是Bacillus sp.C2菌株在严格厌氧和兼性厌氧发酵过程中乙酸激酶和丁酸激酶的变化趋势图。严格厌氧条件下的乙酸激酶和丁酸激酶活性在检测范围初期(12 h)分别为0.251和0.301 U/mg,比兼性厌氧高31.3%和77.1%,随着发酵的继续兼性厌氧条件酶活性开始上升,发酵24 h达到最高值,此时的酶活性超越严格厌氧条件下的酶活性。对照乙酸和丁酸产量变化亦可发现,严格厌氧比之兼性厌氧条件乙酸和丁酸的产量高。
3 讨论
目前报道的丁醇产生菌多数均为专性厌氧的梭状芽孢杆菌,主要是 C.beijerinckii、C.acetobutylicum、C.saccharoperbutylacetonicum、C.saccharobutylicum4个种[21-22]。专性厌氧发酵对仪器设备有着严格的要求,加大了丁醇生产的成本。另外对于专性厌氧微生物来讲,氧气的存在对微生物的生长、代谢途径、底物消耗和产物产生均带来负面影响。早在20世纪30年代Kanysi和Dutky已经研究了氧气对丁醇产生菌的影响,发现氧气的存在下菌体生长受到严重抑制[23]。此后 O’Brien和 Morris同样研究了氧气对C.acetobutylicum生长和代谢的影响,发现当氧气的含量上升到一定值,底物消耗速率明显降低,菌体体内DNA、RNA和蛋白质的合成终止,还会导致芽孢形成的加剧[24]。因此,提高丁醇发酵菌株对氧气的耐受能力是降低丁醇发酵成本、优化发酵工艺、提高发酵产物量及促进丁醇工业化发酵的关键突破点之一。
王少华等[25]研究了利用氧气控制发酵培养基氧化还原电位对Clostridium acetobutylicum DSM 1731丁醇发酵的影响,结果发现控制不同值的氧化还原电位导致不一样发酵结果,特别是控制氧化还原电位在-290 mV溶剂总产量比对照组提高了35%,同时分析代谢流显示溶剂化阶段提前,发酵前24 h的碳代谢流明显增强。碳代谢流的增强影响乙酰辅酶A、乙酰乙酰辅酶A和丁酰辅酶A等中间代谢物累积,而它们又是乙醇、丙酮和丁醇产生的前体,因此在适当的氧化还原电位值可以促进细胞碳代谢流从而提高溶剂的产生。Kim 等[26]对 Clostridium acetobutylicum ATCC 824关于不同值的氧化还原电位发酵研究也得出类似论点,当选择一个适当氧化还原电位值丁醇的产量可能会明显提高。
本研究中Bacillussp.C2在兼性厌氧条件下发酵产生溶剂量高于严格厌氧发酵产生溶剂量的11.5%。对不同溶氧量条件下的关键酶活性检测对比分析发现,兼性厌氧比严格厌氧条件下酶活性高,在酶活性保持时间方面也有明显的提高,丁醇产量高。为今后的工作提出了新的研究方向,探索Bacillus sp.C2最佳的发酵溶氧量,然后确定其合适丁醇发酵的氧化还原电位值;分析在不同溶氧条件下细胞代谢通量的变化及差异,期望能促进关键酶高效表达,提高溶剂产量。
4 结论
通过对Bacillus sp.C2在不同溶氧条件下发酵试验结果整理分析得出,在兼性厌氧条件下发酵产生总溶剂和丁醇分别是13.02和9.50 g/L,丁醇的得率为0.201 g/g;严格厌氧条件下发酵产生总溶剂和丁醇分别是11.74和8.53 g/L,丁醇的得率为0.180 g/g;兼性厌氧比严格厌氧条件下总溶剂和丁醇分别提高11.50%和9.01%。关键酶活性结果对比分析发现,在发酵延滞期兼性厌氧条件下乙醇脱氢酶、丁醇脱氢酶、丁醛脱氢酶、乙酰乙酰辅酶A转移酶乙酸激酶、丁酸激酶活性低于严格厌氧条件下其酶活性。然而随着发酵时间的延长,当发酵时间到24 h之后,兼性厌氧条件下的酶活性逐步超越严格厌氧条件酶活性且持续增长至36 h后开始缓慢降低,并且兼性厌氧比严格厌氧条件下酶活性保持时间较长有利于溶剂产生。
[1] Jang Y S,Malaviya A,Cho C,et al.Butanol production from renewable biomass by Clostridia [J].Bio Resource and Technology,2012,123(20):653-663.
[2] JIN Chao,YAO Ming-fa,LIU Hai-feng,et al.Progress in the production and application of n-butanol as a biofuel[J].Renewable and Sustainable Energy Reviews,2011,15(8):4 080-4 160.
[3] 段晓瑞,王根宇,刘宏娟,等.兼性厌氧芽胞杆菌 TSH1丁醇代谢途径中关键酶的检测[J].生物工程学报,2013,29(5):620-629.
[4] Jones D T,Woods D R.Acetone-butanol fermentation revisited [J].Microbiology Reviews,1986,50(4):484-524.
[5] Qureshi N,Ezeji T C,Ebener J,et al.Butanol production by Clostridium beijerinckii.Part I:use of acid and enzyme hydrolyzed corn fiber [J].Bioresource and Technology,2008,99(13):5 915-5 922.
[6] ZHENG Y N,LI L Z,XIAN M,et al.Problems with the microbial production of butanol[J].Journal of Industrial Microbiology and Biotechnology,2009,36(9):1 127-1 138.
[7] LAN E I,LIAO J C.Metabolic engineering of Cyanobacteriafor 1-butanol production from carbon dioxide[J].Metabolic Engineering,2011,13(4):353-363.
[8] Dhamole P B,WANG Z L,LIU Y Q,et al.Extractive fermentation with non-ionic surfactants to enhance butanol production[J].Biomass and Bioenergy,2012,40(5):112-119.
[9] 杨积晴.重铬酸钾-三氯化钛法测定水中溶解氧[J].环境监测管理与技术,1996,8(5):23-24.
[10] 王风芹,谢慧,楚乐然.产丁醇芽孢杆菌的分离、筛选与鉴定[J].微生物学通报,2010,37(1):7-11.
[11] Stephen F H,ZHU C X.Butanol-ethanol dehydrogenase and butanol-ethanol-isopropanol dehydrogenase:different alcohol dehydrogenases in two strains of Clostridium beijerinckii(Clostridiumbutylicum)[J].Applied and Environment Microbiology,1987,53(4):697-703.
[12] Diirre P,Kuhn A,Gottschalk G.Treatment with allyl alcohol selects specifically for mutants of Clostridium acetobutylicum defective in butanol synthesis[J].FEMS Microbiology Letters,1986,36(1):77-81.
[13] Aceti D J,Ferry J G.Purification and characterization of acetate kinase from acetate-grown Methanosarcinathermophila-Evidence for regulation of synthesis[J].Journal of Biological Chemistry,1988,263(30):15 444-15 448.
[14] Rose I A.Acetate kinase of bacteria(acetokinase)[J].Methods in Enzymology,1955,1:591-593.
[15] Sandra W C,George N B,Frederick B R.Isolation and characterization of mutants of Clostridium acetobutylicum ATCC 824 deficient in acetoacetyl-coenzyme A:acetate/butyrate:coenzyme A-transferase(EC 2.8.3.9)and in other solvent pathway enzymes[J].Applied and Environment Microbiology,1989,55(4):970.
[16] Maddox I S,Steiner E,Hirsch S,et al.The cause of“Acid Crash”and“Acidogenic Fermentations”during the batch acetone-butanol-ethanol(ABE)fermentation process[J].Journal of Molecular Microbiology and Biotechnology,2000,2(1):95-100.
[17] WANG S,ZHANG Y,DOMG H,et al.Formic acid triggers the“Acid Crash”of acetone-butanol-ethanol fermentation by Clostridiumacetobutylicum[J].Applied and Environment Microbiology,2011,77(5):1 674-1 680.
[18] Weisenborn D P,Rudolph F B,Papoutsakis E T.Coenzyme A transferase from Clostridium acetobutylicum ATCC 824 and its role in the uptake of acids[J].Applied and Environment Microbiology,1989,55(2):323-329.
[19] Cary J W,Petersen D J,Papoutsakis E T,et al.Cloning and expression of Clostridium acetobutylicum ATCC 824 acetoacetyl-coenzyme A:acetate/butyrate:coenzyme A-transferase in Escherichia coli[J].Applied and Environment Microbiology,1990,56(6):1576.
[20] Wouter K,Nigel P M,Ana M L,et al.Disruption of the acetate kinase(ack)gene of Clostridium acetobutylicum results in delayed acetate production[J].Applied and Microbiology Biotechnology,2012,3(94):729-741.
[21] Keis S,Shaheen R,Jones D T.Emended descriptions of Clostridium acetobutylicum and Clostridium beijerinckii,and descriptions of Clostridium saccharoperbutylacetonicum sp.nov.and Clostridium saccharobutylicum sp.nov.[J].International Journal of Systematic and Evolutionary Microbiology,2001,51(6):2 095-2 103.
[22] Papoutsakis E T.Engineering solventogenic Clostridia[J].Current Opinion in Biotechnology,2008,19(5):420-429.
[23] Kanysi G,Dulky S R.The growth of a butanol Clostridium in relation to the oxidation-reduction potential and oxygen content of the medium[J].Journal of Bacteriology,1936,31(2):137-149.
[24] O’Brien R W,Morris G.Oxygen and the growth and metabolism of Clostridium acetobutylicum[J].Journal of General Microbiology,1971,68(1):307-318.
[25] WANG S,ZHU Y,ZHANG Y,et al.Controlling the oxidoreduction potential of the culture of Clostridium acetobutylicumleads to an earlier initiation of solventogenesis,thus increasing solvent productivity[J].Applied and Microbiology Biotechnology,2012,93(3):1 021-1 030.
[26] Kim J,Rakesh B,Eugene L I.Redox potential in acetone– butanol fermentations[J].Applied and Biochemistry Biotechnology,1988,18(1):175-186.
