西花蓟马细胞色素P450 基因cDNA 片段克隆与mRNA 表达分析
2015-12-16董红刚谢志娟杜予州王建军
董红刚,谢志娟,杜予州,王建军*
(1.扬州市邗江区植保植检站,江苏扬州 225009;2.泰州市靖江市植保植检站,江苏泰州 214500;3.扬州大学园艺与植物保护学院,江苏扬州 225009)
西花蓟马Frankliniella occidentalis 是蔬菜、果树和观赏作物上重要害虫(Kirk et al.,2003),除了直接取食作物造成危害,还能传播番茄斑萎病毒(TSWV)和凤仙坏死斑点病毒(INSV)(Bielza,2008),目前在欧洲、非洲、亚洲、美洲、大洋洲等69个国家和地区都有发生和危害报道。我国自从2003年7月在北京郊区保护地的辣椒和黄瓜上首次发现了西花蓟马的入侵为害以来(张友军等,2003),目前在山东、云南、贵州、浙江、湖南、江苏、西藏等地都有西花蓟马发生的报道(郑长英等,2007;梁贵红等,2007;袁成明等,2008;刘佳等,2010;严侃丹等,2010;王海鸿等,2013),并呈进一步传播蔓延趋势。目前防治西花蓟马仍以化学药剂为主要手段,但由于化学药剂的大量使用,已经导致西花蓟马对有机氯、有机磷、氨基甲酸酯、拟除虫菊酯和多杀菌素等多种杀虫剂产生了不同程度的抗药性(Bielza,2008;陈雪林等,2011)。
阿维菌素是一种大环内酯抗生素类广谱高效杀虫杀螨剂,也是防治西花蓟马的主要药剂之一。Immaraju 等(1992)研究了美国加利福尼亚沿海地区西花蓟马田间种群对阿维菌素的抗药性,发现加利福尼亚San Diego 和Santa Barbara 地区4个西花蓟马田间种群在LC90水平上对阿维菌素分别产生了18 倍、245 倍、798 倍和101 倍的抗性。最近,Chen 等(2011)对西花蓟马敏感品系进行18 代15 次抗性选育,获得了对阿维菌素具有45.5倍的西花蓟马抗性品系,增效实验和解毒酶活性测定发现,西花蓟马对阿维菌素的抗性可能与多功能氧化酶活性提高有关。本文在此基础上克隆了5个属于CYP4 家族的西花蓟马细胞色素P450酶基因cDNA 片段,并通过实时荧光定量PCR 分析了这5个基因在西花蓟马对阿维菌素抗性和敏感品系中的表达差异。
1 材料与方法
1.1 供试昆虫
西花蓟马相对敏感品系(ABA-S)由浙江省农业科学院植物保护与微生物研究所提供。该品系是2003年从中国农业科学院蔬菜花卉研究所的温室甜瓜上采集的,在室内未接触任何药剂的情况下用豆荚法长期饲养。光照培养箱饲养条件为:温度27℃±1℃、相对湿度60%-75%、光周期L∶D=16 h∶8 h。西花蓟马相对抗性品系(ABA-R)由Chen 等(2011)对西花蓟马相对敏感品系(ABA-S)进行阿维菌素抗性选育获得。经过18 代15 次抗性选育,获得了相对于敏感品系对阿维菌素抗性倍数达45.5 倍的西花蓟马抗性品系。取生长一致的相对敏感和抗性品系2 龄若虫保存于-80℃待用。
1.2 主要试剂
pGEM-T vector 和SV total RNA isolation system购自 Promega 公司,Ex TaqTMDNA 聚合酶、PrimescriptTMFirst-Strand cDNA Synthesis kit 和SYBR® PrimeScriptTMRT-PCR Kit II 购自TaKaRa公司。
1.3 总RNA 提取与cDNA 合成
相对敏感和抗性品系2 龄若虫总RNA 的提取参照SV Total RNA isolation System 说明书。RTPCR 和荧光定量RT-PCR 所用cDNA 模板的合成分别参照PrimescriptTMFirst-Strand cDNA Synthesis kit和SYBR® PrimeScriptTMRT-PCR Kit II 操作说明。
1.4 反转录聚合酶链式反应(RT-PCR)
根据昆虫CYP4 保守性氨基酸残基设计简并引物(表1)。25μL PCR 反应体系中含:14.5μL ddH2O;2.5μL 10×Ex TaqTMBuffer(Mg2+Free);2μL MgCl2(25 mM);2μL dNTPs(10 mM);1μL 上游/下游引物(10μM);1μL 8×Ex TaqTM聚合酶;1μL cDNA 模板。PCR 扩增条件为:94℃预变性5 min;94℃变性30s,52℃-41℃(每个循环降低1℃)退火30s,72℃延伸2 min,循环12 次;94℃变性30s,40℃退火30s,72℃延伸2 min,循环25 次;72℃延伸10 min。PCR 产物经低熔点琼脂糖凝胶电泳回收和基因纯化试剂盒纯化后,克隆于pGEM-T vector 并转化到感受态大肠杆菌DH5α 中,阳性克隆送上海生工生物工程技术服务有限公司用通用引物进行序列测定。
1.5 序列分析和系统发育树构建
利用Clustal W 进行多重序列比对。利用Mega 5 构建系统发育树。
1.6 荧光定量PCR
根据克隆获得的5个西花蓟马CYP4 基因的cDNA 序列设计、合成荧光定量PCR 特异性引物(表1)。以Cifuentes 等(2012)报道的β-Actin 基因作为内参基因。在20μL 实时荧光定量PCR 反应体系中含有:SYBR Premix EX TaqTMII(2×)10.0μL、基因特异性上游引物(10μM)0.8μL、基因特异性下游引物(10μM)0.8μL、ROX Reference Dye II(50×)0.4μL、cDNA 模 板2μL,灭菌超纯水6.0μL。在CFX96TM实时荧光定量PCR 仪(Bio-Rad,美国)上按下列条件进行反应:95℃预变性3 min,然后95℃变性10 s、60℃退火15 s 共40个循环。反应以水为阴性对照,每个处理3 次重复。反应完成后收集Ct 值,并分析熔解曲线检测扩增反应的特异性,对Ct 值采用2-ΔΔCt法进行定量分析,用DPS 软件进行平均值与标准差的计算。

表1 PCR 引物Table 1 Primers used in PCR amplification
2 结果与分析
2.1 西花蓟马CYP4 基因cDNA 片段的克隆
根据昆虫CYP4 保守性氨基酸残基设计简并引物通过RT-PCR 扩增出5个CYP4 基因cDNA 片段,分别命名为CYP4-1、CYP4-2、CYP4-3、CYP4-4、CYP4-5,其中CYP4-1 和CYP4-4 核苷酸序列长449 bp,编码149个氨基酸;CYP4-2 和CYP4-3 核苷酸序列长443 bp,编码147个氨基酸;CYP4-5核苷酸序列长446 bp,编码148个氨基酸(图1A和B)。多重序列比对发现,这5个基因在氨基酸水平的一致性在40%-76% 之间,并且都含有P450 蛋白的保守结构域,如螺旋K 区的保守性基序EXXRXXP 和血红素结合区的细胞色素P450 特征性基序FXXGXRXCXG(图1B)。系统发生分析表明这5个基因都属于CYP4 家族(图2)。
2.2 西花蓟马CYP4 基因mRNA 表达分析
通过实时荧光定量PCR 分析了本文克隆的5个CYP4 基因在西花蓟马敏感和阿维菌素抗性品系2 龄若虫中的mRNA 表达水平。结果表明,抗性品系CYP4-1、CYP4-2 和CYP4-5 相对于敏感品系的表达倍数分别为3.50、4.00 和2.48 倍,但抗性品系与敏感品系CYP4-3 和CYP4-4 基因的表达水平不存在显著差异(图3)。

图1 西花蓟马5个CYP4 基因的核苷酸(A)和氨基酸(B)序列比对Fig.1 Nucleotide(A)and amino acid sequence(B)alignment of five CYP4 genes in Frankliniella occidentalis

图2 不同昆虫细胞色素P450 系统发生Fig.2 Phylogenetic tree of cytochrome P450 proteins in different insect species
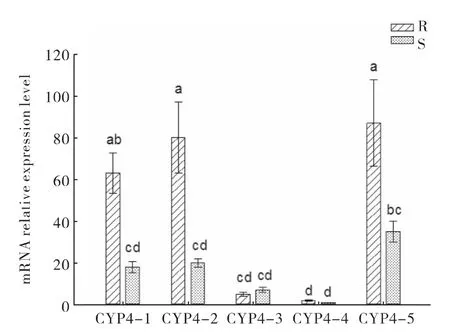
图3 P450 基因在西花蓟马敏感和抗性品系中的表达分析Fig.3 The relative expression levels of P450 genes in susceptible and abamectin resistant strain of Frankliniella occidentalis
3 结论与讨论
多功能氧化酶是昆虫体内重要的解毒酶系,在对外源化合物的解毒代谢和杀虫剂抗性机制中起着重要作用(邱星辉等,2003;Li et al.,2007)。Immaraju 等(1992)首次报道了美国加州4个西花蓟马温室种群对氯菊酯的抗性可能与多功能氧化酶有关,在LC50和LC90水平上胡椒基丁醚(PBO)对氯菊酯的增效倍数分别达到2.7-20.0和8.3-50.2 倍。Espinosa 等(2005)研究发现,PBO 对伐虫脒、灭虫威、氟丙菊酯、溴氰菊酯和甲胺磷等西花蓟马抗性选育种群分别具4.6、3.3、92.6、12.5 和14.3 倍的增效作用。Thalavaisundaram等(2008)研究发现,PBO 对2个对氟胺氰菊酯产生高水平抗性的澳大利亚西花蓟马田间种群的增效倍数分别达到266 和790 倍。王圣印等(2011)测定了西花蓟马抗吡虫啉品系中多功能氧化酶3个组分的含量以及活性,发现在抗性品系中,细胞色素P450 含量是敏感品系的4.5 倍,细胞色素b5含量是敏感品系的4.23 倍,甲氧试卤灵-O-脱甲基酶(MROD)活性是敏感品系的5.99 倍,表明多功能氧化酶在西花蓟马对吡虫啉的抗性中发挥着重要作用。最近,Cifuentes 等(2012)通过实时荧光定量PCR 研究发现,与敏感品系相比,抗性指数达932 倍的抗氟丙菊酯西花蓟马品系二龄若虫和成虫中CYP6EB1 和CYP6EC1均过量表达,说明CYP6EB1 和CYP6EC1 可能与西花蓟马对氟丙菊酯抗性有关。这些研究表明,多功能氧化酶代谢活性的增强可能是西花蓟马对多种杀虫剂产生抗性的共同机制。
阿维菌素是由土壤中灰色链霉菌Streptomyces avermitilis 发酵产生的十六元大环内酯化合物,是高效广谱杀虫杀螨剂,主要作用于γ-氨基丁酸受体和谷氨酸门控氯离子通道。Pu 等(2010)利用增效试验和解毒酶活性测定对一个具有23670 倍抗性的阿维菌素抗性选育小菜蛾品系(TH-Abm)的研究发现,多功能氧化酶活性提高是TH-Abm 品系对阿维菌素产生高水平抗性的重要机制。对烟粉虱的研究也发现多功能氧化酶与阿维菌素抗性相关(Wang et al.,2007)。最 近,Chen 等(2011)以西花蓟马敏感品系和对阿维菌素具有45.5 倍的西花蓟马抗性品系为材料,通过增效实验研究发现,酯酶抑制剂脱叶磷(DEF)、谷胱甘肽S-转移酶抑制剂马来酸二乙酯(DEM)和PBO对西花蓟马相对敏感品系的增效倍数分别为0.77、0.84 和1.19 倍,对抗性品系的增效倍数分别为0.97、0.93 和3.00 倍,表明西花蓟马对阿维菌素的抗性可能与多功能氧化酶活性提高有关。进一步测定了敏感品系和抗性品系这3种解毒酶活性,发现相对于敏感品系,抗性品系多功能氧化酶活性提高了6.66 倍,但酯酶和谷胱甘肽S-转移酶活性没有显著差异。本文在此基础上通过RT-PCR 获得了5个属于CYP4 家族的西花蓟马细胞色素P450 酶基因cDNA 片段,对这5个CYP4 基因的荧光定量PCR 分析发现,阿维菌素抗性品系CYP4-1、CYP4-2 和CYP4-5 基因的mRNA 表达水平显著高于敏感品系,相对表达倍数分别为敏感品系的3.50、4.00 和2.48 倍,表明西花蓟马对阿维菌素的抗性可能与这3个P450 基因的过量表达相关。
References)
Bielza P.Insecticide resistance management strategies against the western flower thrips,Frankliniella occidentalis[J].Pest Management Science,2008,64(11):1131-1138.
Chen X,Yuan L,Du Y,et al.Cross-resistance and biochemical mechanisms of abamectin resistance in the western flower thrips,Frankliniella occidentalis[J].Pesticide Biochemistry and Physiology,2011,101:34-38.
Chen XL,Du YZ,Wang JJ,et al.Advance in insecticide resistance of the western flower thrips,Frankliniella occidentalis[J].Plant Protection,2011,37(5):34-38.[陈雪林,杜予州,王建军,等.西花蓟马抗药性研究进展[J].植物保护,2011,37(5):34-38]
Cifuentes D,Chynoweth R,Guillén J,et al.Novel cytochrome P450 genes,CYP6EB1 and CYP6EC1,are over-expressed in acrinathrinresistant Frankliniella occidentalis(Thysanoptera:Thripidae)[J].Journal of Economic Entomology,2012,105(3):1006-1018.
Espinosa PJ,Contreras J,Quinto V,et al.Metabolic mechanisms of insecticide resistance in the western flower thrips,Frankliniella occidentalis(Pergande)[J].Pest Management Science,2005,61(10):1009-1015.
Immaraju JA,Paine TD,Bethke JA,et al.Western flower thrips(Thysanoptera:Thripidae)resistance to insecticides in coastal California greenhouses[J].Journal of Economic Entomology,1992,85(1):9-14.
Kirk WDJ,Terry LI.The spread of the western flower thrips Frankliniella occidentalis(Pergande)[J].Agricultural and Forest Entomology,2003,5(4):301-310.
Li X,Schuler MA,Berenbaum MR.Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics[J].Annual Review of Entomology,2007,52:231-253.
Liang GH,Zhang HR,Li ZM,et al.Studies on the species of flower thrips and its occurence in Dounan Chenggong county of Yunnan[J].Southwest China Joumal of Agricultural Sciences,2007,20(6):1291-1294.[梁贵红,张宏瑞,李自命,等.云南花丼莉马种类及发生研究[J].西南农学报,2007,20(6):1291-1294]
Liu J,Zhang L,Lu YH,et al.Preliminary investigation of invasive pest of Frankliniella occidentalis in Hunan province[J].Journal of Anhui Agricultural Sciences,2010,38(25):13800-13801.[刘佳,张林,卢焰梅,等.湖南外来入侵害虫西花蓟马初步调查[J].安徽农业科学,2010,38(25):13800-13801]
Pu X,Yang Y,Wu S.et al.Characterization of abamectin resistance in a field-evolved multiresistant population of Plutella xylostella[J].Pest Management Science,2010,66(4):371-378.
Qiu XH,He FQ,Li M.Insecticide resistance mediated by cytochrome P450s in insects[J].Chemistry of Life,2003,23(4):279-281.[邱星辉,何凤琴,李梅.细胞色素P450 介导的昆虫抗药性[J].生命的化学,2003,23(4):279-281]
Thalavaisundaram S,Herron GA,Clift AD.Pyrethroid resistance in Frankliniella occidentalis(Pergande)(Thysanoptera:Thripidae)and implications for its management in Australia[J].Australian Journal of Entomology,2008,47(1):64-69.
Wang HH,Lei ZR,Li X.An important invasive pest,Frankliniella occidentalis,inspected in Tibet[J].Plant Protection,2013,39(1):181-183.[王海鸿,雷仲仁,李雪.西藏发现重要外来入侵害虫-西花蓟马[J].植物保护,2013,39(1):181-183]
Wang LH,Wu YD.Cross-resistance and biochemical mechanisms of abamectin resistance in the B-type Bemisia tabaci[J].Journal of Applied Entomology,2007,131(2):98-103.
Wang SY,Liu YJ,Zhou XH,et al.Mechanisms of imidacloprid resistance in Frankliniella occidentalis[J].Chinese Journal of Applied Entomology,2011,48(3):559-565.[王圣印,刘永杰,周仙红,等.西花蓟马对吡虫啉抗性机制的研究[J].应用昆虫学报,2011,48(3):559-565]
Yan DK,Tang YX,He ZY,et al.Survey in Nanjing and the PCR diagnosis of Frankliniella occidentalis[J].Journal of Nanjing Agricultural University,2010,33(4):59-63.[严丹侃,汤云霞,贺子义,等.南京地区西花蓟马发生调查及其分子检测[J].南京农业大学学报,2010,33(4):59-63]
Yuan CM,Zhi JR,Li JZ,et al.Investigation on the species of thrips in fields of vegetable in Guizhou Province[J].China Plant Protection,2008,28(7):7-10.[袁成明,郅军锐,李景柱,等.贵州省蔬菜蓟马种类调查研究[J].中国植保导刊,2008,28(7):7-10]
Zhang YJ,Wu QJ,Xu BY,et al.The occurrence and damage of Frankliniella occidentalis(Thysanoptera:Thripidae):A dangerous alien invasive pest in Beijing[J].Plant Protection,2003,29(4):58-59.[张友军,吴青君,徐宝云,等.危险性外来入侵生物-西花蓟马在北京发生危害[J].植物保护,2003,29(4):58-59]
Zheng CY,Liu YH,Zhang NQ,et al.Invaded insect pest Frankliniella occidentalis first reported in Shandong Province[J].Journal of Qingdao Agricultural University(Natural Science),2007,24(3):172-174.[郑长英,刘云虹,张乃芹,等.山东省发现外来入侵有害生物-西花蓟马[J].青岛农业大学学报(自然科学版),2007,24(3):172-174]
