牙龈卟啉单胞菌c-di-AMP代谢相关基因的克隆及表达纯化
2015-12-16邱伟程兴群周学东李雨庆
邱伟 程兴群 周学东 李雨庆
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
c-di-AMP[1]是近些年继cAMP、c-di-GMP后新发现的一种在细菌和支原体中广泛存在的环核苷酸第二信使分子,这些细菌包括枯草芽孢杆菌(Bacillus subtilis)[1-3]、单核增生李斯特菌(Listeria monocytogenes)[4-6]、金黄色葡萄球菌(Staphylococcus aureus)[7]、肺炎链球菌(Streptococcus pyogenes)[8]、结核分枝杆菌(Mycobacterium tuberculosis)[9]、乳杆乳球菌(Lactococcus lactis)[10]。c-di-AMP能够调控多种细菌生理活动,与多种致病微生物的毒力因子密切相关。牙龈卟啉单胞菌(Porphyromonas gingivalis)是革兰氏阴性、专性厌氧的产黑色素杆菌,是目前公认的牙周炎主要病原菌之一[11-12]。本课题组通过前期的生物信息学分析发现,在牙龈卟啉单胞菌的基因组中存在一个c-di-AMP合成酶的编码基因(pgn0523)和两个c-di-AMP分解酶的编码基因(pgn1187,pgn2003)。本实验拟通过对这3个牙龈卟啉单胞菌第二信使分子c-di-AMP合成和分解代谢相关基因进行克隆以及表达纯化,得到较高浓度和纯度的目的蛋白,为进一步推测牙龈卟啉单胞菌c-di-AMP的体内代谢途径、探究c-di-AMP对牙龈卟啉单胞菌的生长及毒力的调控作用等奠定理论基础,为牙周炎疾病的防治提供新的理论依据。
1 材料和方法
1.1 材料
pET-28a载体(Novagen公司,德国),T4 DNA连接酶(TaKaRa公司,日本),Taq DNA聚合酶(Toyobo公司,日本),限制性核酸内切酶XbaⅠ和NotⅠ(TaKaRa公司,日本),Ni-Sepharose 6 Fast Flow(GE Healthcare公司,美国),基因组DNA抽提试剂盒、DNA凝胶回收试剂盒、柱式质粒小量抽提试剂盒[天根生化科技(北京)有限公司],BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),实验引物合成、DNA序列测定[生工生物工程(上海)股份有限公司]。
1.2 菌种和培养基
牙龈卟啉单胞菌ATCC33277(四川大学口腔疾病研究国家重点实验室),大肠杆菌(Escherichia coli)DH5α感受态细胞、BL21(DE3)感受态细胞[天根生化科技(北京)有限公司],LB培养基、改良BHI培养基(Sigma公司,美国)。
1.3 引物
根据GenBank所提供的牙龈卟啉单胞菌pgn0523、pgn1187和pgn2003基因序列设计并合成特异性引物(表1)。3个目的基因上下游引物均分别包含XbaⅠ和NotⅠ的限制性酶切位点。
1.4 目的基因的扩增
通过聚合酶链反应(polymerase chain reaction,PCR)克隆牙龈卟啉单胞菌ATCC33277的pgn0523、pgn1187和pgn2003三个基因。将牙龈卟啉单胞菌接种于改良BHI培养基(添加1 mg·L-1维生素K1、5%氯化血红素、5%脱纤维蛋白羊血)琼脂平板,37 ℃厌氧培养箱内(80%N2,10%CO2及10%H2)培养。3 d后常规接种、传代、涂片及生化鉴定,用磷酸盐缓冲液(phosphate buffered saline,PBS)将平板上的牙龈卟啉单胞菌菌落收集入2 mL的EP管中,使用细菌基因组DNA抽提试剂盒,按照说明书操作步骤提取牙龈卟啉单胞菌的基因组DNA。以牙龈卟啉单胞菌基因组DNA为模版进行PCR扩增,反应条件:94 ℃预变性5 min,进入热循环(98 ℃变性30 s,55 ℃退火30 s,68 ℃延伸2 min),共35个循环,最后68 ℃再延伸8 min。通过1.5%琼脂糖凝胶电泳检测PCR扩增产物,琼脂糖凝胶DNA回收试剂盒回收PCR产物中的目的基因片段。
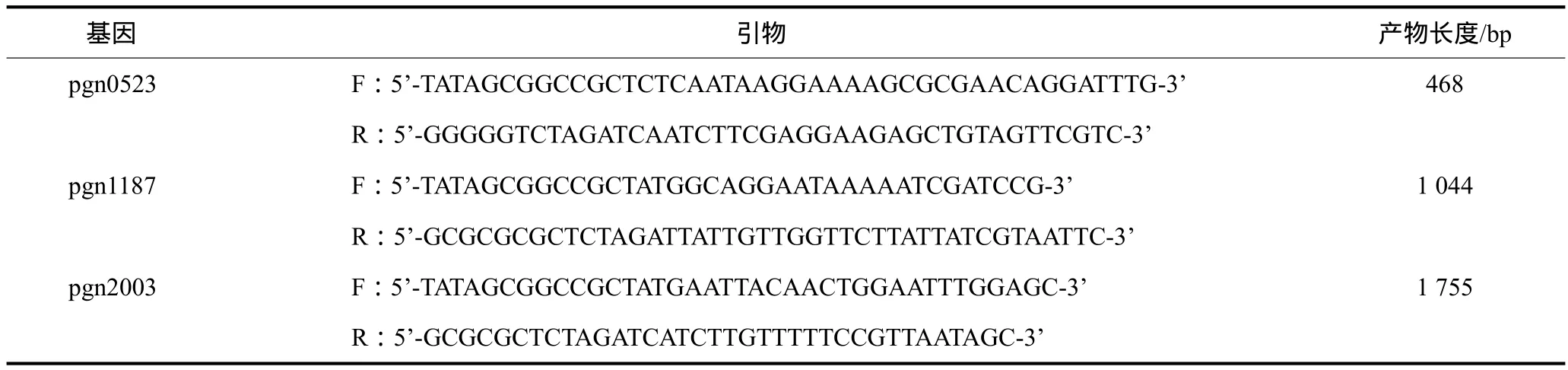
表1 pgn0523、pgn1187和pgn2003基因特异性引物Tab 1 Gene-specific primers for pgn0523, pgn1187 and pgn2003
1.5 含目的基因的原核表达质粒的构建与鉴定
将扩增得到的目的基因片段与大肠杆菌表达质粒pET28a分别用限制性内切酶XbaⅠ和Not Ⅰ双酶切,通过琼脂糖凝胶电泳分别回收酶切产物中的目的基因片段和原核表达质粒pET28a片段,并用T4 DNA连接酶连接过夜,将连接产物转化到大肠杆菌DH5α感受态细胞中,涂布含有30 μg·mL-1卡那霉素的LB培养基琼脂平板,挑选卡那霉素阳性克隆进行增菌培养,提取质粒进行双酶切鉴定,并将其送至生工生物工程(上海)股份有限公司测序。测序正确的重组表达质粒分别命名为pET-pgn0523、pET-pgn1187和pET-pgn2003,-80 ℃保存备用。
1.6 目的蛋白在大肠杆菌中的诱导表达
将酶切验证及测序鉴定正确的重组质粒分别转化到大肠杆菌BL21(DE3)感受态细胞中,涂布含有卡那霉素(30 μg·mL-1)的LB培养基琼脂平板,挑选卡那霉素阳性克隆分别接种到2 mL含卡那霉素(30 μg·mL-1)的LB液体培养基中,37 ℃、200 r·min-1振荡培养过夜。次日以1︰100稀释,加入到4 mL含卡那霉素(30 μg·mL-1)的LB液体培养基中,37 ℃、200 r·min-1振荡培养2~3 h增菌,当吸光度OD600nm为0.6左右时,分别向培养液中加入终浓度为800 μg·mL-1的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG),37 ℃、150 r·min-1继续振荡培养以诱导目的蛋白表达。分别诱导2 h和6 h后,以5 000 r·min-1、4 ℃离心30 min收集菌体沉淀,并加入200 μlPBS重悬,吸取重悬液20 μL于EP管中,加入16 μL十二烷基磺酸钠(sodium dodecyl sulfate,SDS)上样缓冲液和4 μL二硫苏糖醇,混合后沸水煮10 min,10 000 r·min-1离心1 min。分别取10 μL制备好的蛋白样品进行SDS聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),电泳结束后通过0.1%考马斯亮蓝R-250染色分析鉴定。
1.7 镍离子金属亲和层析法纯化目的蛋白
将经SDS-PAGE分析确定目的蛋白得到正确表达的大肠杆菌菌株接种到2 mL含卡那霉素(30 μg·mL-1)的LB液体培养基中,37 ℃、200 r·min-1振荡培养过夜。次日以1︰100稀释,加入到100 mL含卡那霉素(30 μg·mL-1)的LB液体培养基中,37 ℃、200 r·min-1振荡培养2~3 h增菌,当OD600为0.6左右时,分别向培养液加入终浓度为800 μg·mL-1的IPTG,37 ℃、150 r·min-1继续振荡培养以诱导目的蛋白表达。分别诱导2 h和6 h后,以5 000 r·min-1、4 ℃离心30 min收集菌体沉淀,每克沉淀加入5 mL 缓冲液B(5 mmol·L-1咪唑、0.35 mol·L-1NaCl、20 mmol·L-1Tris-HCl、pH 8.0)重悬,冰浴下超声波破碎细胞。破碎后的裂解液10 000 r·min-1,4 ℃离心30 min。按照NI-NTA Purification System说明书提供的方法进行His标签亲和纯化。先以50 mmol·L-1咪唑缓冲液洗脱杂蛋白,最后以250 mmol·L-1咪唑缓冲液洗脱目的蛋白。将收集的洗脱液用透析柱浓缩除盐,用SDS-PAGE分析目的蛋白的纯度,用BCA法检测目的蛋白的浓度。
2 结果
2.1 目的基因PCR扩增产物的鉴定
琼脂糖凝胶电泳结果显示,目的基因pgn0523、pgn1187和pgn2003在大约500、1 000和1 800 bp处分别有特异性单一PCR产物条带,与预期大小(468、1 044和1 755 bp)一致(图1)。

图1 pgn0523、pgn1187和pgn2003基因PCR扩增产物琼脂糖凝胶电泳结果Fig 1 Agarose gel electrophoresis results of PCR products of pgn-0523, pgn1187 and pgn2003 genes
2.2 重组表达质粒的鉴定
琼脂糖凝胶电泳结果显示,重组表达质粒pET-pgn0523、pET-pgn1187和pET-pgn2003在大约5 000 bp处出现特异性条带,与预期重组质粒大小一致(图2)。其PCR产物分别在大约500、1 000、1 800 bp处有特异性单一条带,与3个目的基因大小一致(图2)。将重组质粒送往生工生物工程(上海)股份有限公司进行测序分析,将测序获得的序列经BLAST软件与GenBank中的牙龈卟啉单胞菌ATCC33277国际标准菌株基因序列比对分析,结果表明二者为100%一致。
2.3 目的蛋白在大肠杆菌中的诱导表达
重组表达质粒转化到大肠杆菌表达菌株BL21(DE3)中,经IPTG分别诱导表达2 h和6 h后,SDS-PAGE检测结果显示,分别在19.5×103、39.9×103、66.0×103处可见一条明显的蛋白质增强条带,与预期的3个目的蛋白大小相一致,说明目的蛋白得到成功诱导表达(图3)。

图2 重组质粒及其PCR验证产物琼脂糖凝胶电泳结果Fig 2 Agarose gel electrophoresis results of recombinant plasmids and PCR products

图3 SDS-PAGE检测目的蛋白经IPTG诱导表达的结果Fig 3 SDS-PAGE results of target proteins induced by IPTG
2.4 目的蛋白的亲和纯化
将诱导表达后的细菌菌体经过超声波裂解、镍离子金属亲和层析柱纯化以及Millipore透析柱浓缩除盐后,成功获得了较高浓度和纯度的目的蛋白。SDS-PAGE结果显示,纯化得到的蛋白与预期目的蛋白分子量一致(图4)。BCA法测定目的蛋白的浓度分别为0.708、0.523和0.861 mg·mL-1。

图4 SDS-PAGE检测目的蛋白组氨酸标签亲和纯化结果Fig 4 SDS-PAGE results of purified His-tag proteins
3 讨论
2008年,Karl-Peter Hopfner团队在枯草芽孢杆菌中做DNA完整性扫描蛋白A(DNA integrity scanning protein A,DisA)的晶体结构时意外发现了一种新的环式核苷酸第二信使分子c-di-AMP[1]。c-di-AMP在细菌和支原体中广泛存在,且可调控多种细菌生理活动,包括芽孢的产生、细菌耐药性、细胞大小的调节、刺激宿主免疫系统等[13-15]。Witte等[1]研究发现,枯草芽孢杆菌中DAC结构域具有二核苷酸环化酶活性。通过此结构域,DisA蛋白可将ATP转化为c-di-AMP,且与其他核苷酸相比,其更倾向于以ATP为底物。DAC结构域不仅存在于枯草芽孢杆菌中,其在细菌和支原体中广泛分布。c-di-AMP的分解蛋白是YybT,其是一个跨膜蛋白,具有3个功能性部分:与血红素相连的PAS(Per-ARNT-Sim)端,中间的GGDEF(Gly-Gly-Asp-Glu-Phe)结构以及具有磷酸二酯酶活性的DHH/DHHA1结构域,因此该蛋白又称为GdpP(a GGDEF domain protein containing PDE)[7]。分解c-di-AMP的主要结构域是DHH/DHHA1,其可将c-di-AMP分解为pApA[16]。
牙周炎是一种侵犯牙龈和牙周支持组织的慢性炎症性疾病[17],其主要特征为牙周袋形成以及袋壁炎症、牙槽骨吸收和牙齿逐渐松动脱落。目前,我国慢性牙周炎发病率高达80%以上,是导致成年人牙齿丧失的主要原因。此外,牙周炎与某些系统性疾病(尤其全身性皮肤病)的发生发展密切相关[18]。牙龈卟啉单胞菌是慢性牙周炎病变区域或活动部位最主要的优势菌。该菌的毒力主要体现在3个方面:1)通过菌毛、荚膜的黏附以及抗吞噬能力依附于宿主菌表;2)通过分泌牙龈素等细菌素破坏宿主免疫组织;3)通过一系列的调控作用来增加其他致病菌对宿主的毒力作用[19-20]。
NCBI数据库显示,牙龈卟啉单胞菌pgn0523基因序列编码一个假定的c-di-AMP合成酶。pgn1187和pgn2003基因则分别编码两个潜在的c-di-AMP分解酶,其催化结构域为DHH/DHHA1。本实验根据已发布的牙龈卟啉单胞菌ATCC33277的基因组序列设计出针对这3个基因的特异性PCR引物。通过PCR技术从牙龈卟啉单胞菌ATCC33277的基因组DNA中扩增出基因pgn0523、pgn1187和pgn2003,将其克隆至大肠杆菌表达载体pET28a,构建出原核重组表达载体pET-pgn0523、pET-pgn1187和pET-pgn2003。将重组质粒转化到大肠杆菌表达菌株BL21(DE3)中,用IPTG诱导表达融合蛋白,由于转录和翻译的起始由正常的大肠杆菌序列所控制,因而融合蛋白通常较易获得高效表达[21]。融合蛋白最后用Ni2+金属亲和层析法成功纯化到3个较高浓度和纯度的目的蛋白,从而探索出一套高效的构建牙龈卟啉单胞菌c-di-AMP代谢相关蛋白的原核表达体系。
实验选用的原核表达菌株BL21(DE3),带有噬菌体lacI基因、lacUV5启动子及T7 RNA聚合酶基因,只有在IPTG诱导下目的基因才开始转录,并缺乏纯化过程中降解蛋白的Lon蛋白酶及OmpT外膜蛋白酶,使得目的蛋白能更加稳定的存在。实验所用的原核表达质粒pET-28a载体属于pET载体系列,与许静等[22]表达牙龈卟啉单胞菌FimA重组蛋白所使用的pET-15b载体相似。pET-28a具有卡那霉素抗性,N末端有6个组氨酸标签,在IPTG诱导下表达目的蛋白,表达的融合蛋白含有6-His标签,可以被特异性吸附组氨酸的Ni2+金属亲和层析柱纯化,得到较纯的目的蛋白。His标签与其他标签相比有很多优点,如相对分子质量小,一般不会影响目的蛋白的功能;免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫和制备抗体;可以用Ni离子层析柱进行亲和纯化,目的蛋白纯度高,操作简单,成本低[23]。
本实验通过克隆牙龈卟啉单胞菌c-di-AMP代谢相关蛋白编码基因pgn0523、pgn1187和pgn2003,首次成功诱导表达并纯化得到了3个较高浓度和纯度的目的蛋白。最近,研究人员建立了体外检测c-di-AMP的多项技术,这为今后进一步验证和解析c-di-AMP代谢酶的催化机制提供了重要的技术保障。Bai等[9]通过高效液相色谱与质谱连用的方法成功对结核分枝杆菌c-di-AMP代谢酶的活性进行了验证。Zhou等[24]建立了高通量检测c-di-AMP的甲氧檗因(Coralyne)法,通过检测甲氧檗因与c-di-AMP形成复合物而产生的荧光变化来测定酶活性,并将该方法成功应用于c-di-AMP合成酶抑制剂的高通量筛选。本课题组后续将分别采用上述两种成熟的技术方法对获得的蛋白质活性进行验证,并进一步通过对蛋白质进行定点突变来鉴定调节其活性的关键氨基酸位点,为靶向牙龈卟啉单胞菌c-di-AMP代谢酶的药物筛选提供关键信息。本课题组曾多次尝试构建牙龈卟啉单胞菌c-di-AMP合成酶编码基因pgn0523的缺失突变株,然而由于其作为生存必需基因[25]而无法敲除;故本课题组计划构建c-di-AMP代谢相关基因的超表达菌株,用以进一步研究c-di-AMP作为第二信使分子调控牙龈卟啉单胞菌生命生理活动及毒力因子功能的分子机制,从而为牙周炎的有效防治提供新的理论依据。
[1]Witte G, Hartung S, Büttner K, et al. Structural biochemistry of a bacterial checkpoint protein reveals diadenylate cyclase activity regulated by DNA recombination intermediates[J].Mol Cell, 2008, 30(2):167-178.
[2]Oppenheimer-Shaanan Y, Wexselblatt E, Katzhendler J, et al. c-di-AMP reports DNA integrity during sporulation inBacillus subtilis[J]. EMBO Rep, 2011, 12(6):594-601.
[3]Luo Y, Helmann JD. Analysis of the role ofBacillus subtilisσ(M) in β-lactam resistance reveals an essential role for cdi-AMP in peptidoglycan homeostasis[J]. Mol Microbiol,2012, 83(3):623-639.
[4]Woodward JJ, Iavarone AT, Portnoy DA. c-di-AMP secreted by intracellularListeria monocytogenesactivates a host typeⅠinterferon response[J]. Science, 2010, 328(5986):1703-1705.
[5]Schwartz KT, Carleton JD, Quillin SJ, et al. Hyperinduction of host beta interferon by aListeria monocytogenesstrain naturally overexpressing the multidrug efflux pump MdrT[J].Infect Immun, 2012, 80(4):1537-1545.
[6]Yamamoto T, Hara H, Tsuchiya K, et al.Listeria monocytogenesstrain-specific impairment of the TetR regulator underlies the drastic increase in cyclic di-AMP secretion and beta interferon-inducing ability[J]. Infect Immun, 2012,80(7):2323-2332.
[7]Corrigan RM, Abbott JC, Burhenne H, et al. c-di-AMP is a new second messenger inStaphylococcus aureuswith a role in controlling cell size and envelope stress[J]. PLoS Pathog, 2011, 7(9):e1002217.
[8]Kamegaya T, Kuroda K, Hayakawa Y. Identification of aStreptococcus pyogenesSF370 gene involved in production of c-di-AMP[J]. Nagoya J Med Sci, 2011, 73(1/2):49-57.
[9]Bai Y, Yang J, Zhou X, et al.Mycobacterium tuberculosisRv3586 (DacA) is a diadenylate cyclase that converts ATP or ADP into c-di-AMP[J]. PLoS ONE, 2012, 7(4):e35206.
[10]Smith WM, Pham TH, Lei L, et al. Heat resistance and salt hypersensitivity inLactococcus lactisdue to spontaneous mutation of llmg_1816 (gdpP) induced by high-temperature growth[J]. Appl Environ Microbiol, 2012, 78(21):7753-7759.
[11]Chaudhuri S, Pratap S, Paromov V, et al. Identification of a diguanylate cyclase and its role inPorphyromonas gingivalisvirulence[J]. Infect Immun, 2014, 82(7):2728-2735.
[12]Hajishengallis G, Lamont RJ. Breaking bad: manipulation of the host response byPorphyromonas gingivalis[J]. Eur J Immunol, 2014, 44(2):328-338.
[13]Eiamphungporn W, Helmann JD. TheBacillus subtilissigma(M) regulon and its contribution to cell envelope stress responses[J]. Mol Microbiol, 2008, 67(4):830-848.
[14]Mehne FM, Gunka K, Eilers H, et al. Cyclic di-AMP homeostasis in bacillus subtilis: both lack and high level accumulation of the nucleotide are detrimental for cell growth[J].J Biol Chem, 2013, 288(3):2004-2017.
[15]Boye E. DisA, a busy bee that monitors chromosome integrity[J]. Cell, 2006, 125(4):641-643.
[16]Rao F, See RY, Zhang D, et al. YybT is a signaling protein that contains a cyclic dinucleotide phosphodiesterase domain and a GGDEF domain with ATPase activity[J]. J Biol Chem,2010, 285(1):473-482.
[17]Zheng Y, Zhou J, Sayre DA, et al. Identification of bromophenol thiohydantoin as an inhibitor of DisA, a c-di-AMP synthase, from a 1 000 compound library, using the coralyne assay[J]. Chem Commun: Camb, 2014, 50(76):11234-11237.
[18]Ertugrul AS, Arslan U, Dursun R, et al. Periodontopathogen profile of healthy and oral lichen planus patients with gingivitis or periodontitis[J]. Int J Oral Sci, 2013, 5(2):92-97.
[19]Jannasch A, Sedlak M, Adamec J. Quantification of pentose phosphate pathway (PPP) metabolites by liquid chromatography-mass spectrometry (LC-MS)[J]. Methods Mol Biol,2011, 708:159-171.
[20]Hajishengallis G, Lamont RJ. Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology[J]. Mol Oral Microbiol, 2012, 27(6):409-419.
[21]李昂, 谢红帼, 梁平, 等. 牙龈卟啉单胞菌菌毛蛋白FimA基因在大肠杆菌中的融合表达和纯化[J]. 华西口腔医学杂志, 2010, 28(3):241-245.
[22]许静, 李昂, 苟建重, 等. 牙龈卟啉单胞菌精氨酸牙龈素催化结构域基因的克隆及其在大肠杆菌中的表达[J]. 华西口腔医学杂志, 2006, 24(5):400-403.
[23]Structural Genomics Consortium, China Structural Genomics Consortium, Northeast Structural Genomics Consortium,et al. Protein production and purification[J]. NatMethods,2008, 5(2):135-146.
[24]Zhou J, Sayre DA, Zheng Y, et al. Unexpected complex formation between coralyne and cyclic diadenosine monophosphate providing a simple fluorescent turn-on assay to detect this bacterial second messenger[J]. Anal Chem, 2014,86(5):2412-2420.
[25]Klein BA, Tenorio EL, Lazinski DW, et al. Identification of essential genes of the periodontal pathogenPorphyromonas gingivalis[J]. BMC Genomics, 2012, 13:578.
