地塞米松诱导小鼠腭裂及E-钙黏素基因表达的研究
2015-12-16庞骁霄李丽马利郑谦李承浩
庞骁霄 李丽 马利 郑谦 李承浩
口腔疾病研究国家重点实验室 华西口腔医院唇腭裂外科(四川大学),成都 610041
非综合征型唇腭裂是颌面部最常见的先天性发育畸形,其病因复杂,目前认为与基因和环境因素有关。环境因素中如糖皮质激素类、四氯二苯对二恶英等均可诱发先天性腭裂。地塞米松(dexamethasone,DEX)作为糖皮质激素家族中的一员,具有较高的致畸风险,但具体致畸机制目前尚未清楚。有研究[1]发现,在正常腭融合过程中,腭突上皮细胞中E-钙黏素(E-cadherin)的表达受到抑制,导致腭中嵴上皮缝(medline epithelial seam,MES)裂解并形成上皮岛,最终完成腭突融合。E-cadherin是一种重要的黏附分子,在上皮融合过程中发挥重要作用。在此基础上,本研究通过注射DEX于孕鼠腹膜下,研究DEX作用下腭突中E-cadherin基因的表达情况,进一步探讨DEX对腭突发育的影响及导致腭裂的发病机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 8周龄C57BL/6J小鼠(购自四川大学实验动物中心),质量25~30 g,雌雄分笼饲养于SPF级动物房。实验动物自由摄食饮水,给予充足食物。饲养房的温度为20~25 ℃,分别给予光照与黑夜12 h,相对湿度20%~30%。雌雄合笼过夜,比例为2∶1,于晚18:00合笼,并于次日早7:30检查雌性小鼠的阴栓,查见阴栓之日定为孕0 d(embryonic day,E0),称重放入空笼饲养并做好记录。对E10.0的小鼠再次称重,如体重增加2 g以上则确定怀孕。
1.1.2 实验试剂和器材 生理盐水(normal sodium,NS)(湖南科伦制药公司),DEX(Sigma公司,美国),兔抗鼠E-cadherin抗体和试剂盒(ZYMED公司,美国)等。体视显微镜、光学显微镜,由四川大学口腔疾病研究国家重点实验室提供。
1.2 实验方法
1.2.1 实验分组及给药 孕鼠随机分为实验组和对照组,每组8只。实验组及对照组孕鼠于E10.0—E12.0每天称重后分别于腹膜下注射DEX和NS,DEX剂量为6 mg·kg-1,NS为每只0.1 mL。
1.2.2 标本获取及染色 在E13.5、E14.5、E15.5、E17.5用颈椎脱臼法处死孕鼠,无菌环境中取出胚胎。将胎鼠头部通过脱水、透明、浸蜡及包埋制成5 μm厚切片,切片脱蜡水化。对标本行苏木精-伊红(hematoxylin-eosin,HE)染色,置于光镜下观察腭部的组织学变化。孵化兔抗小鼠E-cadherin抗体对标本进行免疫组织化学染色,采用SABC法,抗体稀释度为1∶200,DAB显色,苏木精轻度复染,透明后经中性树胶封片,置于光学显微镜下观察。
1.2.3 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,real-time PCR)定量分析 体视显微镜下剪取E14.0、E14.5、E15.5的胎鼠腭突,置液氮中保存,将胎鼠腭突组织匀浆,用Trizol试剂提取组织中的总RNA,利用SYBR Premix Ex TapTMⅡ试剂盒(TaKaRa公司,日本)进行real time-PCR,对E-cadherin和β-钙黏素(β-catenin)mRNA的表达水平进行定量分析,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为目的基因的CT值参照。引物序列见表1。real-time PCR反应在ABI PRISM 7300系统(ABI公司,美国)中进行,反应条件:95 ℃,30 s;95 ℃,5 s;60 ℃,34 s,40个循环。
1.2.4 统计学分析 采用SPSS 13.0统计软件进行统计学分析,统计方法采用t检验和卡方检验,检验水准为双侧α=0.05。
2 结果
2.1 DEX诱导腭裂发生的情况
DEX组胎鼠共39只,17只出现腭裂,22只腭突融合,腭裂发生率为43.59%(17/39);对照组胎鼠共33只,1只出现腭裂,32只腭突融合,腭裂发生率为3.03%(1/33)。经统计学检验,2组的腭裂发生率有明显差异(P<0.05),DEX组明显高于对照组,说明DEX具有较高的致畸性。
2.2 HE染色观察
对照组和DEX组胎鼠的腭部形态如图1所示。E13.5,对照组胚胎舌体开始下降,腭突开始上抬并沿舌体两侧垂直向下生长;而DEX组胚胎舌体位置较高。E14.5,对照组舌体降至口底,两侧腭突上抬至舌体上方呈水平位,腭中嵴上皮在中线区形成MES;DEX组腭突位于舌体两侧开始上抬,上抬不规律且短小,两侧腭突不接触。E15.5,对照组MES消失,间充质细胞相互连接形成完整的腭突;DEX组腭突在舌体上方呈水平生长,两侧腭突体积短小,不能在中线区相互接触致形成腭裂。E17.5,对照组腭部发育基本完成,DEX组腭突短小,不能与鼻中隔完全接触,腭裂形成。
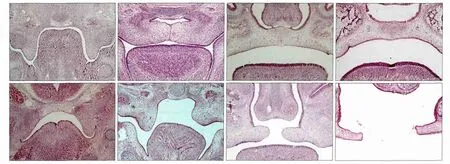
图1 对照组和DEX组胎鼠在不同时间的腭部形态 HE × 100Fig 1 Palate morphology of the mouse in the control and DEX groups at different time HE × 100
2.3 免疫组织化学染色观察
E-cadherin在腭突主要表达于上皮中,其染色阳性部位在细胞膜上。对照组和DEX组胎鼠的免疫组织化学染色结果见图2:以细胞膜染成淡黄色或棕褐色者作为阳性细胞,可见E-cadherin在细胞膜中高表达,细胞质与细胞核未检测到明显的表达。E13.5时,对照组腭突上皮呈现棕黄色,间充质中未见明显棕黄色出现,DEX组腭突上皮中呈现棕黄色染色,但其间充质中有少量散在的棕黄色存在;E14.5,对照组两侧腭突上提,在舌体上方呈水平相对,中线区可见一条棕黄色的上皮中缝,同时在口腔侧及鼻腔侧上皮两腭突接触区域呈现三角形棕黄色区域;DEX组两侧腭突相距较远,单侧腭突上皮表面呈现明显的棕黄色,同时观察到腭突间充质中出现散在棕黄色区域。E15.5,对照组两侧腭突完全融合,中缝区未见棕黄色染色,仅在口腔上皮及鼻侧上皮呈现棕黄色;DEX组两侧腭突相对但不融合,腭突间充质中散在棕黄色区域。E17.5,对照组腭突间充质未发现明显棕黄色区域,而DEX组腭突间充质显示有明显的棕黄色染色。
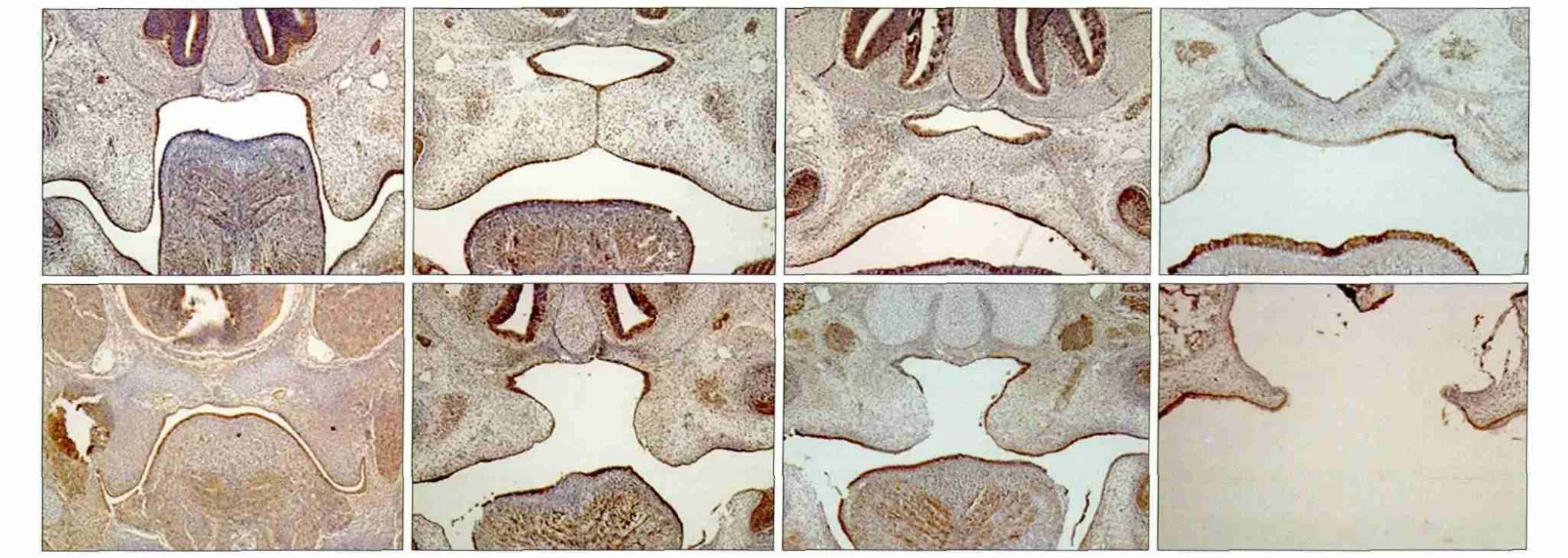
图2 E-cadherin在对照组和DEX组腭突上皮中的表达 SABC × 100Fig 2 E-cadherin expression in palatogenesis of the control and DEX groups SABC × 100
2.4 real-time PCR定量分析
E-cadherin和β-catenin mRNA在对照组和DEX组的表达量见图3。E14.0,DEX组小鼠腭突中的E-cadherin的表达水平约为对照组的2.5倍,β-catenin约为对照组的2.4倍。E14.5,E-cadherin的表达水平明显增加,增至对照组的9.0倍,β-catenin增至对照组的9.2倍。E15.5,E-cadherin的表达下调,但表达量仍约为对照组的1.9倍,β-catenin的表达也下调,但表达量仍为对照组的2.2倍。经统计学分析,E-cadherin及β-catenin在DEX组与对照组表达量的差异均有统计学意义(P<0.05)。
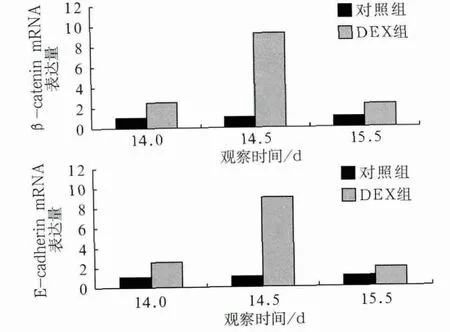
图3 β-catenin(上)和E-cadherin(下)mRNA在对照组和DEX组的表达差异Fig 3 The differences of β-catenin (top) and E-cadherin (bottom)expression between the control and DEX groups
3 讨论
哺乳动物腭部发育过程中,腭突上皮细胞与间充质细胞需要相互协调、相互诱导[2],两侧腭突垂直生长、上抬、接触、融合形成腭,在此过程中任何干扰因素都有可能影响其正常发育而导致腭裂。在正常腭发育过程中,当两侧腭突接触后,腭突上皮细胞E-cadherin的表达受到抑制,腭突上皮细胞E-cadherin表达减少,导致MES裂解并形成上皮岛,最终完成腭突的融合[1]。本研究发现,经过DEX处理后,两侧腭突体积明显缩小,腭突上抬延缓,导致两侧腭突不能接触融合,进一步验证了本课题组之前的研究[3-4]结果。本实验还发现E-cadherin在腭突间充质中异位表达。E-cadherin是一种依赖于钙离子的细胞间黏附分子,属于Ⅰ型跨膜糖蛋白,几乎表达于所有上皮组织,是一种重要的细胞黏附分子和信号转导分子,对于胚胎发育和细胞转归过程等具有重要作用[5-6]。E-cadherin能够促进细胞间的连接,维持细胞骨架和连接支架的稳定,许多转录因子如Snail、Slug、E12/E47、Sip-1(smad-interacting protein 1)、Zeb-1(zinc finger E-box binding homeobox 1)和Twist可通过直接或者间接抑制E-cadherin的表达导致上皮间充质转化[7]。β-catenin与E-cadherin在细胞膜内表面结合形成E-cadherin/β-catenin复合体,可以维持细胞间黏附并调控β-catenin在细胞质中的表达水平[8]。有学者发现,小鼠Zeb-1基因的变异会导致腭裂发生,并且在腭胚突的间充质细胞中出现了E-cadherin的异位表达以及间充质细胞增殖能力降低[9]。这提示E-cadherin的异位表达与Zeb-1变异小鼠的腭裂表型可能具有一定的相关性。本研究通过 real-time RCR定量分析发现,虽然DEX可致胎鼠形成短小腭突,但是腭突中E-cadherin与β-catenin在腭突上皮与间充质中的表达量比对照组明显增多,由此推测腭裂可能的形成机制是:DEX的作用导致E-cadherin在腭突间充质中异位表达,使腭突间充质黏附性增加,不利于间充质的增殖生长,从而形成短小腭突,最终导致腭裂的形成。
[1]Nawshad A, Medici D, Liu CC, et al. TGFbeta3 inhibits E-cadherin gene expression in palate medial-edge epithelial cells through a Smad2-Smad4-LEF1 transcription complex[J]. J Cell Sci, 2007, 120(Pt 9):1646-1653.
[2]Baroni T, Carinci P, Bellucci C, et al. Cross-talk between interleukin-6 and transforming growth factor-beta3 regulates extracellular matrix production by human fibroblasts from subjects with non-syndromic cleft lip and palate[J]. J Periodontol, 2003, 74(10):1447-1453.
[3]何苇, 卢胜军, 李承浩, 等. 地塞米松和维生素B12对小鼠胚胎腭突发育早期成纤维生长因子10及其2b受体信号的影响[J]. 华西口腔医学杂志, 2010, 28(5):551-555.
[4]何苇, 李承浩, 卢胜军, 等. 地塞米松和维生素B12交互作用对小鼠腭胚突超微结构影响的观察[J]. 口腔医学研究,2009, 25(1):8-11.
[5]Takeichi M. Cadherins: key molecules for selective cellcell adhesion[J]. IARC Sci Publ, 1988(92):76-79.
[6]Hay ED. An overview of epithelio-mesenchymal transformation[J]. Acta Anat: Basel, 1995, 154(1):8-20.
[7]Peinado H, Portillo F, Cano A. Transcriptional regulation of cadherins during development and carcinogenesis[J]. Int J Dev Biol, 2004, 48(5/6):365-375.
[8]Pelosi G, Scarpa A, Puppa G, et al. Alteration of the E-cadherin/beta-catenin cell adhesion system is common in pulmonary neuroendocrine tumors and is an independent predictor of lymph node metastasis in atypical carcinoids[J].Cancer, 2005, 103(6):1154-1164.
[9]Liu Y, El-Naggar S, Darling DS, et al. Zeb1 links epithelialmesenchymal transition and cellular senescence[J]. Development, 2008, 135(3):579-588.
