肺炎支原体感染致心包积液1例报道
2015-12-16曾彩霞孙中厚潍坊医学院附属医院儿科山东潍坊261031
曾彩霞,孙中厚(潍坊医学院附属医院儿科,山东潍坊261031)
肺炎支原体感染致心包积液1例报道
曾彩霞,孙中厚
(潍坊医学院附属医院儿科,山东潍坊261031)
肺炎支原体感染;心包积液;小儿;病例报告
支原体属原核微生物,是迄今为止人类发现的能够独立生活的没有细胞壁结构的最小个体。肺炎支原体(MP)是支原体其中的一种,其是介于病毒和细菌之间的原核生物,经由呼吸道飞沫或气溶胶[1]传播。MP主要感染呼吸系统,并引起呼吸系统相关疾病,同时,MP感染还可引起肺外多脏器功能损害。目前,已有大量关于支原体感染引起的呼吸系统疾病的报道,但就其引起的肺外并发症的早期诊断及其治疗研究资料较少[2]。支原体感染肺外并发症可累及多个系统,从而引起肺外多脏器损害,如消化、心血管、神经、泌尿、血液系统和皮肤黏膜等。因支原体感染后在机体内不断增殖,可进一步扩散引起机体自身抗体发生交叉反应而形成免疫复合物,因而引起多个系统病变,受累的脏器越多,改变的越明显,最终导致患儿肺外并发症发生[3-4]。MP有很强的传染性,常在儿童集居地和家庭成员中交叉感染,可导致久治不愈。本文将近期收治的MP感染引起肺外脏器损害致久治不愈患儿1例报道如下。
1 临床资料
患儿,男,9岁。因“心慌乏力1周余,发现心包、胸腔积液3 d”于2013年3月14日9时28分入院,无发热、盗汗,无关节肿痛,无皮疹腹胀,无明显消瘦或恶病质,无疫区疫病接触史,经外院抗感染、胸腔穿刺等治疗后,以“心肌炎、心功能Ⅲ级;心包、胸腔、腹腔积液;MP感染”转入本院。
查体:体温(T)36.7℃,脉搏(P)118次/分,呼吸(R)26次/分,血压(BP)110/70 mm Hg(1 mm Hg=0.133 kPa),精神尚可,呼吸急促,不能平卧,面色略黄,无水肿,咽部充血,扁桃体Ⅱ度肿大,颈部无抵抗,双肺呼吸音低,右肺底叩诊浊音,心音尚有力,律齐,可闻及2/6级舒张期杂音,腹平软,腹水征阳性,肝右肋缘下5 cm,剑突下6 cm,质地略韧,边缘锐利,压痛,脾左肋下4 cm,压痛,余未见异常。
辅助检查:外院胸部CT示(图1)心包积液(中度),胸腔积液(中度)。心脏彩色多普勒超声(彩超)示中量心包积液,左心室射血分数62%。MP抗体弱阳性。本院胸片示肺部炎症;双侧胸腔少量积液。血常规示白细胞计数轻度升高,以中性粒细胞为主。超敏C反应蛋白(hs-CRP)、心肌酶、肝肾功能、电解质、红细胞沉降率(血沉)、风湿检测、人类疱疹病毒、乙型肝炎相关标志物检测、人类免疫缺陷病毒、梅毒、血糖、抗核抗体、柯萨奇病毒及结核抗体均正常。结核菌素试验(PPD)阴性。入院治疗第3天行心包积液检查:MP培养阳性、乳酸脱氢酶1 664 U/L,李凡他试验阳性,未检出瘤细胞,未找到结核杆菌。
先后给予头孢曲松联合利巴韦林抗感染、阿奇霉素联合红霉素序贯抗支原体、大剂量维生素C加磷酸肌酸营养心肌、免疫球蛋白封闭抗体、利尿剂脱水减轻心脏负荷、地塞米松抗炎抗免疫损伤、维生素K促进血液凝固及乙酰酰胺减轻心脏性水肿等对症治疗。入院治疗第3天,患儿复查胸部彩超及心脏彩超,结果提示胸腔积液及心包积液较前增多,考虑患儿肝脾增大与心包填塞有关,经心胸外科会诊后,行心包穿刺置管引流术,共引流出775 mL血性液体。
经对症治疗后,患儿咳嗽、憋气减轻,能平卧入睡,入院治疗第37天,复查胸部磁共振成像(MRI)提示(图2):(1)符合心脏略增大并左室远段侧壁及心尖部心肌损害;(2)两侧胸腔积液并心包积液。胸部X线片提示符合支气管炎表现。胸腹部超声提示少量腹腔积液,左侧胸腔少量积液。心脏彩超提示符合心包炎,心底少量积液,节段性心肌损害。考虑患儿胸腔积液、心包积液反复,行心包病理组织活检提示存在心包炎。于治疗第92天在全身麻醉后行“心包剥离术”,术后复查心脏彩超提示积液逐渐减少,20 d后积液消失,予以拔管出院,出院后随访1年,无咳嗽、憋气,每3~6个月复查1次心脏彩超,可见全心轻度增大,二尖瓣、三尖瓣轻度反流,未见积液,生长发育与同龄儿童无明显异常。
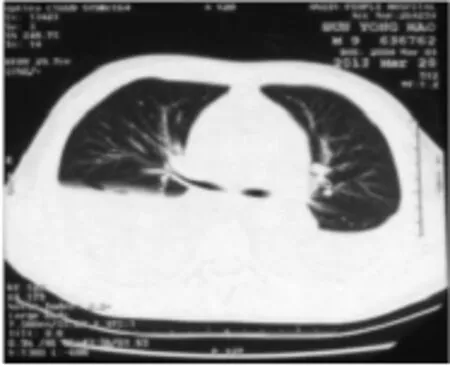
图1 外院胸部CT影像
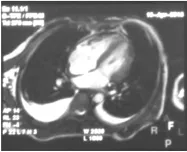
图2 治疗后复查胸部MRI影像
2 讨论
MP感染所致的支原体肺炎占社区获得性肺炎的20%~30%[5]。人群感染率较高,国外统计达1%,MP肺炎的发病率一般占感染率的3%~10%[6],是引起儿童呼吸道感染及非典型肺炎的主要病原。可散发或小流行,近年来有报道MP感染流行的间隔在缩短[7-9]。同时,实验诊断技术在不断进步与发展,如Kim等[10]用聚合酶链反应早期便可从急性呼吸道感染患儿的咽、气管、支气管、肺中,或从其并发症患儿的脑、心及肾脏中分离出抗体。
MP是儿童时期肺炎和其他呼吸道感染的重要病原之一,其可引起肺外多系统损害[11]。近年来报道MP感染肺外并发症的发生率逐年增加[12-13]。其中在并发心血管系统疾病中,并发心肌炎、心包炎,甚至心功能不全的发生率为4%~5%[14],此患儿因支原体感染而致多腔隙积液,如心、胸、腹腔积液。
MP导致肺外损害的机制尚不明确,目前认为免疫因素起主要作用。其可能机制有以下几点[15]:(1)MP感染可引起自身免疫和免疫抑制;(2)MP作为抗原与机体心、脑、肝、肾等存在着共同抗原,MP感染后与自身抗体形成免疫复合物,引起肺外其他脏器损害;(3)神经毒素作用。
在MP感染所致心肌疾病中,其病理改变为心内膜单核细胞浸润,相关研究证实,超微结构改变与柯萨奇病毒所致的病毒性心肌炎的动物模型相仿。有研究报道,MP感染患儿心电图可出现心肌缺血、心动过速、频发室性期前收缩、Ⅰ度房室传导阻滞并T波改变等。国外报道1例成人MP感染合并Ⅱ度房室传导阻滞[14],其表现为轻度呼吸困难、肌肉痛、腹泻,既往无心脏病史,病程第8天查MP-IgM,MP-IgG均阳性,心室率45次/分,心电图Ⅱ度房室传导阻滞,经红霉素治疗5 d,呼吸困难和传导阻滞消失,20 d后复查IgM下降,IgG升高。该患儿血常规示嗜酸性粒细胞不高,胸部CT未见寄生虫征象,不支持寄生虫所致血性积液。该患儿虽有肝脾肿大,但淋巴结不大,且心包积液未找到肿瘤细胞,胸部CT未见肿瘤征象,患儿无明显消瘦、恶病质,故肿瘤所致的血性心包积液亦不支持。患儿无低热、盗汗,PPD试验阴性,血沉不高,胸部CT未见结核征象,心包积液未找到结核杆菌,故结核所致血性积液也不支持。该患儿抗核抗体阴性,血沉不高,故不支持结缔组织疾病所致血性积液。但该患儿胸部MRI示,心脏略增大并左室远段侧壁及心尖部心肌损害,心脏彩超示心脏节段性心肌损害,心电图示窦性心动过速,ST-T改变,检查结果均显示患儿心脏受损,而该患儿心肌酶升高却不明显,故考虑该患儿系MP感染致心外膜的免疫过激反应而致心包积液。
目前,支原体感染的治疗以大环内酯类抗生素为首选,阿奇霉素有较强的抑制蛋白质合成和穿透细胞膜的作用,半衰期可长达70 h,有抗生素的后效应且药物在细胞内浓度高于血清和组织间隙[16]。在MP引起的MP感染并发症中,MP引起心脏受累,可发生于MP感染的急性期,故在治疗MP感染的心脏损害中,除大环内酯类及营养心肌治疗外,对于较严重的病例,加用地塞米松疗效较好。对于该患儿的治疗,本院采用了通常所用的强心、利尿、改善心脏重构、大环内酯类及穿刺抽液等对症治疗,患儿胸腔积液、心包积液反复,经家长同意后行心包病理组织活检提示缩窄性心包炎,在全身麻醉后行“心包剥离术”,术后复查心脏彩超示全心轻度增大,二尖瓣、三尖瓣轻度反流,心功能66%。鉴于患儿病情及恢复情况,提示MP肺炎并发心脏损害,预后欠佳,与文献[17]报道不相符,需注意随访。
[1]Stenger S,Hanson D,Teitelbaum R,et al.An antimicrobial activity of citolytic T cells mediated by granulysin[J].Science,1998,282(5386):121-125.
[2]Hsieh YC,Tsao KC,Huang CG,et al.Life-threatening pneumonia caused by macrolide-resistant Mycoplasma pneumoniae[J].Pediatr Infect Dis J,2012,31(2):208-209.
[3]陈岳明,张卫英,余道军,等.肺炎支原体耐大环内酯类抗菌药物分子机制的初步研究[J].中华医院感染学杂志,2009,19(8):877-879.
[4]李政锦,周文,彭昌,等.小儿肺炎支原体感染后免疫功能变化的研究[J].中华医院感染学杂志,2012,22(15):3221-3223.
[5]何兆坤,张云,张晓.小儿肺炎支原体肺炎的临床诊治分析[J].当代医学,2012,18(13):45-47.
[6]Ngeow YF,Suwanjutha S,Chantarojanasriri T,et al.An asian study on the prevalence of atypical respiratory pathogens in community-acquired pneumonia[J].Int J Infect Dis,2005,9(3):144-153.
[7]Arnold FW,Summersgill JT,Lajoie AS,et al.A worldwide perspective of atypical pathogens in community-acquired pneumonia[J].Am J Respir Crit Care Med,2007,175(10):1086-1093.
[8]Vervloet LA,Marguet C,Camargos PA.Infection by Mycoplasma pneumoniae and its importance as an etiological agent in childhood communityacquired pneumonias[J].Braz J Infect Dis,2007,11(5):507-514.
[9]Lee KY.Pediatric Respiratory infections by Mycoplasma pneumoniae[J].Expert Rev Anti Infect Ther,2008,6(4):509-521.
[10]Kim NH,Lee JA,Eun BW,et al.Comparison of polymerase chain reaction and the indirect particle agglutination antibody test for the diagnosis of Mycoplasma pneumoniae pneumonia in children during two outbreaks[J]. Pediatr Infect Dis J,2007,26(10):897-903.
[11]庞学问,廖锋,张运江.肺炎支原体肺炎合并肺外脏器损伤临床分析[J].中国热带医学,2008,8(7):1168-1169.
[12]赵顺英.肺炎支原体感染的临床表现和肺外并发症[J].实用儿科学杂志,2007,22(4):249-250.
[13]Smith R,Eviatar L.Neurologic manifestations of mycoplasma pneumoniae infections:diverse spectrum of diseases[J].Clin Pediatr,2000,39(4):195-201.
[14]Clhergui K,Fourm T,Veillard-Baron A,et al.Mycoplasma pneumoniae and second-degree heart block[J].Clin Infect Dis,1998,27(6):1534-1535.
[15]胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2002:1162.
[16]王辉.阿奇霉素贯序治疗支原体肺炎现状[J].中国药师杂志,2008,11(5):586-587.
[17]何爱宝,潘素珍.肺炎支原体感染及其心血管并发症的分析[J].临床儿科杂志,1997,15(4):264-265.
10.3969/j.issn.1009-5519.2015.03.069
C
1009-5519(2015)03-0475-03
2014-06-20
2014-09-27)
曾彩霞(1987-),女,湖南长沙人,硕士研究生,主要从事小儿呼吸系统疾病的研究;E-mail:18763681129@sina.cn。
孙中厚(E-mail:szh65@sina.com)。
