嗜热链球菌IMAU10638发酵乳贮藏期间挥发性风味物质的SPME-GC-MS分析鉴定
2015-12-16王丹丹彤孙天松张和平孟和毕力格
王丹,丹彤,孙天松,张和平,孟和毕力格
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,呼和浩特010018)
0 引言
嗜热链球菌(Streptococcus thermophilus)是发酵乳制品中重要的发酵剂之一,其主要作用是使乳糖转化成乳酸、合成风味物质,如甲酸、乙酸、乙偶姻、双乙酰、乙醛等[1-2]。固相微萃取技术(SPME)具有灵敏度高、检出限低、分析范围广、取样灵活等特点,可直接与气相色谱-质谱(GC-MS)联用。近年来SPME技术在食品风味分析中应用越来越广泛[3-7]。
嗜热链球菌IMAU10638是我们实验室筛选出的具有良好发酵特性的菌株,为了进一步了解该菌株发酵产风味物质的特性,本实验采用SPME技术对发酵乳进行挥发性风味物质富集,利用GC-MS技术进行组分分析,旨在了解嗜热链球菌IMAU10638发酵乳在贮藏期不同阶段的风味物质组成及其相对峰面积比的差异与变化情况,为今后研制出风味良好、发酵性能稳定的高品质量发酵剂提供乳酸菌资源和基础数据。
1 实验
1.1 材料和仪器
(1)菌种。本实验所用的发酵菌株嗜热链球菌(Streptococcus thermophilus)IMAU10638(Genbank号:HM218361)由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。
(2)仪器。气相色谱-质谱连用仪(Anilent 7890B GC system-5977A MSD);色谱柱为HP-5毛细管柱(30m×0.25mm,0.25 μm);手动固相微萃取(SPME)进样手柄(USA,SUPELCO),萃取头(65 μm PDMS/DVB;100 μm PDMS,USA,SUPELCO)。
1.2 方法
1.2.1 发酵乳的制备
将冷冻保藏的IMAU10638菌株于脱脂乳培养基(10%脱脂乳,0.1%酵母粉)中活化,用MRS液体培养基(CM0359,英国OXOID公司)活化三代,使菌株活力达到最大。将菌株分别连续扩大培养于50 mL和500 mL MRS液体培养基中,收集菌体并制备菌悬液。以活菌数为5×106mL-1的接种量接种于均质后的全脂乳(非脂乳固体质量分数为13.87%,脂肪质量分数为3.08%)中,随后分装于样品瓶中。将样品放于42℃培养箱中培养,待样品pH值达到4.5时(即发酵终点),将样品转移至4℃冰箱贮藏(此时为贮藏期0 d),并分别于贮藏期0,3,14 d取样,随后进行SPME-GC-MS检测分析。
1.2.2 挥发性风味物质测定
GC条件:采用程序升温方式,起始温度40℃,保持3 min,以4℃/min升温速率上升至140℃,保持1 min,以10℃/min上升至250℃,保持3 min;汽化室温度为250℃;载气为He,流速1.0 mL/min;不分流进样。
MS条件:电离方式为EI源,电子能量70 eV;离子源温度230℃;质量扫描范围m/z33~450 AMU;发射电流100 μA。
萃取条件:平衡温度为50℃,平衡时间为60 min。
解吸附条件:250℃条件下解吸附3 min。
1.2.3 定性与定量分析
利用随机携带Masshunter工作站NIST 1.1标准库自动检索各组分质谱数据,利用面积归一化法计算各组分相对相对峰面积比(即每种风味物质组分峰面积占离子色谱图中所有风味物质总峰面积的百分比)。
2 结果与分析
乳酸菌发酵产风味物质的数量和种类与菌株分解代谢蛋白质、脂肪、乳糖的能力有关[8]。这些代谢产物对酸奶的风味及质地的形成中有着非常重要的作用。本研究采用SPME-GC-MS方法对贮藏期间不同阶段(0,3,14 d)发酵乳样品中的挥发性风味物质进行了检测分析,共检测出46种风味物质(表1)。
图1为采用SPME-GC-MS技术分析检测得到的发酵乳样品中挥发性风味物质总离子流图。
图1中,图1(a)是65 μm PDMS/DVB萃取头对发酵乳样品(0 d)挥发性风味物质的萃取得到的总离子流图;图(b)是100 μm PDMS萃取头对发酵乳样品(14 d)挥发性风味物质的萃取得到的总离子流图。
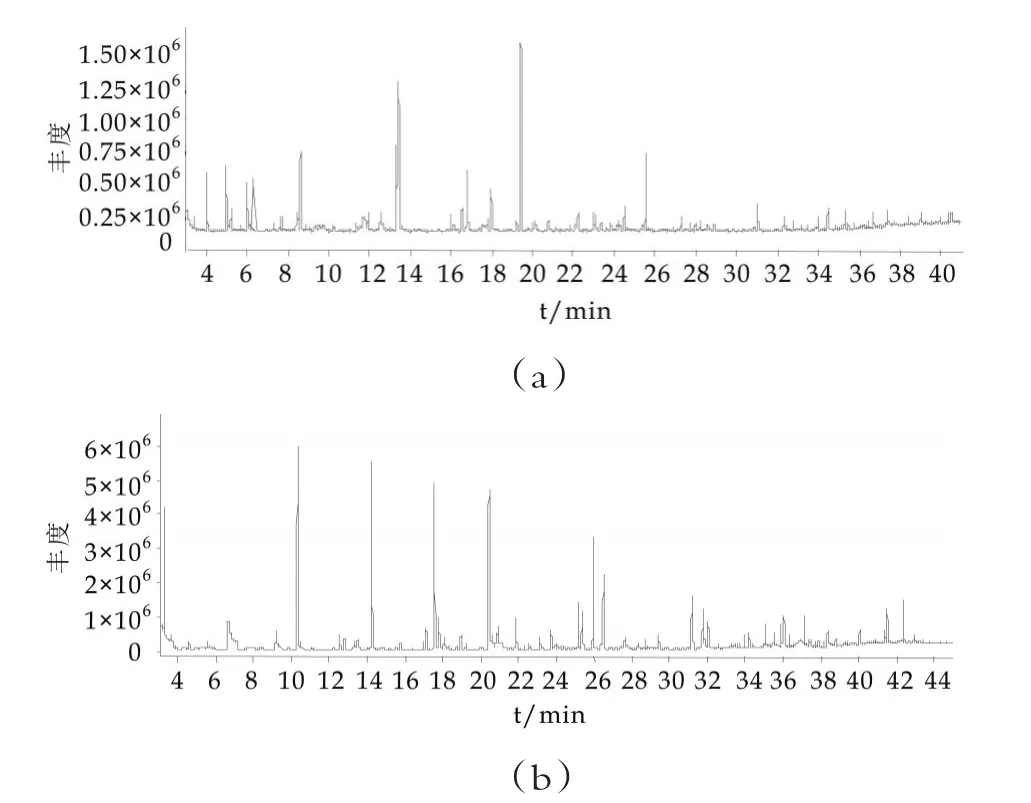
图1 嗜热链球菌IMAU10638发酵乳在贮藏期间挥发性风味组分的总离子流图
由图表可知,嗜热链球菌IMAU10638发酵乳在贮藏期不同时间点的风味物质种类丰富,主要包括羧酸类化合物、醛类化合物、酮类化合物、醇类化合物、酯类化合物、含氮类化合物、碳氢化合物、芳香类化合物、杂环类化合物。其中对酸奶的风味贡献度较大的是羧酸类化合物、酮类化合物及醛类化合物,这些风味物质构成了发酵乳的主体风味。Nursten等[9]的研究表明,发酵乳中挥发性的风味物质大体上可归纳为二类:一类是烃、醇、醛、酮、酸、酯、内酯等简单化合物;另一类是含有氧、氮、硫的杂环化合物,如呋喃及其衍生物和噻吩及其衍生物。这与本实验结果较一致。
2.1 酸类化合物的比较分析
由表1可以看出,在贮藏0 d时的酸类化合物共有10种,在贮藏3 d和14 d时酸类化合物分别有5种和7种。在发酵终点(贮藏0 d)时,主要的酸类物质有乙酸、甲酸、n-棕榈酸等,其相对峰面积比(在本实验中指相对峰面积比,即每种风味物质组分峰面积占离子色谱图中所有风味物质总峰面积的百分比)分别为53.2%,28.65%,18.2%;在贮藏3 d时,主要的酸类物质有乙酸、甲酸、己酸等,其相对峰面积比分别为90%,33.11%,2.96%;在贮藏14 d时,主要的酸类物质有乙酸、甲酸、n-癸酸等,相对峰面积比分别为73.5%,42.33%,2.01%。除上述化合物外,在贮藏期间还检测出1-羟甲基-1,2-乙二醇酯棕榈酸、9-十六碳烯酸、月桂酸、3-羟基月桂酸、己酸、n-葵酸、壬酸、辛酸和十四酸等羧酸类化合物。Condurso等[10]利用固相微萃取与GC-MS相结合的方法测得乳制品在货架期期间含有的酸类化合物有乙酸、丁酸、己酸、辛酸、壬酸、癸酸、癸烯酸、月桂酸、十四酸等,这与本实验测得的结果较一致。
2.2 醛类化合物的比较分析
醛类化合物在发酵乳风味物质中所占比例较低属于微量香气成分,但对发酵乳风味构成有重要影响。从表1可以看出,在贮藏期间发酵乳中主要的醛类化合物有壬醛、十二醛、苯甲醛等,其相对峰面积比分别为17.84%,7.18%,2.16%。这些醛类化合物在贮藏期不同阶段相对峰面积比有明显差异,如十二醛在发酵终点(0 d)的相对峰面积比小于1%,在贮藏3 d时
未检测出该物质,而在贮藏14 d时相对峰面积比达到7.18%。己醛在贮藏期不同阶段的相对峰面积比差异较大,在贮藏14 d时相对峰面积比为1.5%,而在贮藏0 d、3 d几乎没有检测出该物质。在贮藏期间还检测出14-十八烯醛、己二醛、辛醛等醛类化合物。王伟君等[11]检测到酸奶中主要的醛类物质有己醛,14-十八烯醛,与本实验检测结果较一致。

表1 贮藏期间嗜热链球菌IMAU10638发酵乳挥发性风味物质鉴定结果
2.3 酮类化合物的比较分析
酮类化合物多由不饱和脂肪酸的氧化、热降解及氨基酸降解或微生物代谢产生[12]。这项研究共检测出乙偶姻、2-庚酮、2-壬酮、2-十五烷酮、2-十一酮、2-十四酮和2-甲基香豆酮等7种酮类化合物,在贮藏0 d时主要的酮类物质有2-庚酮、乙偶姻、2-十一酮,其相对峰面积比分别为11.18%,3.65%,3.34%;在贮藏3 d时主要的酮类物质是乙偶姻、2-壬酮、2-庚酮,其相对峰面积比分别为12.43%,12.32%,10.21%;在贮藏14 d时主要的酮类物质是2-十一酮、乙偶姻、2-壬酮,其相对峰面积比分别为11.33%,8.24%,7.557%。这些酮类化合物在贮藏期不同阶段的相对峰面积比有明显差异,如2-庚酮在0 d和3 d的相对峰面积比分别为11.18%和10.21%,而在贮藏14d时的相对峰面积比为2.59%。Condurso等[10]在分析乳制品在货架期期间风味物质的变化时,也发现2-庚酮在贮藏期间不同阶段的相对峰面积比有明显差异,这与本实验检测结果较一致。双乙酰是发酵乳风味物质中主要的酮类物质,对发酵乳风味的形成起着重要的作用。在这项研究中没有检测到双乙酰,可能因为在检测时间点之间,双乙酰在酶的作用下被还原为乙偶姻。
2.4 酯类化合物的比较分析
酯类化合物是发酵乳中重要的风味物质之一,牛乳脂肪是酯类的主要来源。酸奶中的醇类物质与游离氨基酸结合可以形成酯类化合物[14]。很多酯类物质的风味阈值较低,虽在检测结果中质量分数较低,但酯类物质对发酵乳的风味影响很大。在本研究中检测出的邻苯二甲酸二乙酯在贮藏开始(0 d)时相对峰面积比(邻苯二甲酸二乙酯组分峰面积占离子色谱图中所有风味物质总峰面积的百分比)较高,随着贮藏时间的延长相对峰面积比降低,在贮藏14 d时仅检测出微量(相对峰面积比小于1%)的邻苯二甲酸二乙酯。Cheng H等[14]报道,大多数酯类物质都具有水果和花香味道,可能有助于降低发酵乳中脂肪酸和胺的尖锐、苦涩味道。
2.5 醇类化合物的比较分析
王伟君等[11]报道,醇类化合物可能来源于发酵乳中乳糖、乳脂肪和氨基酸的分解代谢。醇类化合物的风味阈值较高,因此对发酵乳的风味影响不及醛类,酯类等物质。在这项研究中检测出的醇类化合物有2-甲基-1-十六烷醇和3-苯基-1,3-戊二醇2种醇类化合物,其中3-苯基-1,3-戊二醇在贮藏14 d时的相对峰面积比为77.56%,是贮藏14 d时的主要风味物质之一。
2.6 碳氢化合物的比较分析
在本研究中检测到的碳氢化合物有1,3,5-环庚三烯、2-十三炔、3-乙基-5(2-乙丁基)-正十八烷、6-甲基-十八烷、正二十四烷和正十三烷6种化合物,其中相对峰面积比较高的碳氢化合物有正二十四烷和正十三烷。在贮藏0 d时正二十四烷的相对峰面积比为8.18%,而在贮藏3 d和14 d时没有检测出该化合物,这可能是因为正二十四烷在贮藏期间代谢生成其他化合物。
2.7 杂环类化合物的比较分析
在发酵乳加热的过程中,还原糖与含有游离氨基的化合物会发生美拉德反应,产生呋喃、吡咯、吡嗪以及其它含S、N、O的杂环化合物,如:麦芽酚、5-羟甲基糠醛、4-羟基-2,5-二甲基-3(2H)-呋喃酮、邻氨基苯乙酮和2,5-二甲基吡嗪等[15]。Andreas Ott等人[16]对酸奶中的风味物质进行检测,结果表明牛奶经过热处理会产生吡嗪类化合物,但他们没有发现吡嗪对酸奶香味有贡献。本研究中检测出的杂环类化合物主要有[2,3,c]呋喃-3-腈-2-氨基-4,6-二氢-4,4,6,6-四甲基噻吩、5-甲基-6-苯基四氢-1,3-嗪-2-硫酮。[2,3,c]呋喃-3-腈-2-氨基-4,6-二氢-4,4,6,6-四甲基噻吩在贮藏0 d和3 d时的相对峰面积比分别为6.53%、8.79%,而在贮藏14 d时其相对峰面积比为1.03%,与前两个阶段的相对峰面积比具有较明显的差异。
2.8 含氮化合物的比较分析
牛乳中的酪蛋白、乳清蛋白以及低分子量的肽是嗜热链球菌的主要氮源,低分子量的肽对乳酸菌尤其是嗜热链球菌的生长及产香性能具有促进作用[17]。Pascal Hols等人[1]的研究表明,氨基酸的分解代谢对发酵乳制品中大量的关键风味物质的形成有特定的影响。含硫化合物来源于有机硫的分解与转化,一般包括二甲基硫化物、硫化氢、二甲基二硫化物和甲硫醇等[12]。含硫组分浓度增加引起发酵乳的异味,低级的硫醇有强烈且令人讨厌的气味,但这种气味随碳数增多而减弱,高级硫醇具有令人愉快的气味。在这项研究中检测的含氮化合物有2,6-二甲基苯甲醛缩氨基硫脲、3-(3-羰基-4-羟苯基)-D-丙氨酸、4-氨基呋咱-3-羧酸-(3-对氧氮己环)-酰胺、4-乙基苯甲酰胺和环丙烷甲酰胺-2-环丙基-2-甲基-N-(1-环丙基乙基)等5种含氮和含硫化合物,其中4-氨基呋咱-3-羧酸-(3-对氧氮己环)-酰胺在贮藏开始时相对峰面积比(4-氨基呋咱-3-羧酸-(3-对氧氮己环)-酰胺组分峰面积占离子色谱图中所有风味物质总峰面积的百分比)较高(69.02%),而在贮藏后期几乎没有检测出该化合物,这可能是因为4-氨基呋咱-3-羧酸-(3-对氧氮己环)-酰胺在贮藏期间代谢生成其他化合物。
3 结论
本研究采用65 μmPDMS/DVB和100 μmPDMS萃取纤维对发酵乳中风味物质进行萃取,利用气相色谱-质谱法对嗜热链球菌IMAU10638发酵乳在贮藏期间不同时间段的挥发性风味物质进行分析,确立了固相微萃取条件和SPME-GC-MS测定发酵乳中挥发性风味物质的定性、相对定量方法。本实验共检测出46种挥发性风味物质,包括羧酸类化合物、醛类化合物、酮类化合物、含氮类化合物、碳氢化合物、芳香类化合物、醇类化合物、杂环类化合物、和酯类化合物九大类风味物质,其中,羧酸类化合物、醛类化合物、酮类化合物的数量占总风味物质种类数量的58.7%,是主要的风味物质。同时,贮藏期间不同时间段发酵乳中挥发性风味物质在种类、数量及相对峰面积比上的差异体现了发酵乳在贮藏期间的风味特征。
[1]HOLS P,HANCY F,FONTAINE L,et al.New Insights in the Molecular Biology and Physiology of Streptococcus thermophilus Revealed by Comparative Genomics[J].FEMS microbiology reviews,2005,29(3):435-463.
[2]IMHOF R,BOSSET J O.Quantitative GC-MS analysis of volatile flavour compounds in pasteurized milk and fermented milk products applying a standard addition method[J].LWT-Food Science and Technology,1994,27(3):265-269.
[3]宋廷宇,吴春燕,侯喜林,等.薹菜风味物质的顶空固相微萃取-气质联用分析[J].食品科学,2010,31(8):185-188.
[4]RISTICEVIC S,NIRI V H,VUCKOVIC D,et al.Recent Developments in Solid-phase Microextraction[J].Analytical and bioanalytical chemistry,2009,393(3):781-795.
[5]CONTARINI G,POVOLO M,LEARDI R,et al.Influence of Heat Treatment on the Volatile Compounds of Milk[J].Journal of Agricultural and Food Chemistry,1997,45(8):3171-3177.
[6]CHIOFALO B,ZUMBO A,COSTA R,et al.Characterization of Maltese Goat Milk Cheese Flavour using SPME-GC/MS[J].S.Afr.J.Anim.Sci,2004,34:176-180.
[7]VAN AARDT M,DUNCAN S E,BOURNE D,et al.Flavor Threshold for Acetaldehyde in Milk,Chocolate Milk,and Spring Water using Solid Phase Microextraction Gas Chromatography for Quantification[J].Journal of agricultural and food chemistry,2001,49(3):1377-1381.
[8]刘文俊.嗜热链球菌和保加利亚乳杆菌产酸、风味特性及其功能基因分型和表达研究[D].内蒙古农业大学,2014.
[9]NURSTEN HE.The Flavor of Milk and Diary Products.[J].International Journal of Diary Teach,1997(50):48-55.
[10]CONDURSO C,VERZERA A,ROMEO V,et al.Solid-phase Microextraction and Gas Chromatography Mass Spectrometry Analysis of Dairy Product Volatiles for the Determination of Shelf-life[J].International dairy journal,2008,18(8):819-825.
[11]王伟君,李延华,张兰威,等.发酵乳风味及风味物质成份分析[J].通化师范学院学报,2007,28(8):49-51.
[12]张国农,顾敏锋,李彦荣,等.SPME—GC/M测定再制干酪中的风味物质[J].中国乳品工业,2006,34(9):52-56.
[13]王文平,梁海玲,姚元华.木瓜提取物中总黄酮含量的测定[J].贵州医药,2005,29(6):546-548.
[14]CHENG H.Volatile Flavor Compounds in Yogurt:a review[J].Critical reviews in food science and nutrition,2010,50(10):938-950.
[15]李广富,陈伟,范路平,等.灵芝功能成分酸奶营养品质与风味物质分析[J].食品科学,2015,36(10).
[16]OTT A,FAY L B,CHAINTREAU A.Determination and Origin of the Aroma Impact Compounds of Yogurt Flavor[J].Journal of Agricultural and Food Chemistry,1997,45(3):850-858.
[17]ZOURARI A,ACCOLAS J P,DESMAZEAUD M J.Metabolism and Biochemical Characteristics of Yogurt Bacteria.A review[J].Le lait,1992,72(1):1-34.
