乳腺癌新辅助化疗后腋窝淋巴结状态的评估
2015-12-16王玉洁综述柳光宇审校
王玉洁 综述,柳光宇 审校
复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032
乳腺癌新辅助化疗后腋窝淋巴结状态的评估
王玉洁 综述,柳光宇 审校
复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032
新辅助化疗或新辅助化疗联合生物靶向治疗日趋成为局部晚期乳腺癌(Ⅱb~Ⅲ)的标准治疗方式,除了能降低原发肿块的临床分期,约有40%的患者能达到腋窝淋巴结的病理完全缓解,从而实现了腋窝淋巴结的降期。而对于经过新辅助化疗或化疗联合靶向治疗后经影像学评估达到腋窝淋巴结临床完全缓解的患者,其腋窝淋巴结缓解情况的预测及新辅助化疗后腋窝前哨淋巴结活检等,仍存在诸多争议,成为临床治疗选择上的难题。本文拟对近年来新辅助化疗后腋窝淋巴结处理的相关研究及临床试验进行分析和解读,并对新近开展的临床研究进行梳理,以期为临床提供更多参考信息。
新辅助化疗;腋窝淋巴结;病理完全缓解;前哨淋巴结活检;淋巴结标记
新辅助疗法始于20世纪70年代,最初仅用于不可手术的局部晚期乳腺癌和炎性乳腺癌,且仅限于单一化疗。如今新辅助疗法已发展为包括化疗、化疗联合靶向治疗、化疗联合内分泌治疗在内的综合治疗方式,正逐步应用于可手术的局部晚期乳腺癌,其地位在临床应用中日益升高,并逐渐成为局部晚期乳腺癌的标准治疗。据报道,约有40%的患者能达到腋窝淋巴结的病理完全缓解[1],从而实现了腋窝淋巴结的降期;而在三阴性和HER-2阳性患者中,由于对化疗和靶向药物曲妥珠单抗的灵敏度高,腋窝淋巴结完全缓解的比例更高[2-3]。在临床实践中,对于新辅助化疗后乳房肿块明显缩小或达到临床完全缓解从而实现原发灶降期的患者,经过与其沟通后,可采取保乳手术以达到保留乳房的目的,且其局部复发率及总生存期与单纯切除手术相比,差异无统计学意义(P均>0.05)[4-5]。但对于新辅助化疗后腋窝淋巴结处理,无论术前评估是否发生临床完
全缓解,均采取腋窝淋巴结清扫手术,从而使很多腋窝淋巴结达到病理完全缓解的患者失去保留腋窝的机会。但在目前临床医疗中,如何预测腋窝淋巴结缓解情况以及经病理证实腋窝淋巴结完全缓解如何进一步处理,尚无可靠资料及高级别临床证据。在个体化医疗时代,实现创伤最小、患者获益最大是临床实践的最终目的,在新辅治疗后腋窝淋巴结处理问题上如何实现这一目标仍存在较多争议。
1 数学模型预测新辅助化疗后腋窝淋巴结缓解情况
无创或微创、快速、可重复检测的预测手段一直是临床医生的追求,更是患者的殷切期望,以美国纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center,MSKCC)创建的计算图表[6]及评分系统[7]为代表的数学模型用于预测前哨淋巴结阳性患者非前哨淋巴结转移情况,但由于其评估效果并不稳定,并未在临床中广泛应用。
在新辅助化疗后临床体检腋窝淋巴结转阴患者究竟能否避免腋窝淋巴结清扫手术,在这一问题上也有研究者根据已有乳腺癌患者治疗数据试图建立预测模型用于临床评估,在此仅对其中一个模型加以介绍[8]。这一计算图表纳入了年龄、肿瘤临床分期(原发肿块T分期)、肿瘤病理类型(小叶癌或导管癌)、受体表达情况、化疗方案(是否包含紫杉类)和HER-2过表达患者是否使用赫赛汀6个指标进行建模。受试者工作曲线显示曲线下面积为0.77,具有中等预测价值;在界值为0.5时,灵敏度为43%,特异度为88%,此时有最好的阳性预测值65%。这就意味着当一个经过新辅助化疗后临床评价腋窝转阴的患者各项指标总评分达到0.5时,该患者有65%的可能性达到腋窝病理完全缓解,如果根据此结果给予患者免去腋窝清扫手术,则有35%的可能性使残留有肿瘤细胞的淋巴结遗留体内,增加局部复发及远处转移风险[8]。因此计算图表并不能很好预测新辅助化疗后临床腋窝转阴患者的腋窝淋巴结缓解情况,必要的手术活检手段不可或缺。
2 PET/CT在预测新辅助化疗后腋窝淋巴结缓解情况中的作用
PET/CT在临床中主要用于恶性肿瘤患者全身转移情况评估,近年来研究发现,18F-FDG PET/CT在预测乳腺癌新辅助化疗后原发灶缓解情况中有一定价值[9-13],亦有研究证实其可用于预测新辅助化疗后腋窝淋巴结缓解情况。有文章报道了PET/CT这一应用价值[14]。在此研究中,共有80例患者在新辅助化疗前、新辅助化疗2/3疗程后(对应4/8总疗程)以及新辅助化疗全部结束后接受了PET/CT检查,新辅助化疗后所有患者接受腋窝淋巴结清扫手术。腋窝淋巴结最大标准摄取值相对变化即ΔSUVmax作为评价指标与最终的病理结果进行分析,以判断其预测价值。研究中40%患者达到腋窝淋巴结病理完全缓解,病理完全缓解患者的SUVmax较未达到病理完全缓解患者相对下降差值较大,第1次和第2次PET/CT差异均有统计学意义(P=0.001和0.025)。第2次PET/CT的曲线下面积为0.80,而第3次PET/CT的曲线下面积为0.65,第2次PET/CT较第3次预测价值高,且在ΔSUVmax为60%,即较基线PET/CT的SUVmax下降60%时,特异度(95%)和灵敏度(48%)最好,阳性预测值为86%。这一研究结果预示了PET/CT可能在预测新辅助化疗后腋窝淋巴结缓解情况中极具潜力。近年来也有越来越多的研究相继证实这一结果,并且在HER-2过表达及三阴性亚组中得到类似阳性结果,似乎预示着PET/CT在此领域将有更大发展空间。但由于其价格相对较贵及其安全性限制了这一技术的应用。
3 新辅助化疗后的前哨淋巴结活检
在临床实践中,拟行手术治疗的乳腺癌患者,若术前临床评估为腋窝淋巴结阴性,则推荐其接受腋窝前哨淋巴结活检,其安全性及有效性(检出率>90%,假阴性率<10%)已被广泛接受,逐步取代了腋窝淋巴结清扫手术对腋窝淋巴结进行准确的组织学分期。但在新辅助化疗后,由于淋巴管破坏、淋巴管及淋巴结的纤维化及淋巴结跳跃性转移等因素干扰,前哨淋巴结活检的可行性及准确性并未得到广泛认可,
从而使新辅助化疗后前哨淋巴结活检成为另一争议话题。一些小的回顾性研究显示,新辅助化疗后前哨淋巴结活检检出率为63%~100%,而假阴性率为0%~39%[15-17],均存在较大差异,可靠性较低。自2013年起,陆续有几项前瞻性的随机对照临床试验结果报道[18-20],为新辅助化疗后开展前哨淋巴结活检提供了参考。
3.1 SENTINA临床试验
SENTINA是一项前瞻性的、多中心的临床试验,旨在通过对比新辅助化疗前后前哨淋巴结活检的准确率和假阴性率来探究前哨淋巴结活检在新辅助化疗后的可行性[18]。
该试验入组了1 737例接受新辅助化疗的乳腺癌患者。1 022例临床腋窝淋巴结阴性的患者在新辅助化疗之前接受了前哨淋巴结活检,其检出率为99.1%;该组患者或前哨淋巴结为阳性的患者在新辅助化疗结束之后再次接受前哨淋巴结活检手术,第2次前哨淋巴结活检的检出率只有60.8%,而假阴性率则高达51.6%。而新辅助化疗前临床腋窝淋巴结阳性(经触诊及腋窝淋巴结超声评估)的患者在新辅助化疗之后经临床评估为腋窝淋巴结转阴即接受前哨淋巴结活检,该组人群的前哨淋巴结检出率为80.1%,假阴性率为14.2%。假阴性率与所检出的前哨淋巴结个数相关,只检出一个淋巴结假阴性率为24.3%,若检出数量为2个,则假阴性率相应下降为18.5%。研究最终得出对于新辅助化疗后腋窝淋巴结由阳性转为阴性的患者,前哨淋巴结活检的检出率及准确率并不可靠;而前哨活检淋巴结数为1~2个淋巴结患者,这种手术方式同样不适用;在新辅助化疗前后均行前哨淋巴结活检的方法在临床实践中不可取。
3.2 Alliance临床试验
Alliance是发表在JAMA的另一项旨在探究新辅助化疗后前哨淋巴结活检假阴性率的前瞻性、多中心研究,来自136个研究中心的756例患者入组该研究[19]。
所有患者的原发灶及淋巴结转移均需经细胞学或组织学验证,根据AJCC标准分为cN1和 cN2期的患者符合入组标准。经过新辅助化疗后,所有患者均在接受前哨淋巴结活检后行腋窝淋巴结清扫手术以验证结果,最终663例患者信息纳入结果分析中。该研究证实,在切除了超过2个前哨淋巴结后,前哨淋巴结活检的假阴性率为12.6%,并没有达到令人期待的<10%的阈值,而当检出淋巴结个数≥3个时,假阴性率降至9.1%。此项研究还发现,术中采用染料(异硫蓝或美蓝)及放射核素双重标记能提高前哨淋巴结检出率,将假阴性率降低至10.8%。外科技术的提高或新的活检技术出现是降低假阴性率的重要途径。
3.3 SN FNAC临床试验
另有一项SN FNAC研究,在2013年ASCO年会上首次由Boileau等[20]对研究结果作了汇报。在这项前瞻性研究中,共入组了153例临床分期为T0-3N1-2M0的乳腺癌患者,所有患者腋窝淋巴结转移情况均经组织学验证,最终对141例患者的临床数据进行了统计分析。此项研究为新辅助化疗后前哨淋巴结的开展提供了积极证据,结果显示新辅助化疗后前哨淋巴结的检出率为87.2%(123/141),总假阴性率为9.9%(8/81)。当只有一个前哨淋巴结被检出时,假阴性率高达19.0%(4/21);而检出淋巴结数为2个或2个以上时,假阴性率则下降至6.6%(4/61) (P<0.001)[20]。
从总结这三项临床试验的结果,我们可以发现,当新辅助化疗后仅有一个前哨淋巴结被检出时,假阴性率普遍偏高,三个临床试验的假阴性率分别为24.3%、31.2%和19.0%。而随着前哨淋巴结检出数量的增多,假阴性率相应下降;术中采用染料标记和放射性核素探测双重示踪法也能相应降低前哨淋巴结活检的假阴性率(表1)。同时,我们也可以从中得到启示:一方面,在临床应用中,仍无确凿证据证实新辅助化疗后前哨淋巴结活检可靠性,此项技术往往易造成对新辅助化疗后腋窝分期的低估,从而为高危患者埋下隐患;另一方面,对于经新辅助化疗后腋窝临床转阴的患者,在能保证前哨淋巴结检出个数≥2个的情况下,前哨
淋巴结活检手术仍值得一试,或许能为部分患者免去腋窝清扫手术,减少腋窝清扫手术的术后并发症,而对其局部复发率及总生存期并无太大影响;而对于新辅助化疗前腋窝分期较晚或化疗结束后临床评价腋窝淋巴结未转阴的患者,这一手术并不适宜。三项临床试验并未对入组患者进行进一步的亚组分析,即根据现有的病理分子分型对入组患者进行进一步分析,以找到新辅助化疗后开展前哨淋巴结活检术的最佳人群。对于临床上病理完全缓解率较高的患者如经赫赛汀治疗后HER-2过表达患者或对化疗敏感的三阴性患者或许是新辅助化疗后前哨淋巴结活检的备选人群,其仍需进一步研究证实。
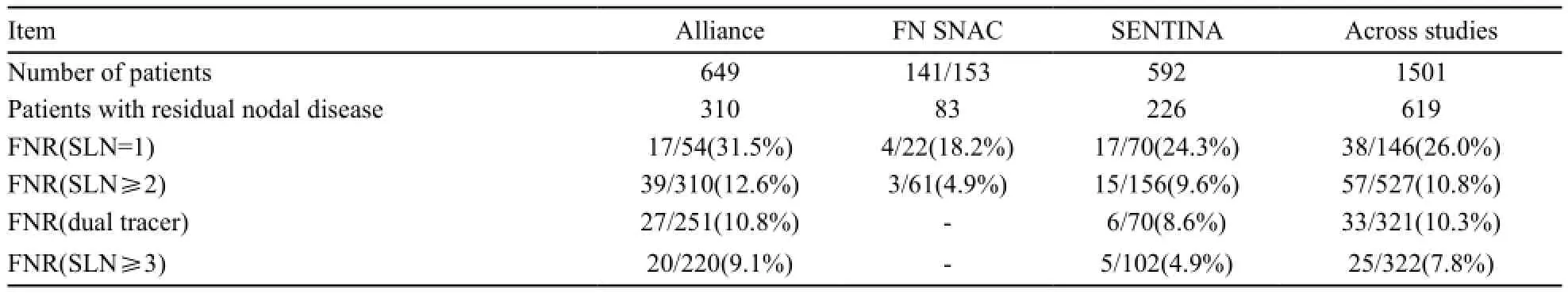
表 1 三项前瞻性研究结果汇总Tab. 1 Summary of 3 prospective study results
4 新辅助化疗前腋窝转移淋巴结的标记及新辅助化疗后的活检
腋窝淋巴结在经过新辅助化疗,恶性肿瘤细胞的凋亡或退缩是否遵循一定的规律,即其中一个转移淋巴结的缓解情况能否代表整个腋窝淋巴结的缓解情况?治疗前对转移的淋巴结进行标记,治疗后术中切除该标记淋巴结,能否通过对标记淋巴结的缓解情况来评估其他腋窝淋巴结的缓解情况?如果这一假设成立,对于经新辅助化疗后临床评估腋窝转阴的患者,采取治疗前标记,治疗后切除标记淋巴结,若标记淋巴结达到完全缓解,是否可以免除腋窝清扫手术?2014年最新NCCN指南推荐应在新辅助化疗前评估腋窝淋巴结状态,经细胞学或组织学证实有转移的淋巴结应放置影像学可探及的标记物。针对这一设想,来自荷兰的一项研究似乎预示该想法不仅可行,而且还极具前景,在此对这项研究作一简要介绍[21-22]。这一临床技术称为放射性碘粒子标记腋窝肿大淋巴结(marking axillary lymph nodes with radioactive iodine seeds,MARI)。在新辅助化疗前,在B超定位下,通过空心针穿刺将包裹在金属钛内的碘粒子置于肿大淋巴结内,在放置碘粒子之前,所有的肿大淋巴结须经细针穿刺证实发生转移。新辅助化疗后,在术中经γ射线探头检测到该标记淋巴结并针对性切除后行腋窝淋巴结清扫手术以检测该项技术的准确性和假阴性率等指标(图1)。经过筛选入组后,共有103例患者签署知情同意书,并完成整个临床试验,最终100例患者的临床数据纳入统计分析。在这100例患者中,有3例患者因在新辅助化疗前未能将碘粒子准确放置于淋巴结中,从而造成MARI的淋巴结检出率为97%。有5例患者的MARI淋巴结为阴性,但腋窝清扫术后病理证实为腋窝淋巴结部分缓解,假阴性率为7%(5/70);整个研究准确率为90%(46/51),特异度高达100%[21]。早在2010年,该研究者所在团队即对这一技术进行了报道,只在15例患者中进行了小规模的临床试验,结果证实15例患者经标记的淋巴结均全部取出,从临床实践中验证了这一技术的可行性[22]。
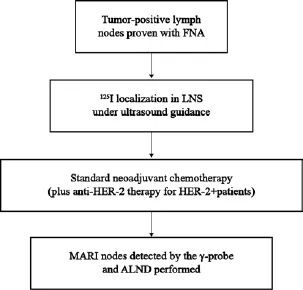
图 1 MARI试验流程Fig. 1 Procedure of MARI
这一项前瞻性研究结果似乎给临床解决新辅助化疗后腋窝淋巴结评估这一难题提供了极好的参考,但仍存在诸多问题亟待探讨。首先,该技术为一项新技术,必然要通过大量临床试验来验证其可操作性。目前放射性碘粒子主要用于标记临床不易触及的乳房病灶以便于术中定位开展保乳手术[23-24],而对于标记腋窝淋巴结以评估新辅助化疗后腋窝淋巴结缓解情况的报道较少,缺乏有力证据。其次,对于125I粒子的精确放置,需要技术较好的穿刺医生进行操作,学习曲线情况未知;对于适宜放置碘粒子的淋巴结性质包括大小和位置,文章中也并未做详细说明。再者,放射性碘粒子本身作为一种微弱的放射源,似乎对腋窝淋巴结起到某种程度上的放疗作用,这一作用强度及性质尚无可靠方法定量分析;放射性物质长时间置于体内,对患者及其接触者是否有放射性损伤,以及由此带来的伦理问题也是值得思考的。
MD Andersen癌症研究所近期开展了一项前瞻性研究,对选择性标记腋窝转移淋巴结的临床可行性进行了验证[25]。10例患者在新辅助化疗前在腋窝转移淋巴结内放置了碘粒子,术中全部顺利取出。这一结果也给上述技术的临床可行性增加了佐证。该技术在新辅助化疗后腋窝淋巴结评估中的初试结果似乎给临床医师带来新的契机,其深入研究或许能为患者带来更多益处。
总结近年来新辅助化疗后临床面临的问题,腋窝淋巴结处理问题尤为突出,不断涌现的大型前瞻性临床试验或新的检测方法为解决这一系列问题提供有价值的参考,最终会带动整个临床实践的发展。
[1] MAMOUNAS E P, BROWN A, ANDERSON S, et al. Sentinel node biopsy after neoadjuvant chemotherapy in breast cancer: results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27[J]. J Clin Oncol, 2005, 23(12): 2694-2702.
[2] BUZDAR A U, VALERO V, IBRAHIM N K, et al. Neoadjuvant therapy with paclitaxel followed by 5-fluorouracil, epirubicin, and cyclophosphamide chemotherapy and concurrent trastuzumab in human epidermal growth factor receptor 2–positive operable breast cancer: an update of the initial randomized study population and data of additional patients treated with the same regimen[J]. Clin Cancer Res, 2007, 13(1): 228-233.
[3] GIANNI L, EIERMANN W, SEMIGLAZOV V, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER-2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER-2-negative cohort[J]. Lancet, 2010, 375(9712): 377-384.
[4] MIN S Y, LEE S J, SHIN K H, et al. Locoregional recurrence of breast cancer in patients treated with breast conservation surgery and radiotherapy following neoadjuvant chemotherapy[J]. Int J Radiat Oncol Biol Phys, 2011, 81(5): e697-e705.
[5] FITZAL F, RIEDL O, MITTLBÖCK M, et al. Oncologic safety of breast conserving surgery after tumour downsizing by neoadjuvant therapy: a retrospective single centre cohort study[J]. Breast Cancer Res Treat, 2011, 127(1): 121-128.
[6] VAN ZEE K J, MANASSEH D M, BEVILACQUA J L, et al. A nomogram for predicting the likelihood of additional nodal metastases in breast cancer patients with a positive sentinel node biopsy[J]. Ann Surg Oncol, 2003, 10(10): 1140-1151.
[7] COUTANT C, ROUZIER R, FONDRINIER E, et al. Validation of the Tenon breast cancer score for predicting non-sentinel lymph node status in breast cancer patients with sentinel lymph node metastasis: a prospective multicenter study[J]. Breast Cancer Res Treat, 2009, 113(3): 537-543.
[8] SCHIPPER R J, MOOSSDORFF M, NELEMANS P J, et al. A model to predict pathologic complete response of axillary lymph nodes to neoadjuvant chemo(immuno)therapy in patients with clinically node-positive breast cancer[J]. Clin Breast Cancer, 2014, 14(5): 315-322.
[9] ROUSSEAU C, DEVILLERS A, SAGAN C, et al. Monitoring of early response to neoadjuvant chemotherapy in stage Ⅱand Ⅲ breast cancer by [18F] fluorodeoxyglucose positron emission tomography[J]. J Clin Oncol, 2006, 24(34): 5366-5372.
[10] SCHWARZ-DOSE J, UNTCH M, TILING R, et al. Monitoring primary systemic therapy of large and locally advanced breast cancer by using sequential positron emission tomography imaging with [18F] fluorodeoxyglucose[J]. J Clin Oncol,
2009, 27(4): 535-541.
[11] DARBY S, MCGALE P, CORREA C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials[J]. Lancet, 2011, 378(9804): 1707-1716.
[12] WANG Y, ZHANG C, LIU J, et al. Is 18F-FDG PET accurate to predict neoadjuvant therapy response in breast cancer? A meta-analysis[J]. Breast Cancer Res Treat, 2012, 131(2): 357-369.
[13] HATT M, GROHEUX D, MARTINEAU A, et al. Comparison between 18F-FDG PET image-derived indices for early prediction of response to neoadjuvant chemotherapy in breast cancer[J]. J Nucl Med, 2013, 54(3): 341-349.
[14] KOOLEN B B, OLMOS R A V, WESSELING J, et al. Early assessment of axillary response with 18F-FDG PET/CT during neoadjuvant chemotherapy in stage Ⅱ–Ⅲ breast cancer: implications for surgical management of the axilla[J]. Ann Surg Oncol, 2013, 20(7): 2227-2235.
[15] XING Y, FOY M, COX D D, et al. Meta-analysis of sentinel lymph node biopsy after preoperative chemotherapy in patients with breast cancer[J]. Br J Surg, 2006, 93(5): 539-546.
[16] KELLY A M, DWAMENA B, CRONIN P, et al. Breast cancer: sentinel node identification and classification after neoadjuvant chemotherapy-systematic review and meta analysis[J]. Acad Radiol, 2009, 16(5): 551-563.
[17] VAN DEURZEN C H, VRIENS B E, TJAN-HEIJNEN V C, et al. Accuracy of sentinel node biopsy after neoadjuvant chemotherapy in breast cancer patients: a systematic review[J]. Eur J Cancer, 2009, 45(18): 3124-3130.
[18] KUEHN T, BAUERFEIND I, FEHM T, et al. Sentinellymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study[J]. Lancet Oncol, 2013, 14(7): 609-618.
[19] BOUGHEY J C, SUMAN V J, MITTENDORF E A, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial[J]. JAMA, 2013, 310(14): 1455-1461.
[20] BOILEAU J F, POIRIER B, BASIK M, et al. Sentinel node biopsy following neoadjuvant chemotherapy in biopsy proven node positive breast cancer: the SN FNAC study[J]. 2015, 33(3): 258-264.
[21] STRAVER M E, LOO C E, ALDERLIESTEN T, et al. Marking the axilla with radioactive iodine seeds (MARI procedure) may reduce the need for axillary dissection after neoadjuvant chemotherapy for breast cancer[J]. Br J Surg, 2010, 97(8): 1226-1231.
[22] DONKER M, STRAVER M E, WESSELING J, et al. Marking axillary lymph nodes with radioactive iodine seeds for axillary staging after neoadjuvant systemic treatment in breast cancer patients: the MARI pocedure[J]. Ann Surg, 2015, 261(2): 378-382.
[23] GRAY R J, SALUD C, NGUYEN K, et al. Randomized prospective evaluation of a novel technique for biopsy or lumpectomy of nonpalpable breast lesions: radioactive seed versus wire localization[J]. Ann Surg Oncol, 2001, 8(9): 711-715.
[24] JAKUB J W, GRAY R J, DEGNIM A C, et al. Current status of radioactive seed for localization of non palpable breast lesions[J]. Am J Surg, 2010, 199(4): 522-528.
[25] CAUDLE A S, YANG W T, MITTENDORF E A, et al. Selective surgical localization of axillary lymph nodes containing metastases in patients with breast cancer: a prospective feasibility trial[J]. JAMA Surg, 2015, 150(2): 137-143.
Evaluation of axillary lymph nodes response after neoadjuvant chemotherapy in locally advanced
breast cancer
WANG Yujie, LIU Guangyu (Department of Breast Surgery, Fudan University Shanghai
Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 20032, China)
LIU Guangyu E-mail: liugy123@yahoo.com
Neoadjuvant chemotherapy or neoadjuvant chemotherapy in combination with targeted therapy has been widely accepted as the standard treatment for locally advanced breast cancer (Ⅱb-Ⅲ). Nearly forty percent of the patients who accepted neoadjuvant chemotherapy achieved pathological complete response of axillary lymph nodes in addition to downstage the primary lesions. However, for patients with clinical complete response of lymph nodes after pre-operative systemic therapy, there are constant controversies regarding the prediction of axillary lymph nodes response and sentinel lymph nodes biopsy after the treatment. Here we design to review the latest studies about how to evaluate the axillary lymph nodes response after neoadjuvant chemotherapy and try to enlighten the treatment choices in clinical practice.
Neoadjuvant chemotherapy; Axillary lymph nodes; Pathological complete response; Sentinel lymph nodes biopsy; Marking lymph nodes
10.3969/j.issn.1007-3969.2015.08.012
R737.9
A
1007-3639(2015)08-0629-06
2015-02-06
2015-04-15)
柳光宇 E-mail:liugy123@yahoo.com
