运动对糖尿病诱导的大鼠海马氧化应激的影响
2015-12-15李靖
李靖
(巢湖学院体育学院,安徽 巢湖 238000)
运动对糖尿病诱导的大鼠海马氧化应激的影响
李靖
(巢湖学院体育学院,安徽 巢湖 238000)
背景:氧化应激形成诱导多细胞通路的基础,其能导致糖尿病并发症,最能导致身体虚弱的疾病——是神经系统疾病。研究的目的是评价跑台运动是否能减轻链脲霉素诱导的糖尿病大鼠海马氧化应激和细胞凋亡率。方法:40只雄性Wistar大鼠随机分为4组,每组10只,即对照组、运动组、糖尿病组和糖尿病运动组,通过给大鼠注射链脲霉素诱导糖尿病模型。所有运动组大鼠在动物电动跑台上进行8周运动,在8周末,大鼠海马在冰冻中立即分离并冷冻保存。收集上清液于-80°C保存,用于测定抗氧化酶和TBARs,用ELISA试剂盒检测细胞死亡检测细胞凋亡指数。结果:糖尿病不运动组和糖尿病运动组的TBARs水平显著高于对照组;运动组SOD和GPx显著增高,糖尿病不运动组显著降低;与对照组相比,糖尿病不运动组CAT活性显著降低;与对照组相比,糖尿病不运动组细胞凋亡率显著增加,运动组显著降低。结论:运动对糖尿病大鼠产生有益影响,部分原因可能是因为运动诱导氧化应激适应能力的改变。
氧化应激;糖尿病;跑台运动;凋亡;海马
1 前言
糖尿病是世界上一个重要的医疗问题,影响超过1.65亿人,导致心血管疾病、肾病、视网膜病变和广泛的周围和中枢神经系统疾病。神经系统疾病可能成为最能导致身体虚弱的并发症之一,会影响大脑敏感认知区域,如海马,其调节记忆功能,呆滞显著的功能障碍和痴呆。氧化应激是形成诱导多细胞通路形成的基础,能最终导致糖尿病发生和后继并发症[1]。
海马突触可塑性和传递性缺损导致学习和记忆损害是糖尿病中枢系统并发症的表现[2]。越来越多的实验和临床研究证据表明氧化应激在糖尿病发生和后继并发症如视网膜病变中起关键作用[3]。
活性氧和氮族,即过氧化物、羟自由基、过氧化氢和一氧化氮(NO)的产生是中枢神经系统生理代谢反应的结果。超氧自由基被超氧物歧化酶(SOD)转换为过氧化氢,过氧化氢被谷胱甘肽过氧化物酶(GPx)和/或过氧化氢酶转换为水[4]。过氧化氢能穿过所有细胞膜,在更远位置导致羟自由基形成。羟自由基能引起脂质过氧化,损害细胞器和细胞膜,导致细胞死亡[4]。NO被超氧自由基快速破坏,其活性在SOD存在下增高[5]。
因为其高氧消耗率,大脑尤其易受氧化损伤,过度的活性自由基产生和高水平转换金属,如铁,催化活性自由基产生。此外,神经膜富含多不饱和脂肪酸,这是脂质过氧化的一个来源[6]。糖尿病患者的葡萄糖氧化、非酶糖基化蛋白和随后的糖基化蛋白氧化降解反应,会不成比例的形成自由基。自由基水平的异常升高,同时抗氧化防御机制下降能导致细胞器和酶的损伤、脂质过氧化的增加和胰岛素抵抗的形成。氧化应激的这些后果能促进糖尿病并发症的发生[7]。
一些研究表明,规律的适度的身体活动会对大脑产生有益的影响[8]。运动能刺激海马中的神经发生、改善学习和记忆[9-11]。据报道,运动能增强健康和糖尿病动物海马的细胞增殖[12-13]。最近,有研究指出运动可能防止链脲霉素诱导的糖尿病大鼠海马突触可塑性损害[2]。可以认为规律运动增加氧化酶活性、增加抵抗氧化应激,因此降低细胞氧化损害[14]。
据笔者所知,目前缺少规律运动影响糖尿病大鼠海马氧化应激和凋亡的研究证据。当前的研究目的是检验跑台跑是否能减轻链脲霉素诱导的糖尿病大鼠海马中氧化应激和细胞凋亡率。
2 材料与方法
40只雄性Wistar大鼠,2月龄,平均体重190±12 g,购于复旦大学实验动物科学部。大鼠室内饲养,室温控制在23±2°C,12小时光照循环,自由进食和饮水。
大鼠随机分为4组,每组10只,即对照组(不运动)、运动组、糖尿病组(不运动)和糖尿病运动组。所有运动组大鼠在动物电动跑台上进行8周运动,坡度为0%,速度为17m/min,每天40min,每周7天[2]。运动组大鼠接受运动计划的同时,糖尿病组大鼠每天放置于跑台上10 min,熟悉跑台环境。为了建立糖尿病大鼠模型,大鼠腹膜内注射50 mg/kg链脲霉素(STZ),对照组大鼠注射生理盐水。STZ注射后2天,用血糖测试仪测定血糖水平,大鼠血糖水平≥300 mg/dl为建模成功(表1)。所有大鼠在建模成功后8周解剖。
运动组和糖尿病运动组大鼠在最后一次运动后24小时,所有大鼠乙醚麻醉,断头。迅速分离海马,1 mL冰冻预冷的裂解缓冲液 (10 mM NaCl,1.5 mM MgCl2,20 mM HEPES,20%甘油,0.1%Triton X-100,1mM二硫苏糖醇,pH=7.4)中匀浆。匀浆后于4°C,1000 rpm分离1 min。收集含有细胞质蛋白的上清液,加入蛋白酶抑制剂混合物 (104 mM AEBSF,0.08 mM抑肽酶,2 mM亮肽素,4 mM抑氨肽酶b,1.5 mM胃酶抑素A和1.4 mM E-64)于-80℃保存。用Bradford法评估上清液蛋白浓度[15]。
通过测定匀浆中硫代巴比妥酸反应物(TBARs)分析脂质过氧化[16]。简单的说,样本与1 mL10%的三氯乙酸和1 mL0.67%的硫代巴比妥酸混合。接着样本在沸水浴中加热15 min,加丁醇(2∶1,v∶v)于溶液中。800 g,离心5 min后,在535 nm吸光度测定TBARs。
用Griffith法测定海马中谷胱甘肽浓度。匀浆制备如下:海马在5 vol.1%三氯乙酸(w/v)中匀浆,接着以18000 g离心10 min。为了测定总谷胱甘肽,等分上清液稀释1/50,10 μL制剂加入含有0.21 mM NADPH,0.6 mM5,5¢-二巯代(2-硝基苯甲酸),5 mM EDTA,和0.5 U谷胱甘肽还原酶的100 mM磷酸钠缓冲液,pH=7.5的混合物,最终容积为1 mL。记录412 nm吸光度。与谷胱甘肽标准曲线对照计算总谷胱甘肽[17]。
用RANSOD试剂盒测定超氧物歧化酶(SOD)活性[18]。上清液中SOD活性用分光光度计在505 nm处测定。依据这种方法,用叶黄素和叶黄素氧化酶产生超氧自由基,与碘硝基氯化四氮唑蓝(INT)反应形成红色甲臜。叶黄素的底物浓度为0.05 mmol/L,INT底物浓度为0.025 mmol/L。通过这个反应的抑制程度测定SOD活性。
用RANSEL试剂盒测定谷胱甘肽过氧化物酶(GPx)活性[19]。通过过氧化氢异丙苯,GPx催化谷胱甘肽氧化(浓度为4 mmol/L)。在谷胱甘肽还原酶(浓度为0.5 units/L)和0.28 mmol/L NADPH存在条件下,氧化型谷胱甘肽立即转换为还原形式,同时NADPH氧化为NAD+。用分光光度计测定340 nm处吸光度。之前,海马匀浆4°C,1000 g离心10 min。
过氧化氢酶活性(CAT)测定方法如文献所述[20]。H2O2分解后直接降低20°C,于240 nm测吸光度。适量上清液(60 μL相当于1.5 mg湿组织)加入反应混合物,含有0.002%Triton X-100,0.1 mm EDTA,0.5 m磷酸氢二钾缓冲液,pH=7.0和15 mm H2O2,最终容积1 mL。用最初30 s分解率计算活性。
根据试剂盒的说明,用细胞凋亡检测ELISA试剂盒定量测定细胞质组蛋白相关DNA片段。简要的说,萃取的海马细胞质作为酶联免疫双抗原夹心法的抗原与一抗组蛋白鼠单克隆抗体涂层微量滴定板和二抗DNA鼠单克隆抗体配对的过氧化物酶。在20°C,免疫复合物与2,2-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)孵化10 min,分光光度计于405 nm下测的定固定的过氧化物酶色泽变化。所有测量进行双份,对照组和训练组样本的分析在相同的微量滴定板上、相同环境中进行。接着OD405读数标准化为样本中总蛋白量。OD405/mg蛋白作为细胞凋亡指数,表示细胞浆单体和寡核苷酸酶的水平。
3 统计分析
用SPSS18.0对数据进行分析。用Shapiro-Wilk检验数据的常态分布,用单因素ANOVA分析组间差异,变量包括TBARs、抗氧化酶和细胞凋亡指数。当获得显著性P值时,Tukey post-hoc检验确定组间差异。设P<0.05为统计显著性。
4 结果
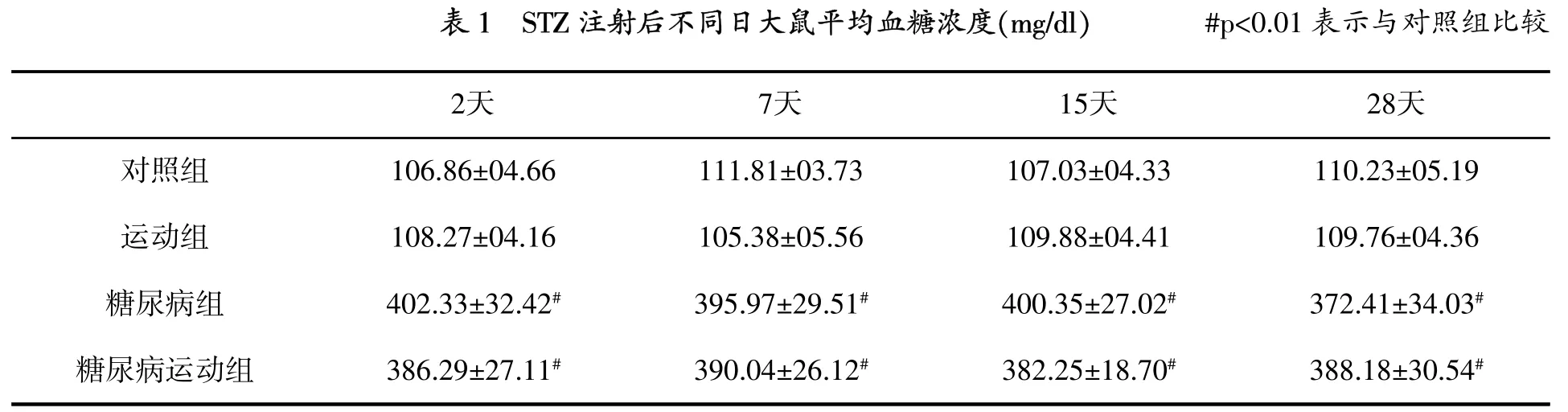
图1显示,与对照组相比,糖尿病组和糖尿病运动组TBARs水平显著增高(p=0.001),但运动的TBARs水平没有变化。虽然运动组和糖尿病运动组与对照组相比,海马GSH水平没有变化(表2),但是与对照组(p=0.009)和运动组(p= 0.004)相比,糖尿病组GSH水平显著降低。
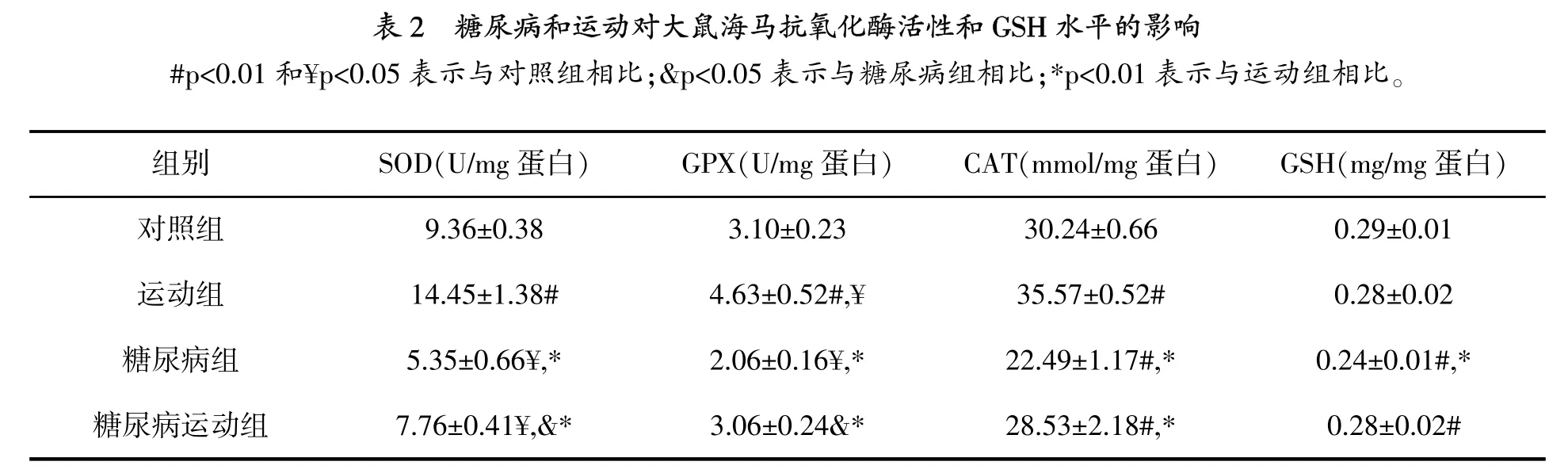
研究结果显示,与对照组相比,运动组大鼠海马SOD活性显著增高 (p=0.001),糖尿病组SOD活性显著降低(p=0.004)(表2)。虽然与对照组相比,糖尿病运动组SOD活性降低(p=0.032),但是比糖尿病组高(p=0.041)。
如同SOD活性,运动组海马GPX活性增加(p=0.009),糖尿病组降低(p=0.019)。虽然与对照组相比,运动组GPX活性没有变化,但是高于糖尿病组(p=0.029)。
与对照组相比,糖尿病组大鼠海马CAT活性显著降低(p=0.001)。然而,与对照组相比,运动组CAT活性显著增高(p=0.004)。与对照组相比,糖尿病运动组CAT活性没有变化,但是与糖尿病组相比,显著增高(p=0.002)。
5 讨论
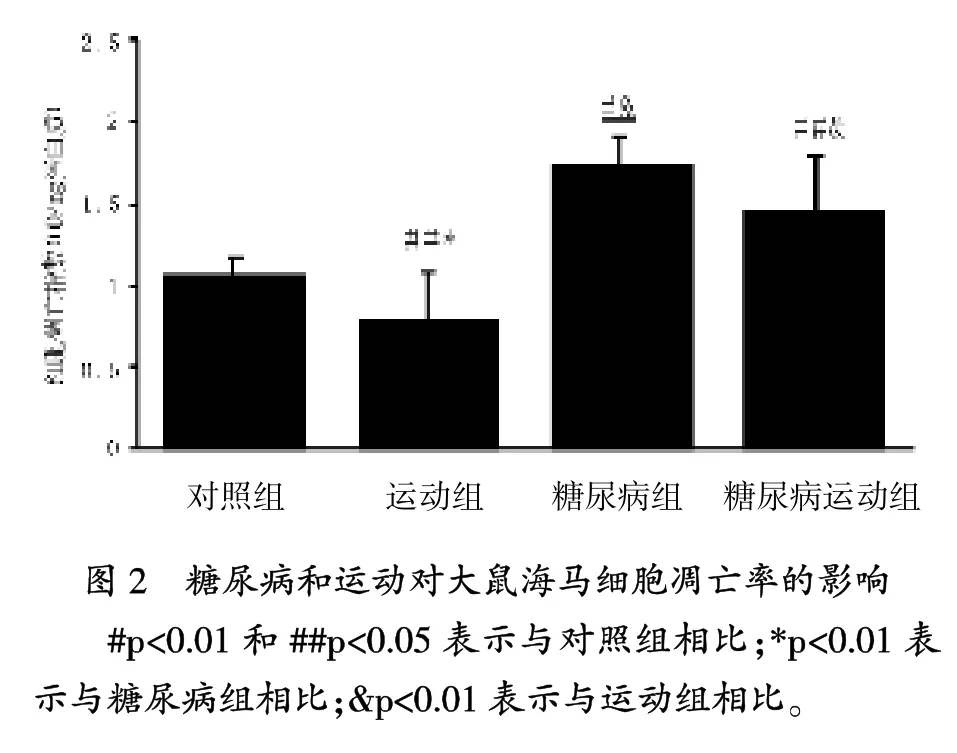
当前的研究中,糖尿病与海马脂质过氧化增加相关,其是一个已知的氧化应激标志,伴随抗氧化酶SOD、GPX和CAT显著下降。另外,糖尿病引起GSH水平显著增加,海马细胞凋亡率也显著增加。
糖尿病大鼠TBARs水平增高,表明氧化应激增加,预期抗氧化剂活性增加。研究发现SOD、GPX和CAT降低,表明这些酶的活性受糖尿病的影响。先前的研究表明,糖尿病诱导氧化应激,大脑和海马中抗氧化酶活性和能力减少[3][21-22]。然而,Ramanathan等报道,诱导糖尿病后72 h,SOD和CAT活性增加,GPX活性没有变化[23]。相反,在诱导糖尿病后1个月,CAT活性增加,GPX活性降低,SOD活性没有变化。笔者测定诱导糖尿病后2个月的抗氧化酶活性。Lappalainen等报道,诱导糖尿病后2个月,大鼠大脑中的谷胱甘肽还原酶降低,GPX活性增高,CAT和SOD活性没有变化[21]。但是,笔者测定海马中的这些酶活性,大脑不同区域这些酶活性可能不同[24]。
在凋亡神经病变过程中,氧化应激是一个关键的参与者,伴随代谢受损和兴奋性中毒[25]。氧化应激过程中,几个脂质过氧化产物形成,这些涉及神经死亡和成为GSH的一个中间底物,聚集进一步的氧化应激[6]。GSH是细胞内主要的抗氧化分子,是构成抗氧化应激的一个重要机制[21]。 GSH水平降低与凋亡神经死亡有关[26]。本研究结果与这个想法一致,与对照组相比,糖尿病大鼠海马GSH率显著降低和细胞凋亡显著增加。Lappalaine等报道,糖尿病通过GSH减少诱导大鼠大脑氧化应激[21]。此外,Piotrowski等描述细胞凋亡蛋白酶-3活性,是凋亡细胞死亡的一个关键酶,糖尿病大鼠的海马中升高[27]。这些数据显示,糖尿病导致氧化应激,可能诱导海马细胞凋亡。
笔者研究表明,非糖尿病运动大鼠比对照组有更高的SOD、GPX和CAT活性。而且,与对照组相比,非糖尿病运动组细胞凋亡率显著降低。非糖尿病运动组和对照组的TBARs水平没有差异,表明规律运动不能影响过氧化指数。Aksu等也报道,规律运动没有引起大鼠海马的氧化应激,通过降低超氧化自由基形成对海马有一个有利影响[28]。另一方面,Lappalainen等报道,8周运动后大脑中的抗氧化酶 (除了谷胱甘肽还原酶)没有增加[21]。这个差异可能是由方法不同、评价大脑区域不同、运动计划不同和最后一次运动与动物处死之间的时间不同产生的。
笔者也研究了运动对糖尿病诱导的大鼠海马氧化应激和细胞凋亡率的影响。结果显示规律运动有效地预防大鼠海马抗氧化酶活性和GSH水平降低。Lappalainen等研究显示,规律运动没有影响大鼠大脑中SOD、GPX和CAT活性[21]。这个差异的原因不清楚,但是可能归因于运动对大脑不同区域的不同效应或评价方法的不同和运动计划的不同。
研究结果表明,规律运动防止糖尿病大鼠海马中脂质过氧化的增加和细胞凋亡率增加。关于抗氧化酶活性的增加,可能是防止凋亡增加而导致氧化应激降低的产生。先前,有人提出涉及氧化应激与海马细胞凋亡的建议[29],Lee等研究显示,跑台运动开始后24小时,大脑出血和诱导糖尿病,齿状回凋亡细胞数量显著降低[13]。另外,跑台运动显著增强高血糖大鼠齿状回细胞的增殖。
6 结论
研究结果表明,规律的运动能减少糖尿病诱导的海马氧化应激和细胞凋亡率。降低周围和中枢神经系统病变,预防学习和记忆损害,防止老年痴呆的发生。
参考文献:
[1]段淑芳,叶真.糖尿病血管并发症与内皮细胞氧化应激的关系[J].浙江中医药大学学报,2010,(6)∶944-946.
[2]Reisi P.,Babri S.,Alaei H.,et al.Effects of treadmill running on short-term pre-synaptic plasticity at dentate gyrus of streptozotocin-induced diabetic rats[J].Brain Res.,2008,(1211)∶30-6.
[3]陈放,徐珊,吕伟红,程宏,等.糖尿病大鼠视网膜氧化应激损伤及葛根素的干预作用[J].眼科新进展,2012,(1)∶15-19.
[4]孙备,姜洪池,赵金鹏,等.大鼠肝脏保存再灌注时羟自由基与细胞凋亡、Bcl-2蛋白表达的关系及丹参的保护作用[J].中华普通外科杂志,2000,(9)∶27-30.
[5]Rubanyi G.M.,Vanhoutte P.M.Superoxide anions and hyperoxia inactivate endothelium-derived relaxing factor[J].Am J Physiol.,1986,(250)∶822-7.
[6]Ansari M.A.,Roberts K.N.,Scheff S.W.Oxidative stress and modification of synaptic proteins in hippocampus after traumatic brain injury[J].Free Radic Biol Med.,2008,(45)∶443-52.
[7]徐华,纳春祥,李海龙,等.糖尿病并发症相关性氧化应激的实验研究[J].中国医药指南,2012,(28)∶1-2.
[8]Ahlskog J.E.,Geda Y.E.,Graff-Radford N.R.&Petersen R.C.Physical exercise as a preventive or disease-modifying treatment of dementia and brain aging[J].Mayo Clin Proc.,2011,(86)∶876-84.
[9]Wolf,S.A.,Melnik,A.&K.empermann,G.Physical exercise increases adult neurogenesis and telomerase activity,and improves behavioral deficits in a mouse model of schizophrenia[J].Brain Behav Immun.,2011,(25)∶971-80.
[10]Liu H.L.,Zhao G.,Cai K.,Zhao H.H.&Shi L.D.Treadmill exercise prevents decline in spatial learning and memory in APP/PS1 transgenic mice through improvement of hippocampal long-term potentiation[J].Behav Brain Res.,2011,(218)∶308-14.
[11]孟兆辉,徐波,李世昌,等.运动诱导海马内IGF-1的变化与学习记忆能力的关系[J].中国康复理论与实践,2008,(10)∶912-915.
[12]Kim H.B.,Jang M.H.&Shin M.C.,et al.Treadmill exercise increases cell proliferation in dentate gyrus of rats with streptozotocin-induced diabetes[J].J Diabetes Complications,2003,(17)∶29-33.
[13]Lee H.H.,Shin M.S.&Kim Y.S.,et al.Early treadmill exercise decreases intrastriatal hemorrhage-ind-uced neuronal cell death and increases cell prolifera-tion in the dentate gyrus of streptozotocin-induced hyperglycemic rats[J].J Diabetes Complications,2005,(19)∶339-46.
[14]Mazzola P.N.,Terra M.,Rosa A.P.,et al.Regular exercise prevents oxidative stress in the brain of hyperphenyla-laninemic rats[J].Metab Brain Dis.,2011,(26)∶291-7.
[15]Bradford M.M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal Biochem.,1976,(72)∶248-54.
[16]Draper H.H.&Hadley M.Malondialdeyde determination as an index of lipid peroxidation[J].Methods Enzymol.,1990,(186)∶421-31.
[17]Griffith O.W.Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine[J].Anal Biochem.,1980,(106)∶207-12.
[18]Delmas-Beauvieux M.C.,Peuchant E.,Dumon M.F.,et al.Relationship between red cell antioxidant enzymatic system status and lipid peroxidation during the acute phase of malaria[J].Clin Biochem.,1995,(28)∶163-9.
[19]Paglia D.E.&Valentine W.N.Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase[J].J Lab Clin Med.,1967,(70)∶158-69.
[20]Aebi H.Catalase in vitro[J].Methods Enzymol.,1984,(105)∶121-6.
[21]Lappalainen,Z.,Lappalainen,J.,Oksala,N.K.,et al.Diabetes impairs exercise training-associated thioredoxin response and glutathione status in rat brain[J].Appl Physiol,2009,(106)∶461-7.
[22]Kosenko E.A.,Kaminskii AIu,Kaminskii,I.G.Activity of antioxidant enzymes in liver and brain is decreased in the early stage of diabetes,and this decrease depends on the function of NMDA-receptors[J].Vopr Med Khim.,1999,(45)∶304-8.
[23]Ramanathan M.,Jaiswal A.K.&Bhat-tacharya S.K.Superoxide dismutase,catalase and glutathione peroxidase activities in the brain of streptozotocin induced diabetic rats[J].Indian J Exp Biol.,1999,(37)∶182-3.
[24]Somani S.M.,Ravi R.&Rybak L.P.Effect of exercise training on antioxidant system in brain regions of rat[J].Pharmacol Biochem Behav.,1995,(50)∶635-9.
[25]Alexi T.,Borlongan C.V.,Faull R.L.,et al.Neuroprotective strategies for basalganglia degeneration∶Parkinson′s and Hunt-ington′s diseases[J].Prog Neurobiol.,2000,(60)∶409-70.
[26]Ansari M.A.,Joshi G.,Huang Q.,et al.Invivo administration of D609 leads to protection of subsequently isolated Gerbil brain mitochondria subjected to invitro oxidative stress induced by amyloid betapeptide and other oxidative stressors∶relevance to Alzheimer′s disease and other oxidative stress-related neurodegenerative disorders[J].Free Radic Biol Med.,2006,(41)∶1694-703.
[27]Piotrowski P.,Wierzbicka K.&Smialek M.Neuronal death in the rat hippocampus in experimental diabetes and cerebral ischaemia treated with antioxidants[J].Folia Neuropathol.,2001,(39)∶147-54.
[28]Aksu I.,Topcu A.,Camsari U.M.,et al.Effect of acute and chronic exercise on oxidant-antioxidant equilibrium in rat hippocampus,prefrontal cortex and striatum[J].Neurosci Lett.,2009,(452)∶281-5.
[29]Zhang Q.,Zhang G.,Meng F.,Tian H.Biphasic activation of apoptosis signal-regulating kinase 1-stress-activated protein kinase 1-c-Jun N-terminal protein kinase pathway is selectively mediated by Ca2+-permeable alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate receptors involving oxidative stress following brain ischemia in rat hippocampus[J].Neurosci Lett.,2003,(337)∶51-5.
THE EFFECT OF EXERCISE ON THE OXIDATIVE STRESS OF THE DIABETES-INDUCED RAT-HIPPOCAMPUS
LI Jing
(School of Physical Education,Chaohu College,Chaohu Anhui 238000)
Background∶Oxidative stress forms the foundation for the induction of multiple cellular pathways which can lead to the complications of diabetes mellitus.The most debilitating ones are diseases of the nervous system.In this study,whether treadmill running could alleviate the oxidative stress and cellular apoptosis rate in the hippocampus of streptozotocin-induced diabetic rats is evaluated.Methods∶Forty male Wistar rats were randomly divided into four groups(n=10)∶Control group,exercised group,diabetic group and diabetic-exercised group.Diabetes was induced by injection of streptozotocin in male rats.All rats in the trained group run on a rodent motor-driven treadmill for eight weeks.At the end of eight weeks,hippocampi of animals were immediately removed on ice and kept frozen.The light supernatant was taken and stored at-80°C.They were used for determination of antioxidant enzymes and TBARs level.Index of apoptosis was detected by cell death detection ELISA Kit.Results∶Levels of TBARs in diabetic group and diabetic-exercised group were significantly higher than control group.SOD and GPx activities significantly increased in exercised group and decreased in diabetic group.CAT activity significantly decreased in diabetic group versus control group.The apoptosis rate significantly increased and decreased in diabetic group and exercised group respectively compared to control group.Conclusion∶exercise has beneficial effects in the diabetic exercised rats,possibly in part because of alterations in the ability to adapt to exercise-induced oxidative stress.
oxidative stress;diabetes;treadmill exercise;apoptosis;hippocampus
G80
A
1672-2868(2015)06-0100-06
责任编辑:杨松水
2015-06-25
李靖(1982-),男,安徽巢湖人。巢湖学院体育学院,讲师。研究方向:运动生理学。
