酸性环境对高磷诱导的大鼠血管平滑肌细胞钙化的影响及机制研究
2015-12-14张俊霞徐金升冯雨白亚玲张胜雷崔立文张慧然
张俊霞 徐金升 冯雨 白亚玲 张胜雷 崔立文 张慧然
心血管疾病是慢性肾脏病(chronic kidney disease,CKD)患者死亡的重要原因,据统计50%以上的CKD患者死于心血管疾病[1]。血管钙化与CKD患者心血管疾病的发生密切相关,其防治已成为肾脏科医生关注的焦点。研究表明,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)表型转化是发生血管钙化的重要环节[2]。慢性代谢性酸中毒是CKD患者的一种常见并发症[3],近期Leibrock等[4]研究发现代谢性酸中毒可以抑制VSMCs表型转化。本课题组前期研究发现,维生素K[5]、γ干扰素[6]、镁离子[7]均可抑制 VSMCs 表型转化的发生。然而,酸性环境对VSMCs表型转化的作用机制尚未清楚,故本实验探讨了酸性环境对高磷诱导大鼠VSMCs钙化的影响及可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 5~8周龄健康雄性SD大鼠6只,体重80~100 g,由河北医科大学实验动物中心提供,动物合格证标号:1305090。
1.1.2 主要试剂和仪器 倒置相差显微镜(LH50A型)(日本 OLYMPUS公司);酶标仪(CYTATION3型)(美国 Biotek公司);胎牛血清(fetal bovine serum,FBS)(美国 GIBCO 公司);DMEM 培养基(美国GIBCO公司);SP免疫组化试剂盒(河北博海生物工程开发有限公司);酸度计(北京赛多利斯科学仪器有限公司);钙含量测定试剂盒(中生北控生物科技股份有限公司);二氨基联苯胺(DAB)显色试剂盒(河北博海生物工程公司);RNA提取试剂盒、RNA反转录试剂盒(美国Therom公司);PCR引物(上海英潍捷基公司);钙离子探针Fluo-3/AM(美国Sigma公司)。
1.2 方法
1.2.1 大鼠VSMCs的原代培养及实验分组 贴壁法原代细胞培养[5],将VSMCs按随机数字表法分为正常对照组和高磷干预组。正常对照组采用含10%胎牛血清培养基;高磷干预组采用高磷培养基(含 10 mmol/L β-甘油磷酸)培养,再分别加入1 mol/L盐酸调整 pH值为6.8、7.1和7.4,每24 h换液1次。一般认为酸性环境培养细胞时间>12 h即为细胞受到慢性酸中毒的刺激[8],本研究所取时间点为4 d和14 d,为研究酸性环境对VSMCs钙化的长期影响提供保证。
1.2.2 细胞鉴定 按文献[7]方法进行细胞鉴定,传代纯化,细胞生长特性未见异常改变。
1.2.3 钙化检测 钙含量测定 细胞培养14 d后弃去上清液,PBS洗3次,加入1 mol/L盐酸脱钙24 h,取上清液采用邻甲酚酞络合酮比色法检测细胞钙化情况[6]。每组设3个复孔,取平均值。
茜素红染色 细胞培养14 d后用细胞茜素红钙染色试剂对样本进行固定、染色及澄清处理,倒置显微镜下观察钙结节染色情况,每组选取3个样本,每个样本按随机数字表法选取1个视野(×100)。SDS结果判断标准:钙盐沉积为橘红色。
1.2.4 碱性磷酸酶(alkaline phosphatase,ALP)活性测定 细胞培养14 d弃上清,PBS洗3次,0.1%Triton X-100置4℃环境中过夜,采用酶联免疫吸附法测定ALP活性[6],每组实验重复3次。
1.2.5 VSMCs内钙离子浓度测定 钙离子可以和荧光探针Fluo-3/AM结合后,被325 nm激光激发,发射出526 nm荧光,荧光强度可以反映出细胞内钙离子水平。按文献[9]方法,根据本课题组前期预实验结果,细胞刺激4 d,检测VSMCs内钙离子浓度。于孔板上培养细胞,胰酶消化细胞收集于离心管内,离心1 000转,5 min,弃上清;冷PBS洗涤细胞后,离心1 000转,5 min,弃上清;含钙 HEPES缓冲液洗涤细胞,重悬细胞,调整细胞浓度为200~300×106/L,Fluo-3/AM加入至细胞悬液当中,终浓度为 5 μmol/L,37℃避光负载 35 min;以 80 mmol/L钾溶液为激动剂,细胞悬液置于孔板内,每组均设置对照孔,使用酶标仪检测,激发光波长为325 nm,于526 nm处检测荧光值,实验重复3次,取平均值。
1.2.6 观察酸性环境对大鼠VSMCs中目的基因表达的影响 通过预实验摸索,我们发现细胞接受4 d干预后,目的基因表达较为稳定。采用RNA分离试剂盒Trizol提取并纯化组织总RNA。PCR反应在ABI5700型PCR仪上进行,反应程序为:95℃预变性 5 min, 95℃ 变性 30 s,LTCCα1C58℃、LTCCβ250℃、LTCCβ358℃和GAPDH 58℃退火30 s,72℃延伸 45 s,32 个循环;Smad1 55℃退火、72℃延伸 45 s,36个循环;Runx2 55℃退火、72℃延伸45 s,28个循环,最后于72℃延伸10 min。取PCR产物,行琼脂糖凝胶电泳。应用RT-PCR方法进行检测。实验重复3次,取平均值,以GAPDH作为内对照,计算相对含量。各基因扩增引物序列见表1。

表1 各目的基因引物序列
1.3 统计学方法
采用SPSS 13.0统计学软件进行分析,符合正态分布的计量资料用±s表示,多组间均数比较采用单因素方差分析(ANOVA),用LSD-t检验作多组间均数两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 酸性环境对高磷诱导的大鼠VSMCs钙化影响
茜素红染色结果显示,与正常对照组相比,高磷+pH7.4组橘红色钙化结节明显增多,且高磷组随pH降低橘红色钙化结节明显减少(图1)。4组大鼠VSMCs钙含量比较,差异有统计学意义(F=65.29,P<0.01);与正常对照组相比,高磷+pH7.4组钙含量明显增多(P=0.011),且高磷组随pH降低钙含量明显减少(均为P<0.05)(表2)。
2.2 酸性环境对Runx2 mRNA表达和ALP活性的影响
4组大鼠VSMCs的Runx2 mRNA比较,差异有统计学意义(F=1 234.839,P <0.01);与正常对照组相比,高磷+pH7.4组Runx2 mRNA表达水平增加(P<0.01),且高磷组随着 pH值降低 Runx2 mRNA 表达量下降(P <0.01)(图2,表3)。
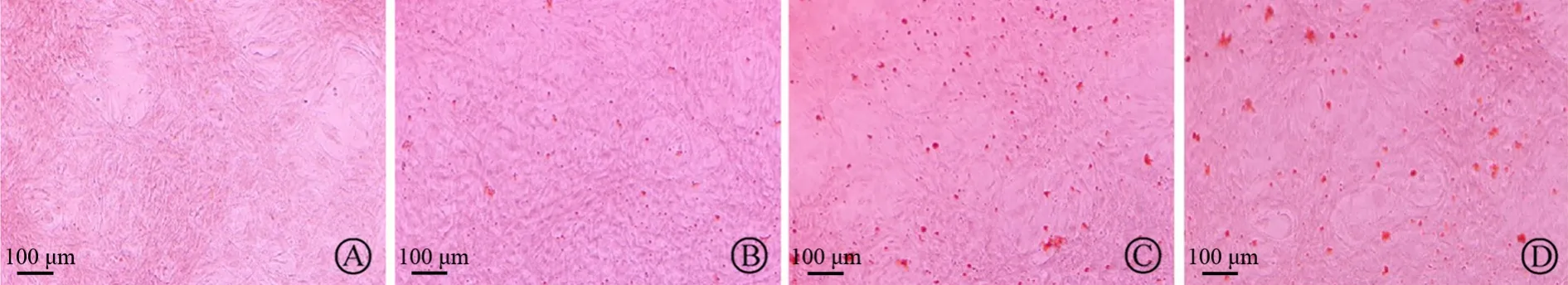
图1 各组大鼠VSMCs钙化结果(茜素红染色,×100)
表2 各组大鼠VSMCs钙含量、ALP活性及钙离子浓度比较(±s)

表2 各组大鼠VSMCs钙含量、ALP活性及钙离子浓度比较(±s)
注:与正常对照组比较,aP<0.05;与高磷+pH6.8组比较,bP<0.05;与高磷+pH7.1组比较,cP<0.05
组别 n 钙含量(mg/g蛋白) ALP活性(U/g蛋白) 钙离子浓度(Fluo-3/AM)正常对照组 3 22.39±3.19 20.39±1.18 149.54±20.89高磷+pH6.8组 3 50.74±3.29a 34.62±1.13a 234.00±17.43a高磷+pH7.1组 3 69.95±1.72ab 51.11±2.05ab 329.66±16.64ab高磷+pH7.4组 3 88.26±6.43abc 94.33±3.08abc 438.33± 7.50abc
表3 各组大鼠VSMCs目的基因表达水平比较(±s)

表3 各组大鼠VSMCs目的基因表达水平比较(±s)
注:与正常对照组比较,aP<0.05;与高磷+pH6.8组比较,bP<0.05;与高磷+pH7.1组比较,cP<0.05
组别 n LTCCα1C亚基 LTCCβ2亚基 LTCCβ3亚基 Runx2 Smad1正常对照组 3 0.66±0.04 0.36±0.02 0.34±0.13 0.01±0.00 0.07±0.01高磷+pH6.8组 3 0.65±0.05 0.38±0.02 0.43±0.01a 0.09±0.01a 0.23±0.01a高磷+pH7.1组 3 0.65±0.04 0.36±0.03 0.64±0.11ab 0.25±0.02ab 0.44±0.04ab高磷+pH7.4组 3 0.64±0.03 0.36±0.02 0.80±0.01abc 0.37±0.02abc 0.65±0.05abc

图2 各组大鼠VSMCs目的基因表达情况
4组大鼠VSMCs ALP活性比较,差异有统计学意义(F=6.282 6,P=0.02);与正常对照组相比,高磷+pH7.4组ALP活性明显增加(P<0.01),且高磷组随pH降低ALP活性明显减少(均为P<0.01)(表 2)。

图3 各组大鼠VSMCs钙离子浓度(Fluo-3/AM,×10)
2.3 酸性环境对高磷诱导的大鼠VSMCs的LTCCα1C、β2和 β3亚基 mRNA 表达的影响
4组大鼠VSMCs的LTCCβ3亚基mRNA比较,差异有统计学意义(F=370.275,P<0.01);与正常对照组相比,高磷 +pH7.4组 LTCCβ3亚基mRNA表达水平增加(P<0.01),且高磷组随着pH值降低LTCCβ3亚基mRNA表达量下降(均为P<0.01);各组之间 LTCCα1C和 β2亚基 mRNA的表达差异无统计学意义(P=0.08,P=0.74)(图 2,表3)。
2.4 酸性环境对VSMCs胞外钙离子内流效应的影响和Smad1 mRNA表达的影响
荧光显色结果显示,与正常对照组相比,高磷+pH7.4组VSMCs钙离子浓度明显增加,且高磷组随pH降低胞内钙离子浓度下降(图3)。4组大鼠VSMCs Fluo-3/AM荧光强度比较,差异有统计学意义(F=305.395,P <0.01),与正常对照组相比,高磷+pH7.4组VSMCs钙离子浓度明显增加(P<0.01),且高磷组随pH降低胞内钙离子浓度下降(均为P<0.01)(表2)。4组大鼠VSMCs的 Smad1 mRNA比较,差异有统计学意义(F=591.948 9,P<0.01);与正常对照组相比,高磷+pH7.4组Smad1 mRNA表达水平增加(P<0.01),且高磷组随着pH值降低Smad1 mRNA表达量下降(均为P<0.01)(图2,表3)。
3 讨论
CKD患者是心血管疾病的高危人群,而血管钙化是心血管疾病的重要危险因素,不同于普通人群发生的动脉粥样硬化,CKD患者以血管中膜钙化为突出表现[2]。VSMCs作为血管中膜的重要成分,在血管钙化发生过程中起重要作用。钙通道、细胞质中的钙和肌浆网储存的钙构成了VSMCs的钙信号通路。由钙通道介导的钙离子内流可以通过促进细胞凋亡,加速基质小泡释放,促进钙磷沉积等多种机制来参与血管钙化的发生、发展[10]。LTCC作为钙通道中重要一员,参与VSMCs的基因转录、表型转化等生物学过程[11]。代谢性酸中毒是CKD患者的常见并发症,近年来就酸性环境对骨形成的作用研究较为深入,然而其对血管钙化作用的研究甚少。我们已知VSMCs成骨/成软骨表型转化是其重要机制之一[9],据此,可将酸性环境对成骨作用的影响推演到血管钙化上。我们通过体外培养VSMCs,深入探讨酸性环境对VSMCs钙化的影响。在前期预实验当中,我们调整高磷组培养基pH从6.5开始,每组相差 0.1,终到 7.4,MTT实验显示细胞在pH6.5到pH7.4的培养基当中均生长良好,为放大造模效应,更好地说明慢性酸负荷对高磷诱导的VSMCs钙化的影响,选取pH6.8及pH7.1两个pH值为实验组。本研究中茜素红钙化染色结果同钙含量结果基本一致,均提示酸性环境可以抑制高磷诱导的VSMCs钙化。
血管钙化常伴随着Runx2、ALP等骨相关蛋白的表达。作为成骨细胞分化的特异性标志物Runx2,亦是VSMCs表型转化的标志[2]。 本研究发现酸性环境可以抑制高磷诱导的VSMCs的Runx2表达,并随着pH降低,Runx2表达减少,提示酸性环境在VSMCs表型转化过程中起着重要作用。另一方面,ALP是血管平滑肌成骨表型转化的早期标志物[2],本研究发现,高磷组ALP活性较正常对照组均有所增加,且高磷组ALP随着pH值降低活性下降,进一步验证了酸性环境可以抑制VSMCs表型转化的发生。
LTCC是VSMCs上重要的电压门控钙通道,目前已知α1C、β2和β33种亚基在VSMCs上表达,它具有高电压活化,开放时间长及失活慢的特点,是介导钙离子内流入VSMCs的主要途径,LTCCβ3亚基位于细胞膜内侧,它与α1C亚基共表达可提高LTCC激活阈值和峰电位,也可增加LTCC在胞膜上的密度[12]。 Dawson 等[13]研究表明,上调 LTCCβ3亚基表达可以显著增加钙离子内流入细胞。本研究结果显示,高磷组VSMCs的LTCCβ3亚基mRNA表达水平降低后VSMCs钙离子浓度相应减少,这提示我们酸性环境可能通过下调LTCCβ3亚基的表达抑制了钙离子内流。钙离子作为VSMCs重要的第二信使,除直接参与生命活动外,同样需要相应蛋白将钙离子下游信号传递到不同的信号网络。Eapen等[14]研究表明,细胞外钙离子内流入细胞后,可以通过调控胞内的信号分子Smad1的丝氨酸磷酸化,Smad蛋白活化后转位至胞核内进而调控其下游目的基因转录,上调Runx2的表达。因此我们进一步研究了酸性环境对Smad1及Runx2 mRNA表达的影响。本实验中发现,高磷组Smad1及Runx2 mRNA表达水平均有不同程度增加,且随着pH值的下降,Smad1及Runx2 mRNA表达量逐渐减少。因此,推测酸性环境抑制VSMCs表型转化和钙化的可能机制是通过降低LTCCβ3亚基表达来阻滞钙离子内流,进一步抑制Smad1和Runx2的表达从而抑制VSMCs表型转化来实现的。
本研究发现酸性环境可以抑制高磷诱导的大鼠VSMCs钙化,其可能机制是通过抑制LTCCβ3亚基表达,降低VSMCs钙离子内流,阻滞VSMCs发生表型转化来实现对VSMCs钙化的抑制作用。这为我们临床治疗血管钙化提供了新思路。本实验仅在基因水平上发现酸性环境抑制LTCCβ3亚基基因表达,有待进一步在蛋白水平上证明LTCCβ3亚基的变化。酸性环境对LTCCβ3亚基基因表达的影响是通过减少了基因转录水平亦或是增加了mRNA降解,其具体作用机制笔者将会进行深入探讨。