冠心病介入治疗术后服用氯吡格雷患者的CYP2C19基因型与血小板抑制率的关系研究
2015-12-14付东亮刘晓飞彭文华张虎杨鹏程文立郑金刚王勇
付东亮 刘晓飞 彭文华 张虎 杨鹏 程文立 郑金刚 王勇
氯吡格雷用于预防冠心病患者经皮冠状动脉介入术(percutaneous coronary intervention,PCI)后的血栓事件,是目前国内外临床指南推荐的标准治疗药物之一。但临床应用氯吡格雷时,仍有4% ~30%的患者在常规剂量治疗中,达不到预期的抗血小板作用,严重者会出现支架血栓、再次心肌梗死甚至死亡等心血管不良事件,称为氯吡格雷抵抗[1]。氯吡格雷是一种前体药物,经肝脏内CYP2C19酶的代谢,转化为具有药效的活性状态,才具有抗血小板聚集的作用[2]。研究发现,CYP2C19酶存在多种突变等位基因,中国人群的 CYP2C19变异主要是CYP2C19*2和CYP2C19*3两型,这两种突变等位基因均能造成CYP2C19酶活性的降低或完全丧失,从而对氯吡格雷的疗效产生重要影响[3]。
有研究显示,CYP2C19基因多态性是引起氯吡格雷抵抗的重要因素[4-5],但Bauer领导的大规模荟萃分析研究却持反对观点,该研究显示CYP2C19基因多态性与氯吡格雷抵抗不存在关联性[6]。那么,CYP2C19基因多态性与氯吡格雷抵抗之间到底有何关联?本研究拟对此问题进行探讨,在冠心病介入治疗术后服用氯吡格雷的患者中,分析CYP2C19基因型与氯吡格雷对二磷酸腺苷(adenosine diphosphate,ADP)诱导的血小板聚集的抑制率之间的相关性,并进行6个月随访,为临床正确应对氯吡格雷抵抗积累循证医学证据。
1 对象和方法
1.1 研究对象和分组
入选2014年5月至2015年7月在北京中日友好医院因冠心病接受PCI治疗的患者500例,其中男性331例,女性169例,年龄28~82岁,平均年龄(66.2±9.3)岁,均同期接受CYP2C19基因和血栓弹力图检测。排除标准:(1)血小板计数>450×109/L或<100×109/L;(2)术前两周使用口服抗凝药或其他抗血小板药物;(3)存在阿司匹林或氯吡格雷使用禁忌证;(4)凝血功能异常或存在严重肝脏疾病者;(5)严重贫血、感染或甲状腺功能亢进等疾病者。所有研究对象均在入选前签署知情同意书。
1.2 研究方法
1.2.1 用药方法 PCI术前未服用过阿司匹林和(或)氯吡格雷或服用不足4 d的患者,首次给予负荷剂量药物,即阿司匹林300 mg和氯吡格雷300 mg(急诊600 mg);术前服药超过4 d的患者,无需给予负荷剂量。PCI术后每天均给予患者阿司匹林100 mg和氯吡格雷75 mg,双联抗血小板治疗持续至少1年。
1.2.2 CYP2C19基因型检测方法 采集患者入院次日清晨空腹静脉血2 ml(EDTA-Na2抗凝),提取基因组DNA。用CYP2C19基因检测试剂盒(DNA微阵列芯片法,北京博奥生物有限公司),根据说明书进行PCR扩增,将PCR产物与固定基因探针的基因芯片进行特异性杂交,经酶促显色反应,根据芯片上的位点排列顺序,确定CYP2C19基因型。根据基因检测结果分组:A组:野生型纯合子组(CYP2C19*1/*1,快代谢);B组:野生型与突变基因杂合子组(CYP2C19*1/*2和*1/*3,中等代谢);C组:突变基因纯合子或杂合子组(CYP2C19*2/*2、*2/*3 和*3/*3,慢代谢)[7]。
1.2.3 血栓弹力图检测血小板抑制率方法 PCI术后次日空腹抽取静脉血2 ml,分别置入枸橼酸钠抗凝真空采血管中,2 h内完成血小板抑制率检测。应用美国Haemoscope公司生产的血栓弹力图分析仪(型号TEG5000),以 ADP为激活物测定氯吡格雷的血小板抑制率。评定标准:根据Haemoscope公司产品说明,给予阿司匹林和氯吡格雷治疗后,血小板ADP受体抑制率75%~100%为效果良好;50% ~75%为有效;20% ~50%为低反应,<20%为无效[8]。
1.3 临床随访
对2014年5月至2015年4月的入选患者进行6个月随访,随访方式包括门诊随诊、再住院及电话随访。观察主要心脏不良事件,包括心血管缺血事件(心原性死亡、支架内血栓形成、再发不稳定型心绞痛、非致死性心肌梗死)和出血事件。
1.4 统计学方法
2 结果
2.1 CYP2C19基因型检测结果
500例患者中CYP2C19*1/*1有210例,占42.0%;CYP2C19*1/*2有 230例,占 40.6%;CYP2C19*1/*3有21例,占4.2%;CYP2C19*2/*2有52例,占10.4%;CYP2C19*2/*3有12例,占2.4%;CYP2C19*3/*3有2例,占0.4%。根据该结果可知,500例患者中氯吡格雷快、中和慢代谢3组人群分布为42.0%、44.8%和13.2%。
2.2 ADP诱导的血小板抑制率检测结果
3.4%的患者血小板抑制率在0~20%,16.8%的患者在20% ~50%,26.6%的患者在50% ~75%,53.2%的患者在75% ~100%。根据Barragan对氯吡格雷抵抗的定义:在治疗的任何时间内血小板活性均较高(>50%)[9],则 500 例患者中有20.2%的患者血小板抑制率小于50%,即血小板活性大于50%,即这部分患者表现为氯吡格雷抵抗。
2.3 CYP2C19基因型与血小板抑制率之间的关系
A组(氯吡格雷快代谢)ADP诱导的血小板抑制率在0~20%、20% ~50%、50% ~75%和75% ~100%的人群分布为1.90%、14.29%、30.00%和50.81%;B组(氯吡格雷中代谢)的人群分布为3.57%、17.86%、22.32%和56.25%;C组(氯吡格雷慢代谢)的人群分布为7.58%、21.21%、30.30%和40.91%(表1)。将3组血小板抑制率在人群中的分布采用秩和检验进行比较,差异无统计学意义(χ2=6.0487,P=0.0686),即 CYP2C19 基因型与ADP诱导的血小板抑制率之间无明显相关性。
2.4 临床随访结果
截至2015年10月,共对437例患者进行了为期6个月的随访,其中4例患者因在外地复诊且电话停机等原因未能完成随访;剩余63例患者因随访时间未满6个月未行统计。完成6个月随访的433例患者:A组183例,发生心血管缺血事件9例,严重出血事件1例(脑出血);B组195例,发生心血管缺血事件13例,无严重出血事件;C组55例,发生心血管缺血事件4例,无严重出血事件。3组之间的心血管缺血事件发生率比较,差异无统计学意义(P>0.05,表2)。 临床随访结果表明,CYP2C19基因型与心血管缺血事件发生之间无明显相关性。
3 讨论
氯吡格雷加阿司匹林已成为急性冠状动脉综合征和PCI术后患者的标准治疗方案,但氯吡格雷抵抗会影响患者疗效,并增加再次发生心血管事件的风险。因此,早期识别患者氯吡格雷抵抗十分重要。CYP2C19基因多态性对氯吡格雷的药物效果产生重要影响,中国人群的基因多态性发生率更高[10]。因此,对中国PCI术后使用氯吡格雷患者的血小板抑制率与CYP2C19基因多态性的相关性进行研究很有必要。
本研究通过基因检测方法,发现CYP2C19基因在中国人群中突变率较高。其中CYP2C19快代谢(*1/*1),中等代谢(*1/*2、*1/*3)和慢代谢(*2/*2、*2/*3和*3/*3)在 500例患者中的分布频率分别为42.0%、44.8%和13.2%。这与2007年周健等[11]研究得出的CYP2C19基因型分布结果类似。国外研究证实,CYP2C19(*1/*2)和CYP2C19(*1/*3)由于只有1条有效的CYP2C19等位基因,而使得CYP2C19酶活性降低,故含有*2或*3突变等位基因的患者,残余血小板聚集率明显高于野生纯合型[12]。那么携带CYP2C19突变基因的中国患者是否一定会发生氯吡格雷抵抗呢?
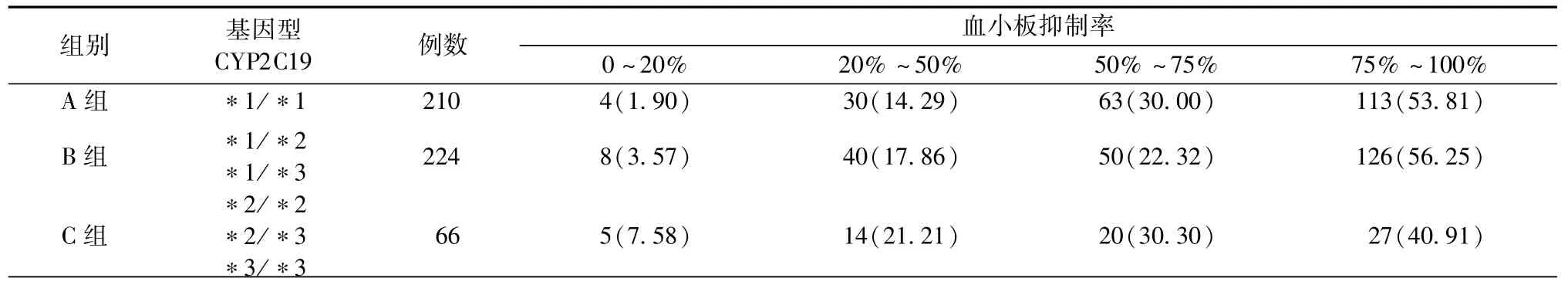
表1 CYP2C19基因型与ADP诱导的血小板抑制率分布之间的关系[例(%)]

表2 完成6个月随访的3组患者的心血管缺血事件比较[例(%)]
根据本研究血小板抑制率在500例患者中的分布可以看出,3.4%的患者血小板抑制率在0~20%,16.8%的患者血小板抑制率在20% ~50%。合计约有20.2%的患者对氯吡格雷表现为无效或低反应,即氯吡格雷抵抗。但结合CYP2C19基因型分布数据来看,超过50%以上的患者带有CYP2C19突变基因,但仅有20.2%发生氯吡格雷抵抗,表明CYP2C19突变基因不都会引起氯吡格雷抵抗。
进一步分析,将CYP2C19快、中、慢3组基因型和血小板抑制率分布进行关联分析,发现二者并无明显相关性。通过对433例患者6个月的随访,发现CYP2C19基因多态性与心血管缺血事件也无相关性。因此可以推测,CYP2C19基因多态性和氯吡格雷抵抗之间无明显相关性。2011年欧洲Bauer等[6]领导的小组对关于CYP2C19基因多态性与不良心血管事件关联性的15项原创性研究进行了荟萃分析,结论是CYP2C19基因多态性与氯吡格雷的临床效用无实质性关系,与本试验结果相同。
有关CYP2C19基因的前期研究,大多数倾向于CYP2C19基因多态性与氯吡格雷抵抗存在关联性[4-5],但部分研究得出结论却有所不同。分析原因,我们可以看到血小板抑制率的减低与基因变异、药物间相互作用、基础血小板反应等多种因素相关,CYP2C19基因型只是其中一个影响因素。即便在基因层面上,氯吡格雷抵抗与 P2Y12、CYP3A4和CYP2C19等许多基因的多态性都有关系,而CYP2C19的变异只是常见类型,但其他基因的变异也会发生作用[13]。因此,单独使用CYP2C19基因无法预测患者是否会发生氯吡格雷抵抗,必须结合其他检查才能做出正确判断。
