LC-MS/MS检测生物检材中雷公藤甲素和雷公藤酯甲
2015-12-13翟金晓刘伟
翟金晓,刘伟
(1.司法部司法鉴定科学技术研究所上海市法医学重点实验室,上海 200063;2.苏州大学医学部基础医学与生物科学学院,江苏苏州 215123)
LC-MS/MS检测生物检材中雷公藤甲素和雷公藤酯甲
翟金晓1,2,刘伟1
(1.司法部司法鉴定科学技术研究所上海市法医学重点实验室,上海 200063;2.苏州大学医学部基础医学与生物科学学院,江苏苏州 215123)
目的建立生物检材中雷公藤甲素和雷公藤酯甲的液相色谱-串联质谱(LC-MS/MS)分析方法,并进行方法学验证。方法0.4mL血液、尿液或0.4g肝组织加入内标混匀后用乙酸乙酯进行提取,提取物经Allure PFP Propyl柱(100mm×2.1mm,5μm)分离,以甲醇-20mmol/L乙酸铵溶液梯度洗脱,采用电喷雾正离子化(ESI+)、多反应监测检测雷公藤甲素和雷公藤酯甲。结果各生物检材中雷公藤甲素和雷公藤酯甲在相应的线性范围内线性良好(r>0.9950),检出限均为2ng/mL或2ng/g,回收率为61.08%~102.98%,日内精密度和日间精密度均小于12.58%,准确度为90.61%~105.80%。结论所建方法简便、选择性好,适用于同时分析各种生物检材中的雷公藤甲素和雷公藤酯甲,为雷公藤中毒的法医学鉴定和临床诊治提供技术保障。
法医毒理学;色谱法,液相;串联质谱法;雷公藤甲素;雷公藤酯甲;生物检材
雷公藤(Tripterygium wilfordii Hook.f.)为卫矛科(Celastraocse)雷公藤属植物,是我国重要的天然药物资源,主要分布在长江以南[1]。雷公藤也是近半个世纪以来发生中毒事件最多的中草药之一。雷公藤全株均有不同程度的毒性,嫩芽及叶最大,木质部最小[2]。雷公藤甲素,又称雷公藤内酯醇、雷公藤内酯,是从雷公藤中分离的具有松香烷结构的三环氧二萜内酯类化合物,是雷公藤药材及其制剂的主要有效成分之一,也是引起毒副作用的主要成分[3-4]。我国临床上应用的各种雷公藤制剂多数以其作为主要活性成分。生药中也以雷公藤甲素的含量多少来评价药材质量的好坏[5]。雷公藤酯甲属于三萜类成分,具有较强的抗感染及免疫抑制作用,同时具有明显的毒副作用,主要表现在消化系统、生殖系统、心血管系统、骨髓及血液
系统等[6]。雷公藤多苷片的主要成分为雷公藤酯甲,其质量标准中含量测定是以雷公藤酯甲作为对照,采用薄层扫描法进行测定[7]。雷公藤的治疗剂量与中毒剂量非常接近,疗效与剂量呈明显的量效关系[8]。雷公藤嫩叶7个尖(约12 g)即可致死,服其叶2~3片可中毒,根的韧皮部30~60 g可致死,一般中毒后24 h死亡,最多不超过4d[9],因摄入雷公藤中毒及死亡的案(病)例时有报道[10-11]。
对雷公藤及雷公藤制剂的成分、检测及提取方法已有了广泛的研究[12-14]。目前对体外雷公藤甲素或雷公藤酯甲的检测方法应用最为广泛的是高效液相色谱法(high performance liquid chromatography,HPLC)[15-16],对于体内雷公藤甲素的检测方法主要是液相色谱-大气压化学源-质谱法(liquid chromatography-atmospheric pressure chemical ionization-tandem mass spectrometry,LC-APCI-MS)[17-18]和液相色谱-串联质谱法(LC-MS/MS),后者包括LC-APCI-MS/MS[13]和LC-ESI-MS/MS[14,19]。本研究旨在建立液液提取技术和LC-ESI-MS/MS同时检测血液、尿液及肝组织中痕量雷公藤甲素和雷公藤酯甲的分析体系,以简便、快速、准确、可靠地满足雷公藤中毒鉴定的需要,为雷公藤中毒的法医学鉴定、临床诊断及救治提供科学的手段,并对此方法进行方法学验证。
1 材料与方法
1.1 材料
1.1.1 仪器
API 4000 Q trap四极杆-线性离子阱质谱仪(美国AB公司),配AcquityTMUltra Performance LC超高效液相色谱仪(美国Waters公司);XW-80A涡旋混合器(上海医科大学仪器厂);MD200-2氮吹仪(杭州奥盛仪器有限公司);TDZ4-WS离心机(赛特湘仪离心机仪器有限公司);MINSPIN高速离心机(德国Eppendorf公司)。
1.1.2 药品与试剂
对照品雷公藤甲素、雷公藤酯甲(纯度≥98%)购自中国药品生物制品检定所;内标纳洛酮(纯度≥98%)购自中国药品生物制品检定所。
乙腈(HPLC级)、甲醇(HPLC级)均购自美国Sigma-Aldrich公司,乙酸铵(HPLC级)购自Fluka公司,甲酸(优级纯)、乙酸乙酯(分析纯)和乙醚(分析纯)均购自上海国药集团化学试剂有限公司,超纯水由Milli-Q(Millopore纯水系统)制得。
空白全血(经肝素抗凝)、空白尿液均由近期未服用过目标药物的健康志愿者提供,空白肝为市售新鲜猪肝。
1.2 方法
1.2.1 溶液配制
对照品溶液:分别精密称取对照品雷公藤甲素及雷公藤酯甲5mg于5mL容量瓶中,加入甲醇溶解配制成质量浓度均为1mg/mL的对照品储备液,密封储存于-18℃冰箱中,待用。实验中所用的其他浓度的对照品溶液均由上述对照品储备液用甲醇稀释而得。
内标溶液:精密称取对照品纳洛酮10mg于10mL容量瓶中,加入甲醇配制成质量浓度为1 mg/mL的纳洛酮储备液。取纳洛酮储备液适量用甲醇稀释得2μg/mL的内标甲醇工作液。
20 mmol/L乙酸铵溶液:称取乙酸铵1.54 g置于1000mL容量瓶中,加入水溶解定容。
混合溶液:V(甲醇)∶V(20mmol/L乙酸铵溶液)= 33∶67。
1.2.2 样品前处理
取血液或尿液0.4mL,加入2μg/mL纳洛酮内标工作液10 μL,涡旋混合1 min,用3 mL乙酸乙酯提取,涡旋混合3min,以1 650×g离心3 min,将上清液转移至另一试管中,在60℃氮吹仪上吹干,残留物用80μL混合溶液复溶,供LC-MS/MS分析。
将生物组织研碎,称取0.4 g,加入2 μg/mL纳洛酮内标工作液10μL,涡旋混合1min,用3mL乙酸乙酯提取,涡旋混合3 min,1 650×g离心5 min,将上清液转移至另一试管中,在60℃氮吹仪上吹干,残留物用80μL混合溶液复溶,复溶液置于微量离心管中-20℃冷冻过夜,次日以1 650×g离心3 min,取上清液于进样小瓶中,供LC-MS/MS分析。
1.2.3 仪器条件
(1)液相条件。色谱柱:Allure PFP Propyl(100mm× 2.1 mm,5 μm),前接Phenomenex保护柱。流动相:A(甲醇)-B(20 mmol/L乙酸铵缓冲溶液),洗脱程序为0~3min,V(A)∶V(B)=33∶67,流速为0.2mL/min;3~ 7min,V(A)∶V(B)=5∶95,流速为0.3mL/min;7~10min,V(A)∶V(B)=33∶67,流速为0.3mL/min。柱温:室温。进样量:10μL。
(2)质谱条件。电喷雾正离子化(ESI+),多反应监测(MRM)检测。离子源电压(IS):5 500 V。气帘气(CUR):206.8kPa。雾化气(GS1):206.8kPa。辅助气2(GS2):413.7kPa。离子源温度(TEM):500℃。
按上述条件,通过质谱参数优化,分别得到由雷公藤甲素、雷公藤酯甲和内标纳洛酮的母离子与其两个子离子组成的两对母离子/子离子对。各离子对的驻留时间均为150ms。定性分析以各化合物的两对母离子/子离子对进行,并以第一对离子对进行定量分析。定性、定量离子对、去簇电压(DP)、碰撞能量(CE)和保留时间(tR)见表1。

表1 雷公藤甲素和雷公藤酯甲与内标纳洛酮的MS/MS参数
2 结果
2.1 方法的选择性
对10份不同来源的空白血液、空白尿液及空白肝按照“1.2.2样品前处理”进行操作,按“1.2.3仪器条件”进行分析,并与相同空白基质中添加两种目标物及内标的添加样品比较。结果表明,空白样品在目标物及内标出峰时间上无响应,说明空白内源性基质无干扰,方法的选择性良好。空白血液及空白血液中添加目标物的MRM色谱图见图1。
2.2 线性范围、检出限和定量限
分别取空白血液、空白尿液和空白肝各0.4mL(g)若干份,加入内标工作液10 μL,加入雷公藤甲素和雷公藤酯甲对照品溶液适量,配制成质量浓度分别为2、5、10、20、50、80、100、200、400、500ng/mL(g)的雷公藤甲素和雷公藤酯甲血液、尿液和肝的样品,其中将10、100、400 ng/mL(g)作为质控样品,质控样品每一浓度6份,其余样品每一浓度为2份,以前述方法进行样品前处理和测定。分别以雷公藤甲素和雷公藤酯甲的峰面积与内标物的峰面积比(y)对雷公藤甲素和雷公藤酯甲浓度(x,ng/mL或ng/g)作线性回归,得到血液、尿液和肝的线性方程及相关系数,并以信噪比S/N≥3的浓度得到检出限(LOD),S/N≥10的浓度得到定量限(LOQ),结果见表2。

图1 空白血液及添加血液的MRM色谱图
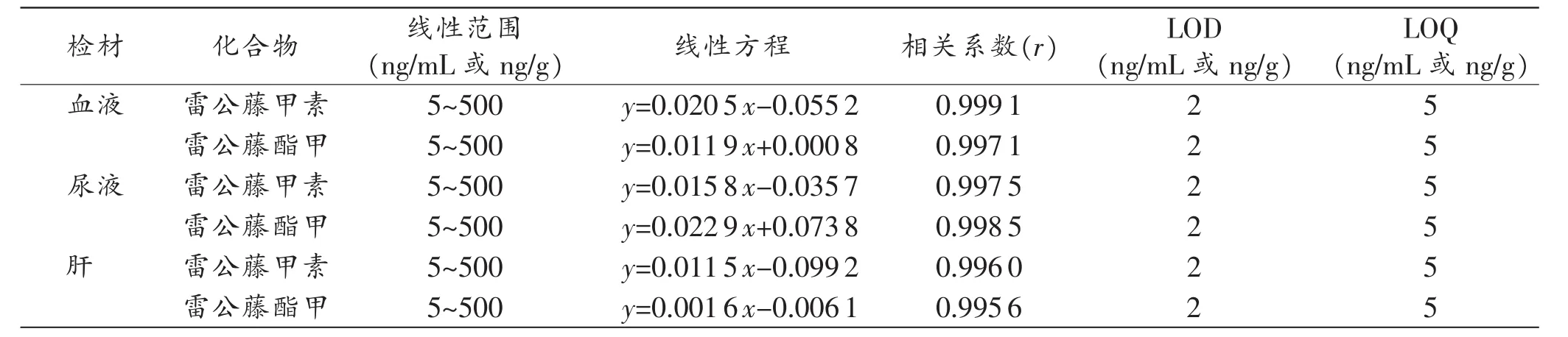
表2 血液、尿液及肝中雷公藤甲素和雷公藤酯甲的线性方程、相关系数、LOD及LOQ
2.3 提取回收率和基质效应
分别取空白血液、空白尿液和空白肝各0.4mL(g)若干份,同上法配制成含雷公藤甲素和雷公藤酯甲低、中、高3个浓度[10、100、400 ng/mL(ng/g)]的质控样品各6份,按照前述方法进行样品前处理后进样分析,所得各目标物的峰面积为A1;相同的空白基质同法处理后,在吹干的残余物中加入一定量浓度的对照品溶液配制成相应质量浓度的溶液,定容,进样分析,所得目标物的峰面积为A2;提取回收率=A1/A2×100%;另取相应浓度的对照品溶液,吹干后用混合溶液定容后进样分析,测得目标物的峰面积为A3,基质效应= A2/A3×100%,结果见表3。
2.4 精密度和准确度
分别取空白血液、空白尿液和空白肝各0.4mL(g)若干份,同上法配制成含雷公藤甲素和雷公藤酯甲低、中、高3个浓度[10、100、400ng/mL(ng/g)]的质控样品各6份,按照前述方法进行样品前处理后进样分析。以当日工作曲线计算各样品中的雷公藤甲素和雷
公藤酯甲的含量,求得6份质控样品的准确度和日内精密度(RSD)。同法连续测定4 d,计算日间精密度(RSD),结果见表3。
由表3中可见,各样品中雷公藤甲素和雷公藤酯甲的日内精密度和日间精密度均在12.58%以内,准确度为90.61%~105.80%,提取回收率为61.08%~102.98%,基质效应为76.67%~105.96%,可以满足生物检材中毒物分析的要求。

表3 各检材中雷公藤甲素和雷公藤酯甲的准确度、精密度、提取回收率和基质效应(%)
2.5 稳定性
取空白血液0.4mL若干份,同上法配制雷公藤甲素和雷公藤内酯甲低、中、高3个质量浓度(10、100、400ng/mL)的质控样品,分别考察4种不同保存条件下[室温下放置24 h、3个反复冻融循环(-20℃到室温)、经样品前处理后的样品提取物室温放置24 h、-20℃条件下冷冻保存1个月]样品的稳定性,每种条件下每个浓度样品各6份。
结果显示,血液样品在室温下放置24h、-20℃反复冻融、处理后的样品提取物室温放置24 h以及在-20℃条件下冷冻保存1个月的4种条件下,样品的相对偏差均小于14.60%,表明血液样品在上述保存条件下的稳定性较为良好。
3 讨论
3.1 样品前处理方法的选择
一般而言,生物样品是不能直接进样分析的,必须经过一定的前处理步骤来去除样品中的脂质、内源性蛋白等杂质成分。样品前处理是生物样品分析中的一个关键步骤,在LC-MS/MS分析中,常用蛋白沉淀、液液提取、固相萃取等方法对生物样品进行分离纯化。由于雷公藤甲素具有极性小、难溶于水、溶于甲醇、乙酸乙酯、氯仿等的化学性质,常用的液液提取法能很好地将其从生物检材中提取出来。本研究比较了乙醚、乙酸乙酯两个常用的提取溶剂,实验结果显示以乙酸乙酯作为提取溶剂时,雷公藤甲素和雷公藤酯甲的提取回收率比用乙醚时略高,故本研究选用了以乙酸乙酯为提取溶剂的液液提取前处理方法。结果表明,以此样品前处理技术可以得到较高的灵敏度和提取回收率,且操作简单方便,选择性强,重现性好。
另一方面,样品的复溶溶液会对目标物在色谱柱中的色谱行为和离子化效率产生影响,为了得到良好的检测结果,本研究分别选用甲醇、乙腈、流动相溶液(混合溶液)作为样品的复溶溶剂,考察进样后的出峰情况。结果表明,使用混合溶液作为进样前的复溶溶剂时,目标物的色谱峰峰形对称,分离度较佳,且两种物质的色谱峰丰度相对较高。因此本研究选用混合溶液作为样品的复溶溶液。
3.2 仪器条件的选择
3.2.1 色谱柱的选择
本研究考察了几种不同填料的色谱柱对雷公藤甲素和雷公藤酯甲分离效率的影响,发现Allure Aqueous C18柱(50mm×2.1mm,5μm)及其他规格的C18柱对雷公藤甲素和雷公藤酯甲的分离情况不理想,两种目标
物的色谱峰保留时间很接近,不能使其有效分离,且峰形不理想,这种情况对定量结果会产生影响,而Allure PFP Propyl柱(100 mm×2.1 mm,5 μm)可使雷公藤甲素和雷公藤酯甲完全分离,且峰形较窄,没有明显的拖尾现象,无生物基质的干扰,灵敏度也相对较高,故本研究选择Allure PFP Propyl(100mm×2.1mm,5μm)色谱柱对待测物进行分析。
3.2.2 流动相的选择
为达到最佳的离子化效率,获得最佳的灵敏度,本研究对流动相进行了优化。一般认为,在流动相中加入缓冲盐如甲酸铵、乙酸铵等,或加入酸性物质如甲酸、乙酸等,可以提高离子化效率,提高灵敏度和改善分离效果。本研究考察了乙腈-20mmol/L乙酸铵缓冲溶液(含0.1%甲酸)、乙腈-20 mmol/L乙酸铵缓冲溶液、甲醇-20mmol/L乙酸铵缓冲溶液三种流动相体系作为流动相,发现流动相中存在甲酸时目标物峰形欠佳,而选用甲醇-20mmol/L乙酸铵缓冲溶液作为流动相时,其分离情况相对较好,且峰型较窄,丰度较高,说明在中性条件下,更利于被测组分离子化和被测组分色谱峰的分离。而由于雷公藤甲素较难电离,且雷公藤甲素和雷公藤酯甲极性差异较大,选用梯度洗脱更能使两者都得到较好的分离。
3.2.3 质谱母离子、子离子的选择
分别将雷公藤甲素和雷公藤酯甲的对照品储备液用甲醇配制成200ng/mL的对照品溶液,采用电喷雾正离子化(ESI+)模式,通过直接进样法,优化质谱条件,从而确定各分析物的母离子质量数,通过全扫描方式得到各分析物的二级质谱图。结果在离子源(ESI+)电离模式下,采用全扫描方式可得到雷公藤甲素和雷公藤酯甲的[M+18]+准分子离子峰,依次为m/z 378.4、m/z 472.5,以此作为其母离子。在确定母离子的基础上选择两个丰度较高的子离子与母离子组成两个母离子/子离子对,并优化去簇电压(DP),再采用Product Ion方式对子离子碰撞能量(CE)进行优化,使得母离子的强度占最大子离子强度的1/3~1/2时获得的二级质谱图为最佳,选择能产生最高丰度子离子的碰撞能量作为该子离子的最佳碰撞能量。最终选定两对母离子/子离子对进行定性分析(雷公藤甲素:378.4→361.2,378.4→145.2;雷公藤酯甲472.5→437.2,472.5→191.4),选其中一对离子对(雷公藤甲素:378.4→361.2;雷公藤酯甲472.5→437.2)进行定量分析。
3.3 内标的选择
分析方法中为得到良好的定量结果,一般选择内标法定量,由于内标法定量通过测定内标物及被测组分的峰面积相对值来进行计算,因而在一定程度上消除了实验操作过程所引起的误差。同位素氘代内标无疑是质谱定量分析的最佳选择,由于本研究中没有商品化的雷公藤甲素和雷公藤酯甲的氘代物质,故选用了纳洛酮作为内标。选择纳洛酮作为内标的原因在于:(1)样品中不含有此内标物质;(2)纳洛酮色谱峰的保留时间在两个待测组分之间,三种物质分离良好,峰形均佳;(3)纳洛酮性质稳定,在提取溶液中充分溶解且与目标物无化学反应。选择添加恰当质量浓度的内标物(50 ng/mL),使其峰面积与待测组分相近。结果表明,选择纳洛酮作为内标物对雷公藤甲素和雷公藤酯甲进行定量,获得了良好的分析结果。
3.4 结论
本研究建立了一种经液液提取后、运用LC-MS/MS检测多种生物检材中雷公藤甲素和雷公藤酯甲的方法,该方法操作简便、灵敏度高、特异性强,适用于同时分析生物检材中雷公藤甲素和雷公藤酯甲,可为雷公藤中毒的法医学鉴定和临床诊治提供技术保障。
[1]杨小红,张伟程.雷公藤制剂的应用及其副作用[J].中医药临床杂志,2004,16(5):511-512.
[2]童静,马瑶,吴建元,等.雷公藤长期毒性作用及其时间节律性研究[J].中药材,2004,27(12):933-935.
[3]刘良,王战勇,黄光照,等.雷公藤甲素亚慢性中毒对昆明种小鼠肾脏及睾丸的影响[J].同济医科大学学报,2001,30(3):214-217.
[4]王君明,贾玉梅,崔瑛.基于以雷公藤甲素为主要抗癌活性成分的雷公藤毒性研究进展及对策[J].时珍国医国药,2012,23(3):558-559.
[5]李波.雷公藤的临床应用及毒性作用[C]//第五届全国雷公藤学术会议论文汇编,2008:475-481.
[6]谢谊,王实强,刘可柔.反相高效液相色谱法测定雷公藤多甙片中雷公藤酯甲的含量研究[J].湖南中医杂志,2007,23(1):79-80.
[7]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准:中药成方制剂(第六册)[S].1998:275.
[8]马伟光,张滔,张超,等.有毒药物雷公藤的研究及展望[J].中华中医药杂志,2006,21(2):117-120.
[9]赵铖,陈战瑞,周明彤.雷公藤治疗原发性肾病综合征的肝脏毒副作用观察[J].临床荟萃,1998,13(24):1131-1132.
[10]何松岳.急性雷公藤中毒8例报告[J].浙江预防医学,2000,12(1):57-58.
[11]陈林囡,蔡辉,于德勇.雷公藤中毒10例临床分析[J].江苏医药,1987,(12):667-668.
[12]陈玉,杨光忠,李援朝.雷公藤化学成分的研究[J].天然产物研究与开发,2005,17(3):301-302.
[13]Chen KB,Cai MQ,Chen XH,et al.Quantitative analysis of triptolide in human whole blood by LCAPCI-IT-MS-MS[J].Chromatographia,2008,67(3-4):225-230.[14]Zhuang XM,Liu PX,Zhang YJ,et al.Simultaneous determination of triptolide and its prodrug MC002 in dog blood by LC-MS/MS and its application in pharmacokinetic studies[J].J Ethnopharmacol,2013,150(1):131-137.
[15]刘建群,刘一文,舒积成,等.HPLC法测定江西雷公藤各部位雷公藤甲素的含量[J].江西中医药,2012,43(6):52-54.
[16]刘法千,鲍立曾,熊仕强.HPLC法测定雷公藤多苷中雷公藤内酯甲的含量[J].中国药品标准,2007,8(4):38-40.
[17]Shao F,Wang G,Sun J,et al.Liquid chromatographic/mass spectrometry assay of triptolide in dog plasma and its application to pharmacokinetic study[J]. J Pharm Biomed Anal,2006,41(2):341-346.
[18]Ouyang XK,Jin MC,He CH.Simultaneous determination of triptolide and tripdiolide in extract of Ttripterygium wilfordii Hook.F.by LC-APCI-MS[J]. Chromatographia,2007,65(5-6):373-375.
[19]刘萍霞,庄笑梅,王晓霞,等.LC-MS/MS法测定大鼠全血中前药MC002活性代谢产物雷公藤内酯醇浓度[J].解放军药学学报,2009,25(1):43-45,67.
(本文编辑:于笑天)
Determination of Triptolide and Wilforlide A in Biological Samples by LC-MS/MS
ZHAI Jin-xiao1,2,LIU Wei1
(1.Shanghai Key Laboratory of Forensic Medicine,Institute of Forensic Science,Ministry of Justice,P.R.China,Shanghai 200063,China;2.School of Biology and Basic Medical Sciences,Department of Medicine, Soochow University,Suzhou 215123,China)
Objective To determinate triptolide and wilforlide A in biological samples by liquid chromatography-tandem mass spectrometry(LC-MS/MS)method and to verify the method.Methods After 0.4mL blood,urine or 0.4 g hepatic tissues with internal standard were extracted by ethyl acetate,they were separated on a Allure PFP Propyl(100mm×2.1mm,5μm)with a mobile phase of methanol-20mmol/L ammonium acetate using gradient elution.For mass spectrometric detection,electrospray ionization(ESI+)in positive mode was elected and the data was collected using multiple-reaction monitoring(MRM). Results The linearity was good(r>0.9950)and the limit of detection was 2ng/mL or 2ng/g for triptolide and wilforlide A.The recovery was 61.08%-102.98%.The intra-day and inter-day precision was less than 12.58%for each biological sample,and the accuracy was 90.61%-105.80%.Conclusion This method is simple,convenient and good selective,and could be applied to analysis of triptolide and wilforlide A in different biological samples.And the method may provide technical support for forensic medicine identification,clinical diagnosis and treatment of tripterygium wilfordiiHook.f.poisoning.
forensic toxicology;chromatography,liquid;tandem mass spectrometry;triptolide;wilforlide A;biological samples
DF795.1
A
10.3969/j.issn.1004-5619.2015.06.008
1004-5619(2015)06-0445-05
上海市科委科研项目(072512019);上海市法医学重点实验室资助项目(14DZ2270800)
翟金晓(1989—),女,硕士,主要从事法医毒物学研究;E-mail:zhaijinxiao@126.com
刘伟,女,主任法医师,硕士研究生导师,主要从事法医毒物学研究;E-mail:liuw@ssfjd.cn
