含钆对比剂与肾源性系统性纤维化关联度变化趋势的Meta分析及因果解析
2015-12-13张斌梁龙陈文波李新云郑君惠梁长虹张水兴
张斌,梁龙,陈文波,李新云,郑君惠,梁长虹,张水兴*
1.南方医科大学研究生学院,广州510515
2.广东省人民医院/广东省医学科学院放射科,广州 510080
肾源性系统性纤维化(nephrogenic systemic fibrosis, NSF)是一种罕见的、但可致命的全身疾病,以广泛组织纤维化为特征,发展到最后常引起关节固定和挛缩。最初发现时表现为皮肤的增厚变硬,当时命名为肾源性纤维化皮肤病(nephrogenic fibrosing dermopathy, NFD)[1-2]。该病几乎均发生在肾功能不全患者中,特别是肾小球滤过率(glomerular filtration rate, GFR)<30 ml/(min·1.73 m2) 的严重肾功能损害的患者[3-4]。目前,NSF 的确切病因及发病机制尚未可知[5]。早期已有一些报道称NSF的发生与含钆磁共振对比剂的使用有关[6-15]。然而,近几年来NSF的发生率明显下降,相关研究报道因而未能得出含钆对比剂与NSF之间存在必然关系的结论[16-19]。所以,为了探讨含钆对比剂暴露与肾源性系统性纤维化风险之间是否存在因果关联,以及随时间变化的趋势,笔者运用Meta分析的方法对以往符合纳入排除标准的临床对照试验进行定量综合评估,以期一定程度上弥补单个研究的不足,提高关联分析的统计效力,并联合运用希尔标准进行评价。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)肾功能不全患者,年龄≥18岁,国籍、种族、性别不限,无钆对比剂过敏史;(2)钆暴露组和非暴露组患者在研究期间内均接受过MRI检查,暴露组使用过钆类对比剂,非暴露组则没有;(3)优先考虑随机对照研究(randomized controlled trial, RCT)如若不满足,则考虑队列研究(cohort study)或病例对照研究(casecontrol study);(4)结局指标为NSF或NFD,其诊断至少应包含皮肤组织的病理活检,且至少由2位医师独立诊断;(5)随访时间应至少大于3个月。排除标准:重复文献,低质量研究,不能有效提取数据的文献。
1.2 检索与策略
检索数据库PubMed、Wiley Online Library、Cochrane Library,检索年限为建库起至2014年12月18日。以gadolinium-based contrast agents、Gd、gadolinium、contrast media、contrast agent、nephrogenic systemic fi brosis、nephrogenic fi brosing dermopathy、fibrosi*、GBCAs、NSF、NFD为主题词(MeSH)及自由词进行英文检索。另外结合手工检索及文献回溯法尽可能寻找更多文献。
1.3 文献筛选和质量评价
2位评价者独立阅读检索所得文献标题以及摘要,在排除明显不符合纳入标准的文献后仔细阅读可能被纳入文献的全文,然后交叉核对筛选,对有争议的文献通过讨论的方式解决,并由第3位文献评价者裁决。对最终纳入的文献进行数据资料的提取,包括一般资料、基线资料、质量资料、结局资料等。使用纽卡斯尔-渥太华队列研究及病例对照研究质量评价量表(newcastle-ottawa scale for cohort studies or case-control study)进行质量评价[20]。满分9颗星。
1.4 统计分析
采用R软件加载Meta及Metafor安装包进行统计学分析。以比值比(odds ratio, OR)为合并统计量,各统计量均以95%可信区间(confidence interval, CI)表示。利用Q检验(P<0.10视为有异质性)和I2统计量(25%、50%、75% 分别代表轻、中、重度异质性)确定研究间的异质性。如若无异质性,采用固定效应模型(fixed effects model)进行合并分析,否则采用随机效应模型(random effects model),并分析异质性来源,并对异质性进行处理。
1.5 发表偏倚
绘制漏斗图,结合Peters 检验[21]。根据考克兰手册,当纳入研究数少于10,发表偏倚检验效能低下,此时只绘制漏斗图,不做相关检验。
1.6 累积Meta分析
按照年代顺序依次将研究纳入分析,观察OR值及95%CI随时间的动态变化。
1.7 敏感性分析
计算失安全系数(fail-safe number, FSN)及进行影响性分析(influence analysis),以验证结果是否稳健。
1.8 亚组分析
评价不同条件下肾源性系统性纤维化的发生率,例如地域或种族、研究类型、年龄、性别、研究样本量等。
1.9 评价是否为因果关系
采用希尔标准(Hill’s criteria)进行评价。共包含9个条目,分别为证据的相关强度(strength of association)、一致性(consistency)、特异性(specificity)、时间性(temporality)、量-效关系(dose-response relationship)、生物学可信性(biological plausibility)、连贯性(coherence)、实验(experiment)、类比(analogy)。针对每个条目收集相关证据,并评价是否达到标准[22]。
2 结果
2.1 文献检索及筛选结果
共检索到文献1678篇,排除重复文献115篇,阅读标题和摘要后排除1506篇,获取全文后排除43篇,最终纳入14篇文献,其中3篇由于NSF发生例数为0而未能纳入最后的定量分析。
2.2 纳入研究的一般资料
共纳入9篇回顾性队列研究,3篇前瞻性队列研究,2篇病例对照研究。所有研究均来源于欧美国家,研究的时间跨度为3个月到12年不等。所有研究对象均有不同程度的肾功能不全。3项研究使用的钆对比剂为Gadodiamide (Omniscan),2项研究分别使用G d-DOTA和Gadopentetate (Magnevist),其余研究均使用多种钆对比剂。NSF诊断主要有实验室检查和皮肤组织活检,并结合病史(表1)。
2.3 文献质量评价
NOS量表得分的中位数为6颗星(范围,5~8颗星)。只有两项研究控制了性别、年龄等混杂因素,但NSF的诊断可靠,文献总体质量与同类研究相比较高。
2.4 Meta 分析结果
2.4.1 钆对比剂与肾源性系统性纤维化的关联
Meta分析结果显示钆对比剂暴露会增加肾源性系统性纤维化的风险(OR=16.50,95%CI:7.46~36.53,P<0.01)。各研究间不存在显著异质性(P=0.819,I2=0%)(图 1)。累积Meta分析结果显示,与文献发表时间截止至2007年的OR值为26.71(95%CI:0.27~69.44)相比,2007年之后的OR值呈下降趋势,且95%CI逐渐缩窄,即估计总体风险的精确性逐渐提高(图2)。普通漏斗图基本对称,Peters检验显示无发表偏倚(P=0.932)(图3)。敏感性分析显示无任何单个研究对合并效应产生显著影响(图4)。Rosenberg法计算的失安全系数为115,即结论从具有显著统计学意义(P<0.01)变为统计学意义(P=0.05)时,需要纳入115项未发表的阴性结果的研究。故敏感性分析的结果表明Meta分析的结果较稳健。
表 1 纳入研究的一般资料Tab.1 The baseline characteristics of included studies
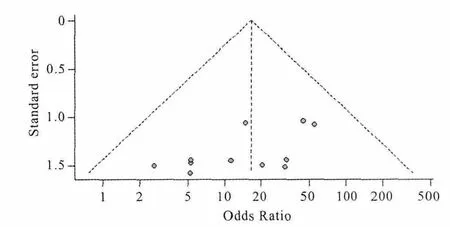
图3 发表偏倚的漏斗图Fig.3 Funnel plot for publication bias of GBCAs and NSF.
2.4.2 钆双胺与肾源性系统性纤维化的关联
共有3项研究仅使用钆双胺作为钆对比剂。Meta分析结果显示,钆双胺暴露可能会增加肾源性系统性纤维化发生的风险(OR=20.04,95%CI:3.72~107.78,P<0.01)。各研究之间不存在异质性(P=0.873,I2=0%)(图 5)。普通漏斗图显示基本对称(图 6)。
2.4.3 亚组分析结果
无法根据年龄、性别以及研究类型进行亚组分析,原因如下:(1)纳入文献未提供年龄、性别方面可供分析的数据;(2)除3篇无法定量分析的文献外,其余为10篇回顾性研究,仅1篇前瞻性研究。依据地域和样本量分层的结果显示,肾源性系统性纤维化与地域的关系不甚密切,与纳入研究的样本量可能有关(表2)。
2.5 钆对比剂与肾源性系统性纤维化因果关联的评估
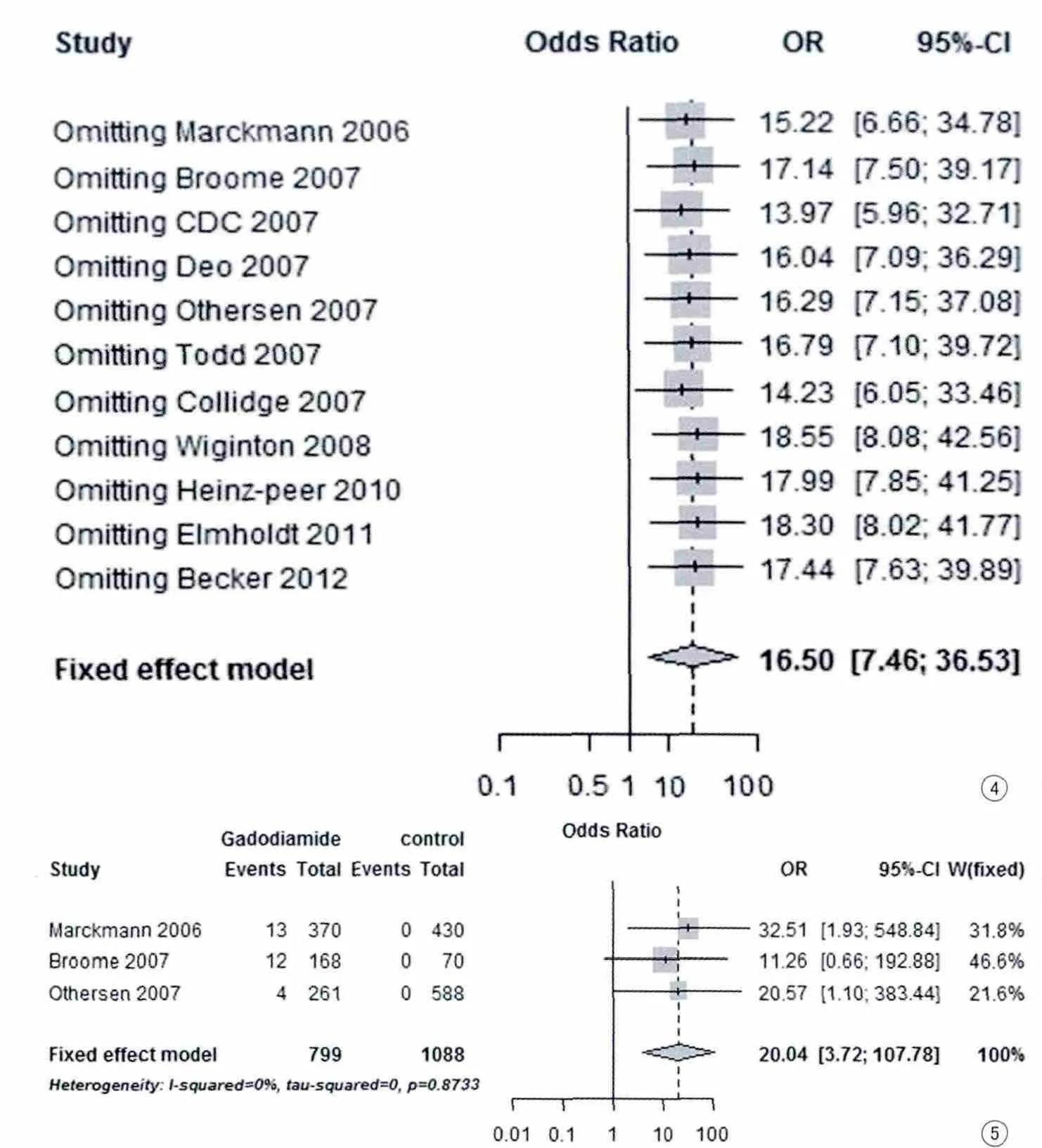
图4 影响性的分析森林图(一次删除一项研究,观察该单个研究对总体效应的影响) 图5 钆双胺与肾源性系统性纤维化关联性的森林图Fig.4 Inf l uence analysis plot(To assess the inf l uence of a single study on pooled estimate, we omitted one study at a time). Fig.5 Forest plot of association between Gadodiamide exposure and the development of NSF.
图6 发表偏倚的漏斗图Fig.6 Funnel plot for publication bias of Gadodiamide and NSF.
采用希尔标准,列举相关证据,对钆对比剂与肾源性系统性纤维化之间的相关性是否为因果相关进行评估。(1)相关强度(strength of association):10项研究[6-15]表明GBCAs暴露与NSF的发生具有显著关联性。本Meta分析结果显示钆对比剂暴露人群患NSF的风险是非暴露人群的16.50倍。其中3项仅使用钆双胺的研究表明钆双胺暴露人群患NSF的风险是非暴露人群的20.04倍。(2)一致性(consistency):尽管此类研究是在不同的国家(美国、丹麦、日本、英国等),结论却是相似的。本Meta分析中除4项研究外[16-19],其他研究的结论是一致的。(3)特异性(specificity):3项研究[9,12-13]表明钆双胺与NSF的关联。其他类型钆对比剂与NSF的关联尚无研究数据支持。(4)时间性(temporality):NSF患者在症状出现前接受过使用含钆对比剂的磁共振检查。(5)量-效关系(doseresponse relationship):4项研究[6,10,12,15]表明二者之间存在量-效关系(表3)。(6)生物学可信性(biological plausibility):具有非离子线性结构的钆对比剂不稳定,易分解和释放钆离子,如钆双胺,并且钆的清除几乎只经过肾脏。(7)连贯性(coherence):钆离子可在NSF或NFD病人皮肤组织中探测到,并且可以测出相对含量。(8)实验(experiment):NSF病人症状消失后再次暴露于钆对比剂,又出现NSF的症状。(9)类比(analogy):暂无相关证据。
根据以上较强证据,可以认为钆对比剂暴露与肾源性系统性纤维化之间的关联为因果关系。
3 讨论
肾源性系统性纤维化是进展性致死性的疾病,尚无证据证明与性别有关,男女比例基本相当,发病年龄8~87岁(平均46.4岁),无明显种族或地域差异。目前该病的治疗并无特殊,如肾透析、肾移植、血浆置换、激素治疗、以控制和延缓关节病变为主要目的的物理疗法等,但是没有持续有效的治疗方案。因此,如何预防NSF显得尤为重要。尽管目前还没有较好的预防措施,但是认识NSF的风险因素将有利于预防工作。本Meta分析结果表明含钆磁共振对比剂与NSF之间存在强关联,且这种关联为因果关系。在所有钆对比剂中,钆双胺是惟一确定可能与NSF发生有关的对比剂,尽管有单个研究 使用钆特酸葡胺和钆喷酸葡胺,但因其偏倚的局限性或NSF的发生例数为0,尚无明确证据。
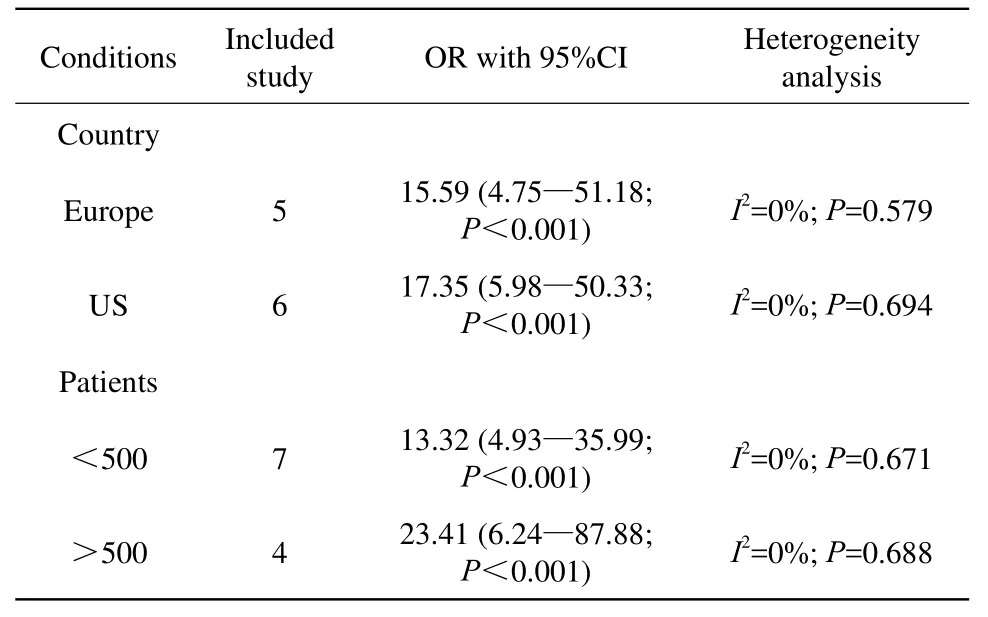
表 2 不同条件下肾源性系统性纤维化发生率的亚组分析Tab.2 Subgroup analyses on the incidence of NSF in various conditions
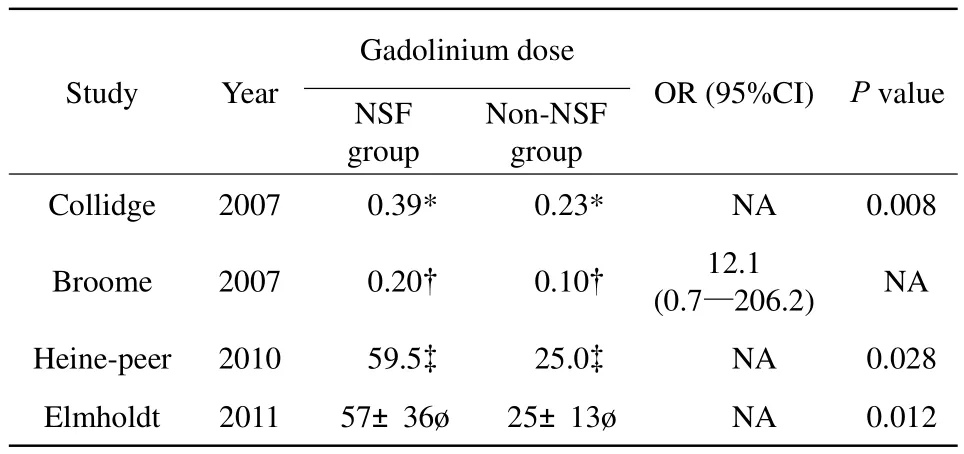
表 3 肾源性系统性纤维化与钆对比剂之间的量-效关系Tab.3 Dose-response relationship between gadolinium and NSF
1997-2007年期间,已经有超过500例NSF的相关报道[23]。2006年美国食品和药品监督管理局(US food and drug administration, FDA)发布公共卫生咨文(public health advisory, PHA),让公众警惕NSF的发生。次年要求所有含钆对比剂及药品的标签必须说明可能导致NSF风险的几种情况:(1)急性或慢性重度肾功能不全,即肾小球滤过率小于30 ml/(min·1.73 m2);(2)因肝肾综合征所导致的或肝移植围手术期内出现的严重急性肾功能不全。欧洲药品管理局(European medicines agency,EMA)也采取了类似措施,在钆对比剂标签中给予说明。此外,美国放射学会(American college of radiology, ACR)及欧洲泌尿生殖系统放射学会(European society of urogenital radiology, ESUR)编写指南,指导医护人员处理NSF的风险[24-25]。2007年之前,NSF的发病率一直上升,之后随着对钆对比剂可造成NSF危害的认识加深,NSF的发生率开始下降[26-27]。本研究按照文献发表年限的累积Meta分析与该变化基本吻合,结果显示,与2007年之前相比,2007年之后钆对比剂暴露致NSF的风险较明显下降。然而,鉴于文献发表时间滞后于研究时间,个别研究的时间终点是在2007年之前,加之纳入文献数量有限,因此,累积Meta分析所显示的风险减低趋势并不能完全反映上述咨文、指南等引起的改变。此问题有待今后进一步研究。
根据有关研究报道,钆对比剂与NSF之间的关联性还受到诸多因素(包括协同因素),其中包括钆对比剂的剂量以及类型。本研究纳入的4项研究表明了钆对比剂与NSF之间的剂量依赖关系。Broome等[12]发现使用两倍剂量(0.2 mmol/kg)的钆对比剂患NSF的风险是单倍剂量(0.1 mmol/kg)的12.1倍。其他研究也证实了在一定范围内,钆对比剂使用剂量越高,患NSF的风险也越高[6,10,15]。目前,获美国食品和药品监督管理局批准的钆对比剂有6种,其中线性结构的5种,大环类结构的1种[28-29]。此外,还区分离子型和非离子型。不少研究提出假说,与大环类分子相比,线性分子与钆的结合不紧密,不稳定;与离子型螯合物相比,非离子型更易释放出钆离子,因此,非离子型线性钆对比剂,在肾功能不全患者体内滞留时间延长,生物半衰期延长,可能更容易导致NSF的发生[30]。本研究表明患者暴露于非离子线性化学结构的钆双胺后罹患NSF的风险是非暴露者的20.04倍。但仅纳入3项早期研究,且均为高危患者,尚不能确定其风险。其他影响因素还包括患者肾功能不全的严重程度,本研究中几乎所有的NSF发生在慢性肾病4~5期的患者中。肾小球滤过率GFR>30 ml/(min·1.73 m2)的患者几乎不发生NSF,故美国放射学会对此类病人并无特别建议[31]。此外患者是否透析以及透析方式也是相关影响因素之一。一项丹麦的病例对照研究发现在所有NSF患者中,41%的患者接受血液透析,24%的患者接受腹膜透析,35%的患者不需要透析[15]。目前对于血液透析和腹膜透析是否会导致NSF发生率的差别,尚无更多研究,但有研究称不需要透析的患者发生NSF的风险较低[32]。导致NSF的其他因素还包括慢性炎症、动脉粥样硬化、高凝状态、血栓形成、近期血管手术、近期移植失败或突发肾脏疾病伴四肢重度水肿等[33-34]。确切机制尚不可知。
因此,为了减少NSF的发生,在肾小球滤过率小于30 ml/(min·1.73 m2)的患者及需要透析的患者行MRI增强检查前,要权衡利弊,利大于弊的情况下才可能考虑,并积极预防NSF的发生。且钆对比剂尽可能在满足诊断要求的情况下使用最低剂量,如有关研究推荐的1/4剂量(0.025 mmol/kg)[35],此外尽量减少钆对比剂暴露次数,减少其在患者体内的累积剂量,寻求替代对比剂或技术,如锰对比剂或无对比剂增强的磁共振血管成像技术[36-37]。其他如控制炎症,改善患者全身状况等。
本研究的主要局限性有:(1)未能纳入随机对照研究,证据等级相对降低;(2)研究来源于欧美国家,相关结论是否适应其他国家地区,尚待今后验证;(3)研究对象主要为3~5期慢性肾病患者,无法说明急性肾衰及其他分期患者钆对比剂使用后患NSF的风险;(4)除钆双胺外,其他类型的钆对比剂与NSF的风险尚不可知;(5)2007年之后的文献样本量偏小,根据亚组分析结果,可能会造成一定偏倚;(6)考虑到国内NSF的临床研究几乎没有或缺乏可靠的诊断依据,仅纳入英文文献,可能存在一定语言偏倚。
4 结论
在肾功能不全患者中,钆对比剂使用与肾源性系统性纤维化之间存在强关联性,且为因果关联,但是此关联强度在2007年之后较明显下降。在实际工作中,特别针对肾小球滤过率小于30 ml/(min·1.73 m2)的患者,降低钆对比剂的使用剂量,规范钆对比剂的使用,参照相关指南操作,有助于降低NSF的发生率。今后,单类钆对比剂与NSF的关联有待进一步研究。
[References]
[1]Heverhagen JT, Krombach GA, Gizewski E.Application of extracellular gadolinium-based MRI contrast agents and the risk of nephrogenic systemic fi brosis.Rofo, 2014, 186(7): 661-669.
[2]Elmholdt TR, Olesen AB, Jorgensen B, et al.Nephrogenic systemic fibrosis in Denmark--a nationwide investigation.PLoS One, 2013,8(12): e82037.
[3]Gupta A, Shamseddin MK, Khaira A.Pathomechanisms of nephrogenic systemic fi brosis: new insights.Clin Exp Dermatol, 2011,36(7): 763-768.
[4]Kitajima K, Maeda T, Watanabe S, et al.Recent topics related to nephrogenic systemic fibrosis associated with gadolinium-based contrast agents.Int J Urol, 2012, 19(9): 806-811.
[5]Swaminathan S, Bose C, Shah S V, et al.Gadolinium contrast agentinduced CD163+ ferroportin+ osteogenic cells in nephrogenic systemic fi brosis.Am J Pathol, 2013, 183(3): 796-807.
[6]Heinz-Peer G, Neruda A, Watschinger B, et al.Prevalence of NSF following intravenous gadolinium-contrast media administration in dialysis patients with endstage renal disease.Eur J Radiol, 2010, 76(1):129-134.
[7]Wiginton CD, Kelly B, Oto A, et al.Gadolinium-based contrast exposure, nephrogenic systemic fi brosis, and gadolinium detection in tissue.AJR Am J Roentgenol, 2008, 190(4): 1060-1068.
[8]Todd DJ, Kagan A, Chibnik LB, et al.Cutaneous changes of nephrogenic systemic fibrosis: predictor of early mortality and association with gadolinium exposure. Arthritis Rheum, 2007, 56(10):3433-3441.
[9]Othersen JB, Maize JC, Woolson RF, et al.Nephrogenic systemic fibrosis after exposure to gadolinium in patients with renal failure.Nephrol Dial Transplant, 2007, 22(11): 3179-3185.
[10]Collidge TA, Thomson PC, Mark PB, et al.Gadolinium-enhanced MR imaging and nephrogenic systemic fibrosis: retrospective study of a renal replacement therapy cohort.Radiology, 2007, 245(1): 168-175.
[11]Deo A, Fogel M, Cowper SE.Nephrogenic systemic fibrosis: a population study examining the relationship of disease development to gadolinium exposure.Clin J Am Soc Nephrol, 2007, 2(2): 264-267.
[12]Broome DR, Girguis MS, Baron PW, et al.Gadodiamide-associated nephrogenic systemic fi brosis: why radiologists should be concerned.AJR Am J Roentgenol, 2007, 188(2): 586-592.
[13]Marckmann P, Skov L, Rossen K, et al.Nephrogenic systemic fi brosis:suspected causative role of gadodiamide used for contrast-enhanced magnetic resonance imaging.J Am Soc Nephrol, 2006, 17(9): 2359-2362.
[14]Centers for Disease Control and Prevention(CDC).Nephrogenic fibrosing dermopathy associated with exposure to gadoliniumcontaining contrast agents-St.Louis,Missouri,2002-2006.MMWR Morb Mortal Wkly Rep, 2007, 56(7): 137-141.
[15]Elmholdt TR, Pedersen M, Jorgensen B, et al.Nephrogenic systemic fi brosis is found only among gadolinium-exposed patients with renal insufficiency:a case-control study from Denmark.Br J Dermatol, 2011,165(4): 828-836.
[16]Amet S, Launay-Vacher V, Clement O, et al.Incidence of nephrogenic systemic fibrosis in patients undergoing dialysis after contrastenhanced magnetic resonance imaging with gadolinium-based contrast agents:the Prospective Fibrose Nephrogenique Systemique study.Invest Radiol, 2014, 49(2): 109-115.
[17]Becker S, Walter S, Witzke O, et al.Application of gadolinium-based contrast agents and prevalence of nephrogenic systemic fi brosis in a cohort of end-stage renal disease patients on hemodialysis.Nephron Clin Pract, 2012, 121(1-2): c91-c94.
[18]Deray G, Rouviere O, Bacigalupo L, et al.Safety of meglumine gadoterate (Gd-DOTA)-enhanced MRI compared to unenhanced MRI in patients with chronic kidney disease (RESCUE study).Eur Radiol,2013, 23(5): 1250-1259.
[19]Janus N, Launay-Vacher V, Karie S, et al.Prevalence of nephrogenic systemic fi brosis in renal insufficiency patients: results of the FINEST study.Eur J Radiol, 2010, 73(2): 357-359.
[20]Wells GA, Shea B, O’Connell D, et al.The Newcastle-Ottawa Scale(NOS) for assessing the quality of nonrandomized studies in metaanalysis.Available: www.ohri.ca/programs/clinical_epidemiology/oxford.asp.Accessed December 18, 2014.
[21]Sterne JA, Sutton AJ, Ioannidis JP, et al.Recommendations for examining and interpreting funnel plot asymmetry in meta-analyses of randomised controlled trials.BMJ, 2011, 343: d4002.
[22]Hill AB.The Environment and Disease: Association or Causation?.Proc R Soc Med, 1965, 58: 295-300.
[23]Kitajima K, Maeda T, Watanabe S, et al.Recent topics related to nephrogenic systemic fibrosis associated with gadolinium-based contrast agents.Int J Urol, 2012, 19(9): 806-811.
[24]Yang L, Krefting I, Gorovets A, et al.Nephrogenic systemic fi brosis and class labeling of gadolinium-based contrast agents by the Food and Drug Administration.Radiology, 2012, 265(1): 248-253.
[25]Thomsen HS, Morcos SK, Almen T, et al.Nephrogenic systemic fi brosis and gadolinium-based contrast media:updated ESUR Contrast Medium Safety Committee guidelines.Eur Radiol, 2013, 23(2):307-318.
[26]Daftari BL, Aran S, Shaqdan K, et al.Current status of nephrogenic systemic fi brosis.Clin Radiol, 2014, 69(7): 661-668.
[27]Kim KH, Fonda JR, Lawler EV, et al.Change in use of gadoliniumenhanced magnetic resonance studies in kidney disease patients after US Food and Drug Administration warnings: a cross-sectional study of Veterans Affairs Health Care System data from 2005-2008.Am J Kidney Dis, 2010, 56(3): 458-467.
[28]Thomsen HS, Marckmann P, Logager VB.Update on nephrogenic systemic fibrosis.Magn Reson Imaging Clin N Am, 2008, 16(4):551-560.
[29]Juluru K, Vogel-Claussen J, Macura KJ, et al.MR imaging in patients at risk for developing nephrogenic systemic fibrosis: protocols,practices, and imaging techniques to maximize patient safety.Radiographics, 2009, 29(1): 9-22.
[30]Cowper SE.Gadolinium - is it to blame?.J Cutan Pathol, 2008, 35(5):520-522.
[31]Kanal E, Barkovich AJ, Bell C, et al.ACR guidance document on MR safe practices: 2013.J Magn Reson Imaging, 2013, 37(3): 501-530.
[32]Chrysochou C, Power A, Shurrab A E, et al.Low risk for nephrogenic systemic fibrosis in nondialysis patients who have chronic kidney disease and are investigated with gadolinium-enhanced magnetic resonance imaging.Clin J Am Soc Nephrol, 2010, 5(3): 484-489.
[33]Grebe SO, Borrmann M, Altenburg A, et al.Chronic inflammation and accelerated atherosclerosis as important cofactors in nephrogenic systemic fi brosis following intravenous gadolinium exposure.Clin Exp Nephrol, 2008, 12(5): 403-406.
[34]Cowper SE.The international center for nephrogenic fibrosing dermopathy research(ICNFDR): official site of the nephrogenic fi brosing dermopathy (NFD/NSF).Registry, 2007: 1-6.
[35]de Campos RO, Heredia V, Ramalho M, et al.Quarter-dose (0.025 mmol/kg) gadobenate dimeglumine for abdominal MRI in patients at risk for nephrogenic systemic fi brosis:preliminary observations.AJR Am J Roentgenol, 2011, 196(3): 545-552.
[36]Zeng QB, Guo QN, Luo Q, et al.Manganese-based contrast agents for MRI.Chin J Magn Reson Imaging, 2014, 5(4): 315-320.曾庆斌, 郭茜旎, 罗晴, 等.锰对比剂在MRI中的应用.磁共振成像,2014, 5(4): 315-320.
[37]An J, Sun ZG, Zhang Q.syngo NATIVE: non-contrast-enhanced MR angiography.Chin J Magn Reson Imaging, 2011, 2(1): 65-68.安靖, 孙治国, 张琼.无对比剂增强的磁共振血管成像技术.磁共振成像, 2011, 2(1): 65-68.
