磁共振灌注加权成像在宫颈癌表现特点的研究
2015-12-13叶裕丰陈秋梅向之明李晶何翠雯郭冬梅李淑明
叶裕丰,陈秋梅,向之明,李晶,何翠雯,郭冬梅,李淑明
1.广州市番禺区中心医院放射科,广州 511400
2.广州市番禺区妇幼保健院超声科,广州 511400
3.广州市番禺区中心医院病理科,广州 511400
宫颈癌是最常见的女性生殖道恶性肿瘤,其发病率在世界范围内居女性肿瘤的第二位,且呈逐年升高和年轻化趋势[1-2],目前确诊主要依靠临床妇科检查及细胞学检查,存在创伤性、主观性和局限性。磁共振灌注成像[3-4](magnetic resonance perfusion weighted imaging,PWI)作为一种主要的功能成像,反映的主要是组织中微观血流动力学信息,可以进行定量分析病灶的微血管及其通透性,为评价器官、组织的血供情况、血流动力学状态提供一种直观、活体和无创、无辐射、快捷的检查手段。本研究旨在探讨磁共振灌注成像在宫颈癌中的应用价值。
1 材料与方法
1.1 研究对象
1.1.1 宫颈癌组
收集2013年1月至2014年6月在某院确诊的32例宫颈癌患者资料,年龄28~69岁,平均年龄(49± 11.9)岁。23例在MRI检查后行子宫全切术并术后病理证实,9例在行MRI检查前活检证实。鳞癌23例,腺癌9例。入选标准:宫颈癌Ib期以上,病灶大约7 mm;已行活检的病例,肿块大小必须大于15 mm,避免活检对MR检查的数据造成影响。所有患者在行MRI检查前未接受任何治疗,均排除了MR检查禁忌证,如装有心脏起搏器、金属异物或幽闭恐惧症等。
1.1.2 正常对照组
30例正常对照组中10例健康志愿者,20例为卵巢囊肿患者,在检查前均已告知相关检查内容,并签署了知情同意书,同时报医院伦理委员会批准,平均年龄(33±7.5)岁,所有受检查者均无MR检查禁忌证,并行常规MRI检查未发现子宫疾病。
1.1.3 肌瘤对照组
30例宫颈肌壁间肌瘤全部经病理证实。入选标准:肿块无明显变性,且大小一般≤50 mm。所有患者平均年龄(41±5.3)岁,均无MR检查禁忌证。
1.2 研究方法
1.2.1 成像设备及对比剂
采用西门子Avanto 1.5 T磁共振扫描仪进行扫描,空间分辨力≤0.5 mm;选用32通道相控阵体线圈,并使用呼吸门控技术;使用Madrad公司生产的MR自动高压注射器;对比剂为拜耳药业公司生产的钆喷替酸葡甲胺注射液(Gd-DTPA)。
1.2.2 扫描序列
所有病例都依次行常规扫描、灌注扫描、增强扫描。其中灌注扫描采用容积内插体部检查序列(volume interpolated body examination, VIBE)横断位扫描,TR/TE:6.56/1.78 ms,翻转角:12度,FOV:260 mm,层厚:4.0 mm,层间隔:0 mm,矩阵:256×128,SLICES PER SLAB=8,以病灶为中心对宫颈进行无间断连续90期扫描,按0.2 mmol/kg体重计算对比剂Gd-DTPA的用量,利用高压注射器以3.5 ml/s静脉团注,注射完后以相同速率注射生理盐水15 ml冲洗管道,静脉团注开始后立即启动VIBE扫描,扫描时间共计180 s。灌注扫描序列结束后立即行常规增强扫描,采用TSE序列T1WI成像,分别行横断位、矢状位、冠状位T1Wl,TR/TE:4.0/1.9 ms,FOV:320 mm,层厚:4 mm,重建厚度:2 mm,Matrix:320×160。
1.2.3 图像处理与分析
影像图像由2名不知道病理结果的资深经验的放射科医生分析。图像的后处理通过syngo工作站, 将动态增强的图像及蒙片放入Imaging V35软件处理。时间-信号强度曲线(time- signal intensity curve, TIC)采用感兴趣区法, 根据TIC计算每个感兴趣区(ROI)的灌注参数值(相对值):最大增强(maximum enhancement, ME)、首过最大灌注斜率(steepest slope, SSmax),达峰时间(time to peak,TTP)。ROI设置:宫颈癌和肌瘤选择在1~90期之间肿块内外信号差别较大的一期,并参考平扫序列和增强序列,确保ROI在肿瘤病灶之内,同时避开血管、囊变和病灶坏死区;正常宫颈选择在肌层。感兴趣区大小约3 mm×3 mm,且3次测量取其平均值。
公式如下:最大增强=峰值强度-初始强度;首过最大灌注斜率=初始强度时间和峰值强度时间之间的最大斜率;达峰时间=峰值强度时间-初始强度时间。
1.3 统计方法
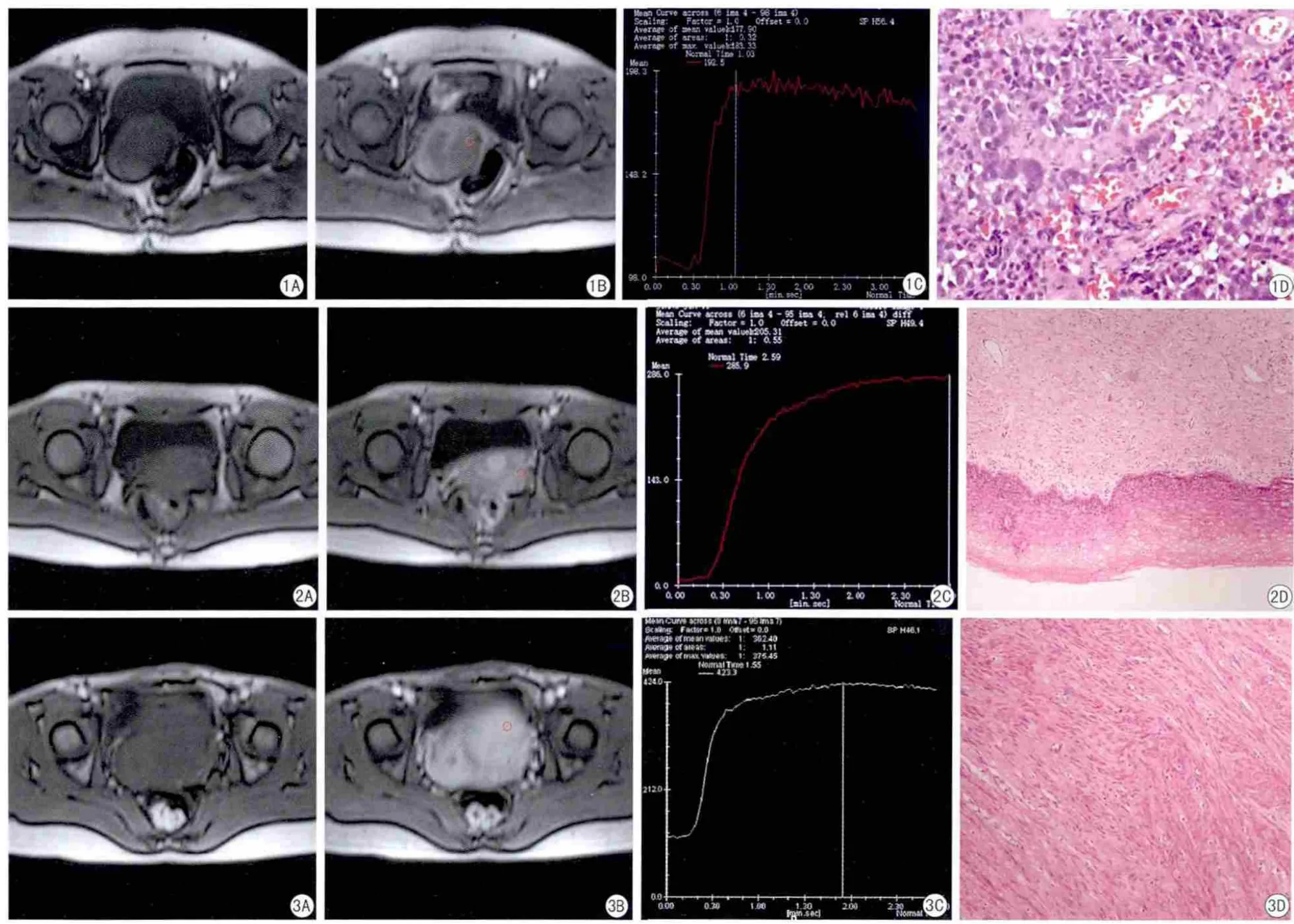
图1 A~D 宫颈癌病例。A:灌注加权成像第1期图像;B:灌注加权成像第90期图像,容积内插体部检查序列的使用,能清晰地显示肿块与周围组织结构的关系,同时观察到肿块的边缘强化较好;C: TIC曲线呈“速升平台”型;D: 病理切片(HE ×100)显示明显异型性的肿瘤细胞 图2A~D 正常宫颈病例。A:T1WI-VIBE第1期图像;B:T1WI-VIBE第90期图像;C: TIC曲线呈“缓慢上升”型。D: 病理切片(HE ×40)显示正常的宫颈粘膜。 图3A~D 宫颈肌壁间肌瘤病例。A:T1WI-VIBE第1期图像;B:T1WI-VIBE第90期图像;C: TIC曲线呈“速升平台”型;D: 病理切片(HE ×40)显示大量平滑肌细胞(ER+-, PR+, ACT+++, PCNA+-, SMA+++, Desmin+, ki67++)Fig.1 A—D The same patient of cervical cancer.A: The first phase of perfusion weighted imaging; B: The 90th phase of perfusion weighted imaging, could clearly show the relationship between the tumor and surrounding tissue structure, at the same time observe the tumor edge enhancement is better, by the volume interpolated body examination; C: TIC showed“rapidly ascending branch followed by a plateau”.D: Pathological slice(HE ×100)demonstrates tumor cells with atypia, and la lot of microvessel. Fig.2 A—D The same patient of normal cervix.A: The fi rst phase of T1WIVIBE; B: The 90th phase of T1WI-VIBE; C: TIC showed "slow ascending".D: Pathological slice (HE ×40) demonstrates normal cervical mucosa.Fig.3 A—D The same patient of cervical intermural leiomyomas.A: The fi rst phase of T1WI-VIBE; B: The 90th phase of T1WI-VIBE; C: TIC showed”rapidly ascending branch followed by a plateau”; D: Pathological slice (HE ×40) demonstrates a large number of smooth muscle cells (ER+-, PR+,ACT+++, PCNA+-, SMA+++, Desmin+, ki67++).
所有统计数据采用SPSS17.0软件包统计分析:宫颈癌组、正常对照组、肌瘤对照组相关参数属于连续变量,采用均数±标准差形式表示;各实验组之间参数彼此独立,故两组参数之间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌与正常宫颈、宫颈肌壁间肌瘤MRI灌注TIC曲线特点
32例宫颈癌有25例TIC曲线呈“速升平台”型(图1C),7例呈“速升缓降”型。30例正常宫颈中有22例TIC曲线呈“缓慢上升”型(图2C),有8例属于“速升平台”,与宫颈癌的“速升平台”型相比,正常宫颈组的TIC曲线上升支比较平缓,较慢到达峰值及平台期,平台期维持时间相对较短且平台末期仍略有上升趋势。30例宫颈肌瘤的TIC曲线有24例TIC曲线呈“速升平台”型(图3 C),6例呈“缓慢上升”型,子宫肌瘤的“速升平台”型的上升支斜率低于宫颈癌“速升平台”型上升支的斜率,高于正常宫颈“速升平台”型上升支的斜率;子宫肌瘤的“缓慢上升”型的上升支斜率高于正常宫颈“缓慢上升”型上升支的斜率。
2.2 根据TIC曲线,计算得出宫颈癌与正常宫颈MRI灌注成像参数(表1)
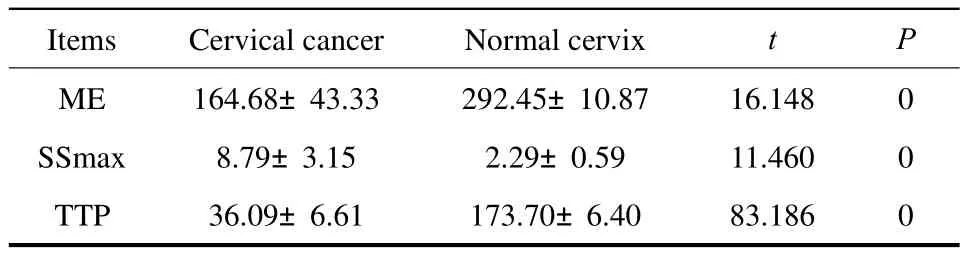
表1 宫颈癌与正常对照组中的ME、SSmax、TTP参数的相关性Tab.1 The relationship between cervical cancerand normal cervix by ME, SSmax, TTP
2.3 根据TIC曲线,计算得出宫颈癌与宫颈肌壁间肌瘤MRI灌注成像参数(表2)
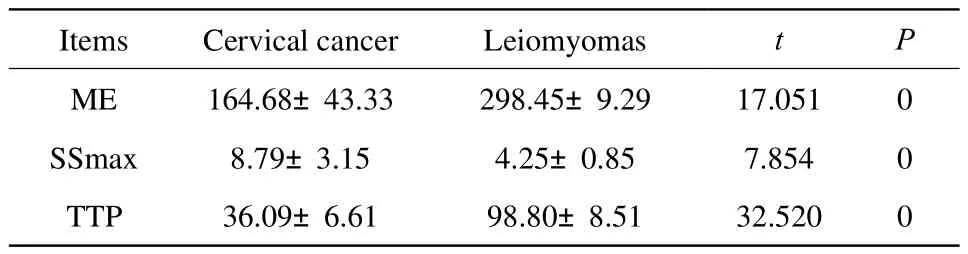
表2 宫颈癌与宫颈肌壁间肌瘤对照组中的ME、SSmax、TTP参数的相关性Tab.2 The relationship between cervical cancer and cervical intermural leiomyomas by ME, SSmax, TTP
3 讨论
新生血管是肿瘤赖以生长的必备条件,恶性肿瘤的血管生成决定其生长、转移和预后,血管生成程度与其侵袭力或恶性度密切相关。研究表明[5-7],微血管生成反映了肿瘤细胞的增殖活性和侵袭、转移的潜能。肿瘤新生血管的增多势必引起血管容积、血流灌注及毛细血管通透性的变化 ,这就为影像学评价肿瘤的新生血管提供了可能。而磁共振灌注成像就是通过观察离子型非特异性细胞外液对比剂在组织中的早期分布特点,来了解组织血管化程度、血流灌注状况、毛细血管通透性等生理信息的功能成像方法,在显示器官形态学变化的同时反映血流动力学,提供有关微血管密度方面的信息[8]。
微血管渗漏优势期主要反映对比剂由微血管内向血管外间质间隙渗漏的过程,通过分析磁共振灌注成像的相关参数可以获得血液动力学方面的信息。本组研究的结果与Lee[9]、王浩初[10]和丁文金等[11]的研究结果有较多相似之处,但仍有不同之处。相似之处:正常宫颈组织由于微血管壁较完整、间质腔隙较小,所以其磁共振灌注成像的TIC曲线主要表现为“缓慢上升”型,首过最大灌注斜率最小,达峰时间最长。而宫颈癌组织的微血管壁不完整、间隙腔隙较大,故其磁共振灌注成像的TIC曲线基本上是由一个低平的基线,再加上一个非常陡峭的上升支,达到峰值后便进入一个相对较长的平台期,这类TIC曲线最大增强强度最小,首过最大灌注斜率最大,达峰时间最短。另一项研究[10-12]的血流动力学分析显示,宫颈癌组织的血管化作用、血管通透性及组织间质间隙均大于正常宫颈组织,与正常宫颈基质不同,肿瘤组织中有更大的空间输送和积存对比剂,肿瘤间质间隙的排空期、血管内和间质内的血流阻滞,可导致对比剂滞留闭,相对正常宫颈组织而言,平台期信号应该更高、时间更长。不同之处:本研究发现宫颈肌壁间肌瘤的磁共振灌注成像TIC曲线与宫颈癌的非常相似,同样是“速升平台”型,但最大增强强度最大,首过最大灌注斜率和达峰时间介于正常宫颈与宫颈癌之间,这主要是由于宫颈肌壁间肌瘤的微血管非常丰富,而且血管壁较完整、间质腔隙较小。上述研究表明,磁共振灌注成像的TIC曲线与宫颈癌的血流灌注状况及毛细血管通透性等有很好的相关性,但缺乏特异性。然而在临床工作中,结合常规序列及增强序列,就能很好的观察宫颈癌的形态和掌握血液动力学方面的信息,将使MRI检查在评估宫颈癌放化疗的疗效方面变为可能[9-11]。
随着分子影像学技术的发展,利用磁共振灌注成像评价肿瘤的生物学特性方面的研究越来越多,在宫颈癌方面,主要用来评估宫颈癌放化疗的疗效。近年来有研究报道[10,13]利用灌注成像来评价肿瘤组织的癌基因表达水平。机制可能是由于癌基因与肿瘤血管形成具有非常密切的关系,癌基因可通过调节血管形成因子,进而影响肿瘤微环境和调控肿瘤血管的形成。
本研究灌注扫描序列上进行了一些新的尝试,采用容积内插体部检查序列, 既兼顾了时间分辨率,又实现了组织分辨率的提高,较以往的MRI灌注成像序列相比,可以很清楚地观察到宫颈癌和周围组织在灌注期间的信号变化及其相关性。虽然本研究取得了一些初步的结果,但存在一定局限性,如本组病例以符合手术条件的宫颈鳞癌居多,缺少对不同期别、不同类型宫颈癌的大样本分析;肿瘤的不均匀性及组织病理取材的局限性(显微镜下观察的组织有限)可能加大样本数据的偏倚;患者年龄跨度大,身体条件(特别是心血管情况)相差较大,也会造成灌注参数一定程度的变异,后续研究将针对这些问题进行深入探讨。
综上所述,磁共振灌注成像参数与宫颈癌生物学行为具有相关性,可不同程度反映活体肿瘤血流灌注状况及毛细血管通透性等,有助于宫颈癌的鉴别诊断和临床治疗评估提供参考。
[References]
[1]JosepMariadelCampo, AleixPrat, AntonioGil-Moreno, et al.Update on novel therapeutic agents for cervical cancer.Gynecol Oncol, 2008, 110(3 Suppl 2): S72-S76.
[2]Zhang J, Xue HD, Li S, et al.Value of magnetic resonance imaging in parametrial invasion of cervical cancer.Chin J Magn Reson Imaging,2014, 5(4): 287-290.张洁, 薛华丹, 李烁, 等.MRI对宫颈癌宫旁浸润的诊断价值.磁共振成像, 2014, 5(4): 287-290.
[3]Thomassin-NaggaraI, SilesP, BalvayD, et al.MR perfusion for pelvic female imaging.Diagnostic and interventional imaging, 2013, 94(12):1291-1298.
[4]Van-Vierzen PB, Massuger LF, Ruys SH, et al.Fast dynamic contrast enhanced MR imaging of cervical carcinoma.Clinical Radiology,1998, 53(3): 183-192.
[5]Abede D, Chiles C, Gatsonis C, et al.Imaging and cancer: research strategy of the American College of Radiology Imaging Network.Radiology, 2005, 235(3): 741-751.
[6]Cao ZD, Cui ZX.Cervical cancer tumor angiogenesis and MSCT perfusion correlation research progress.Hebei Medical Journal, 2011,33(7): 1060- 1063.曹振东, 崔志新.宫颈癌肿瘤血管生成与MSCT灌注相关性研究进展.河北医药, 2011, 33(7): 1060-1063.
[7]Fu JH, Chang XD, Wang YY, et al.The feasibility of MRI to indicate protein expressions in primary breast cancer.Chin J Magn Reson Imaging, 2014, 5(4): 274-278.付姣慧, 常晓丹, 王盈盈, 等.MRI预测乳腺癌分子生物特性 可行性的初步探索.磁共振成像, 2014, 5(4): 274-278.
[8]Milcs KA.Tumor angiogenesis and its relation to contrast enhancement on computed tomography: a review.Eur J radiol, 1999, 30(3):198-205.
[9]Lee EY, Yu X, Chu MM, et al.Perfusion and diffusion characteristics of cervical cancer based on intraxovel incoherent motion MR imaging-a pilot study.European radiology, 2014, 24(7): 1506-1513.
[10]Wang HC, Fan Sf, Gao Y, et al.Appncafion of MR perfusion weighted imaging in the diagnosis of uterine cervix cancer.Chin J Clin Med Imaging, 2009, 20(10): 750-754.王浩初, 樊树峰, 高燕, 等.磁共振T1灌注加权成像在宫颈癌诊断中的应用.中国临床医学影像杂志, 2009, 20(10): 750-754.
[11]Ding WJ, Gong GW, Zhou SK, et al.Evaluation of MR perfusion weighted imaging in diagnosis of uterine cervix cancer and assessment of therapeutic effect.Chinese Computed Medical Imaging, 2012,18(5): 415-418.丁文金, 龚光文, 周顺科, 等.磁共振灌注成像在宫颈癌诊断及疗效评估价值的初步探讨.中国医学计算机成像杂志, 2012, 18(5): 415-418.
[12]Yamashita Y, Baba T, Balm Y, et a1.Dynamic contrast enhanced MR imaging of uterine cervical cancer.pharmaeokinetie analysis with histopathologie correlation and its importance in predicting the Out come of radiation therapy.Radiology, 2000, 216(3): 803-809.
[13]Ju GZ, Wang XM, Fu SB, el a1.Effect of ionifing radiation Onthe expression of p16.cyclinDl and CDK4 in mouse thymocyt and splenocytes.Biomed Environ Sci, 2003, 16(1): 47-52.
