直肠癌DCE-MRI参数与病理特征的相关性研究
2015-12-13谢宗源徐香玖黄刚周星马小梅王治民铁萍张庆
谢宗源,徐香玖,黄刚,周星,马小梅,王治民,铁萍,张庆
1.宁夏医科大学,银川 750000
2.甘肃省人民医院放射科,兰州730000
3.甘肃中医学院,兰州 730000
MRI作为诊断直肠癌的重要影像学检查方法已经广泛应用于临床,主要用于观测肿瘤的分期、周围侵犯及远处转移情况。随着各种磁共振功能成像新技术的开发与临床广泛应用,动态对比增强磁共振成像(dynamic contrast-enhanced,DCE-MRI)反映了磁共振对比剂进入和排出肿瘤的血流动力学过程,不仅能够提供清晰的图像,反映直肠癌的形态学特征,而且能够通过图像后处理得到各项参数:TIC,Ktrans、Ve、Kep值,是直肠癌一种既无创又有较高敏感性和特异性的检查方法。DCE-MRI已在多种肿瘤性病变诊断中广泛使用,例如对乳腺癌[1-3]和前列腺癌[4-5]的研究,取得了较好的效果。本研究探讨直肠癌的DCE-MRI参数的特点及其与病理分化程度、Dukes分期的相关性。
1 资料与方法
1.1 一般资料
收集甘肃省人民医院2014年1月-2014年10月经手术病理证实为直肠癌的56例患者的MRI常规,DCE-MRI扫描图像进行回顾性分析。男36例,女20例,年龄40~83岁,平均(60.5±11.8)岁。56例直肠癌患者中,高分化腺癌13例,中分化腺癌32例,低分化腺癌11例;Dukes A期11例,B期28例,C期11例,D期6例。
1.2 MRI检查方法
采用SIEMENS Skyra 3.0 T MR仪,18通道体表相控阵列线圈,常规T1WI轴位,T2WI轴位、矢状位、冠状位,DWI轴位扫描。DCE-MRI扫描:应用T1 VIBE序列(FOV 260×260 mm,TR 5.08 ms,TE 1.77 ms,矩阵154×192,层厚3.5 mm,翻转角度为15°,NEX 1),对比剂选用Gd-DTPA(钆双胺注射液,商品名欧乃影),由高压注射器自手背静脉注射,速度3 mL/s,剂量0.1 mmol/kg;35个扫描时相不间断扫描,单个时相扫描时间8 s,第3个时相扫描开始注入对比剂,扫描时间280 s。范围包括整个肿瘤部分。对比剂注射后即刻用20 mL生理盐水冲洗管道。DCE扫描后行T1轴位、矢状位、冠状位的常规增强扫描。
1.3 图像分析及数据处理
所有的动态增强原始图像均在M M W P version:VE40工作站上使用TISSUE 4D软件(该设计采用药代动力学“两室模型”[6])行动态对比增强磁共振成像。由2名具直肠MRI工作经验的放射科医师共同对增强后的图像进行评估,评估之前2名医生都被隐瞒病理学结果,两者一致性用kappa检验,定量参数的一致性均大于0.85,结果取2名医生所测的平均值;TIC的类型由2名医生共同评估,得出统一结论,做出诊断。设置感兴趣区(ROI)面积约30 mm2,选取在病变明显强化区,尽量避开肉眼可见大血管、液化、出血及囊变坏死区(参照T1WI、T2WI、DWI及常规增强扫描图像),图1A~图4A是DCE-MRI的原始图像。①绘制时间-信号强度曲线(time-intensity curve,TIC)。TIC分为3种类型:Ⅰ型:缓慢上升型即流入型(图1C),早期无强化高峰,信号强度随时间延长缓慢增加;Ⅱ型:速升维持型即平台型(图2C),为早期注药3 min内病变的信号强度达到最高峰,中晚期强度无明显变化,注药3~5 min内信号强度升高或降低幅度在10% 以内;Ⅲ型:速升速降型即流出型(图3 C、4C),为早期注药3 min内病变的信号强度达到最高峰,中晚期信号强度明显降低,注药3~5 min内信号强度下降幅度超过10%。②获得Ktrans、Ve、Kep伪彩图(图1 B、2 B、3 B、4B)并测量以下3个参数。容量转移常数(volume transfer constant, Ktrans)为对比剂从血管(血浆)空间泄漏到细胞外血管外间隙(extravascular extracellular space, EES)的速率(单位:min-1);EES容积比(leakage Space, Ve)为单位容积组织内EES的容积;速率常数(rate constant, Kep)为对比剂从EES返回到血管(血浆)空间的速率(单位:min-1)。
1.4 统计学分析
采用SPSS 17.0统计软件,计量资料数值用(±s)表示,在统计前先行方差齐性检验(Levene检验)。应用单因素方差分析对DCE-MRI定量参数Ktrans、Ve、Kep值与直肠癌的分化程度、Dukes分期进行相关性分析;检验水准α=0.05。
2 结果
2.1 直肠癌TIC类型分析
56例直肠癌患者,Ⅱ型曲线(图2C)8例,占14.3%(8/56),其中高分化腺癌5例,中分化腺癌3例;Dukes A期4例、B期3例、C期1例。Ⅲ型曲线(图3C、4C)48例,占85.7%(48/56),其中高分化腺癌8例,中分化腺癌29例,低分化腺癌11例;Dukes A期7例、B期25例、C期10例、D期6例。肿瘤周围正常直肠壁Ⅰ型曲线为41例(图1C),Ⅱ型曲线15例。
2.2 直肠癌的病理分化程度、Dukes分期与DCE-MRI定量参数分析
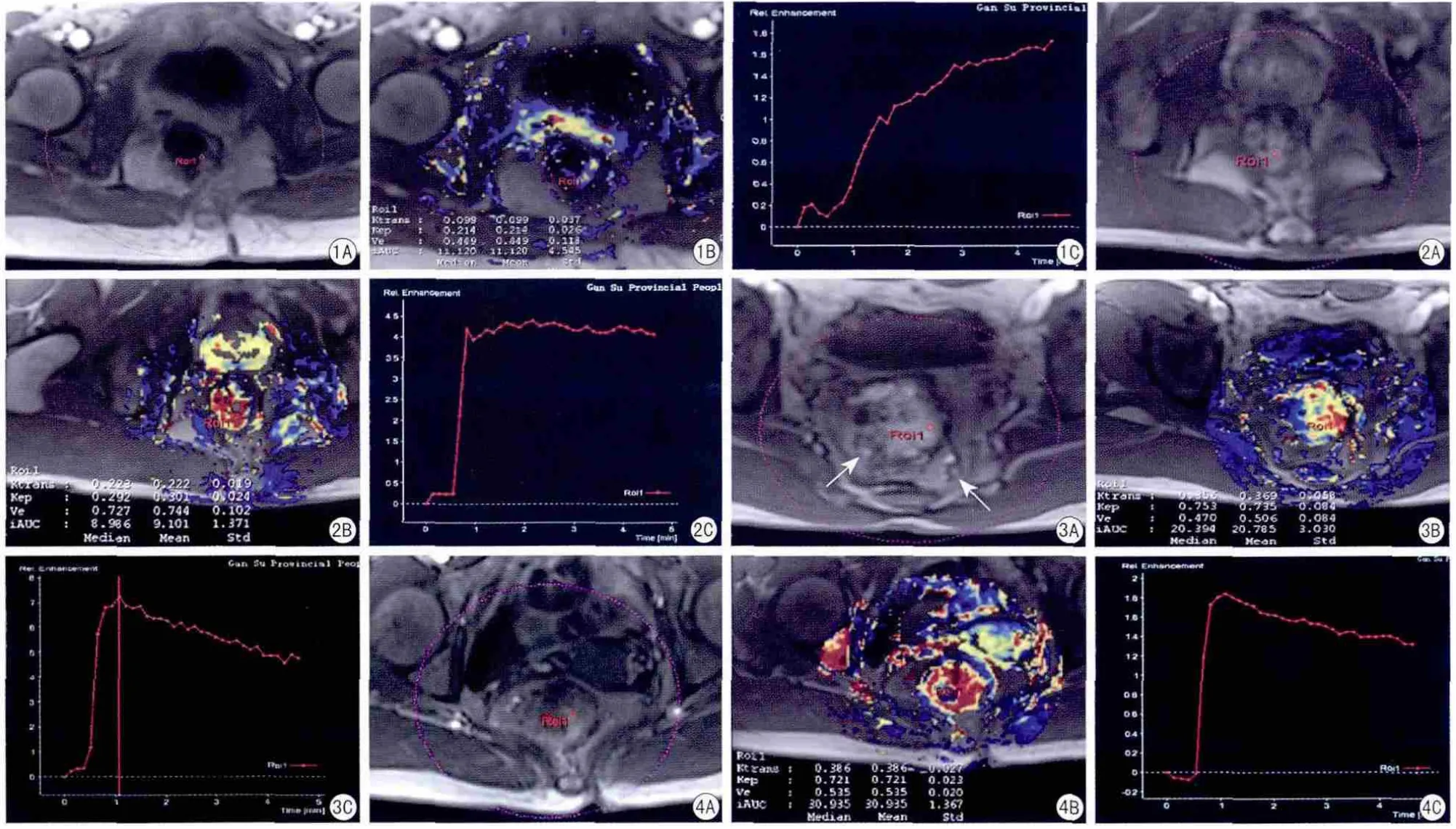
图1 肿瘤周围正常直肠壁。A:第10期DCE-MRI图像,肠壁略强化,选取强化最明显区为ROI;B:Ktrans、Ve、Kep伪彩图,正常肠管壁呈中等信号(黄色),测量Ktrans=0.10/min、Ve=0.45、Kep=0.21/min;C:Ⅰ型 TIC 图2 高分化管状腺癌、Dukes B期患者。A:第10期DCE-MRI图像,肿瘤明显强化,选取强化最明显区为ROI;B:Ktrans、Ve、Kep伪彩图,肿瘤呈高信号(红色),测量Ktrans=0.22/min、Ve=0.74、Kep=0.30/min;C:Ⅱ型TIC 图3 中分化粘液腺癌并广泛淋巴结转移、Dukes D期患者。A:第10期DCE-MRI图像,肿瘤明显强化,转移性淋巴结为不均匀强化(箭头),选取肿瘤强化最明显区为ROI;B:Ktrans、Ve、Kep伪彩图,肿瘤呈高信号(红色),测量Ktrans=0.37/min、Ve=0.51、Kep=0.74/min;C:Ⅲ型TIC,达峰时间为1.1 min 图4 低分化管状腺癌、Dukes B期患者。A:第10期DCE-MRI图像,肿瘤明显强化,选取肿瘤强化最明显区为ROI;B:Ktrans、Ve、Kep伪彩图,肿瘤呈明显高信号(红色),测量Ktrans=0.39/min、Ve=0.54、Kep=0.72/min;C:Ⅲ型TICFig.1 The normal rectal wall around the tumor.A: Number 10 of DCE-MRI map, rectal wall Slightly enhanced, select the most obvious enhanced area as ROI; B: Ktrans, Ve, Kep pseudo-color map, the normal rectal wall show moderately signal (yellow), measure Ktrans=0.10/min, Ve=0.45, Kep=0.21/min; C: Type one TIC. Fig.2 Well differentiated tubular adenocarcinoma, Dukes stage B patients.A: Number 10 of DCE-MRI map, tumor significantly enhanced, select the most obvious enhanced area as ROI; B: Ktrans, Ve, Kep pseudo-color map, tumor show high signal (red), measure Ktrans=0.22/min, Ve=0.74, Kep=0.30/min; C: Type two TIC. Fig.3 Moderately differentiated mucous adenocarcinoma and extensive lymph node metastasis,Dukes stage D patients.A: Number 10 of DCE-MRI map, tumor significantly enhanced, uneven enhancement of metastatic lymph nodes(arrow), select the most obvious enhanced area as ROI; B: Ktrans, Ve, Kep pseudo-color map, tumor show high signal(red), measure Ktrans=0.37/min, Ve=0.51, Kep=0.74/min;C: Type three TIC, the peak time of 1.1 minute. Fig.4 Poorly differentiated tubular adenocarcinoma, Dukes stage B patients.A: Number 10 of DCEMRI map, tumor significantly enhanced, select the most obvious enhanced area as ROI; B: Ktrans, Ve, Kep pseudo-color map, tumor show significantly high signal(red), measure Ktrans=0.39/min, Ve=0.54, Kep=0.72/min; C: Type three TIC.
直肠癌的分化程度与定量参数比较见表1,随着肿瘤分化程度的减低,Ktrans值逐渐升高,差异有统计学意义(P<0.01)。组内两两比较:高、中分化腺癌之间P=0.01,高、低分化腺癌之间P<0.01,中、低分化腺癌之间P=0.02,Ktrans值差异均有统计学意义。不同病理分化程度直肠癌的Ve、 Kep值差异无统计学意义(P>0.05)。
直肠癌的Dukes分期与定量参数比较见表2,随着肿瘤Dukes分期程度的增加,Ktrans值逐渐升高,差异有统计学意义(P<0.01)。组内两两比较:Dukes A、B期之间P=0.06,Dukes C、D期之间P=0.07,Ktrans值差异无统计学意义(P>0.05);Dukes A、C期之间P<0.01,Dukes A、D期之间P<0.01,Dukes B、C期之间P<0.01,Dukes B、D期之间P<0.01,Ktrans值差异均有统计学意义。不同Dukes分期直肠癌的Ve、 Kep值差异无统计学意义(P>0.05)。
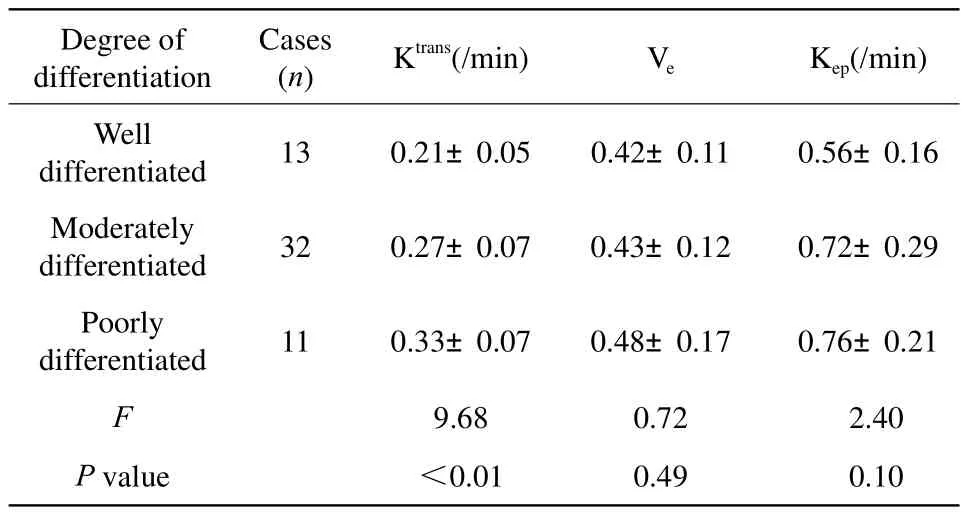
表1 直肠癌的分化程度与定量参数比较Tab.1 The degree of differentiation in rectal cancer compared with the quantitative parameters

表2 直肠癌的Dukes分期与定量参数比较Tab.2 Dukes stage in rectal cancer compared with quantitative parameters
3 讨论
直肠癌的肿瘤血管生成是肿瘤生长的基础,并且和肿瘤的病理分化程度、分期、淋巴结转移及血行转移有关。DCE-MRI是在注射磁共振对比剂后多次连续扫描记录病灶信号强度随时间发生的变化,可反映病灶血供状况,并间接反映病灶微血管分布情况[7],具备了在分子水平上对肿瘤血管评估的能力,为观察直肠肿瘤血管属性提供了可能。MRI上病灶的强化是由对比剂缩短T1的效应引起的,T1加权信号强度的变化可以反映对比剂浓度的变化,并可通过药代动力学模型量化[8]。本研究使用的DCE-MRI即所谓强化动力学评价法参数,分为两类: 一类是评价增强曲线图形方法TIC,是对比剂在病变组织内分布变化的直观描述;另一类为根据药代动力学模型对TIC进行数学处理,得出定量参数Ktrans、Ve、Kep值。两类均可用于评价组织、器官的血流灌注情况[9]。
TIC用视觉观察强化曲线,以代替复杂的数学模型或确定绝对强化的量或率。本研究48例呈Ⅲ型曲线,全部低分化腺癌及Dukes D期病例均为Ⅲ型曲线,表明这种曲线为高度恶性,转移率高。8例呈Ⅱ型曲线,均为高、中分化腺癌,Dukes A期4例,Dukes B期3例,Dukes C期1例。肿瘤周围正常直肠壁Ⅰ型曲线为41例,Ⅱ型曲线15例。48例直肠癌呈Ⅲ型曲线,是由于癌细胞能分泌肿瘤血管生成因子,作用于血管内皮,使肿瘤生成更多的新生血管,对比剂集聚于血供密集区,使肿瘤增强后迅速、明显的强化。由于肿瘤毛细血管管壁薄、基底膜不完整、内皮细胞连接松散、间隙增大,从而导致通透性增高且肿瘤毛细血管存在动静脉瘘,因此肿瘤达峰值后对比剂很快地流出。肿瘤周围正常直肠壁41例呈Ⅰ型曲线,为正常血供,血管壁有完整的基层及基底膜,对比剂从动脉流入静脉时缓慢地进入间质,经静脉流出的量少,因此局部信号呈缓慢持续上升,无明显峰值或达峰后形成较短峰值后缓慢持续走形或略下降。8例直肠癌及15例肿瘤周围正常直肠壁呈Ⅱ型曲线,对比剂浓度达峰值后,在微血管内、外组织间隙达到平衡,持续在峰值平台水平,这与关于直肠癌的研究II 型曲线在良恶性病变中多有重叠[10]相符。目前关于直肠癌TIC曲线的应用报道较少,本研究曲线类型与直肠癌的恶性程度具有一定的相关性和相关学者对直肠癌的报道[10]相符,Ⅰ型曲线多提示正常肠壁结构及良性病变,Ⅱ型曲线可以是良性病变也可以是恶性病变,Ⅲ型曲线多提示恶性病变。
定量分析采用“两室模型”,第一室定义为血管(血浆)称中央室,第二室定义为EES称周边室,血管内对比剂依靠浓度梯度在两室间转移[5],可以测得血流动力学参数Ktrans、Ve、 Kep值。Ktrans值代表对比剂从血管内向血管外间隙的通过率,反映组织血流量,为研究肿瘤血管生成提供重要信息[11]。本研究结果表明Ktrans值随着肿瘤病理分化程度的减低、Dukes分期程度的增加而升高,说明恶性程度越高的直肠癌血管越不成熟,血管的完整性存在不同程度破坏或缺陷,血管通透性增大,容易引起血管对比剂分子的外漏,Ktrans值升高。这与Kim等[12]对直肠癌DCEMRI的研究中用Ktrans值评估肿瘤的恶性程度指标的研究结果是一致的。Ve值为单位容积组织内EES的容积,Ve值的研究受到越来越多的关注,可以用来评价肿瘤的治疗效果[3],随着肿瘤恶性程度的增高,不成熟的血管越多,血管壁不完整,对比剂分子从血管内泄漏到血管外的量增多、占EES的比值增大,Ve值增大。本研究Ve值随着肿瘤分化程度的减低、Dukes分期程度的增加但差异无统计学意义。分析原因可能与肿瘤血供复杂、分布不均匀,周围水肿明显,病变发展过程中EES环境复杂多变等情况有关。Kep值代表渗漏到EES的对比剂分子流返回到血管内的的速率。本研究Kep值随着肿瘤分化程度的减低、Dukes分期程度的增加但差异无统计学意义。从理论上讲肿瘤恶性程度越高,肿瘤细胞对血管的刺激性越强,会导致血管结构的异常,微血管管壁破坏严重,通透性明显增高,对比剂从EES回流入血管内的能力强,恶性程度高的直肠癌Kep值高于恶性程度低的直肠癌Kep值。但是Kep值与Ktrans、Ve值存在关系,Kep=Ktrans/Ve,Kep值受到Ktrans、Ve值的影响,受血流在时间和空间上不平衡分布等综合因素的影响。本研究Ktrans值对病理分化程度、Dukes分期具有一定的相关性;关于Ve、Kep值与肿瘤恶性程度的相关性尚需扩大样本量进一步研究。
本研究DCE-MRI使用了T1 VIBE序列具有对肿瘤体积扫描范围大,具有较薄的层厚(3.5 mm),扫描时间快、单个时相扫描时间仅8 s,具有较高的空间分辨率,同时兼顾了时间分辨率。将直肠癌TIC明确分型,并对DCE-MRI参数的特点及与病理分化程度、Dukes分期的关系进行了分析,目的在于帮助判断肿瘤恶性程度及分级,探索DCEMRI参数与病理特征的关系。
DCE-MRI能够较全面地显示对比剂进入和排出肿瘤的血流动力学过程,DCE-MRI参数TIC及Ktrans值与病理分化程度、Dukes分期间有一定相关性,TIC形态对于判断直肠癌的恶性程度有帮助,Ktrans值在常规MRI的基础上可提供的微循环信息,可能用于无创性预测肿瘤的恶性程度。
[References]
[1]Zhao JL, Guan HT, Li MD, et al.Dynamic contrast-enhanced MR imaging combined with T2*-weighted fi rst-pass perfusion imaging in diagnosis of breast tumor.Chin J Magn Reson Imaging, 2014, 5(1):54-59.赵金丽, 管海涛, 李敏达, 等.MR动态增强扫描结合T2*WI首过灌注成像诊断乳腺肿瘤的价值.磁共振成像, 2014, 5(1): 5(1):54-59.
[2]Li M, Jin Z, Li GJ, et al.Correlation between angiogenesis and multiparameters of dynamic contrast enhancement MRI for assessments of benign and malignant breast lesions.Chin J Magn Reson Imaging,2010, 1(1): 36-42.李敏, 金真, 李功杰, 等.乳腺动态增强MRI参数与肿瘤血管的相关性及其鉴别诊断价值.磁共振成像, 2010, 1(1): 36-42.
[3]Kim H, Folks KD, Guo L, et al.DCE-MRI detects early vascular response in breast tumor xenografts following anti-DR5 therapy.Mol Imaging Biol, 2011, 13(1): 94-103.
[4]Liu L, Wu N, Ouyang H,et al.Diversity and characteristics of prostate cancer in dynamic contrast-enhanced MRI.Chin J Med Imaging Technol, 2011, 27(12): 2506-2509.刘莉, 吴宁, 欧阳汉, 等.前列腺癌动态增强MRI的多样性表现及特点.中国医学影像技术, 2011, 27(12): 2506-2509.
[5]Franiel T, Hamm B, Hricak H.Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer.Eur Radiol, 2011, 21(3): 616-626.
[6]Tofts PS, Brix G, Buckley DL, et al.Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer:Standardized quantities and symbols.J Magn Reson Imaging,1999,10(3): 223-232.
[7]Zhang SJ, Peng WJ, Zhou LP.Basic principles and clinical applications of dynamic contrast-enhanced MRI in prostate cancer.Chin J Med Imaging Technol, 2010, 26(2): 378-380.张盛箭, 彭卫军, 周良平.动态增强MRI基本原理及其在前列腺癌中的应用.中国医学影像技术, 2010, 26(2): 378-380.
[8]Wang H, Li J, Chen F, et al.Morphological,functional and metabolic imaging biomarkers:assessment of vascular-disrupting effect on rodent liver tumors.Eur Radiol, 2010, 20(8): 2013-2026.
[9]Yao WW, Zhang H, Ding B, et al.Rectal cancer: 3D dynamic contrast-enhanced MRI;correlation with microvascular density and clinicopathological features.Radiol Med, 2011, 116(3): 366-374.
[10]Zhou NN, Chen M, Wang WC, et al.Effects of neoadjuvant chemoradiotherapy prior to surgery on rectal cancer assessing by DCEMRI.Chin J Magn Reson Imaging, 2010, 1(2): 103-109.周妮娜, 陈敏, 王文超, 等.动态增强磁共振成像对直肠癌术前新辅助治疗疗效的评价.磁共振成像, 2010, 1(2): 103-109.
[11]Yankeelov TE, Gore JC.Dynamic contrast enhanced magnetic resonance imaging in oncology:theory,data acquisition,analysis,and examples.Curr Med Iamging Rev, 2009, 3(2): 91-107.
[12]Kim DJ, Kim JH, Lim JS, et al.Restaging of rectal cancer with MR imaging after concurrent chemotherapy and radiation therapy.Radiographics, 2010, 30(2): 503-516.
