人黑色素瘤中肿瘤相关巨噬细胞的检测和临床意义
2015-12-13王晓楠宋宁静程兴旺陈向红
王晓楠,宋宁静,程兴旺,李 群,陈向红
(1.安徽医科大学病原与免疫学实验中心,安徽合肥 230032;2.上海国际医学中心皮肤科,上海 200000;3.蚌埠医学院附属医院急诊外科,安徽蚌埠 233000;4.安徽医科大学第一附属医院病理科,安徽合肥 230032)
黑素瘤是一种人皮肤常见的侵袭性强、转移率高且预后不良的皮肤恶性肿瘤[1]。黑素瘤好发于皮肤及邻近皮肤的黏膜组织,其发病率在皮肤恶性肿瘤中位居第三(约占6.8% ~20%)。近20年来,由于多因素的影响,本病的发病率和死亡率呈逐年递增趋势,年增长率约 3% ~5%[2-4],且多数患者在初诊时即处于本病的快速进展期甚至晚期,导致患者预后差,5年生存率低[5]。我国黑素瘤的发病率较低,但由于我国人口基数大,绝对发病人数也很多。手术切除对于早期黑素瘤的是非常有效的治疗手段,但对于中晚期发生转移的患者,现有的各种治疗效果均不佳,患者5年生存率仅有14%[6]。虽然近年医疗发展水平有了一定的提高,但是其治疗手段和方法进展尚不明显,导致黑色素瘤患者效果仍不容乐观[7]。深入认识皮肤黑素瘤的发生发展的分子机制,发掘其过程中重要的关键因子,可以为其诊断和治疗提供新的生物靶点和思路。肿瘤细胞必须依赖于宿主间质细胞的支持才能够无限增殖并形成肿瘤,这些间质成分包括维持肿瘤生长和作为日后远处转移途径的血管、纤维和一些免疫细胞,它们构成了肿瘤发生发展的微环境。其中,在肿瘤的微环境中就包括了巨噬细胞。研究表明在实体肿瘤中有大量的肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)浸润,这些TAM与肿瘤的发生、发展关系密切[8-10]。为深入了解TAM在皮肤黑色素瘤发病中作用,本研究应用免疫组织化学方法检测皮肤恶性黑素瘤和良性色素痣CD68表达来衬染TAM,然后分别进行计数,分析其与黑素瘤临床病理特征的关系,以探讨TAM在皮肤恶性黑素瘤发生发展中可能扮演的角色。
1 资料和方法
1.1 病例资料 收集安徽医科大学第一附属医院74例皮肤黑素瘤和30例皮肤色素痣。所有标本均以4%甲醛固定,石蜡包埋,常规做苏木精—伊红(HE)染色,经组织病理学确诊。所有病例以3 μm厚度连续切片,敷贴于10%多聚赖氨酸预先处理的载玻片上,备用。
1.2 主要试剂 人CD68单克隆抗体,通用型两部法免疫组织化学试剂盒及DAB显色剂均购自中国福州迈新公司。
1.3 方法
1.3.1 免疫组织化学染色 采用免疫组织化学两部法染色。将组织切片常规脱蜡至水,柠檬酸盐缓冲液高温高压抗原修复,DAB显色。苏木精溶液复染,脱水,中性树胶封片。具体操作按说明书染色步骤进行。阳性对照采用已知阳性切片,阴性对照以PBS缓冲液代替一抗。
1.3.2 结果判定 TAM的评定通过光学显微镜下计数CD68阳性细胞完成。具体计数步骤采用Russell D Leek方法[11]:首先在低倍镜(100倍)下选取视野中巨噬细胞最密集的三个区域(即“热点区”),然后在高倍镜(400倍)下进行巨噬细胞计数,取三个数据的平均值进行统计学分析。
1.4 统计学分析 采用SPSS(13.0 for window)软件进行统计学分析。计量资料以(±s)描述,两组间的比较采用成组t检验。Logistic回归模型分析CD68阳性TAM浸润数目的影响因素;计数资料则采用卡方检验(一般资料)或秩和检验(等级资料),P<0.05视为差异有统计学意义。
2 结果
2.1 TAM在皮肤黑色素瘤和色素痣中的分布和计数 CD68阳性信号呈棕黄色颗粒,主要定位于巨噬细胞的胞浆和胞膜(图1)。在黑色素瘤组织中有大量CD68阳性的巨噬细胞浸润,细胞形态不一,主要分布于肿瘤的浸润前沿和肿瘤细胞巢的间隙中,呈片状分布;良性色素痣中CD68阳性的巨噬细胞罕见,主要分布于痣细胞的间隙中,呈零星散在分布。74例皮肤黑素瘤组织中,每个高倍视野中的巨噬细胞平均计数为15.08个,显著高于色素痣中巨噬细胞计数3.87个,两者差异有统计学意义(P=0.001),见表1。

表1 人皮肤黑色素瘤和色素痣中巨噬细胞计数的比较
2.2 TAM计数与黑素瘤患者临床病理特征的关系 将黑色素瘤中TAM计数平均值15.08设置为界点,将每例黑色素瘤TAM计数分为低级别和高级别,然后观察TAM级别与临床病理特征的关系。如表2所示,人黑色素瘤组织中巨噬细胞浸润的数目与肿瘤的厚度、肿瘤浸润深度和肿瘤淋巴结转移呈显著正相关(均P<0.05);与患者年龄、性别和肿瘤分型均无显著相关性(均P>0.05)。
2.3 黑色素瘤CD68阳性TAM浸润的影响因素为了探讨黑色素瘤组织中CD68阳性TAM浸润的相关影响因素,我们建立了Logistic回归模型,将患者年龄、肿块厚度和肿瘤浸润深度等临床病理参数指标一并纳入回归模型,对TAM计数进行多因素分析。研究结果显示肿瘤浸润深度和淋巴结转移是决定TAM计数具有统计学意义的影响因子(P=0.001和0.016)。
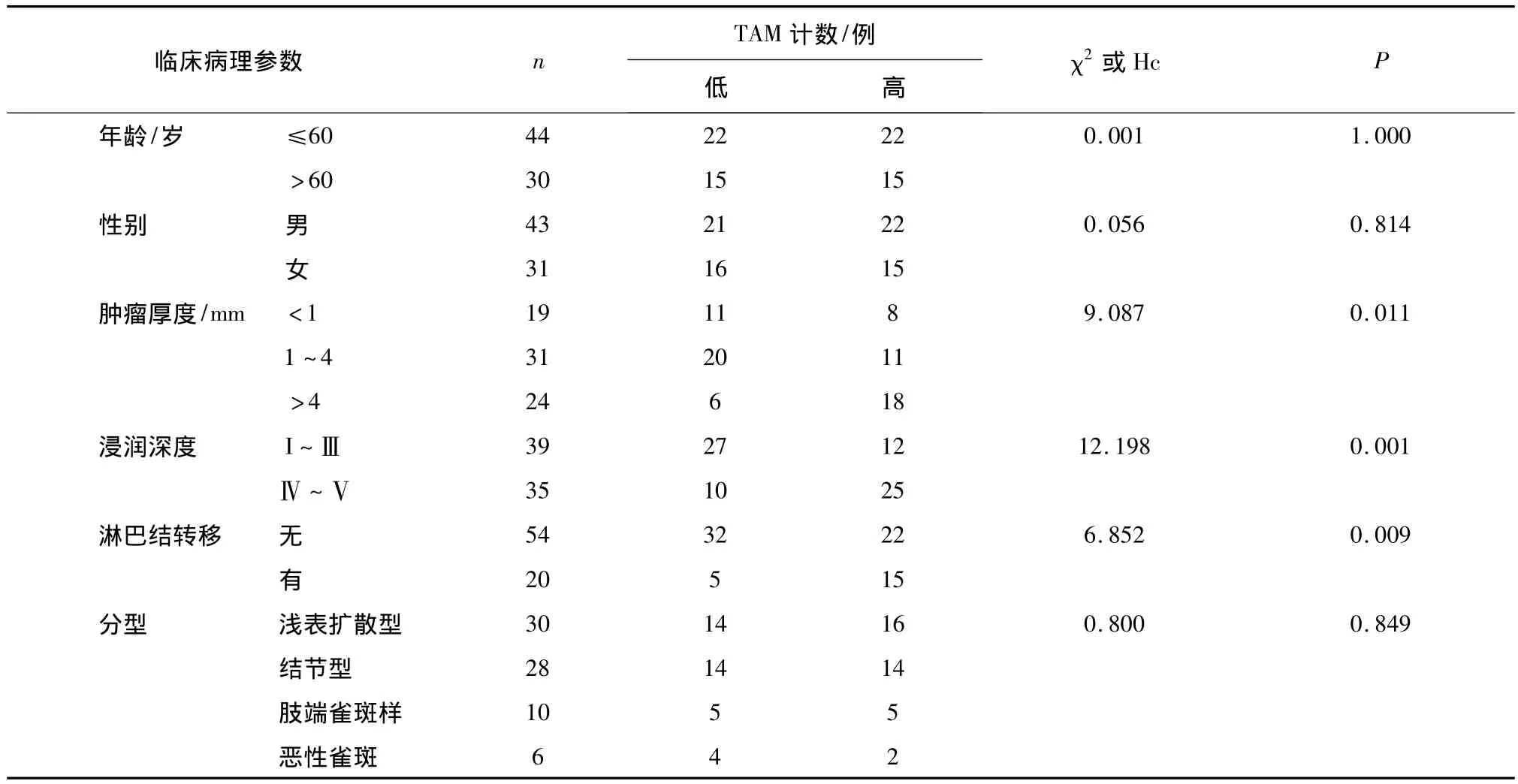
表2 人黑色素瘤TAM计数与患者临床病理特征的关系
3 讨论
目前TAM在肿瘤中发挥作用已经逐渐得到认可[12],但在不同肿瘤中发挥的作用和机制目前尚不明朗,甚至出现了矛盾的研究报道。传统理论认为,单核/巨噬细胞作为机体主要抗原呈递细胞,是参与特异性和非特异性抗肿瘤免疫的第一防线细胞。巨噬细胞在抗肿瘤免疫中的作用不仅是作为抗原呈递细胞,而且是溶解肿瘤细胞的效应细胞。临床病理研究资料表明,肿瘤组织周围若有明显的巨噬细胞浸润,肿瘤扩散转移的发生率较低,预后也较好;反之,肿瘤扩散转移率高,预后较差[13]。郭英军等[14]研究发现:在真皮浅层尤其是接近真表皮交界处,单核/巨噬细胞形成了数层较致密的细胞网,这些细胞在真皮内具有明确的方向性,可有效防御侵入真皮的入侵物。而且,活化的单核巨噬细胞还通过分泌某些细胞因子,如:IL-10、IL-12等,参与调节机体抗肿瘤免疫的不同时相,其中IL-12是一种新型促炎症细胞因子,研究发现,其对多种实体肿瘤尤其是黑色素瘤和肾细胞肿瘤既能直接消灭[15],又能间接抑制肿瘤周围的血管生成[16-18]。这些研究表明,黑色素瘤中的巨噬细胞,即TAM是参与抗黑色素瘤免疫和侵袭转移的重要防御细胞。另一方面,研究发现黑色素瘤与TAM间存在共生关系,甚至TAM促进黑色素瘤细胞的生存,如:黑素瘤细胞通过分泌趋化因子吸引TAM并维持其生存,受黑素瘤组织中微环境因子如组织缺氧(低氧压)的影响,TAM通过产生促进肿瘤血管生成的重要有丝分裂原及各种生长因子和酶类而有助于黑素瘤细胞的生长和转移[19];在临床黑色素瘤组织中,浸润的巨噬细胞数量指数、血管分级程度、黑素瘤恶性程度三者正相关[20]。这些研究结果提示:TAM可能参与并促进了黑色素瘤的发生和发展,是一类促癌细胞。我们在观察人皮肤黑素瘤的病理切片时,也经常会发现:在大多数黑素瘤的瘤体中有一定量的巨噬细胞存在,这些所谓的TAM主要出现在肿瘤细胞的间隙和肿瘤浸润的前沿,其数目不一,有时甚至可以超过肿瘤细胞总数的50%。而在良性的皮肤色素痣中,通常没有这些巨噬细胞的浸润,即使在合并感染的情况下,在痣细胞巢周围浸润的炎性细胞主要为中性白细胞或淋巴细胞,而没有TAM浸润。通过临床发现的在黑素瘤和色素痣病例中存在的这些规律性现象,提示了巨噬细胞在黑素瘤的发病过程中可能发挥了一定的作用,并且肿瘤细胞和这些TAM之间必定存在着一些“通讯”和“反馈”来调控黑素瘤的发病和生长侵袭。
本研究通过免疫组化CD68染色标记组织中浸润的巨噬细胞,然后进行计数和统计学分析,结果显示:黑色素瘤组织中巨噬细胞个数显著高于良性色素痣,提示TAM可能在黑色素瘤发生过程中发挥了一定作用。进一步分析发现,TAM个数与黑色素瘤的肿瘤厚度、肿瘤浸润深度和肿瘤淋巴结转移呈正相关,提示TAM可能在黑色素瘤恶性进展过程中发挥了作用。并且我们的结果显示TAM对黑色素瘤的发生发展发挥了促进作用,而非抑制作用,与文献报道一致[9]。有研究显示:TAM在肿瘤微环境中通过分泌血管生成因子来促进肿瘤血管生成,为肿瘤的生长和侵袭提供营养和通道,并且能够抑制机体内抗肿瘤免疫应答,促进肿瘤细胞逃逸免疫杀伤,最终促进病情进展[21-22]。
综上所述,本研究通过比较人皮肤黑色素瘤和色素痣中巨噬细胞的计数及其与肿瘤临床病理特征的关系,发现黑色素瘤中TAM显著增高,并且与肿瘤进展密切相关,提示TAM在人体皮肤黑素瘤中的发生发展发挥了一定重要的促进作用,可能是黑素瘤预后差和治疗效果不佳的一个重要因素。
[1]Rubin KM,Lawrence DP.Your patient with melanoma:staging,prognosis,and treatment[J].Oncology(Williston Park),2009,23(8 Suppl):13-21.
[2]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277 -300.
[3]Andreeva VA,Cockburn MG.Cutaneous melanoma and other skin cancer screening among hispanics in the United States:a review of the evidence,disparities,and need for expanding the intervention and research agendas[J].Arch Dermatol,2011,147(6):743 -745.
[4]McGuire ST,Secrest AM,Andrulonis R,et al.Surveillance of Patients for Early Detection of Melanoma:Patterns in Dermatologist vs Patient Discovery[J].Arch Dermatol,2011,147(6):673 -678.
[5]Cayuela A,Rodriguez-Dominguez S,Lapetra-Peralta J,et al.Has mortality from malignant melanoma stopped rising in Spain?Analysis of trends between 1975 and 2001[J].Br J Dermatol,2005,152(5):997-1000.
[6]Jemal A,Tiwari RC,Murray T,et al.Cancer statistics,2004[J].CA Cancer J Clin,2004,54(1):8 -29.
[7]Balch CM,Soong SJ,Gershenwald JE,et al.Prognostic factors analysis of 17,600 melanoma patients:validation of the American Joint Committee on Cancer melanoma staging system[J].J Clin Oncol,2001,19(16):3622 -3634.
[8]Wang R,Zhang J,Chen S,et al.Tumor-associated macrophages provide a suitable microenvironment for non-small lung cancer invasion and progression[J].Lung Cancer,2011,74(2):188 -196.
[9]Chen J,Yao Y,Gong C,et al.CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3[J].Cancer Cell,2011,19(4):541 - 555.
[10]智 敏.肿瘤相关巨噬细胞在肿瘤发展中的作用[J].中外医疗,2012,32(12):186 -187.
[11]Leek RD,Lewis CE,Whitehouse R,et al.Association of macrophage infiltration with angiogenesis and prognosis in invasive breast carcinoma[J].Cancer Res,1996,56(20):4625 - 4629.
[12]吴 飞,宋宁静,王晓楠.肿瘤相关巨噬细胞在恶性皮肤肿瘤侵袭进展中的作用[J].国际皮肤性病学杂志,2013,39(5):324-326.
[13]齐海花,胡云才,兰天飞,等.B16F10黑素瘤细胞培养上清液对脂多糖刺激小鼠腹腔巨噬细胞分泌肿瘤坏死因子-α和一氧化氮的影响[J].中国中西医结合急救杂志,2012,19(3):169-171.
[14]郭英军,赵玉铭,王雅坤,等.正常皮肤中单核巨噬细胞和树枝状细胞的分布规律[J].中国免疫学杂志,2006,22(6):565-568.
[15]Alatrash G,Hutson TE,Molto L,et al.Clinical and immunologic effects of subcutaneously administered interleukin-12 and interferon alfa-2b:phase I trial of patients with metastatic renal cell carcinoma or malignant melanoma[J].J Clin Oncol,2004,22(14):2891-2900.
[16]Duda DG,Sunamura M,Lozonschi L,et al.Direct in vitro evidence and in vivo analysis of antiangiogenesis effects of interleukin-12[J].Cancer Res,2000,60(4):1111 -1116.
[17]Indraccolo S.Undermining tumor angiogenesis by gene therapy:an emerging field[J].Curr Gene Ther,2004,4(3):297 -308.
[18]宋宁静,曾学思,王千秋.白介素12抗肿瘤作用的进展[J].国际皮肤性病学杂志,2008,34(5):330 -332.
[19]Torisu-Itakura H,Lee JH,Huynh Y,et al.Monocyte-derived IL-10 expression predicts prognosis of stage IV melanoma patients[J].J Immunother,2007,30(8):831 -838.
[20]Shi L,Lei D,Ma C,et al.Clinicopathological implications of tumour-associated macrophages and vascularization in sinonasal melanoma[J].J Int Med Res,2010,38(4):1276 -1286.
[21]Obeid E,Nanda R,Fu YX,et al.The role of tumor-associated macrophages in breast cancer progression[J].Int J Oncol,2013,43(1):5-12.
[22]陈厚娣,夏先如,杜金凤.ManLAM对免疫细胞的抑制作用[J].安徽医药,2013,17(11):1968 -1970.
