Caspase-3/Caspase-9活化与皮鳞癌1号方抑制A431细胞生长的关系研究
2015-12-13潘年松刘英波张学愈
许 俏,罗 俊,潘年松,刘英波,丁 斗,张学愈,张 珏
(1.上海交通大学医学院附属新华医院崇明分院,上海 202150;2.贵阳医学院,贵州贵阳 550004;3.遵义医药高等专科学校,贵州遵义 563000)
据报道,90%的皮肤癌与紫外线照射损伤有关。近年来,由于臭氧层的破坏及人们的室外活动增加,皮肤癌特别是鳞状细胞癌的发病率明显上升;但目前临床治疗皮肤癌的方法有限,寻找一种新的有效的防治皮肤癌的天然药物就成为当前亟待解决的课题之一。
1 材料
1.1 药物 皮鳞癌1号方(SSP)由白头翁、莪术等中药组成(工艺、质量标准见专利申请号:2013104223796.7),试验品由遵义医药高等专科学校提供,每毫升相当于生药2 g,以白头翁皂苷B4含量及浸膏收率作为质量控制标准,低温保存备用。
1.2 试剂 高糖的Dulbecco modified eagle medium(DMEM)、胎牛血清购自 Hyclone公司,3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide(MTT)购自Amresco公司。
1.3 细胞系 A431细胞购自武汉大学中国典型培养物保藏中心。
2 方法
2.1 细胞培养 A431细胞培养于含10%胎牛血清、青霉素(100 U·L-1)和链霉素(100 U·L-1)的高糖DMEM培养基中,置于5%CO2、37℃饱和湿度的培养箱中。
2.2 MTT法测皮鳞癌1号方对A431细胞的增殖抑制作用 取对数生长期的细胞,调整细胞密度为每毫升1.25×105,每孔160 μL 接种于96 孔板。培养24 h后,每孔加40 μL不同浓度的药物,药物浓度设5个梯度,分别为原药的1/400、1/200、1/100、1/50、1/25,因每毫升皮鳞癌1号方相当于2 g生药,经换算后得到药物剂量相当于5(A2组)、10(A3组)、20(A4组)、40(A5 组)、80(A6组)mg·L-1,每个组设5个复孔,每组加40 μL。同时设空白对照组(A0组,加200 μL无血清培养基)、阴性对照组(A1组,不加药物)、阳性对照组(A7组,5-Fu 10 mg·L-1)。分别培养 24、48、72 h 后,弃去上清,加 200 μL 无血清培养基及 20 μL MTT(5 g·L-1),置于二氧化碳培养箱培养4 h后,弃上清,加150 μL二甲基亚砜(DMSO),振荡10 min后,于酶联免疫检测仪490 nm处测定吸光度值(OD值)。细胞存活率(%)=(实验组OD-空白对照组OD)/(阴性对照组OD-空白对照组OD)×100%。
2.3 Hochest33258染色法观察细胞凋亡 药物干预48 h后,弃去上清,用磷酸盐缓冲液(PBS)清洗3遍,每次5 min。加入500 μL染色液,混匀,室温放置30 min。弃去染色液,用PBS清洗3遍后,置于荧光显微镜下观察细胞核的形态变化,激发波长为346 nm,发射波长为460 nm。
2.4 ELISA测定细胞色素C(Cytc)含量 药物干预48 h后,收集细胞,用裂解仪裂解。低温离心20 min,3 000 r·min-1,取上清。细胞色素C检测试剂盒(安迪生物科技有限公司)说明操作。
2.5 比色法测定 Caspase-3、Caspase-9活性 药物干预48 h后,吸取细胞培养液备用。用胰酶消化细胞,并收集至备用的细胞培养中。600 g 4℃离心5 min收集细胞后,小心清除上清。PBS洗涤一次,吸尽上清后,按每200万细胞加入100 μL裂解液,重悬沉淀,冰浴裂解15 min。4℃ 20 000 g离心15 min,把上清转移到预冷的离心管中。按Caspase-3、Caspase-9活性检测试剂盒(碧云天生物技术研究所)说明操作。
2.6 统计学分析 采用SPSS13.0软件进行统计分析。观测资料主要为定量数据,均通过正态性检验,文中以(±s)描述之。多组多时点观测资料则采用两因素重复测量方差分析。所有检验均为双侧检验,并以α=0.05作为检验水准。
3 结果
3.1 形态学观察 显微镜下观察可见:阴性对照组细胞贴壁生长,生长状态良好,呈多边形或不规则形,折光性强。皮鳞癌1号方处理后,A431细胞增殖变缓,细胞出现皱缩,与周围细胞黏附力减弱。随着该药物浓度增加,上述现象更加明显。可见细胞大片脱落,细胞数明显减少,胞质内黑色颗粒增多,可见死亡细胞。见图1。
3.2 皮鳞癌1号方对A431细胞的存活影响(增殖抑制作用) 本实验采用MTT法检测皮鳞癌1号方在不同剂量浓度和不同作用时间条件下对A431细胞的增殖抑制效应(数据以存活率方式体现),见表1。对该表资料分别做两因素重复测量方差分析:6个剂量组间(空白对照A0组为实验备份观查组,未列入MTT法测试及其它观测项目,故表1及其它各表中均无该组资料),3个时点间,整体上差异均有统计学意义(P<0.05),且剂量和时间的交互作用也有显著性意义(P<0.05)。遂进行精细比较并结合数据来看:皮鳞癌1号方在不同浓度、不同作用时间对A431细胞增生存活率的影响(反映抑制作用),差异均有统计学意义(P<0.05),且随着药物作用浓度增加和时间的延长,皮鳞癌1号方对A431细胞的增殖抑制率也逐渐增强,表现为存活率下降(P<0.05)。说明皮鳞癌1号方对A431细胞增殖具有显著的抑制作用,且呈时间—剂量依赖性。
表1 对A431细胞的存活率影响分析(±s,n=5)

表1 对A431细胞的存活率影响分析(±s,n=5)
注:(1)此表资料为两因素重复测量资料,数据经正态性检验通过;经球型性检验后,以H-F法进行涉时间自由度调整;(2)整体分析方法为两因素重复测量方差分析;整体分析的显著性水准α=0.05;(3)精细比较为t检验(组间为成组检验,时点间为差值检验);精细比较的显著性水准调整为α’=0.01。
A1组:阴性对照组A2组:5 mg·L-1 A3组:10 mg·L-1 A4组:20 mg·L-1 A5组:40 mg·L-1 A6组:80 mg·L-1 A7组:5-Fu T1:24 h 87.91 ±1.58 82.13 ±6.11 71.05 ±5.40 56.48 ±5.98 38.17 ±7.80 20.06 ±4.09 83.25 ±5.90 T2:48 h 96.46 ±1.83 73.69 ±3.42 62.22 ±4.34 47.20 ±9.76 26.34 ±3.48 8.46 ±1.97 74.57 ±5.44 T3:72 h 99.40 ±0.71 56.28 ±8.00 41.36 ±1.84 33.60 ±6.54 15.36 ±3.56 4.41 ±1.05 50.31 ±3.36整体分析F,P (HF系数:0.6875)组间比较 272.812,0.000时点间比较 188.773,0.000组 × 时点 23.738,0.000组间比较t,P A1 vs A2 A1 vs A3 A1 vs A4 A1 vs A5 A1 vs A6—T1 2.128,0.066 6.741,0.000 11.40,0.000 13.94,0.000 34.81,0.000 —T2 13.203,0.000 16.470,0.000 11.16,0.000 40.21,0.000 73.58,0.000 —T3 11.923,0.000 66.005,0.000 22.20,0.000 51.40,0.000 167.87,0.000 —时点比较t,P A1 A2 A3 A4 A5 A6—T2 vs T1 11.073,0.000 3.760,0.020 3.085,0.037 1.948,0.123 4.028,0.016 8.508,0.001 —T3 vs T1 17.191,0.000 5.892,0.004 15.007,0.000 6.024,0.004 8.522,0.001 10.720,0.000—
3.3 Hochest33258染色观察细胞凋亡形态 药物作用48 h后,用Hochest33258染色。在荧光倒置显微镜下观察,阴性对照组细胞均匀呈现微弱荧光,荧光完整,细胞核较大,染色质分布均匀;用药组细胞出现细胞凋亡形态学特征,细胞核呈较强蓝色荧光,提示胞核固缩,大小不一,染色质凝聚。见图2。
3.4 细胞色素C含量测定 结果提示,药物作用A431细胞48 h后,细胞色素C表达随着药物作用剂量的增加而增加,与阴性对照组比较,差别非常明显,见表2。
3.5 比色法检测 Caspase-3、Caspase-9活力 结果提示,皮鳞癌1号方高、中、低剂量组与阴性对照组比较,Caspase-3、Caspase-9活力增加,且随着药物作用浓度增高,Caspase-3、Caspase-9活力增强,差别非常明显,见表3。
表2 ELISA法测皮鳞癌1号方作用A431细胞48 h后细胞色素C表达(±s,n=3)

表2 ELISA法测皮鳞癌1号方作用A431细胞48 h后细胞色素C表达(±s,n=3)
组别 剂量/mg·L-1 细胞色素C/nmol·L -1阴性对照组 —12.36 ±2.58 SSP低剂量组 5 49.62±26.41 SSP 中剂量组 10 58.76±5.28 SSP 高剂量组 20 135.18±26.19 5-Fu组10 27.04 ±5.80
表3 比色法测Caspase-3、Caspase-9活性(±s,n=3)
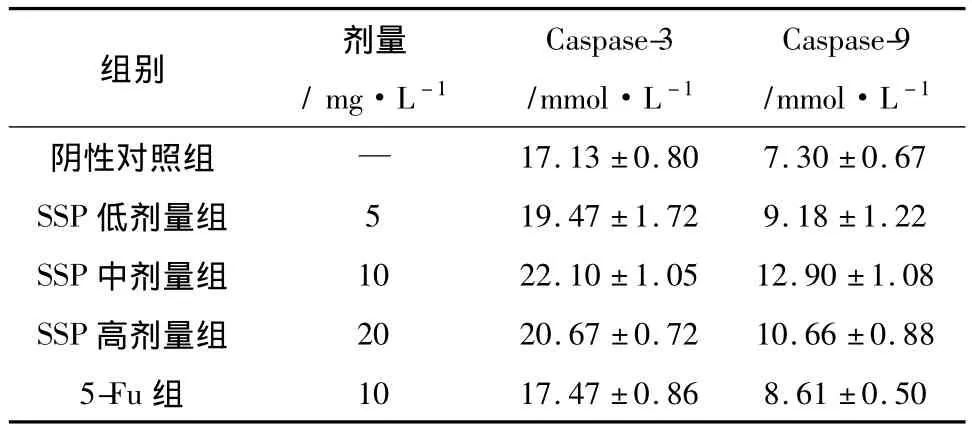
表3 比色法测Caspase-3、Caspase-9活性(±s,n=3)
组别 剂量/mg·L-1 Caspase-3/mmol·L-1 Caspase-9/mmol·L -1阴性对照组 —17.13 ±0.80 7.30 ±0.67 SSP 低剂量组 5 19.47 ±1.72 9.18 ±1.22 SSP 中剂量组 10 22.10 ±1.05 12.90 ±1.08 SSP 高剂量组 20 20.67 ±0.72 10.66 ±0.88 5-Fu组10 17.47 ±0.86 8.61 ±0.50
4 讨论
肿瘤是一种细胞周期性疾病,与细胞的无限增殖及增殖周期失控有关。手术、化疗和放疗是肿瘤治疗的三大主要手段。然而,各种治疗方法在一定程度上都有其局限性,而中药具有毒性低、不良反应小等优势。大量的临床实践研究表明,中药的多层次、多靶点、多环节的作用机制特点[1-2],在提高恶性肿瘤的临床疗效,逆转肿瘤的多药耐药性以及改善病人生活质量方面,发挥着越来越重要的作用[3]。
白头翁又名白头草,为毛茛科多年生草本植物。现代药理学研究发现白头翁具有抗肿瘤、抗炎、调节免疫功能的作用[4]。莪术的主要有效部位为根,挥发油是其主要活性成分。莪术油具有抗癌、抗氧化等作用[5]。
细胞凋亡是指在凋亡基因调控下细胞自主有序死亡的一种方式。细胞凋亡时发生的最显著的变化就是染色体固缩,DNA裂解使细胞核形态发生变化。Hochest33258荧光染料是一种无毒、水溶性的可以穿透细胞膜的蓝色荧光染料,在聚AT序列富集区域的小沟处与DNA结合。在凋亡细胞中,细胞膜对33258的摄取量增多,并且由于染色体高度浓缩,Hochest33258与之结合增强,染色呈强蓝色荧光,而正常细胞只呈微弱荧光,死细胞则不被染色,由此可检测出凋亡。细胞凋亡的机制非常复杂,机体内的细胞凋亡信号转导途径主要有线粒体凋亡通路和死亡受体凋亡通路[6],而线粒体通路是最常见的凋亡信号通路。Cytc是线粒体呼吸链中的一个基本成分,正常情况下,Cytc位于线粒体膜间隙,呈电稳定性结合于线粒体内膜,不能通过线粒体外膜。当在外界NO等因子的刺激下,线粒体发生聚集,Cytc便释放到胞浆中[7]。Cytc从线粒体释放到细胞浆是多种细胞凋亡的共同表现[8],是线粒体介导的细胞凋亡途径中不可或缺的重要因子,在凋亡过程中起着重要作用[9]。在细胞凋亡的发生机制中,天冬氨酸特异性半胱氨酸蛋白酶(Caspase)的激活是细胞凋亡过程中的关键元件,目前已知的几条凋亡信号传导通路均要依赖Caspase家族的级联反应[10]。它的激活与超常表达均引起细胞凋亡,因此又称死亡蛋白酶。Caspase分为三大类:凋亡启动因子、凋亡执行因子和炎症介导因子,组成了级联放大效应。位于级联反应上游区域的细胞凋亡起始因子包括 Caspase-2、Caspase-8、Caspase-9等,可识别和活化下游区域细胞凋亡执行因子Caspase-3等,诱导凋亡的发生[11]。Cytc从线粒体释放后,在dATP和或(ATP)的作用下,与胞浆中的凋亡蛋白酶激活因子(Apaf-1)形成多聚复合物,通过Apaf-1氨基末端的Caspase募集域募集胞质中的Caspase-9前体,Caspase-9剪切活化,进一步激活效应Caspase-7和Caspase-3,从而启动Caspase级联反应[12]。Caspase-3作为Caspase家族中最重要的凋亡执行者之一,在凋亡过程中扮演着重要的效应分子的角色[13],Caspase-3的激活标志着细胞凋亡进入了不可逆转的阶段[14]。
综上所述,笔者认为,皮鳞癌1号方能抑制A431细胞的生长,与其能促进Cytc的释放,活化Caspase-3和 Caspase-9,诱导 A431细胞发生凋亡有关。
[1]陈 曦,汪永忠,段贤春,等.中药有效成分防治糖尿病肾病的实验研究进展[J].安徽医药,2013,17(9):1461-1463.
[2]汤庆丰,季 青,周文超,等.中药抗肿瘤多药耐药机制的研究进展[J].中国医药指南,2013,11(35):336-338.
[3]赵 瑛.中药抗肿瘤药理作用研究进展[J].现代中西医结合志,2012,21(33):3752-3753.
[4]陈 静,朴钟云,刘显军,等.白头翁的生物学功能及应用现状[J].江苏农业科学,2011,39(3):4-6.
[5]孙宏岩,邵淑丽,李 爽,等.莪术油对胃癌细胞SGC-7901增殖和凋亡的影响[J].齐齐哈尔大学学报(自然科学版),2012,28(4):33-37.
[6]贺艳杰,李玉华,卢会芳,等.线粒体通路和死亡受体通路在中华眼镜蛇毒组分诱导KG1a细胞凋亡中的作用[J].中国药理学通报,2013,29(3):356-360.
[7]王 叨,席微波,李 白,等.线粒体膜通透性转换孔及细胞色素C在去铁胺诱导HL-60细胞凋亡中的作用[J].中华实用儿科临床杂志,2013,28(15):1159-1161.
[8]唐慧玲.线粒体介导的细胞凋亡的研究进展[J].安徽医药,2012,16(11):1696-1699.
[9]Niizuma K,Yoshioka H,Chen H,et al.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia[J].Biochim Biophys Acta,2010,1802(1):92-99.
[10]王进京,孙保存.乳腺癌中caspase-3和caspase-9的表达及其意义[J].临床与实验病理学杂志,2012,28(4):378-381,389.
[11]张建勇,董晓菊,孙万彬,等.细胞凋亡相关因子 Caspase-3、Caspase-9和增殖细胞核抗原在人肾透明细胞癌中的表达[J].河北医科大学学报,2009,30(9):878-882.
[12]Tang W,Wang W,Zhang Y,et al.Tumour necrosis factor-related apoptosis-inducing ligand(TRAIL)-induced chemokine release in both TRAIL-resistant and TRAIL-sensitive cells via nuclear factor kappa B[J].FEBS,2009,276(2):581-593.
[13]邹叶青,刘 哲,刘 川,等.异氟醚对过氧化氢诱导内皮细胞凋亡的保护作用[J].实用医学杂志,2013,29(13):2081-2083.
[14]Larsen BD,Rampalli S,Burns LE,et al.Caspase-3/Caspase-activated DNase promote cell differentiation by inducing DNA strand breaks[J].Proc Natl Acad Sci USA,2010,107(9):4230-4235.
