LC-MS/MS法测定人血浆中双氯芬酸浓度的不确定度评定
2015-12-13裘福荣王猛猛
过 林,裘福荣,王猛猛,贺 敏,蒋 健
(上海中医药大学附属曙光医院临床药理科,上海 201203)
双氯芬酸钠是芳基乙酸类非甾体类抗炎镇痛药,其作用机制为抑制环氧化酶活性,从而阻断花生四烯酸转化为前列腺素,具有较强的抗风湿、消炎、镇痛和退热作用,目前已广泛应用于临床。其特点是剂量小,起效快,不良反应少,且耐受性好,长期应用无蓄积作用。
文献中现有一些关于双氯芬酸体内的分析检测方法报道[1-5],判定测量结果的准确与否,主要是通过测量误差来表示。近些年,国家质量技术监督局和中国实验室国家认可委员会相继制定了《测量不确定度评定与表示》《化学分析中不确定度的评估指南》等技术规范,说明不确定度作为测量的重要评定方法,已经越来越受到重视。目前不确定度评价研究也越来越多[6-11],它能够更客观、准确的评价测定结果的质量。新药临床药动学和生物等效性研究需进行大量的生物样品检测工作,当使用这些分析结果作为决策依据时,结果的可靠性直接决定了新药的安全性及有效性,而该方面进行不确定度评价的研究相对较少[8-11],究其原因,主要是生物样本基质复杂,处理步骤繁多,结果变异的相关因素多,因此其不确定度评定较为困难。本文建立了液相色谱—串联质谱(LC-MS/MS)法测定人血浆中双氯芬酸钠浓度的方法,并对测定的不确定度进行了评定,为药动学研究中进行测量不确定度的评定提供参考依据。
1 仪器与试剂
4000 Q-trap型LC-MS/MS(美国Applied Biosystems公司),AB135-S型十万分之一分析天平(瑞士梅特勒公司);Allegra型高速离心机(Beckman公司),VX2E型振荡器(德国IKA公司)。双氯芬酸钠(批号100334-200302,纯度100%,中国药品生物制品检定所),内标4-羟基甲苯磺丁脲(批号0001407794,纯度100%,美国Sigma公司),乙腈(色谱纯,美国TEDIA公司),甲酸、醋酸铵(分析纯,中国国药集团化学试剂有限公司),超纯水为Milli-Q型纯水系统制备,健康人空白血浆(上海曙光医院I期病房提供)。
2 实验方法
2.1 分析条件 色谱条件:色谱柱选用Agilent C18(150 mm ×4.6 mm 5 μm),流动相由乙腈—水(含4 mmol乙酸铵,0.08% 甲酸)(75∶25,V/V),流速为0.8 mL·min-1,柱温 20℃,进样体积为 5 μL。
质谱条件:电喷雾离子源(ESI),气帘气(CUR)压力为20 psi,喷雾气(GS1)压力为55 psi,干燥气(GS2)压力为55 psi,源喷射电压(IS)为-4 000 V,离子源温度(TEM)为400℃。双氯芬酸及内标的扫描离子反应(MRM)分别为 293.6→249.9、284.9→185.9,碰撞能量(CE)分别为 -14.8、-23.8 V。
2.2 对照品工作液及内标溶液的配制 精确称取双氯芬酸钠对照品11.07 mg(相当于双氯芬酸10.27 mg),置于10 mL容量瓶中,加入乙腈定容,即得浓度为1.027 g·L-1双氯芬酸储备液。接着,用移液器(量程50 ~200 μL、200 ~1 000 μL)吸取乙腈稀释储备液,配制双氯芬酸系列工作液(L1~L8),过程见表1。
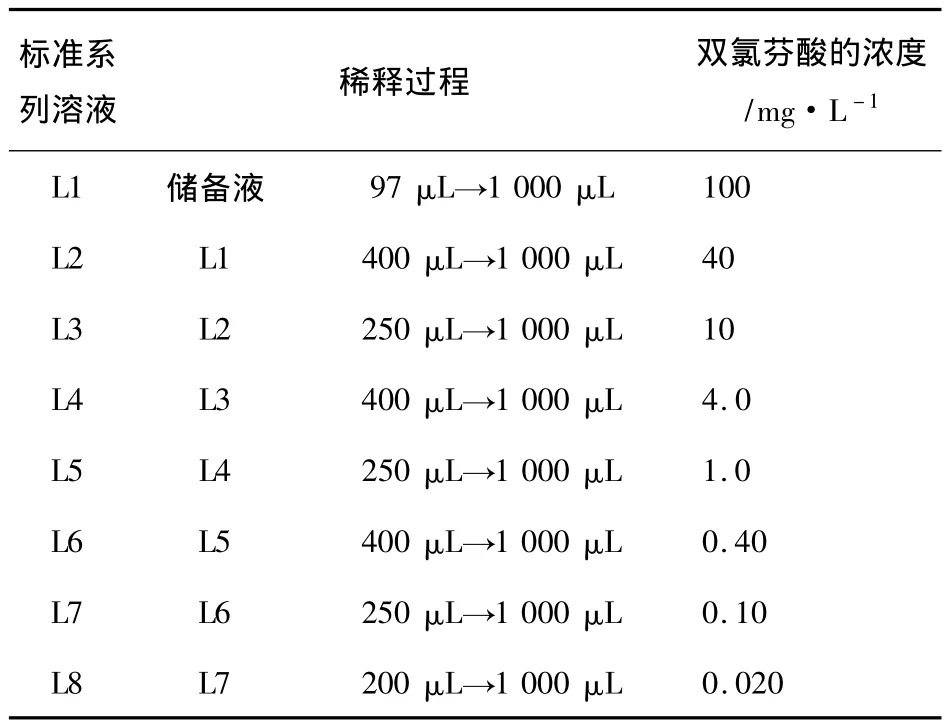
表1 双氯芬酸标准系列溶液的配制
精确称取4-羟基甲苯磺丁脲对照品2.10 mg,置于10 mL容量瓶中,加入乙腈定容,即得浓度为0.210 g·L-1的4-羟基甲苯磺丁脲储备液。再以乙腈稀释成浓度为4.2 μg·L-1的内标乙腈溶液。
2.3 含药标准血浆的配制 用移液器(量程2~20 μL)分别吸取5 μL系列浓度的双氯芬酸工作液(L2~L8)于1.5 mL EP离心管中,然后用移液器(量程 50 ~200 μL)分别加入人空白血浆 95 μL,涡旋30 s混匀,配制成双氯芬酸浓度分别为1.0、5.0、20.0、50.0、200、500 和 2 000 μg·L-1的标准曲线血浆样本。
按上述方法配制2.0、50.0 和1 600 μg·L-1的含药标准血浆,分别作为低、中、高(L、M、H)浓度质控样品,进行方法的精密度和回收率考察。
2.4 血浆样品处理方法 采用蛋白沉淀法处理血浆样品。用移液器(量程50~200 μL)吸取100 μL血浆样品,加入 300 μL(量程 200 ~1 000 μL)内标乙腈溶液,涡旋振荡3 min,经16 000 rpm离心5 min后,取上清液16 000 rpm再次离心5 min,吸取上清液进样。
2.5 数学模型及不确定度的来源分析 标准曲线:y=bC+a其中:C为双氯芬酸的浓度(μg·L-1);b为标准曲线的斜率;a为标准曲线的截距;y=As/Ai;As为双氯芬酸峰面积响应值;Ai为内标峰面积响应值。所以,数学模型为C=(y-a)/b+d1+d2+…公式中,d1、d2为对不确定度有贡献的影响因素,主要为:(1)双氯芬酸样品检测精密度;(2)双氯芬酸储备液和系列工作液的配制:包括天平称量、容量瓶允差和移液器允差等;(3)血浆样品的配制和提取;(4)回收率;(5)LC-MS/MS仪器测定;(6)标准曲线的拟合;(7)温度等。这些步骤中的每个因素都会对测定结果产生影响,因此都是引入的不确定度的来源。
3 结果
不确定度分量可分为A类和B类。A类不确定度是由统计确定的标准不确定度分量,B类不确定度是用非统计方法确定的标准不确定度分量。
3.1 A类不确定度评定 由重复测量(精密度)引入的不确定度ur(1)。配制低、中、高三浓度质量样品,每批每一浓度配制5份(n=5),共做3批,分别在3 d内进行LC-MS/MS测定,代入当天的标准曲线,计算样品的浓度,结果见表2。
计算合并样本偏差:
式中k为每组平行测定份数(n=5),j为组数(m=3),G 为组别(L,M,H)。经计算,Sp(C,L)=0.182 μg·L-1,Sp(C,M)=2.47 μg·L-1,Sp(C,H)=70.8 μg·L-1。以平均值计算标准偏差的公式为经计算0.0471 μg·L-1637 μg·L-1,Sp18.3 μg·L-1。
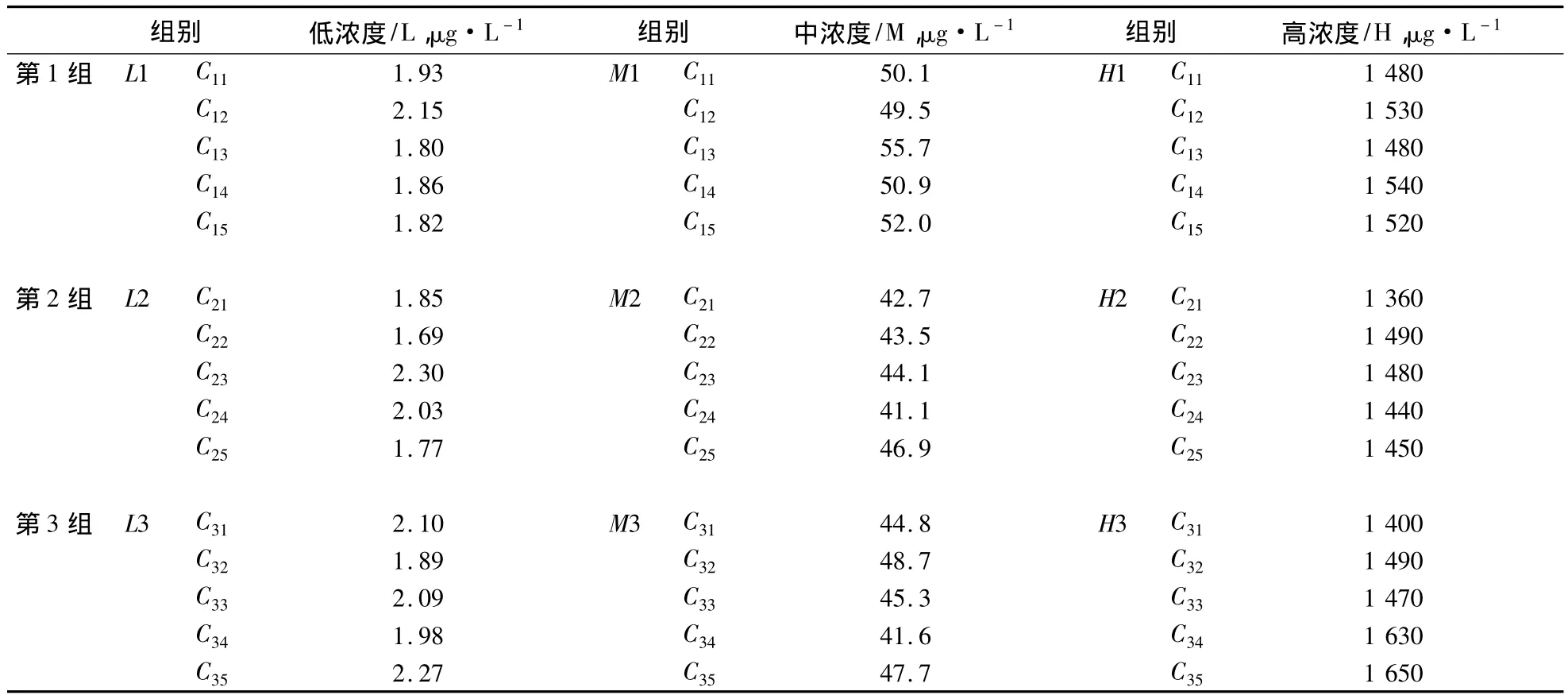
表2 双氯芬酸重复测定浓度数据
测量结果的相对标准不确定度为ur1,()G=经计算,u(1,L)=0.0239,u(1,M)rr=0.0136,ur(1,H)=0.0122。
3.2 B类不确定度评定
3.2.1 称量引入的不确定度,ur(2) 用十万分之一的电子天平分别称取双氯芬酸钠和内标。称量引入的标准不确定度u(2)u(Δ)为天平非线性误差引起的标准测量不确定度,u(Δ0)为天平调零引起的标准测量不确定度。依据计量检定证书,本实验所用电子天平的天平分度为e=0.01 mg。按均匀考虑,天平的标准测量不确定度为:u(Δ)==0.002 9 mg。
天平自动调零作为一次扣皮,其a0=a,则天平自动调零引起的误差为:u(Δ0)=0.0029 mg。不考虑重复性误差时,称量的标准不确定度为:u(2)mg。因此,称量双氯芬酸的相对标准不确定度为ur(2)=
3.2.2 标准溶液配制引入的不确定度,ur(3) 配制储备液所用容量瓶为10 mL容量瓶,其最大允许误差为±0.020 mL。实验室由空调控制,保持恒温恒湿,且供试品溶液和对照品溶液配制时环境条件相同,容量瓶等精密玻璃量器和溶剂的膨胀系数都相同,故可忽略由温度引起的相对不确定度。按均匀分布,容量瓶相对标准不确定度为:ur(x,p)=15,p为量程。
标准溶液配制用到的移液器均为Glison移液器,配制标准溶液时用到量程有:p1:200~1 000 μL,p2:50 ~200 μL,p3:2 ~20 μL;按厂商提供的技术参数,各移液器的允许误差分别为 ±8 μL,±1.6 μL ,±0.20 μL;由于温度对于移液管影响较小,忽略不计。按均匀分布,其相对标准不确定度为:
标准溶液配制过程中用到1次10 mL容量瓶、2次量程50 ~200 μL 的移液器(其中97 μL 1 次、200 μL 1次)、14次量程200~1000 μL的移液器(其中903 μL 1 次、800 μL 1 次、750 μL 3 次,600 μL 3次、400 μL3 次、250 μL3 次),其相对标准不确定度为:
3.2.3 配制含药血浆时引入的不确定度,ur(4)在EP管中加入人空白血浆95 μL和5 μL系列浓度的双氯芬酸工作液,混匀,不确定度主要由移液器引起。配制血浆标准液所用移液器量程有:50~200 μL,2 ~ 20 μL。由于温度对定容的影响非常小,忽略不计。因此,配制血浆溶液时的相对标准不确定度为:
3.2.4 血浆样品蛋白沉淀过程引入的不确定度,ur(5) 配制低、中和高浓度质控样品各5份,蛋白沉淀处理后进样,得到峰面积为B;按照相同方法配制低、中和高浓度的乙腈溶液样品各3份,进样后得到的峰面积为A,双氯芬酸的回收率=B/A ×100%。结果,低、中和高浓度质控样品平均回收率分别为(94.90 ± 6.34)%,(100.74 ± 6.01)%,(94.99±3.46)%。回收率的相对标准不确定度:u其中为回收率各组别的偏差为回收率各组别的均值。因此,
3.2.5 仪器量化引入的不确定度ur(6) 所用AB 4000 Q-trap型号的仪器,其定量的最大允差为3%,按均匀分布,其相对不确定度为:
3.2.6 线性回归过程引入的不确定度ur(7) 生物样本中药物测定时需要先建立标准曲线,然后用标准曲线计算得到未知样品的浓度,直线回归是最常用且最简单的一种,回归方程的建立对计算未知样品的浓度至关重要。制标准曲线血浆样本,以y=As/Ai计算不同浓度的y值(见表3),共拟和3条标准曲线方程,其平均斜率a=0.0434,截距b=0.0173。
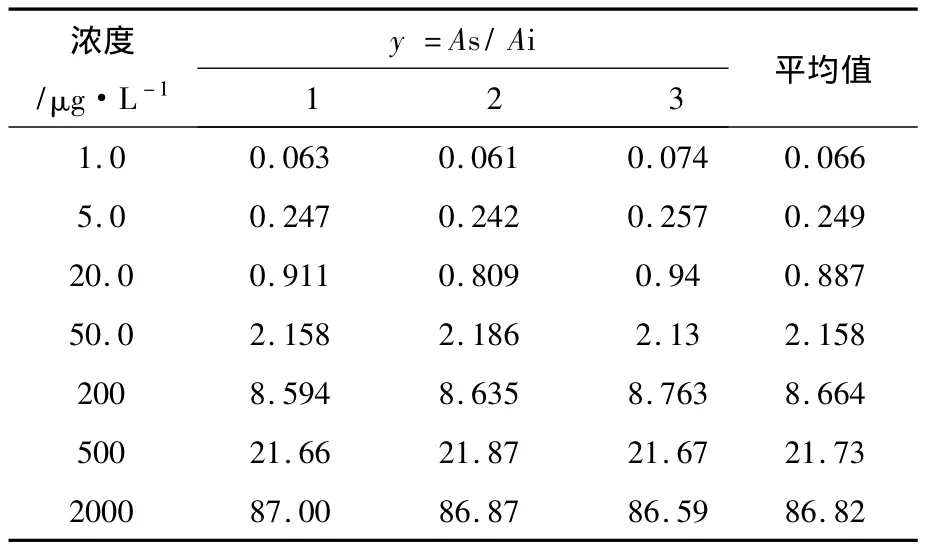
表3 双氯芬酸与内标峰面积比值(n=3)
剩余标准偏差为:
自相关方差:
公式中P测定质控样本的总次数(P=15);N测定标曲样本的总次数(N=i×j=7×3=21);i为标曲血浆样本的序数(i=7);j为标曲每个浓度血浆样本测定次数(j=3);每组标曲血浆样本浓度的平均值;Ci第i个标准血浆溶液的浓度;G为组别(L、M、H)。
其相对标准不确定度为:ur(7,G)=ur(C,G)
3.3 合成不确定度的评定 双氯芬酸浓度测定的相对标准不确定度为:
因此,uc,r,L=0.376,uc,r,M=0.039 7,uc,r,H=0.029 2。
低、中和高浓度的标准不确定度分别为:
3.4 扩展不确定度的评定 由于生物样品检测过程比较复杂,涉及不确定度分量较多,因此可估计为正态分布,包含因子取k=2,此时对应的置信概率为95%,双氯芬酸的浓度测定的扩展不确定度为:
人血浆中低、中和高浓度质控样品中双氯芬酸的浓度可分别表示为(1.97 ± 1.482)、(46.97 ±3.72)、(1494 ± 87.2)μg·L-1,k=2(95% 的置信区间)。
4 讨论
随着国内外分析检测手段的丰富,检测标准在不断提高,对分析结果的评定也越来越标准化、科学化,不确定度评定检测方法也越来越重要。中国合格评定认可委员会对检测实验室进行认可时,也要求开展测量不确定度的评定。由于生物样本基质复杂,样本浓度很低,检测过程繁琐,目前有关测定生物样本中药物浓度不确定度评定的文献相当有限,不确定度评定也并未如方法学验证那样具有公认和指导性的方法。本文以人血浆中双氯芬酸浓度测定为模板,建立相关不确定度分析方法。
本文按照实验的顺序逐步寻找人血浆中双氯芬酸浓度测定过程的不确定度的来源,重点考查了测量重复性(精密度)、称量对照品、配制标准溶液、配制标准血浆、回收率、仪器量化、线性回归等因素。在本方法不确定度评定中,由扩展不确定度可以看出,标准曲线的拟合过程对不确定影响的贡献最大,其次是回收率,尤其是对低浓度而言。究其原因,主要是由于在药代动力学研究中,生物样本待测物含量极低,标曲的最低浓度非常小,在本实验中最低浓度仅1 μg·L-1,因此相对误差被放大,操作过程中的任何微小误差都会造成很大的影响,并且标曲最低点溶液的配制经过多步稀释,误差经多次累积。在药代动力学研究中进行标曲拟合时,通常都使用了加权(W=1/x2)最小二乘法进行回归运算,注重了低浓度点的拟合的准确性,但曲线中高浓度点在剩余标准偏差评定时,对低浓度点的不确定度影响会很大。同时,本实验方法学考察的标曲是3个分析批的标曲,分3 d配制并测定,而部分文献[8-10]采用的方法是同一标曲连续进样3次来考察。因此,标准血浆配制、固相萃取、仪器响应波动等因素均会叠加影响不确定度,造成标曲拟合对不确定度的影响最大。
通过对LC-MS/MS法测定血浆中双氯芬酸浓度的测量不确定度评定,为合理改进分析方法,将检测误差降至最小提供了可靠依据。对于影响较大的因素,在测量过程中应加以关注,并且将这些不确定度分量较大的步骤细化,找出影响因素,提供解决办法。在日常工作中,对一些步骤可加以关注。例如配制溶液尽可能使用同一规格的量器、选用精密的量器和仪器、血浆前处理方法尽可能简单重现、标准曲线的线性拟合尤其要注意低浓度的样品等等。通过减小测量结果的不确定度,使测定结果更加准确可靠,为建立检测方法提供科学指导。在临床药代动力学研究中,如何结合自身特点,建立的评定方法如何全面准确的反映分析过程中的影响因素,客观评价不确定度的结果,建立公认和指导性的方法以及评判标准,都需要作进一步的探索。
[1]Victoria O,Marta IB,Bozo Z,et al.Simultaneous determination of diclofenac,its human metabolites and microbial nitration/nitrosation transformation products in wastewaters by liquid chromatography/quadrupole - linear ion trap mass spectrometry[J].J Chromatogr A,2014,1347:63 -71.
[2]彭向东,周 淦,周宏灏,等.双氯芬酸钠缓释片在健康人体的药代动力学和生物等效性[J].中国新药杂志,2011,20(20):2005-2009.
[3]张永刚,董 吉,缪丽燕.UPLC-MS/MS法测定人血浆中双氯芬酸钠及其代谢物的浓度[J].中国临床药理学杂志,2013,29(12):948-950.
[4]李冬艳,丁水平,陈小梅,等.超快速液相色谱-质谱联用法测定人血浆中双氯芬酸钠的浓度[J].中国医院药学杂志,2011,31(18):1507-1510.
[5]项苗苗,周 臻,丁存刚,等.双氯芬酸依泊胺凝胶在大鼠体内的药动学[J].中国医药工业杂志,2013,44(1):56 -59.
[6]杨锡祥,杨建林.盐酸吗啉胍含量测定不确定度评估[J].安徽医药,2013,17(10):1676 -1678.
[7]左登平.HPLC法测定盐酸林可霉素注射液含量的不确定度分析[J].安徽医药,2013,17(11):1871 -1873.
[8]吴国兰,徐起扬,申屠建中,等.LC-MS/MS法测定人血浆中培美曲塞浓度的不确定度评定[J].药物分析杂志,2013,33(4):678-683.
[9]严 蓓,杨 晨,李 扬,等.HPLC法测定人血浆中奥硝唑浓度的不确定度评定[J].药物分析杂志,2011,31(9):1797-1803.
[10]刘 一,杨 静,李 娜,等.液-质联用测定人血浆中己烯雌酚浓度的不确定度分析[J].中国医院药学杂志,2013,33(3):187-192.
[11]杨 静,丁莉坤,王 钊,等.液质联用法测定人血浆中来曲哇浓度的不确定度评定[J].中国药师,2012,15(12):1688 -1692.
