血浆DLC-1甲基化与肝细胞性肝癌患者临床特征和预后的关系*
2015-12-09茅国新
刘 艳,盖 领,茅国新
(南通大学附属医院肿瘤化疗科,江苏226001)
血浆DLC-1甲基化与肝细胞性肝癌患者临床特征和预后的关系*
刘 艳**,盖 领,茅国新
(南通大学附属医院肿瘤化疗科,江苏226001)
目的:研究肝细胞性肝癌患者血浆DLC-1甲基化状态,研究其与各临床相关因素的关系及对肝细胞性肝癌患者预后的意义。方法:采用甲基化特异性PCR法检测肝细胞性肝癌患者和健康人群血浆中提取DNA的DLC-1甲基化状态,结合临床特征(性别、年龄、肝硬化、AFP水平、HbsAg及临床分期),分析DLC-1甲基化状态与肝细胞性肝癌患者复发转移和预后的关系。结果:96例肝细胞性肝癌患者血浆中DLC-1甲基化阳性率为30.2%,对照健康组无甲基化,差异有统计学意义(P<0.05)。肝细胞性肝癌患者血浆DLC-1甲基化状况与性别、年龄、抗-HBV、肝硬化无相关性(P>0.05),与HBsAg、肿瘤大小、淋巴结转移及TNM分期相关(P<0.05)。DLC-1甲基化阳性组较阴性组转移复发率高,存活率较甲基化阴性组低。结论:DLC-1基因甲基化状态与肝细胞性肝癌发生发展及预后密切相关,对肝细胞性肝癌复发转移预测具有重要的价值,有望成为评估肝细胞性肝癌预后的有效指标。
甲基化;DLC-1;肝细胞性肝癌;预后
近年来,多项研究表明基因的异常甲基化与肝细胞性肝癌的发生、进展和预后存在紧密关联,可能对肝细胞性肝癌的诊断、治疗以及预后具有重要价值[5-6]。有研究表明DLC-1基因在肝细胞性肝癌、乳腺癌、结直肠癌中常低表达或缺失,DLC-1基因DNA启动子甲基化的改变通常是肿瘤抑制基因未被激活、蛋白未发挥其作用的重要机制[7]。DLC-1全称为肝癌缺失基因1,定位于人类染色体8p22,目前认为是一种肿瘤抑制基因,DLC-1 DNA启动子甲基化的改变通常是作为肿瘤抑制基因未被激活的重要机制[8-9]。本实验通过甲基化特异性PCR(MSP)技术检测分析DLC-1基因在肝细胞性肝癌患者血浆中甲基化状态,分析血浆甲基化状态与HCC复发转移和预后的关系。
1 资料与方法
1.1 临床资料 收集南通大学附属肿瘤医院2008年3月—2009年10月间接受肝细胞性肝癌手术患者96例外周血,术后组织标本均经过病理证实,所有病例均有完整的临床及随访资料,包括男75例,女性21例,抽血均在患者初入院时;96例健康体检者为健康对照组,男72例,女24例,2组人员均空腹抽取外周静脉血(抗凝),血液标本5mL,离心5~10分钟,取上层血浆,-80℃低温冰箱冻存或立即提取DNA。所有患者入组前均经知情同意,并签署知情同意书。
1.2 主要试剂 Takara(宝生物工程大连公司)DNA提取试剂盒;EZ DNA甲基化试剂盒(北京天漠公司);2XTag PCR MasterMix(北京天根公司);Marker(北京天根公司);美国Bio-rad琼脂糖。
1.3 MSP方法 从患者和健康体检者血浆中提取DNA,设计合成MSP引物,PCR反应体系:引物3μL,模板 3μL,10×PCR缓冲液 2.5μL,2.0mmol/L 4× dNTP混合物0.5μL,TaKaRaTM热启动Taq 0.5μL,25mmol/L MgCl22μL,甲基化扩增体系总体积为14.5μL。PCR反应过程:预变性95°C 12分钟,40个循环变性94°C 15秒,退火55°C 30秒,延伸72°C 40秒,延伸72°C 10分钟,甲基化扩增体系除了退火温度提高到56°C外其他均相同。判断标准:(1)甲基化特异性引物扩增出目的条带,非甲基化特异性引物无条带扩增出,判断为甲基化;(2)非甲基化特异性引物扩增出目的条带,甲基化引物无条带扩增出,判断为非甲基化;(3)2对引物均扩增出目的条带,这种情况称为半甲基化或部分甲基化,也判断为甲基化。
根据GenBank的甲基化引物由上海生工公司设计合成:

1.4 统计学处理 本组资料采用EpiData 3.02软件录入数据,SPSS 18.0统计软件进行分析,计量资料差异性比较采用t检验,计数资料采用χ2检验,生存分析采用Kaplan-Meier法,生存检验采用Log-rank检验,检验水准α=0.05。单因素和多因素COX回归分析计算比值比(OR)及其95%可信区间(CI)。
2 结 果
2.1 MSP检测HCC患者血浆DLC-1甲基化状态在肝细胞性肝癌患者DLC-1血浆甲基化率为30.2%(29/96),正常对照人群中均未有甲基化,差异有统计学意义(P<0.05)。DLC-1基因启动子甲基化与96例肝细胞性肝癌患者的临床特征关系见表1,肝细胞性肝癌患者血浆DLC-1基因甲基化状态与HBsAg是否阳性、肿瘤大小、淋巴结转移及TNM分期有关。在肝细胞性肝癌患者中,HBsAg阴性者DLC-1甲基化阳性率显著高于HBsAg阴性者(P= 0.024);肿瘤<6cm者DLC-1甲基化阳性率显著高于肿瘤>6cm者(P=0.01);淋巴结转移患者甲基化阳性率显著高于无淋巴结转移患者(P=0.041);晚期患者甲基化率显著高于早期患者(P=0.013),而与患者年龄、性别、抗-HBV状态、AFP水平及是否肝硬化间差异均无统计学意义(P>0.05)。
2.2 DLC-1甲基化状态与预后的关系 随访96例肝细胞性肝癌患者是否发生转移复发或死亡,部分患者未完全按照指定时间进行复查,直至病情严重时才得以确定复发或转移,故以发生复发和转移的具体时间为入院确诊当天。其中5例失访,截尾数据认为失访患者死亡。96例肝细胞性肝癌患者中位无进展生存期(PFS)为8.2月,总生存期为17.5月。
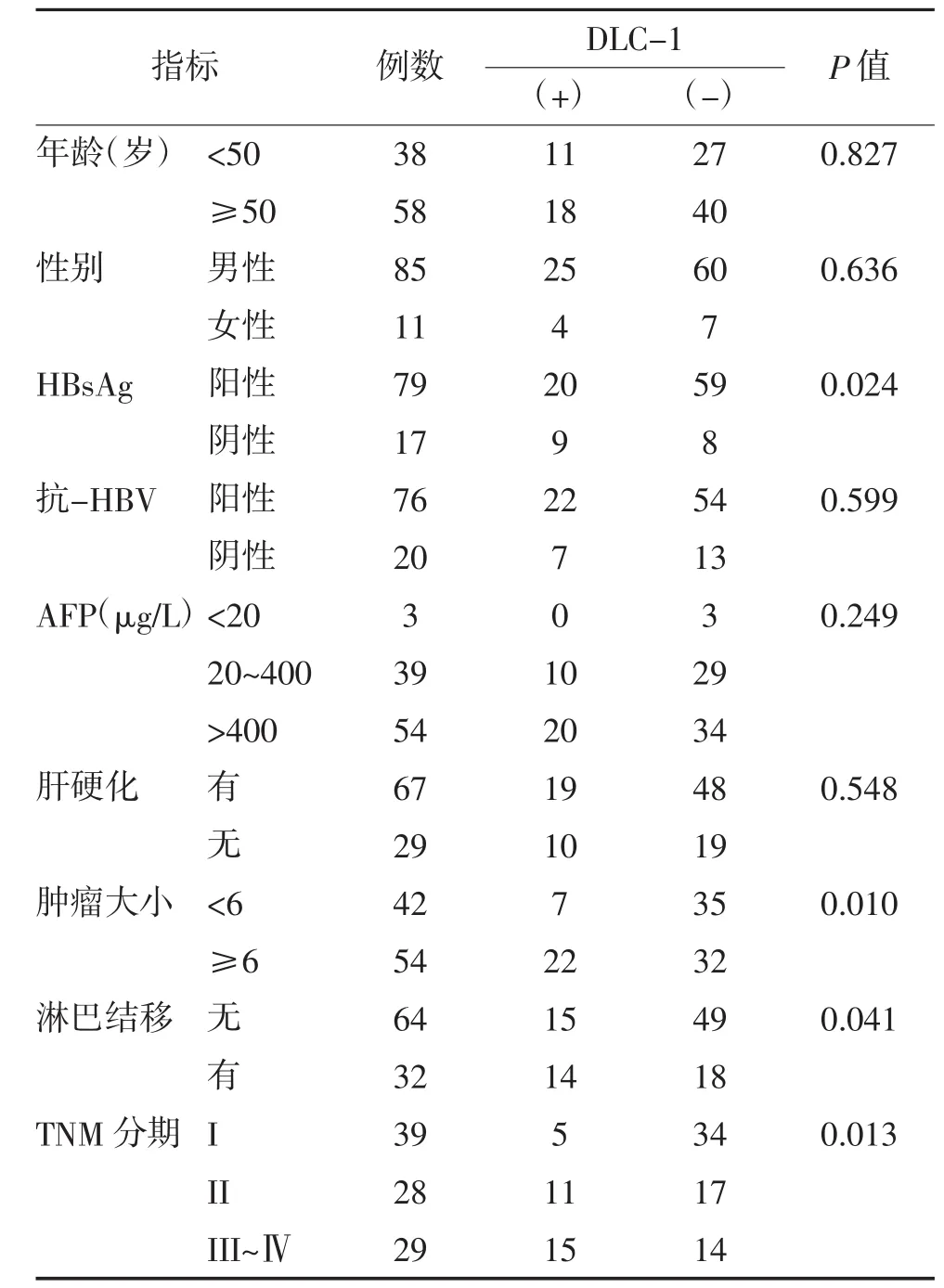
表1 甲基化状态与肝细胞性肝癌临床病理特征之间的关系
对96例肝细胞性肝癌患者随访12个月,DLC-1甲基化阳性患者死亡率为89.65%(26/29),DLC-1甲基化阴性患者,疾病进展率为26.87%(18/ 67),死亡率73.13%(49/67);DLC-1甲基化阳性患者与阴性患者PFS分别为5.1月和7.1月,OS分别为14.7月和25.8月,DLC-1甲基化阳性患者PFS、OS均短于阴性患者,差异有统计学意义(P<0.05)(图1、2)。
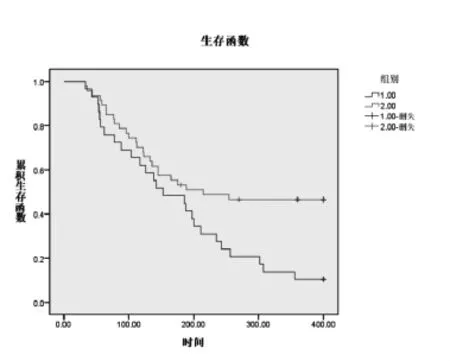
图1 DLC-1甲基化阳性与阴性肝细胞性肝癌患者PFS曲线图
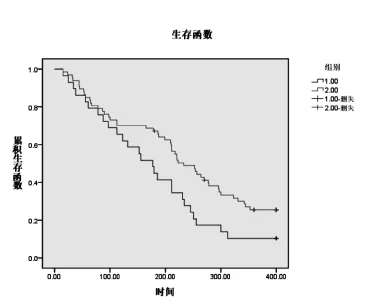
图2 DLC-1甲基化阳性与阴性肝细胞性肝癌患者OS曲线图
2.3 相关因素对肝细胞性肝癌患者预后影响的COX比例风险回归分析 将患者性别、年龄、肝硬化、AFP水平、临床分期、甲基化表达情况采用COX模型进行多因素回归分析,结果显示除肿瘤大小、TNM分期外(OR=2.366,OR=2.590),血浆DLC-1基因甲基化表达也是影响患者PFS及OS的独立因素,相对危险度分别为4.343(P<0.05),见表2。

表2 肝细胞性肝癌多因素生存分析结果
3 讨 论
恶性肿瘤的发生是一个多因素、多阶段的复杂过程,涉及多种基因的功能异常,基因表观遗传学改变在肿瘤发生、发展过程中起着重要作用。其中DNA甲基化是目前研究最广泛、也是最重要的表观遗传修饰形式之一。DNA甲基化是指将腺苷甲硫氨酸作为甲基供体,在DNA甲基转移酶的催化下,CpG二核苷酸中的胞嘧啶环上5′位置的氢被活性甲基所取代,从而转变成5-甲基胞嘧啶(5-mC)的生物过程。正常的甲基化对于维持机体的功能是必需
的,但通过对DNA甲基化模式的研究发现,多个基因异常的DNA甲基化状态存在于包括肝细胞性肝癌在内的多种肿瘤中,随着对肝细胞性肝癌的抑癌基因及其影响因素等研究的深入,DLC-1异常甲基化研究日益受到重视[10-11]。
DLC-1基因通过GTP酶活性抑制肿瘤的转移,抑制了一些癌基因的作用元件,从而在原发性肝癌中执行抑制癌细胞增殖的功能[12];DLC-1基因表达产物为RhoA和Cdc42特异性的GTP酶激活蛋白,主要通过下调Rho的活性而抑制肿瘤,与调控细胞增殖和粘附的信号传导通路关系密切[13],而DNA启动子甲基化的改变通常是肿瘤抑制基因未被激活的重要机制。
我们将包括年龄、性别、肝硬化、肿瘤大小等在内的临床参数资料与DLC-1甲基化进行了研究。与HbsAg相关性研究提示,DLC-1基因甲基化状态与HBV感染有着显著的关联性(P=0.024)。DLC-1基因甲基化在HBV感染的肝细胞性肝癌发生发展过程中可能的重要作用,其临床意义有待于进一步探讨。与临床分期研究结果发现肿瘤的大小、肿瘤淋巴结转移与肝细胞性肝癌甲基化显著相关,肿瘤越大,转移淋巴结数目越多,DLC-1甲基化越频繁(P<0.05)。此外,TNM分期与DLC-1甲基化也显著相关,TNM III~Ⅳ期患者中的甲基化频率显著高于TNM I~Ⅱ期患者,且甲基化状态呈现明显增加的趋势,提示抑癌基因DLC-1甲基化是肝细胞性肝癌发生的早期分子事件,随着肿瘤的进展表达增高(P= 0.013)。其它临床特征如肿瘤患者年龄、性别及肝硬化、AFP水平等临床特征与甲基化差异则无统计学意义。由于在本研究中的例数较少,未检测其肝硬化、AFP水平等临床参数与DLC-1甲基化表达的关系,有待进一步加大样本量研究。
本实验探讨了DLC-1基因甲基化与肝细胞性肝癌转移复发的关系,结果提示DLC-1甲基化与肝细胞性肝癌转移复发显著相关,DLC-1甲基化可能是预测肝细胞性肝癌复发转移的一个独立的新的危险因素,但由于标本量和人群种族的限制,今后还需要大规模多中心的研究加以证实。
[1]Wang Z,Zhang L,Shi X,et al.Association between two common polymorphisms and risk of hepatocellular carcinoma:evidence from an updated meta-analysis[Z].2014:468605.
[2]Cheng Y,Zhang C,Zhao J,et al.Correlation of CpG island methylator phenotype with poor prognosis in hepatocellular carcinoma[J].Exp Mol Pathol,2010,88(1):112-117.
[3]Hsu HS,Wen CK,Tang YA,et al.Promoter hypermethylation is the predominant mechanism in hMLH1 and hMSH2 deregulation and is a poor prognostic factor in nonsmoking lung cancer[J].Clin Cancer Res,2005,11(15):5410-5416.
[4]Li Z,Zhu WG.Targeting histone deacetylases for cancer therapy:from molecular mechanisms to clinical implications[J].Int J Biol Sci,2014,10(7):757-770.
[5]Yang M,Park Jy.DNA methylation in promoter region as biomarkers in prostate cancer[J].Methods Mol Biol,2012,863:67-109.
[6]Rodríguez-Paredes M,Esteller M.Cancer epigenetics reaches mainstream oncology[J].Nat Med,2011,17(3):330-339.
[7]Radpour R,Barekati Z,Kohler C,et al.Hypermethylation of tumor suppressor genes involved in critical regulatory pathways for developing a blood-based test in breast cancer[J]. PLoS One,2011,6(1):e16080.
[8]Yuan BZ,Zhou X,Durkin ME,et al.DLC-1 gene inhibits human breast cancer cell growth and in vivo tumorigenicity[J].Oncogene,2003,22(3):445-450.
[9]Paluszczak J,Baer-Dubowska W.Epigenetic diagnostics of cancer——the application of DNA methylation markers[J].J Appl Genet,2006,47(4):365-375.
[10]Yuan BZ,Durkin ME,Popescu NC.Promoter hypermethylation of DLC-1,a candidate tumor suppressor gene,in several common human cancers[J].Cancer Genet Cytogenet,2003,140(2):113-117.
[11]Levenson VV,Melnikov AA.DNA methylation as clinically useful biomarkers-light at the end of the tunnel[J].Pharmaceuticals(Basel),2012,5(1):94-113.
[12]Kim TY,Jong HS,Song SH,et al.Transcriptional silencing of the DLC-1 tumor suppressor gene by epigenetic mechanism in gastric cancer cells[J].Oncogene,2003,22(25):3943-3951.
Expression and clinical significance of DLC-1 DNA methylation in hepatocellular cancer
LIU Yan,GAI Ling,MAO Guoxin
(Department of Oncology,the Affiliated Hospital of Nantong University,Jiangsu 226001)
Objectives:To analyze the relationship between the promoter region DLC-1 DNA methylation status and the characteristics in hepatocellular cancer,and explore the role of DLC-1 DNA methylation in the occurrence and metastasis of hepatocellular cancer.Methods:96 cases of hepatocellular cancer specimens were selected,the methylation specific-PCR(MSP)was used to detect the tumor suppressor gene DLC-1 methylation in the above-mentioned tissues.To explore their roles of them in the occurrence and development of hepatocellular cancer,and the relationship associated with the clinical relevant factors.And to further analyze of the relationship between the promoter region of DLC-1 methylation status and the characteristics of methylation of the genome-wide in hepatocellular cancer.Disscussion the relationship between the methylation status with clinicopathologic factors(sex,age,AFP,differentiation degree,clinical stage,)and progression-free survival(PFS)as well as overall survival(OS)was analyzed.Results:The methylation status of DLC-1 in plasma of hepatocellular cancer patients was 30.1%.There were no correlations among the DLC-1 methylation status in hepatocellular cancer plasma and the patient's sex,age,cirrhosis and anti-HBV(P>0.05),but it was correlated with degrees of differentiation TNM staging.Multivariate analysis indicated that besides the tumor size,the methylation status is also an independent risk factor influencing recurrence,also independently correlated with TTP and OS in hepatic patients. Conclusions:DLC-1 methylation shows great importance in the field of judging the prognosis.Tumor suppressor gene DLC-1 methylation is an early molecular index of hepatocellular cancer.
methylation;DLC-1;hepatocellular carcinoma;prognosis
R735.7
A
江苏省卫生厅资助项目(H200957)。
2015-09-19
1006-2440(2015)05-0443-04
**[作者简介]刘艳,女,汉族,江苏盐城人,生于1985年12月,硕士研究生。研究方向:恶性肿瘤化学治疗。 通信作者:茅国新,E-mail:MAOGX33@163.com
肝细胞性肝癌(hepatocellular carcinoma,HCC)是最常见的肝脏恶性肿瘤,占全球肿瘤发生率的第五位[1],其发生发展涉及染色体畸变、基因突变、表观遗传学改变、生长因子异常分泌和多种信号通路异常激活。表观遗传修饰主要包括DNA以及一些与DNA密切相关的蛋白质的化学修饰,如DNA甲基化、组蛋白修饰、染色质重塑以及非编码RNA等,其中DNA甲基化(methylation)是目前研究最广泛、也
是最重要的表观遗传修饰形式之一[2-4]。
