嗜酸性氧化硫硫杆菌的分离鉴定及其产酸特性
2015-12-07杨期勇邱秀文程鹏飞李也韩金凤蒋晟单瑶瑶孙超
杨期勇,邱秀文,程鹏飞,李也,韩金凤,蒋晟,单瑶瑶,孙超
1. 九江学院鄱阳湖生态经济研究中心,江西 九江 332005;2. 九江学院化学与环境工程学院,江西 九江 332005
嗜酸性氧化硫硫杆菌的分离鉴定及其产酸特性
杨期勇1*,邱秀文1,程鹏飞1,李也1,韩金凤2,蒋晟2,单瑶瑶2,孙超2
1. 九江学院鄱阳湖生态经济研究中心,江西 九江 332005;2. 九江学院化学与环境工程学院,江西 九江 332005
嗜酸性氧化硫硫杆菌是生物淋滤技术去除污泥中重金属的主要菌种,其生物氧化产酸反应是生物淋滤的关键步骤。为筛选、培育出高效的嗜酸性氧化硫硫杆菌。通过研究氧化硫硫杆菌的产酸特性,找出提高其产酸效果的方法,筛选、培育出高效的嗜酸性氧化硫硫杆菌。本研究从某污水处理厂活性污泥中分离、纯化得到一株高效氧化单质硫的菌株JJU-1,通过菌株和菌落形态观察、生理生化试验、16S rDNA序列分析和同源性比较等分析方法,鉴定该菌株为嗜酸性氧化硫硫杆菌(Acidithiobacillus thiooxidan),并从初始pH值、硫粉投加量、单质硫粒度、吐温60浓度等4个方面对JJU-1菌株的产酸特性进行了研究。实验结果表明:培养液初始pH值对后期产酸性能影响较小,当培养到第7天时,各培养液的pH值基本处于同一水平,但初始pH值小于1时,菌株的生长受到抑制;硫粉投加量越大,菌株产酸效率越高,当培养到第8天时,不同硫粉投加量的培养液pH值最大差值达到0.54;菌株产酸速率随单质硫粒度的减小而增大,粒径小于180 μm的硫粉比大于180 μm的硫粉产酸速率快;吐温60的投加对氧化硫硫杆菌产酸有一定的影响,当吐温60的浓度为0.4~1.6 g·L-1时,对氧化硫硫杆菌产酸有一定的促进作用,但当吐温60的浓度大于2.0 g·L-1时,培养8 d后氧化硫硫杆菌的生长受到一定的抑制;微滤膜实验表明JJU-1菌株与单质硫表面的直接接触是发生产酸反应的先决条件。在最佳生长条件(初始pH=2.5~3.5、θ=28~32 ℃)下,JJU-1菌株培养5 d后,培养液pH值从3.5降到1.5左右,由此可见,该菌株具有良好的氧化单质硫产酸性能,在污泥生物淋滤技术中具有一定的应用前景。
氧化硫硫杆菌;分离鉴定;16S rDNA;产酸特性
城镇污水处理厂污泥的处置已成为一个重要的环境问题,因此,寻找一条有效处理和利用污泥的技术具有重要的现实意义。污泥中含有大量的重金属污染物,这是阻碍污泥资源化利用的重要因素之一。生物淋滤技术可以显著的改善污泥脱水性能、去除重金属、消除病原菌,并为其后续资源化利用创造良好条件,是一种极具工程应用价值的污泥处理新技术(周立祥,2012)。生物淋滤主要是利用嗜酸性硫杆菌的生物氧化产酸作用,形成强酸环境将污泥中难溶性重金属从固相中溶出进入液相,再通过固液分离加以去除(Gorkem等,2011)。目前,以氧化硫硫杆菌(Acidithiobacillus thiooxidan)为主要菌株、单质硫为能源底物的生物淋滤技术被认为是实现污泥重金属去除最为快捷的途径之一(Löser et al.,2006;Chen et al.,2011)。
氧化硫硫杆菌是存在富硫环境中的一种嗜酸性菌,以其快速氧化单质硫和还原态的硫化物逐渐为人们所熟知。1921年Waksman et al.(1921)首次分离出能够产酸的氧化硫硫杆菌,后来Suzuki et al.(1965;1992)研究了氧化硫硫杆菌氧化元素硫的生物酶和氧化机理。氧化硫硫杆菌最早用于微生物浸矿,主要是由于其氧化产酸特性及可以消除矿石表面阻止其溶解的硫磺层。Travisany et al.(2014)从铜矿中筛选到一株氧化硫硫杆菌,并对其进行了基因组序列测定,目前已成功应用于工业化生物浸矿。龚文琪等(2007)从煤矿的酸性矿坑水中分离出能有效浸出低品位磷矿的氧化硫硫杆菌菌株,初步试验浸磷率可达到48.41%。张建民等(2010)研究了氧化硫硫杆菌的脱硫作用,对S2-氧化成单质硫的控制条件进行优化、评价了脱硫性能。Yin et al.(2014)从煤矿堆坑废水中分离出一株A01氧化硫硫杆菌,经测序后发现该菌株含有氧化元素硫和无机硫化物的特殊基因。随着含重金属污泥的处理处置越来越严格,氧化硫硫杆菌在重金属污泥生物淋滤领域的应用研究逐渐增多。目前有研究者直接从污泥中分离出可用于污泥重金属生物淋滤的氧化硫硫杆菌,并探讨了其用于重金属污泥的生物淋滤效果(周顺桂等,2003;方迪等,2009;温烨明等,2009)。由于嗜酸性氧化硫硫杆菌具有硫氧化酶和亚硫酸盐氧化酶系统,硫杆菌的生物氧化产酸反应是重金属污泥生物淋滤的主要限速步骤之一。曹亚彬等(2011)研究了金属离子对氧化硫硫杆菌TT03的生长及产酸的影响。龚文琪等(2008)研究了吐温类表面活性剂对嗜酸性氧化硫硫杆菌浸磷的影响,吐温类表面活性剂促进细菌与矿物的作用,提高了浸磷率。由于天然菌株的产酸能力有限,彭会清等(2009)采用微波和紫外线诱导育种的方法使嗜酸氧化硫硫杆菌的产酸能力得到进一步提高。
本研究从某学校生活污水处理厂浓缩污泥中筛选、分离出一株氧化硫硫杆菌,对其进行了理化特性、分子学鉴定,并通过对该菌株产酸特性的研究,找出提高其产酸效果的方法,为进一步应用于重金属污泥的生物淋滤提供基础数据和工艺参考。
1 材料与方法
1.1 菌种筛选供试污泥
本实验供试污泥为某学校第二污水处理厂浓缩污泥,该污水处理厂采用SBR工艺,污水来源主要为学校生活污水,每日处理水量为2000 t。浓缩污泥取回后保存在4 ℃的冰箱中备用。
1.2 实验仪器
SKY-2102型恒温培养振荡器(上海苏坤实业有限公司)、ORP-431型氧化还原电位测定仪(上海康仪仪器有限公司)、YXQ-LS-70A型立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)、V-1100D型分光光度计(上海美谱达仪器有限公司)、2720 thermal cycler型 PCR仪(Applied Biosystems)、 3730XL 型 测 序 仪 ( Applied Biosystems)、DYY-5型电泳仪(北京六一仪器厂)、FR980凝胶成像仪(上海复日科技仪器有限公司)、CX-31型显微镜(Olympus)、Quanta 200环境电子扫描电镜(FEI公司,荷兰)。
1.3 培养基类别与配制
1.3.1 Waksman液体培养基的配制
称取(NH4)2SO4:0.20 g,K2HPO4·3H2O:3.93 g,MgSO4·7H2O:0.50 g ,CaCl2:0.19 g,溶于1000 mL蒸馏水,用5 mol·L-1H2SO4调节pH为3.5~4.0,将各瓶培养基分装到5个250 mL锥形瓶中,每个锥形瓶加入单质硫 1 g,用无菌透气封口膜密封包扎好后在105 ℃下蒸汽灭菌30 min。
1.3.2 Waksman固体培养基的配制
A液:称取(NH4)2SO4:2.0 g,KCl:0.1 g,K2HPO4·3H2O:0.33 g,MgSO4·7H2O:0.25 g,Ca(NO3)2·4H2O:0.01 g,溶于500 mL蒸馏水,用5 mol·L-1H2SO4调PH为3.0~3.5,并分装于2个500 mL锥形瓶。
B液:称取22.1 g Na2S2O3·5H2O溶于200 mL无菌水,并分装于2个500 mL锥形瓶。
C液:分别称取10 g琼脂条溶于2个装有150 mL蒸馏水的250 mL锥形瓶中,加热溶解,然后用无菌透气封口膜密封包扎好。
灭菌:A、C液分别在 121 ℃下蒸汽灭菌 20 min,B液用022 μm的针筒式过滤器过滤灭菌。
灭菌后冷却至65 ℃,将A、B、C液中混合,迅速倒平板,每个平板约15~20 mL混合后的培养基液,制成单层平板。
1.4 菌株分离与纯化
用移液管吸取10 mL生物酸化污泥于装有90 mL Waksman液体培养基的锥形瓶中,在28 ℃、180 r·min-1的恒温培养振荡器中培养,每天测定pH的变化,至pH下降至2.0以下。再用已经灭菌的移液管吸取已酸化的培养基液5 mL于95 mL新配无菌Waksman液体培养基中培养,按上述条件富集培养直至pH降至2.0以下,重复以上操作2~3次。经3~4次分选富集后采用Waksman固体培养基稀释涂布平板法分离、纯化菌种,获得纯培养菌株。当固体培养基上陆续出现直径为 1 mm左右的圆形、边缘整齐、中间微凸的淡黄色菌落时,挑取单菌落于 Waksman液体培养基中于 28 ℃摇床中培养,待其pH降到1.0~2.0时,再同以上10倍稀释法步骤在固体培养基上再次进行分离培养,经过多次反复纯化,分离出菌株,命名为JJU-1(GenBank登录号:KM101109)。
1.5 菌株菌落形态观察
将菌株菌落置于生物显微镜下,观察其菌落形态;将处于对数生长期的细菌进行革兰氏染色,并用显微镜观察;挑取单菌落于Waksman液体培养基中,细菌经过预处理、喷金后,用扫描电镜观察。
1.6 菌株理化特性实验
1.6.1 最适生长条件
接种相同量的菌液到Waksman培养基,保持其他条件不变,调节初始温度(pH值设定为3.0)和初始pH值(培养温度设定为28 ℃)进行培养。7d后观察细菌量,以光密度OD600值(600 nm处的吸光度值)表征,OD600越大,细菌量越大。根据实验数据作曲线图,确定最适生长条件。每次实验做3个平行样(n=3)。
1.6.2 生长曲线
将菌液(10 mL)接种到Waksman液体培养基中,每天测定其OD600值、pH值和ORP值(氧化还原电位值),绘制氧化硫硫杆菌的生长曲线。每次实验做3个平行样(n=3)。
1.6.3 能源利用
试验以Waksman液体培养基为基础培养基(不含单质硫、初始pH值3.0),添加以下一种物质作为能源:Na2S2O3(10 g·L-1)、单质硫S0(10 g·L-1)、FeSO4(44.7 g·L-1)、蛋白胨(1 g·L-1)和葡萄糖(1 g·L-1),通过接种等量(10 mL)的菌液培养8~12 d,测定OD600值和ORP值。每次实验做3个平行样(n=3)
1.6.4 氮源利用
以Waksman液体培养基为基本培养基(含单质硫、初始pH值3.0),将其中的氮源(NH4)2SO4替换为其它的无机氮(w=0.1%)和有机氮(w=0.5%)。接种等量(10 mL)的菌液培养7 d,测定OD600值和pH值。每次实验做3个平行样(n=3)
1.7 菌株16S rDNA测序
采用Ezup柱式细菌基因组DNA抽提试剂盒SK8255(生工生物工程股份有限公司,上海)提取菌株JJU-1的DNA。然后,进行)PCR扩增,其操作条件如下:正向引物(F27)为:5’-AGTTTGATCMTGGCTCAG-3’,反向引物(R1492)为:5’-GGTTACCTTGTTACGACTT-3’;反应体系:反应总体积25 μL,其中,Template(基因组DNA 20~50 ng·μL-1)0.5 μL,10×Buffer 2.5 μL,dNTP(各2.5 mM)1 μL,酶0.2 μL,F27(10 uM)0.5 μL,R1492(10 uM)0.5 μL,加双蒸H2O至25 μL;循环条件:预变性94 ℃ 4 min,循环(共30次)94 ℃ 45 sec、55 ℃ 45 sec、72 ℃ 1 min,修复延伸72 ℃ 10 min,终止反应4 ℃。对PCR 扩增产物使用胶回收试剂盒进行纯化,测序由生工生物工程(上海)有限公司完成。
1.8 菌株产酸特性实验
1.8.1 初始pH值对菌株产酸特性的影响
在 15个 500 mL锥形瓶中各加入 350 mL Waksman液体培养基和3 g升华硫(粒径<75 μm),将pH值分别调整到1、2、3、4、5,每个pH值做3个平行样。灭菌、冷却后加入10 mL菌悬液,恒温摇床培养(180 r·min-1、28 ℃)。每天测定pH值,对照实验不加菌悬液。
1.8.2 单质硫投加量对菌株产酸特性的影响
在 15个 500 mL锥形瓶中各加入 350 mL Waksman液体培养基,将pH值分别调整到3.0左右,加入升华硫(粒径<75 μm)使其浓度分别为0、1.5、3、9、15 g·L-1,每个投加量做3个平行实验。灭菌、冷却后加入10 mL菌悬液,恒温摇床培养(180 r·min-1、28 ℃)。每天测定pH值,对照实验不加菌悬液。
1.8.3 单质硫粒度对菌株产酸特性的影响
在 12个 500 mL锥形瓶中各加入 350 mL Waksman液体培养基,将 pH值分别调整到 3.0左右,分别加入3 g不同粒度范围的单质硫(20~50目:粒径270~830 μm、50~80目:粒径180~270 μm、80~140目:粒径109~180 μm、大于200目:粒径<75 μm),每个粒度做3个平行实验。灭菌、冷却后加入 10 mL菌悬液,恒温摇床培养(180 r·min-1、28 ℃)。每天测定pH值,对照实验不加菌悬液。
1.8.4 表面活性剂对菌株产酸特性的影响
在 18个 500 mL锥形瓶中各加入 350 mL Waksman液体培养基,将pH值分别调整到3.0左右,加入吐温60使其浓度分别为0、0.4、0.8、1.2、1.6、2 g·L-1,每个浓度做3个平行实验。灭菌、冷却后加入10 mL菌悬液,恒温摇床培养(180 r·min-1、28 ℃),每天测定pH值。
2 结果与分析
2.1 菌落形态特征
将分离纯化的菌株在 Waksman液体培养基中培养。随着菌株培养的进行,培养基液体表面漂浮的硫粉逐渐分散成细小颗粒,最后沉入瓶底;培养基逐渐变浑浊,培养基的pH快速降低(约5 d后pH值由初始的4.0降到1.4左右)。菌株在Waksman固体培养基28 ℃培养9 d后,出现白色的较小菌落,边缘整齐,中间微凸,随着培养时间的延长,菌落变大,在白色中呈现出淡淡的黄色(如图1)。细菌革兰氏染色,显微镜下观察为红色,表明为革兰氏阴性菌。扫描电镜观察菌体为短杆状,长1~3 μm、宽0.5 μm左右(如图2)。菌株JJU-1的菌落形态特征与吕早生等(2011)报道的氧化硫硫杆菌菌落特征相似。
2.2 菌株生理生化特征
2.2.1 最适生长条件
分离纯化的菌株JJU-1在不同温度和不同初始pH值条件下的生长情况如图3和4所示。从图4中可看出,该菌株培养7 d后,温度在28~32 ℃之间时,培养液的光密度OD600值最大,为菌株最适生长温度,与黄峰源等(2006)报道的一致;当温度低于20 ℃、超过35 ℃时菌株生长逐步变缓慢。该菌株在pH值1.0~7.0范围内都能生长,最适pH值为2.5~3.5,与吕早生等(2011)报道的最适生长pH值为1.5~3.5相近。
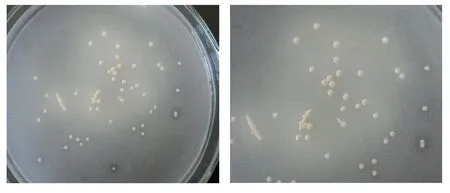
图1 菌株JJU-1的菌落形态Fig. 1 Colony of strain JJU-1
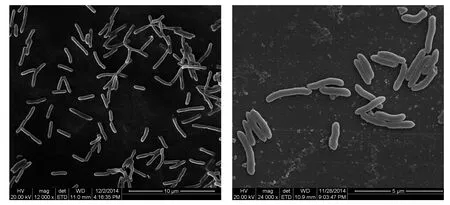
图2 菌株JJU-1的扫描电镜图Fig. 2 SEM image of strain JJU-1
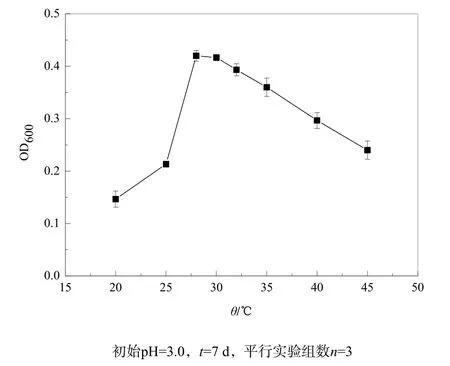
图3 温度对菌株JJU-1生长的影响Fig. 3 Effect of temperature on growth of strain JJU-1 (primary pH=3.0, t=7 d)
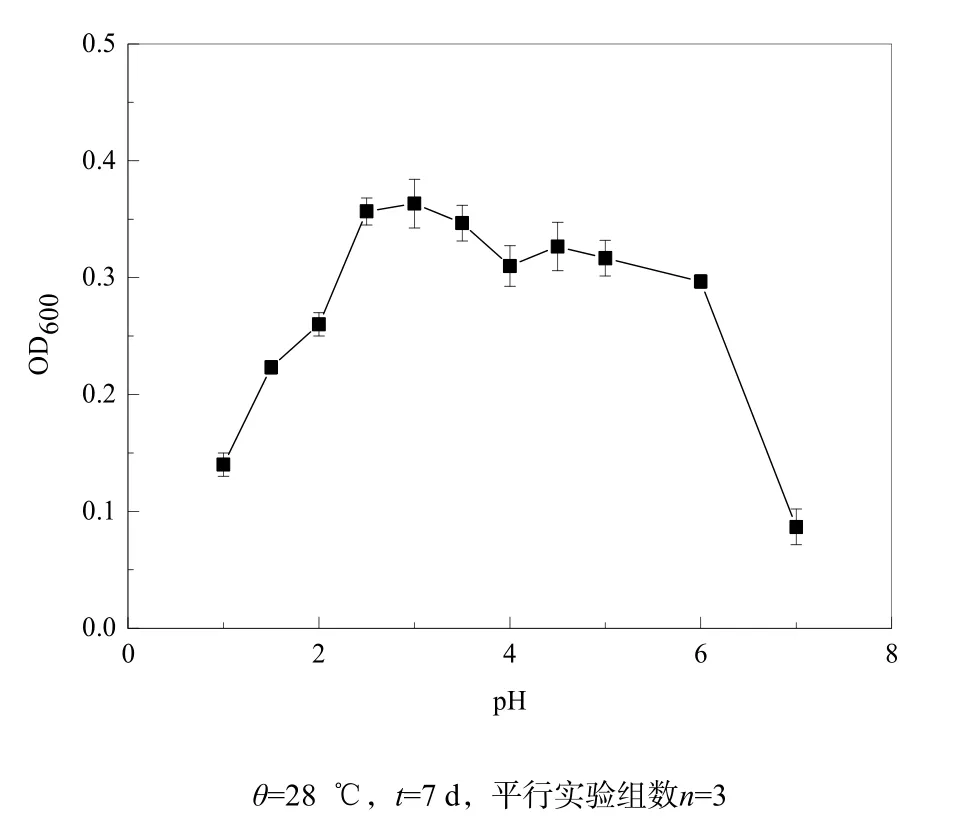
图4 初始pH值对菌株JJU-1生长的影响Fig. 4 Effect of primary pH on growth of strain JJU-1 (θ=28 ℃, t=7 d)
2.2.2 生长曲线
按5%的接种量接种菌株JJU-1于Waksman液体培养基中。从图5中看出,在培养过程中培养液的ORP值先升高,在第5天达到一个峰值456 mv,随后又逐渐下降;同时由于细菌的繁殖,细菌的数量剧烈增长,吸光值由开始的接近零升高到第8天的1.25;相应地,培养液的pH值下降迅速,第6天pH值下降到1.0左右,经8 d的培养从开始的3.45降到0.7左右,而王永东等(2007)报道氧化硫硫杆菌培养了17 d pH值从3.3下降到1.0左右,表明菌株JJU-1产酸能力强于王永东分离的氧化硫硫杆菌。
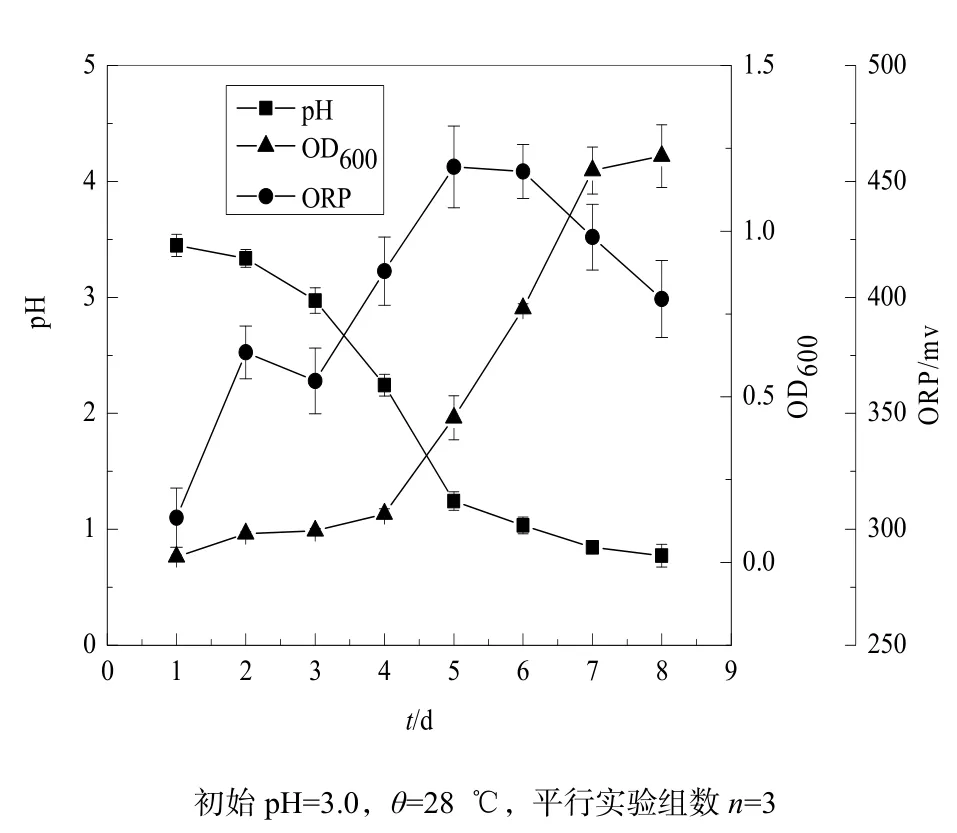
图5 菌株JJU-1的生长曲线Fig. 5 Growth curves of strain JJU-1 (primary pH=3.0, θ=28 ℃)
2.2.3 能源利用特征
图6为菌株 JJU-1在不同能源培养基上的生长情况。从图中可以看出,以单质硫为能源时,培养基的OD600值迅速增大,从起始的0.007增加到第10天的0.993,表明菌株生长良好;以硫代硫酸钠为能源时,前8 d OD600值变化很小,到第10天OD600值变化较大,增加到0.28,表明菌株在以硫代硫酸钠为能源的培养基上生长有一个较长的滞后期,然后才进入快速生长的对数生长期,王永东等(2007)认为在使用硫代硫酸钠做能源时,氧化硫硫杆菌生长的初期,会发生缓慢的歧化反应,有一个迟缓期。而以葡萄糖、蛋白胨、硫酸亚铁为能源时,OD600值几乎不变化,表明该菌株不能利用这3种物质作为能源。由于氧化硫硫杆菌和氧化亚铁硫杆菌在许多生理特性上非常相似,在分离纯化时比较难鉴别。本实验条件下,该菌株不能利用亚铁作为能源,而氧化亚铁硫杆菌能够在亚铁培养基上生长,因此,可以判定该菌株不是氧化亚铁硫杆菌。

图6 菌株JJU-1在不同能源培养基中的OD600值变化Fig. 6 Variation of OD600when strain JJU-1 growing in different medium as energy sources
2.2.4 氮源利用特征
分别用碳酸铵、硝酸钾、蛋白胨代替Waksman培养基中的硫酸铵,并投加单质硫作能源,将菌株接种到培养基中培养8 d,其生长情况见图7。由图可知,无机氮培养基pH值快速降低,培养液OD600值快速增长,菌株生长良好,表明该菌株能利用无机氮作为氮源生长。而该菌株在有机氮培养基中的生长缓慢,OD600值从开始的0.009增加到第8天的 0.071,pH值先略微升高,然后缓慢降低。因此,该菌株可以很好地利用无机氮作为生长氮源,但利用有机氮作为氮源生长时出现滞后期,生长缓慢。

图7 菌株JJU-1在不同氮源培养基中的生长及pH变化Fig. 7 Variation of OD600and pH when strain JJU-1 growing in different nitrogen sources
因此,该菌株特征、菌落形态、生物学特性与布坎南等(1984)描述的硫杆菌属氧化硫硫杆菌基本一致,初步判断该菌株为氧化硫硫杆菌。下面将进一步对其进行分子学鉴定。
2.3 菌株JJU-1的16S rDNA测序分析和同源性比较
菌株JJU-1的PCR产物经1%琼脂糖凝胶电泳检测,扩增产物是一条特异性条带,其大小约1500 bp。将菌株JJU-1 16S rDNA的PCR反应产物连接T载体进行测序,测得序列长度为1422 bp,把测得的16S rDNA序列提交到GenBank,获得该菌株的基因序列登录号为KM101109。在NCBI核酸数据库中进行BLAST比对,JJU-1菌株与Gene Bank中硫杆菌的16S rDNA序列相似性均达到99%。采用MEGA 4软件对JJU-1菌株的测序结果进行系统发育分析,结果如图8所示,从系统发育树可以看出,菌株JJU-1与Acidithiobacillus thiooxidans BAD2的亲缘关系最近,与属内其它菌如Acidithiobacillus thiooxidans WJSo和 Acidithiobacillus thiooxidans ATCC的亲缘关系相对较远。
2.4 菌株JJU-1的产酸特性
菌株JJU-1在扩大培养阶段,显现出良好的产酸性能,为了更好地了解菌株JJU-1的产酸特性,本研究进行了产酸实验。由于氧化硫硫杆菌能够将单质硫和还原态硫氧化成SO42-,并产生H+,从而引起培养液 pH的变化,可以通过比较培养液 pH的大小来衡量各因素对其产酸效果的影响。
2.4.1 初始pH值对菌株产酸特性的影响
氧化硫硫杆菌是嗜酸性菌,在酸性条件下才能够更好的生长。那么初始pH值的大小会不会影响JJU-1菌株的产酸效果呢?其实验结果见图9。随着硫杆菌的繁殖,初始pH值为3、4、5的培养液pH值迅速下降,到第6天后pH的变化逐步变缓,而初始pH=2的培养液pH值下降速度较缓,初始pH=1的培养液 pH值变化非常小,这主要是由于在 pH值低于1的条件下,菌株的生长受到抑制,实验中我们对pH=1的培养液的菌量进行检测发现其增长速率非常缓慢。不接菌的对照实验 pH值(初始pH=4)基本保持恒定。实验结果表明,初始pH值的大小对JJU-1菌株的产酸性能在前6 d时段内有一定影响,但到第7天各培养液的pH值基本处于同一水平。
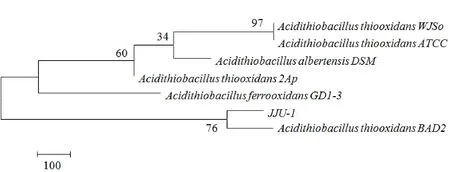
图8 菌株JJU-1的16S rDNA序列系统发育树Fig. 8 Phylogenetic dendrogram of strain JJU-1
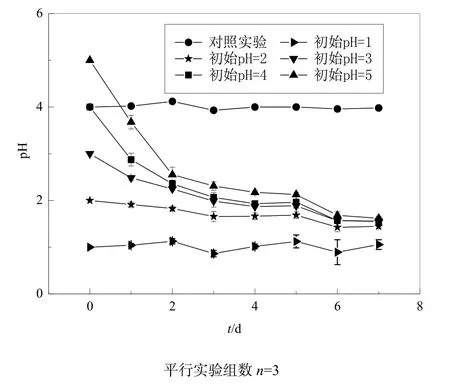
图9 初始pH值对菌株JJU-1产酸特性的影响Fig. 9 Influence of initial pH on acid production of strain JJU-1
2.4.2 单质硫投加量对菌株产酸特性的影响
由上述的能源实验可知,单质硫是菌株 JJU-1最主要的能源物质之一。为了了解硫投加量对菌株JJU-1产酸特性的影响,选择了5个硫投加量作了对比实验,其结果见图10。如图所示,不加单质硫的培养液pH值从3降到2.7左右后基本保持不变,而其他不同硫投加量的培养液随着培养时间的延长pH值逐步降低,并且硫投加量越大,其pH值下降越快,产酸效果越好。当培养到第8天时,不同硫投加量的培养液pH值差距越来越大。这可能是由于硫投加量较少时,提供给硫杆菌的空间位置有限,当所有的空间位置完全被硫杆菌占据时,其他的硫杆菌就没有机会与硫接触而不能发生产酸反应。
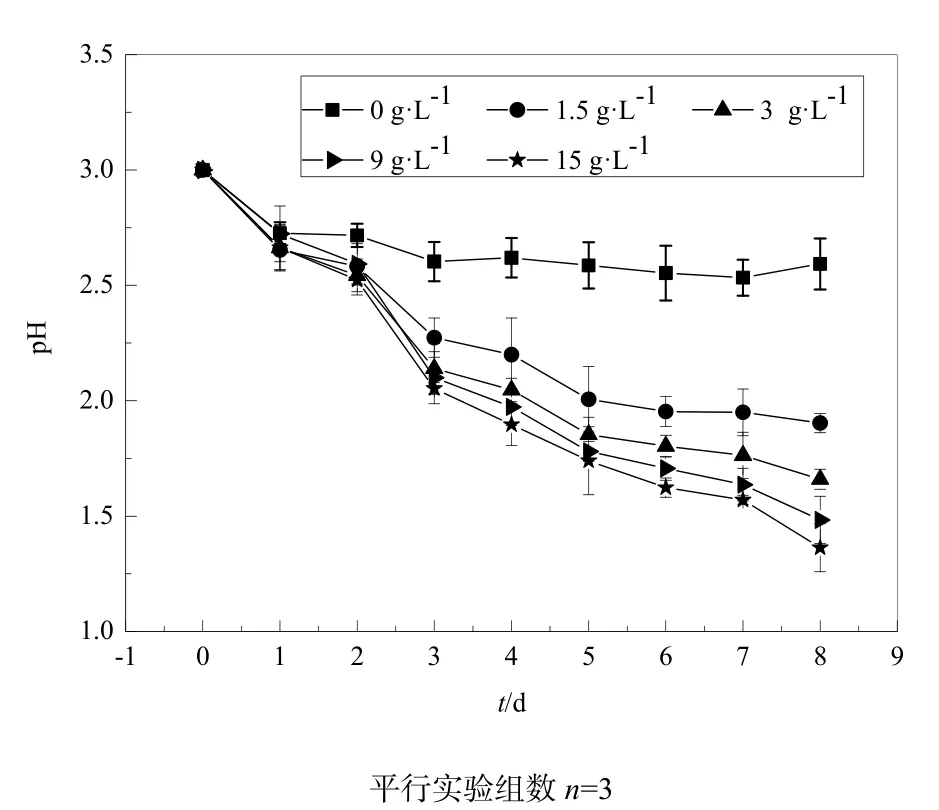
图10 单质硫投加量对菌株JJU-1产酸特性的影响Fig. 10 Influence of quantity of sulfur on acid production of strain JJU-1
2.4.3 单质硫粒度对菌株产酸特性的影响
氧化硫硫杆菌在氧化单质硫生产硫酸的过程,首先是硫杆菌细胞吸附在单质硫的表面,其在单质硫的表面作用受单质硫的结构、比表面积的大小影响较大(Vogler et al.,1941)。本实验研究了20~50目(粒径270~830 μm)、50~80目(粒径180~270 μm)、80~140目(粒径109~180 μm)、大于200目(粒径<75 μm)4个不同粒度单质硫的产酸特性。从图11中可知,20~80目的单质硫(粒径180~830 μm)随培养时间的延长 pH值下降的速度明显小于80~140目和200目的单质硫,即粒径小于180 μm的硫粉比大于180 μm的硫粉产酸速率快。氧化硫硫杆菌JJU-1的产酸速率随单质硫粒径的减小而增大,但是随着粒度的进一步降低,增大效应有减弱趋势。有学者研究得出类似的结论:50~150 μm粒径的硫粉要比150~250 μm粒径的硫粉生物氧化速度快。
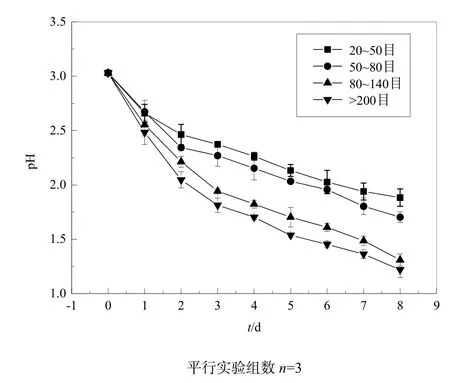
图11 单质硫粒度对菌株JJU-1产酸特性的影响Fig. 11 Influence of size of sulfur particle on acid production of strain JJU-1
2.4.4 表面活性剂对菌株产酸特性的影响
氧化硫硫杆菌与反应底物单质硫的直接接触,是氧化硫硫杆菌发生生物氧化产酸反应的前提(Vogler et al.,1941)。然而由于单质硫的疏水性,单质硫在反应器中分散困难,硫杆菌很难与其充分接触,并附着其表面,导致单质硫的生物氧化产酸反应成为生物淋滤的限速步骤。为此,本实验采用润湿剂吐温60改善单质硫的表面性质,提高JJU-1菌株的产酸速率。如图12所示,当吐温60浓度小于1.6 g·L-1时,培养液的pH值小于没有投加吐温60的培养液的pH值,也即JJU-1菌株的产酸速率提高,吐温60对其产酸有促进作用,其中吐温60浓度为0.8 g·L-1的效果最好。而当吐温60浓度为2.0 g·L-1时,培养液的pH值大于对照组培养液的pH值,说明吐温60对JJU-1菌株的生长有抑制作用,降低其产酸速率,这可能是吐温 60对细胞膜中的脂类具有溶解作用导致细菌死亡。Pith Otero et al.(1995)研究了吐温 80对氧化硫硫杆菌生长及产酸的影响:当吐温80的浓度大于2.5 g·L-1时,培养10 d后氧化硫硫杆菌的生长受到较大抑制,当吐温80的浓度1.0 g·L-1时,对氧化硫硫杆菌产酸有较大的促进作用。本实验结果与其研究结论基本一致:低浓度的表面活性剂对氧化硫硫杆菌产酸有较大的促进作用,高浓度的表面活性剂会抑制氧化硫硫杆菌的产酸效果。
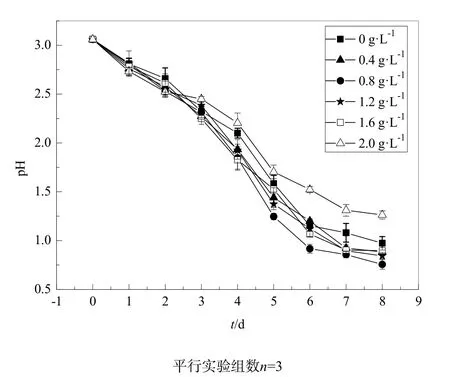
图12 吐温60对菌株JJU-1产酸特性的影响Fig. 12 Influence of surfactant agent Tween 60 on acid production of strain JJU-1
2.5 氧化硫硫杆菌与单质硫的作用机理分析
从上述产酸特性实验可知,嗜酸氧化硫硫杆菌JJU-1具有良好的氧化单质硫的能力,而且采用增加硫粉投加量、减小单质硫粒径、投加表面活性剂剂吐温60等方法均可以提高JJU-1菌株的产酸速率。从中我们可以看出,这几种方法的共同点就是增加了细菌与单质硫的直接接触空间和接触面积,为单质硫进入硫杆菌细胞及后续的生化产酸反应提供了前提条件。而采用改变初始pH值的方法对菌株后期产酸性能影响较小,这是因为改变初始pH值仅仅改变了培养液的化学性质,影响了硫杆菌前期的生长,并没有为细菌与单质硫的相互作用增大直接接触面积。因此,可以推测氧化硫硫杆菌与单质硫表面的直接接触是发生产酸反应的先决条件。
为了证实该推测,本实验采用0.1 μm孔径的平板微滤膜将3 g单质硫包裹密封,然后投加到装有300 mL Waksman液体培养基和10 mL菌悬液的锥形瓶中,恒温摇床培养(180 r·min-1、28 ℃)。同时,同样条件下做一个对照实验,即将单质硫直接加到接种菌悬液的培养基中。经过连续 10 d的培养,用微滤膜将单质硫包裹密封的培养液pH值基本保持在3左右,变化很小,而对照实验的培养液pH值逐渐降低到1.0左右。
由上述扫描电镜观测可知,JJU-1菌株为短杆状,长1~3 μm、宽0.5 μm左右,0.1 μm孔径的平板微滤膜完全可以将氧化硫硫杆菌JJU-1与单质硫隔离,不让两者直接接触。本实验也证实了氧化硫硫杆菌与单质硫表面的直接接触是发生产酸反应的先决条件。至于单质硫与氧化硫硫杆菌表面接触后,如何进入嗜酸性氧化硫硫杆菌细胞体内不在本研究讨论范围。
3 结论
(1)通过菌落形态观察、生理生化试验、16S rDNA序列分析和同源性比较,筛选出的JJU-1菌株为嗜酸性氧化硫硫杆菌(Aciditythiobacillus thiooxidan)。
(2)对筛选出的JJU-1菌株进行产酸特性研究,发现该菌株具有良好的氧化单质硫产酸性能,在最佳生长条件(初始pH=2.5~3.5、θ=28~32 ℃)下,JJU-1菌株培养5 d后,培养液pH值从3.5降到1.5左右。
(3)在产酸特性研究中,对影响JJU-1菌株产酸的不同因素进行了分析:初始pH值对菌株培养前期有一定影响,对菌株后期产酸性能影响较小,初始pH值小于1时,菌株的生长受到抑制;硫粉投加量越大,菌株产酸效率越高;菌株产酸速率随单质硫粒度的减小而增大,粒径小于180 μm的硫粉比大于180 μm的硫粉产酸速率快;低浓度吐温60能提高JJU-1菌株的产酸效率,而高浓度吐温60则对产酸有抑制作用。
(4)对氧化硫硫杆菌与单质硫的作用机理进行分析,发现硫杆菌与单质硫表面的直接接触是发生产酸反应的先决条件。
CHEN P, YAN L, LENG F F, et al. 2011. Bioleaching of realgar by Acidithiobacillus ferrooxidans using ferrous iron and elemental sulfur as the sole and mixed energy sources [J]. Bioresource Technology, 102(3): 3260-3267.
GORKEM A, DUYUSEN E G. 2011. Bioleaching of heavy metals contaminated sediment by pure and mixed cultures of Acidithiobacillus spp. [J]. Desalination, 268(1-3): 221-226.
LÖSER C, ZEHNSDORF A, GÖRSCH K, et al. 2006. Remediation of heavy metal polluted sediment in the solid bed: Comparison of abiotic and microbial leaching [J]. Chemosphere, 65(1): 9-16.
PITH OTERO A, CURUTCHET G, DONATI E, et al. 1995. Action of thiobacillus thiooxidans on sulphur in the presence of a surfactant agent and its application in the indirect dissolution of phosphorus [J]. Process Biochemistry, 30(8): 747-750.
SUZUKI I, CHAN C W, TAKEUCHI T L. 1992. Oxidation of elemental sulfur to sulfite by thiobacillus thiooxidans cells [J]. Applied and Environmental Microbiology, 58(11): 3767-3769.
SUZUKI I. 1965. Oxidation of elemental sulfur by an enzyme system of thiobacillus thiooxidans [J]. Biochimica et Biophysica Acta. 104(2): 359-371.
TRAVISANY D, CORTES MARÍA PAZ, LATORRE M, et al. 2014. A new genome of Acidithiobacillus thiooxidans provides insights into adaptation to a bioleaching environment [J]. Research in Microbiology, 165(9): 743-752.
VOGLER K G, UMBREIT W W. 1941. The necessity for direct contact in sulfur oxidation by thiobacillus thiooxidans [J]. Soil Science, 51(5): 331-338.
WAKSMAN S A, JOFFE J S. 1921. Acid production by a new sulfur-oxidizing bacterium [J]. Science, 53(1366): 216.
YIN H Q, ZHANG X, LIANG Y L, et al. 2014. Draft genome sequence of the extremophile Acidithiobacillus thiooxidans A01, isolated from the wastewater of a coal dump [J]. Genome Announcements, 2(2): e00222-14.
布坎南 R E, 吉本斯 N E. 1984. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所译(8版). 北京: 科学出版社: 622-651.
曹亚彬, 吴皓琼, 于丽萍, 等. 2011. 金属离子对氧化硫硫杆菌生长及产酸的影响[J]. 生物技术, 21(2): 85-87.
方迪, 赵亮, 单红仙, 等. 2009. 1株嗜酸硫杆菌的分离鉴定及其对污染底泥中重金属的去除效果[J]. 环境科学, 30(11): 3358-3363.
龚文琪, 边勋, 陈伟, 等. 2007. 氧化硫硫杆菌的培养特性及低品位磷矿浸出[J]. 武汉理工大学学报, 29(5): 53-58.
黄峰源, 王世梅, 周立祥. 2006. 氧化硫硫杆菌TS6的生长条件及其对重金属耐受性研究[J]. 环境科学学报, 26(8): 1290-1294.
吕早生, 关海燕, 李凌凌, 等. 2011. 一株高浸磷嗜酸氧化硫硫杆菌的分离与鉴定[J]. 应用与环境生物学报, 17(3): 326-329.
彭会清, 赵永红. 2009. 提高嗜酸氧化硫杆菌产酸能力的研究[J]. 金属矿山, (5): 143-145.
王永东, 李广悦, 刘玉龙, 等. 2007. 一株新的氧化硫硫杆菌的分离纯化与培养[J]. 南华大学学报(自然科学版), 21(2): 1-3.
温烨明, 王清萍, 林鸿雁, 等. 2009. 污泥中氧化硫硫杆菌的分离及其应用效果[J]. 环境污染与防治, 31(7): 52-55.
张建民, 张继, 李颖杰, 等. 2010. 氧化硫硫杆菌的选育及其脱硫性能研究[J]. 西安工程大学学报, 24(2): 180-184.
周立祥. 2012. 污泥生物沥浸处理技术及其工程应用[J]. 南京农业大学学报, 35(5): 154-166.
周顺桂, 周立祥, 王世梅. 2003. 嗜酸硫氧化菌株的分离及其在污泥生物脱毒中的应用[J]. 环境科学研究, 16(5): 41-44.
Isolation, Identification of an Acidithiobacillus Thiooxidan Strain and Its Characteristic of Acid Production
YANG Qiyong1*, QIU Xiuwen1, CHENG Pengfei1, LI Ye1, HAN Jinfeng2, JIANG Shen2, SHAN Yaoyao2, SUN Chao2
1. Poyang Lake Eco-economy Research Center, Jiujiang University, Jiujiang 332005, China; 2. College of Chemistry and Environmental Engineering, Jiujiang University, Jiujiang 332005, China
Acidithiobacillus thiooxidan is the major microorganism in bioleaching of heavy metal from sewage sludge. The biological oxidation of sulfur by Acidithiobacillus thiooxidan is the committed step of bioleaching of heavy metal. In order to isolate and cultivate efficient Acidithiobacillus thiooxidan, its characteristic of acid production is studied, and then the method of improving the effect of its acid production is selected. An autotrophic sulfur-oxidizing bacterium (strain JJU-1) was isolated from the activated sludge of a sewage plant. According to its colonial morphology, SEM image of strain, physiological-biochemical properties and its16S rRNA gene sequence analysis, the strain was identified as Acidithiobacillus thiooxidan. Sulfur oxidation by JJU-1 was studied from four aspects, such as initial pH, quantity of sulfur, size of sulfur particle and concentration of surfactant agent (Tween 60). The culture mediums with different initial pH were studied and the results indicated that the initial pH of culture medium almost had no effect on growth of Acidithiobacillus thiooxidan in later stage, more specifically, the pH of culture mediums were almost the same on the 7thday. The experiment results also showed the growth of microorganism was restrained at pH below 1. Considering the influence by different amount of substrate sulfur added into the culture mediums, the rate of sulfate formation by JJU-1 strain was higher when the sulfur amount increased. On the 8thday the maximum difference of the culture mediums pH with different amount of sulfur was 0.54. The rate of sulfate formation by JJU-1strain increased with the decrease in sulfur particle size. The sulfur particles passing through 180 μm yielded lower rates of sulfate formation than these of size below 180 μm. The addition of Tween 60 had some effect on sulfate formation by JJU-1 strain. When the concentration of Tween 60 was at 0.4~1.6 g·L-1, it would increase the rate of sulfate formation. However, when the concentration of Tween 60 exceeded 2.0 g·L-1, there was a negative effect on the growth of JJU-1 strain on the 8thday. The microfiltration membrane experiment indicated that the Acidithiobacillus thiooxidan must be in direct physical contact with the sulfur particle before oxidation could take place. At the optimal growth conditions (pH=2.5~3.5, θ=28~32 ℃), the pH of culture media decreased from 3.5 to around 1.5 after 5 days, which indicated that the JJU-1 strain showed efficient in sulfur oxidation and sulfate formation. Therefore, The JJU-1 strain could be widely used in sewage sludge bioleaching
Acidithiobacillus thiooxidan; isolation and identification; 16S rDNA; characteristic of acid production
10.16258/j.cnki.1674-5906.2015.08.017
X172
A
1674-5906(2015)08-1366-09
杨期勇,邱秀文,程鹏飞,李也,韩金凤,蒋晟,单瑶瑶,孙超. 嗜酸性氧化硫硫杆菌的分离鉴定及其产酸特性[J]. 生态环境学报, 2015, 24(8): 1366-1374.
YANG Qiyong, QIU Xiuwen, CHENG Pengfei, LI Ye, HAN Jinfeng, JIANG Shen, SHAN Yaoyao, SUN Chao. Isolation, Identification of an Acidithiobacillus Thiooxidan Strain and Its Characteristic of Acid Production [J]. Ecology and Environmental Sciences, 2015, 24(8): 1366-1374.
国家自然科学基金项目(21367014);江西省自然科学基金项目(20151BAB203026);江西省科技厅对外科技合作计划项目(20132BDH80008);江西省教育厅科技项目(GJJ14732)
杨期勇(1972年生),男,教授,博士,主要从事水污染控制及废物资源化技术研究。E-mail: yqy46901@163.com *通信作者。
2015-05-30
