微生物修复石油污染土壤的生态毒性指示
2015-12-07沈伟航朱能武尹富华王华金党志
沈伟航,朱能武,,尹富华,王华金,党志,
1. 华南理工大学环境与能源学院,广东 广州 510006;2. 工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 510006
微生物修复石油污染土壤的生态毒性指示
沈伟航1,朱能武1,2*,尹富华1,王华金1,党志1,2
1. 华南理工大学环境与能源学院,广东 广州 510006;2. 工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 510006
发光菌的相对发光度和植物光合色素含量以及土壤酶活性是土壤石油污染程度和生态毒性强弱的综合反映。为探究不同生物指示方法对石油污染土壤生态毒性的指示效果以及污染土壤在生物修复过程中毒性的变化规律,采用前期筛选分离的三株对石油烃具有良好降解效果的降解菌构建混合菌体系,开展石油污染土壤模拟微生物修复实验。文章首先以明亮发光杆菌为指示生物考察不同修复时期土壤生态毒性,并以高等植物毒性试验以及土壤酶活性试验结果作为辅助证据从生态学角度揭示修复过程中石油污染土壤生态毒性的变化,并分析了以上3种指示方法的一致性。结果表明,该混合菌能高效降解对石油烃污染物,污染土壤经40 d修复后,石油烃污染物浓度从5 000 mg·kg-1降到1 781 mg·kg-1,去除率达到64%。高等植物生态毒性试验、土壤酶活性试验与发光菌生态毒性试验结果呈现良好的一致性,石油污染土壤的生态毒性随着微生物修复过程的进行呈先上升后下降的趋势。具体而言,修复初期的土样对小麦光合色素含量的抑制作用最大,叶绿素a含量相对于对照组降低了39.3%,仅为(1.36±0.04) mg·g-1;土壤过氧化氢酶酶活性与石油烃残留量呈极显著负相关关系(-0.973);污染土壤生态毒性在修复的第8天达到最大,其二氯甲烷/二甲基亚砜浸提液中发光菌的相对发光度为18.1%,与0.187 mg·L-1HgCl2的毒性相当。明亮发光杆菌的相对发光度和小麦光合色素含量以及土壤过氧化氢酶活性能较好地指示石油污染土壤在生物修复过程中的生态毒性,可作为石油污染土壤微生物修复效果的指示生物。
石油污染土壤;生物修复;发光菌;生物指示
石油工业的迅猛发展使得石油污染物对土壤的污染状况日趋严重。石油污染物(烷烃类、芳香烃类以及苯类等)毒性大且具有致癌作用,进入土壤后难以去除,并会引发土壤性质变化甚至地下水污染等重大生态危机,如何有效地修复石油污染土壤已成为全球性的环境难题(黄廷林等,2009)。在众多修复方法中,石油污染土壤的微生物修复以其对土壤环境干扰小、成本低廉、无二次污染等优点,正逐步成为国内外学者的一个研究热点(王华金等,2013)。然而,要成功运作石油污染土壤微生物修复仍面临诸多难题。研究表明,恢复污染土壤的原有生态功能是一个缓慢且复杂的过程(宋玉芳等,2004)。随着微生物修复过程的进行,污染土壤逐步向健康状态转变,并伴随着土壤及微生物一系列生理生化指标的变化。对石油污染土壤的微生物修复过程及此过程中土壤健康状况的监测、指示以及生态毒理学研究有助于全面掌握石油污染土壤微生物修复过程中生态毒性的强弱及变化规律。
已有研究表明,土壤生态系统中的敏感指示物能够较为全面地反映土壤生态毒性(刘五星等,2007)。针对石油污染土壤生态毒性的指示和评价系统,国内外学者提出了包括发光菌毒性试验、高等植物毒性试验和土壤酶活性试验在内的多种生态毒性试验方法。在这些生态毒性指示方法中,发光细菌生态毒性试验以其相关性好,灵敏性高、监测效率高等优点而被国内外学者广泛应用于石油污染土壤修复过程中土壤生态毒性的评价与监测(林志芬等,2001)。有学者采用发光细菌生态毒性性试验来评价生物堆肥 16个月之后的石油污染土壤的生态毒性,土壤毒性的最大值出现在堆肥的初期,随着堆肥过程的进行,土壤生态毒性呈减弱趋势,但仍有较高的生态毒性(Chaineau et al.,2003)。有研究通过发光细菌生态毒性试验研究两种不同堆肥条件下的石油污染土壤发现,自然条件下堆肥处理的生态毒性最高可达到人工强化堆肥的4倍(Płaza et al.,2005)。高等植物作为土壤生态系统中的基本组成部分,利用其生长发育状况及叶片生理生化指标来指示土壤生态毒性是土壤污染生态毒理学诊断的重要组成部分。Banks et al.(2005)以莴苣、粟、萝卜、红三叶草和小麦的种子发芽率为指标,考察它们作为供试植物的可行性,结果表明,仅莴苣种子能准确地指示受污土壤和净土之间生态毒性的差异。土壤酶活性作为土壤微生物新陈代谢是否正常的关键性指标,是土壤整体健康状况的综合反映(张晓阳,2013),将土壤酶活性作为土壤生态毒性的指示物,也具有理论上的可行性。研究表明,在柴油污染土壤的生物修复过程中土壤脂肪酶和脱氢酶与石油烃残留量呈显著负相关,而β葡萄糖苷活性与土壤中石油烃残留量呈显著正相关(Riffaldi et al.,2006)。
虽然上述方法在生态毒性指示方面各有优势,但是涉及不同指示方法的指示效果研究以及它们之间的一致性分析还比较少。由于通过不同指示生物对土壤生态毒性进行指示和评价能够有效地整合土壤中不同食物链生物对有毒有害物质的整体毒性效应,可以较为全面地反映土壤的受污情况。因此,石油污染土壤微生物修复过程需要整合各种生态毒性指示和评价方法对土壤生态系统的安全性做出全面、科学地判断。课题组前期研究表明,土壤过氧化氢酶活性与土壤中的残留石油烃相关系数最大(王华金等,2013);小麦与萝卜相对于莴苣、黑麦草以及小青菜更适合作为供试植物来指示石油污染土壤的生态毒性变化(沈伟航等,2015)。然而前期研究并未涉及石油污染土壤的复合指示效果研究以及不同指示方法之间的一致性分析。基于此,本研究选取明亮发光杆菌,土壤过氧化氢酶活性以及小麦和萝卜的叶片光合色素毒性试验来进一步探究石油污染土壤生态毒性变化规律以及不同方法之间的一致性分析。文章首先通过发光菌毒性试验考查石油污染土壤微生物修复过程中土壤的生态毒性强弱及变化规律,通过度量发光细菌在不同修复时期土壤中的相对发光强度,并结合毒性等级划分标准确定石油污染土壤发光菌指示的可行性与敏感性。随后,文章以高等植物毒性试验及土壤酶活性试验结果作为辅助证据从生态学角度揭示石油污染土壤微生物修复过程中残留的石油污染物和中间代谢产物对土壤生态系统的影响,在佐证发光菌毒性试验结果的同时也完成了石油污染土壤微生物修复过程中污染土壤的生态毒性变化规律的探究及指示效果的一致性分析。
1 材料与方法
1.1 混合菌的制备
本研究选取课题组前期分离出的洋葱伯克霍尔德氏菌(Burkholderiacepacia)中的烷烃降解菌GS3C(CCTCC No. M 207169);鞘氨醇单胞菌(Sphingomonas sp.)中的菲降解菌GY2B(CCTCC No. M 206019);伯克菌科 Pandoraea菌属的pnomenusa种中的芘降解菌 GP3B(CCTCC No. M207167)为初始菌种资源。将上述3种菌株分别取1环进行富集培养,然后在25 mg·mL-1的原油无机盐培养基(5.0 mL PBS, 1.0 mL CaCl2溶液,1.0 mL FeCl3溶液,3.0 mL MgSO4溶液,1.0 mL微量元素,1000 mL蒸馏水)中分别加入1 mL富集液,接着将投加了石油降解菌的原油无机盐培养基置于的摇床中驯化培养(30 ℃,150 r·min-1),每 5天为一个驯化周期,共驯化55 d后离心分离分别获取3种驯化产物。最后将驯化后的GS3C、GY2B、GP3B菌(4.0×108CFU·mL-1)按等量配比的原则(1∶1∶1,V/V/V)复配后形成石油烃降解混合菌。
1.2 石油污染土壤的制备
供试土壤采自广东增城的水稻田表层土壤。土壤取回经干燥处理后过4.75 mm筛,去除大颗粒物质后分为两份,一份保存在4 ℃冰箱中并于避光条件下测定新鲜土样的初始指标(表1),另一份置于阴凉处风干后过2 mm筛,保存待用。实验用油由广州石化提供的原油(饱和烃:45.55%,芳烃:17.69%,胶质和沥青质:9.68%)。
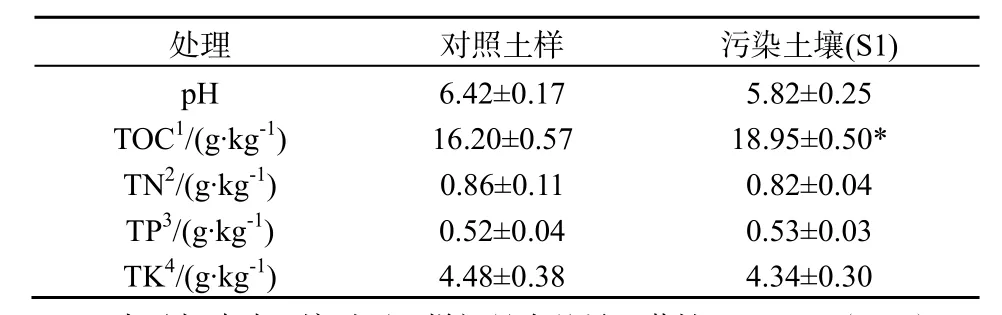
表1 供试土壤的理化性质Table 1 Basic physiochemical properties of the tested soils
在φ15 cm×20 cm塑料盆装入3 kg干土,将溶于石油醚中的石油均匀地加入土壤中,使土壤中石油烃的初始浓度为5000 mg·kg-1(每千克干土中含5 g原油),并搅拌均匀(Vouillamoz et al.,2001)。接着按3%(每100 g土加3 mL石油烃降解混合菌菌液)的比例接种到石油污染土壤中。
最后将各培养皿置于恒温培养箱(30 ℃)中进行石油污染土壤的微生物修复实验,每2天翻土搅拌一次并维持土壤含水率的稳定。实验过程中,采集微生物修复第0、8、16、24、32、40 d的土壤,分别标记为 S1,S2,S3,S4,S5,S6,同时采集净土标记为S0,将这7个土样作为不同微生物修复时期的石油污染土壤,备用(Tang et al.,2010)。
1.3 测试项目及方法
1.3.1 供试原油的标准曲线
原油标准溶液的配制:准确称取 0.1000 g原油,加入少量正己烷,将其溶解后转移至50 mL容量瓶中定容,然后摇匀,配制成2 mg·mL-1的标准溶液。系列浓度原油标准溶液的配制:分别移取上述原油标准溶液1、3、5、7、9 mL于25 mL容量瓶中,并用正己烷定容。再分别取1 mL的系列原油溶液定容于25 mL容量瓶中,配成标准系列的浓度分别是3.2、9.6、16、22.4、28.8 mg·L-1。在绘制标准曲线前,先取少量原油标准液于紫外-分光光度计的220~260 nm处进行光谱扫描,找出本研究中油样的最大吸收波长。然后在最大吸收波长下分别测定标准浓度油样的吸光度,并将数据进行线性回归分析,绘制标准曲线。
石油及其产品在紫外区有特征吸收,带有苯环的芳香族化合物的主要吸收波长为250~260 nm,带有共轭双键的化合物主要吸收波长为215~230 nm,一般原油的两个主要吸收波长为225及254 nm(何丽媛,2010)。本研究中的原油样品在220~260 nm的特征吸收波段下的扫描结果如图1(a)所示。可以看出,原油样品在波长225 nm和235 nm处均出现了较强的吸收峰,其中在波长225 nm处为最大吸收峰。研究认为,在最大吸收峰处吸收最大、干扰最小(李宝明,2007)。故本研究中选取225 nm作为最佳吸收波长。在最大吸收峰波长225 nm下,分别测定标准油样品溶液的吸光度。为了能够更准确的反映样品浓度和吸光度之间的关系,对实验数据进行回归分析,得到标准曲线,如图1(b)所示。

图1 原油标准曲线的绘制Fig. 1 The drafting of crude oil standard curves
标准曲线的线性回归方程为:
式中:y—吸光值;x—原油浓度,mg·mL-1。
1.3.2 土样中总石油烃含量的测定
称取风干土壤5 g于50 mL离心管中,加入适量Na2SO4和10 mL正己烷,然后在1800 r·min-1条件下振荡1 min,再将其超声半小时并离心(3000 r·min-1,10 min)收集上清液。重复上述操作4次,确保土样中的石油烃全部被提取出来。将上述上清液过 0.45 μm 的有机系滤膜后移至旋转蒸发仪(RE-52CS)中进行浓缩,用25 mL的容量瓶定容,最后在225 nm波长处测定其吸光度值,对照石油的标准曲线,计算出石油污染土样中石油烃残留量和降解率(Han et al.,2009)。

式中:α1为土样中石油烃的初始含量;α2为不同微生物修复时期土样中石油烃的残留量。
1.3.3 发光细菌的生态毒性测定
将等质量的污染土壤与无菌蒸馏水混合,在25 ℃条件下,在振荡机(HZQ-F160)上反复振荡(120 r·min-1)1 h,随后土壤水样于4000 r·min-1的条件下离心30 min,过滤备用。污染土壤二氯甲烷(DCM)/二甲基亚砜(DMSO)浸提液制备:称取5.0 g土壤,用二氯甲烷(DCM)超声提取30 min,然后在4000 r·min-1的条件下离心10 min,收集上层液体。重复上述操作4次,确保土壤中的石油烃全部被洗出。然后将萃取液减压旋转浓缩至5 mL,再加入5 mL二甲基亚砜(DMSO),然后将该混合物继续浓缩至5 mL,备用(刘五星等,2007)。
发光菌生态毒性测试在2 mL的测试管中进行,分别向测试管中加入200 μL 22%的NaCl溶液,200 μL的待测溶液,1580 μL的去离子水,20 μL的复苏好的菌液。加完复苏好的菌液(实验所采用的明亮发光杆菌,T3变种冻干粉购于中国科学院南京土壤研究所)后盖上瓶塞,用手颠倒5次,拔取瓶塞,放回测试架上(Bundy et al.,2004)。反应15 min后在生态毒性测试仪上测定其发光强度(mV)。本研究采用相对发光度(%)(样品的发光强度除以对照的发光强度),同时根据参比毒物氯化汞的标准曲线,计算出与样品急性毒性相当的氯化汞浓度(mg·L-1)。

图2 不同修复时期的土壤中石油烃残留量及表观降解率Fig. 2 Changes in TPH removal efficiency and residual oil during different phases of bioremediation
1.3.4 光合色素含量的测定
取不同微生物修复时期的石油污染土样各 100 g于不同培养皿中,再将小麦(Triticum aestivnm L.)和萝卜(Raphanus sativus L.)种子(各20粒,购于广东省农业科学院),均匀嵌入不同培养皿的土样中,再在种子上面均匀覆盖20 g对应修复时期的供试土壤,并调节土壤含水率(Al-Mutairi et al.,2008),随后盖好玻璃培养皿并置于25 ℃光照培养箱(SPX-250)中培养。黑暗培养2 d后进行为期3 d的光照和黑暗交替培养,每天光照16 h,黑暗培养8 h,维持光照强度为4300 lux(Al-Mutairi,2008;Banks et al.,2005)。种子发芽后在之前的光照条件下继续培养9 d后,测定不同土壤中小麦和萝卜的叶片叶绿素a和类胡萝卜素含量。具体操作为:准确称取新鲜植物叶片0.1 g(鲜重)用10 mL100%甲醇进行提取,然后放入 4 ℃冰箱中,静止提取24 h后,提取液在4 ℃、2000 r·min-1下离心15 min,保留上清液。用甲醇做参比溶液,在紫外可见分光光度计下扫描上清液,得到其在400~750 nm波段的吸光度值。
叶绿素a的含量根据Porra的计算公式(3)计算(Porra,2002),类胡萝卜素的含量,根据公式(4)计算(Parsons et al.,1963):

式中:A750、A665、A652、A510、A480分别代表波长为750、665、652、510和480 nm下的吸光度值。
1.3.5 过氧化氢酶活性
过氧化氢酶的测定采用高锰酸钾滴定法测定(周礼恺等,1980):取5 g过1 mm筛的风干土样、置于150 mL锥形瓶中,注入40 mL蒸馏水和5 mL 0.3%过氧化氢。另设对照(往瓶中注入40 mL蒸馏水和5 mL 0.3%过氧化氢,而不加土样)。将瓶塞紧,置于120 r·min-1往返式摇床上,振荡30 min。随后,注入5 mL1.5 mol·L-1硫酸以终止反应,将瓶中内容物用致密滤纸过滤。取25 mL滤液用0.1 mol·L-1高锰酸钾溶液滴定至微红色。土壤的过氧化氢酶活性,以单位重量土壤消耗的0.1 mol·L-1高锰酸钾毫升数(对照与试验测定的差值)表示,也可以将高锰酸钾毫升数转化为氧化氢的毫克数表示。
注:实验所用试剂均为分析纯,购于阿拉丁。
1.4 数据处理
实验数据使用SPSS 17.0软件进行差异显著性(P=0.05和P=0.01)和相关性统计分析。结果以算术平均值±标准差的形式表示。
2 结果与讨论
2.1 石油污染土壤的微生物修复作用
不同微生物修复时期土壤中总石油烃降解率及残留量如图2a和2b所示。整体来看,与不投加混合菌的石油污染土壤相比,投加混合菌的污染土壤在石油污染土壤微生物修复的各阶段都表现出更高的石油烃降解率以及更低的残留量。具体而言,在投加菌剂的污染土壤中,从土样S1到S2石油烃降解率有一个急速的增长过程,之后随微生物修复过程的进行而稳步上升,在土样S2~S6中石油烃表观降解率在54%~64%范围内变化,从土样S5开始石油烃的降解率基本维持在64%左右(图2a),相应地,残留量也基本保持稳定(1.79 mg·g-1)(图2b)。在微生物修复的前期,石油污染物的进入为土壤中的微生物提供了丰富的碳源,微生物经过一段时间的适应期之后便开始利用其中易降解的短链石油烃进行繁殖,大量消耗了石油中的短链石油烃组分,整体呈现出很高的降解率;随着微生物修复过程的继续进行,易降解的石油烃组分继续被大量消耗,残留物变成了以芳香烃等难降解物为主的混合物,这些物质大多难以被微生物利用,仅有小部分仍在继续被降解(Margesin et al.,1999),从微生物修复中后期的的数据可以看出在,虽然降解率仍在上升,但上升的速率却已经十分缓慢,相应地石油烃的残留量也基本保持稳定。
同时应注意到,在不投加菌剂的污染土壤中,石油烃的降解率随修复过程的进行也有缓慢上升,但降解速率基本仅维持在16%左右,即使是在土样S6中仍有83.2%的石油烃被剩余(图2b),由此可以确认,土壤中土著微生物对石油烃的降解也有贡献(Langbehn et al.,1995),但其效果远远不及本实验复配形成的混合菌。综上可知,投加菌剂的污染土壤表观出的高降解率和低残留量是复配的降解菌对石油烃污染物的去除起主导作用这一微观结果的宏观体现。
2.2 不同修复时期土壤水浸提液及 DCM/DMSO浸提液生态毒性
参比毒物HgCl2的生态毒性分析。将一系列的HgCl2标准液进行生态毒性测试,得到不同浓度对应的发光量,相对于空白对照换算成相对发光度,得到以HgCl2浓度为横坐标,相对发光度为纵坐标的标准曲线,如图3(a)所示。

图3 (a)HgCl2的生态毒性的标准曲线;(b)不同生物修复阶段土壤浸提液的生态毒性Fig. 3 (a) The standard curve of ecotoxicityof HgCl2; (b) the ecotoxicity of soil extracts in different phases of bioremediation The asterisk (*) indicates differences at the 0.05 level compared with the control group (S0). The double asterisks (**) indicates differences at the 0.01 level compared with the control group (S0)n.s. not significant
其标准曲线的回归方程为:

其中:y为相对发光度(%);x为HgCl2的标准液浓度,mg·L-1。
在国标GB/T15441─1995(水质急性毒性的测定-放光细菌法)中规定:当氯化汞标准液浓度为0.10 mg·L-1,发光细菌的相对发光度为50%,其误差不能超过±10%,否则更换发光细菌冻干粉,重新进行测定。按照该标准进行本研究中标准曲线的检验,将 x=0.10代入上式,得到 y=58.006,其误差η=8.006%<10%,这说明了 HgCl2系列的标准液生态毒性可以作为本研究的参比毒物的生态毒性。
此外,可以看出不同修复时期土壤的发光细菌相对发光强度呈现“先减弱后增强”的趋势。当发光细菌受到外界影响时,其发光过程就会受到相应的干扰,并且发光细菌的发光强度与毒性作用强度呈负相关关系(马梅等,1998)。这说明土壤中的生态毒性强度是先增强后减弱的,这与(Xu et al.,2010)以及(Al-Mutairi et al.,2008)的研究结果是一致的。其中以土样 S2的生态毒性最大,其次是土样S3,相对发光度分别为18.1%和18.8%,对照表2中美国Microtox的毒性等级划分可以看出:它们的生态毒性级别为剧毒,同时对照通过公式(4)计算可知土样S2的生态毒性值与0.187 mg·L-1的HgCl2毒性相当,土样S3的生态毒性值与0.185mg·L-1的HgCl2毒性相当。随着修复的进行土壤的生态毒性有所降低,在修复结束后,土样 S6的DCM/DMSO浸提液中发光菌的相对发光度为51.4%,其生态毒性级别为中毒,与 0.114 mg·L-1HgCl2的毒性相当。

表2 国外发光细菌的生态毒性实验毒性等级划分Table 2 The toxicity classification on Microtox test in different state
微生物修复初始阶段,由于高浓度的石油污染物进入土壤中危害到了混合菌的生长代谢,从而导致初始阶段土壤浸提液表现出强生态毒性。随着修复的进行,毒性有所降低但仍高于对照组。值得注意的是,强烈的生态毒性是出现在生物修复的前中期,此时大部分烃类污染物已被去除。这可能是由于微生物在修复石油污染土壤过程中产生了毒性更强的中间体或者代谢产物(Al-Mutairi et al.,2008)。这也可以看出,目标污染物浓度的降低并不意味着其生态毒性的减弱,中间代谢产物的生成或者是污染物的生物可利用性变化可能会产生更强的生态毒性(Xu et al.,2010)。
此外,由于不同的石油烃降解微生物对石油烃的代谢途径存在差异,在实际修复过程中构建混合菌体系中微生物的种类、复配比例等因素都会对微生物降解石油烃产生较为明显的影响,从而导致土壤的毒性存在差异(冷凯良等,2001)。石油类污染物进入土壤后会破坏原有的土壤生态系统,引起土壤中生物的分子、细胞、个体、种群和群落五个水平的响应(焦海华等,2013),进而会对土壤生态系统食物链上的生物体的遗传物质进行诱导并产生一系列的变化,影响遗传物质的传递和表达,最终表现出与正常生物个体不同的外部症状(杨丽芹等,2011)。在过去的很长一段时间里,学者们普遍将石油烃目标污染物作为评价污染土壤修复效果的一项指标。然而,土壤环境本身就是一个复杂的系统,化学方法并不能科学、全面地评价土壤的修复效果和表征修复后土壤整体的质量特征,需要采用其他方法对此作出补充(赵晴等,2005)。
虽然发光菌毒性试验结果很好地指示了石油污染土壤的生态毒性,但涉及不同指示方法之间的效果及一致性分析的研究还比较少。由于通过不同指示生物对土壤生态毒性进行指示和评价可以有效地集合土壤中不同食物链生物对有毒有害物质的整体毒性效应,能较为全面地反馈土壤的污染信息。因此,本文通过高等植物毒理性试验以及土壤酶活性试验进一步佐证发光菌毒性试验结果的正确性,整合这几种毒性试验方法,进行相互检验以及一致性分析。借此对土壤系统的生态安全性做出全面、科学地判断。
2.3 高等植物光合色素试验
石油污染物对高等植物光合作用的影响是它们受害的重要原因之一,即便生长于不同生态毒性土壤中的植物外在形貌上的差异不大,其生理机能如光合作用强度、光合时间长短以及光合色素含量等均受到不同程度的影响(廖长君,2015;卢丽丽,2008)。其中,光合色素在植物光合作用的光吸收过程中起关键作用,且与各种形式的生命活动紧密联系在一起,发挥着着不可替代的作用。因此,探究石油污染土壤对植物叶片光合色素含量的影响,有助于理解植物在污染土壤中的生长状况,进而推断石油污染物的生态毒性强弱。
不同微生物修复时期污染土壤中小麦和萝卜叶片中的叶绿素a以及胡萝卜素含量变化如图4所示。可以看出,小麦的叶绿素a含量在不同微生物修复时期的污染土壤中均表现出显著抑制作用,其中土样 S1对其抑制作用达到最大,相对于对照组S0(2.24±0.08) mg·g-1降低了39.3%,仅为(1.36±0.04) mg·g-1;其次是土样 S3和 S4,分别相对于对照组S0减少了34.6%和37.3%,最终叶绿素a的含量分别为1.46±0.07和(1.39±0.29) mg·g-1。小麦类胡萝卜素含量和叶绿素a含量的变化趋势一致,两者在统计学上具有极显著的正相关性,r=0.996(P<0.01),这说明在石油污染的胁迫下叶绿素a和类胡萝卜素含量具有较好的一致性。
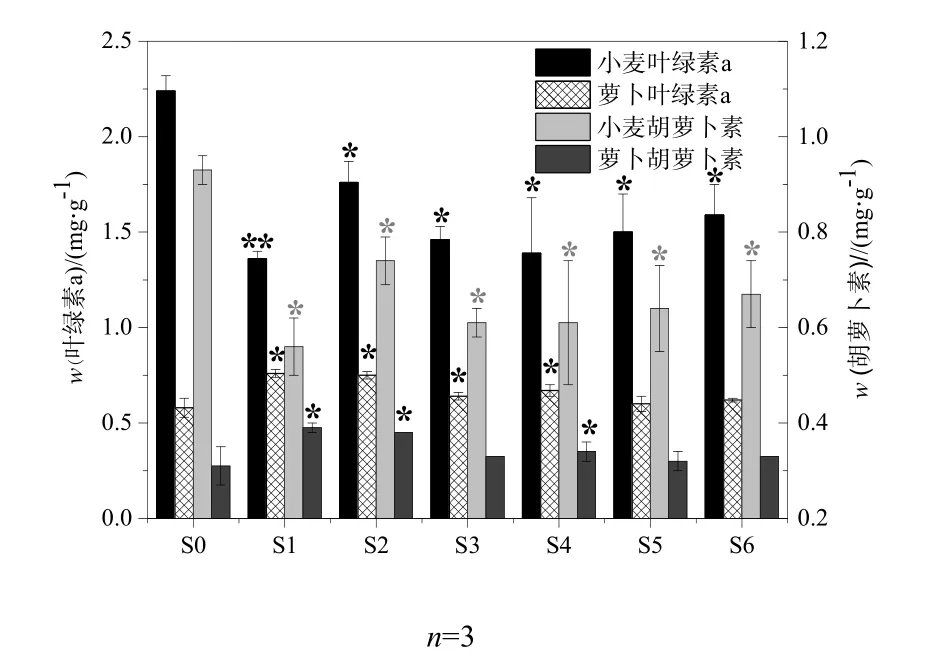
图4 原油对小麦和萝卜叶片光合色素的影响Fig. 4 Effects of crude oil on the photosynthetic pigments (Triticumacstivnm L.andRaphanussativusL.)
一方面石油污染物进入土壤会降低土壤养分的有效性、干扰植物细胞的正常生理活动,削弱植物对土壤养分的摄取,进而影响植物光合色素的合成(Karthikeyan et al.,2014);另一方面,在石油土壤中的余油以及微生物修复过程中的中间代谢产物会破坏细胞膜和叶绿体结构的破坏导致植物的光合作用(Xie et al.,2014)。也有研究表明光合色素的降低可能与气孔的变化密切相关。例如,铅的重毒性可引起茄子(Solarium melongena)叶绿素含量明显降低,铅浓度对气孔参数具有负作用(Yilmaz et al.,2009)。由于植物所生长的土壤生态毒性越强,植物生理生化过程受到的抑制就越强,有机物质合成受阻,部分酶的功能受到抑制,最终导致光合色素含量降低越明显(Cartmill et al.,2014;Xie et al.,2014)。所以小麦光合色素含量可以间接地反映石油污染土壤的生态毒性的强弱。以上结果说明石油污染土壤的生态毒性在前中期较强,后期生态毒性有所减弱但仍强于对照组,该结果与发光菌毒性试验结果吻合。
《义务教育语文课程标准(2011年版)》中指出:“各个学段的阅读教学都要重视朗读和默读。”从某种意义上说,学生朗读的水平直接体现其语文素养的高低。语文课程的学科特点决定了必须通过大量的朗读和背诵来积累语言,提高语言文字的运用能力。全国著名特级教师于永正说:“语文教学的亮点,首先应该在朗读上,老师读得正确、流利、有感情,并引导学生读得正确、流利、有感情,是一种美好的境界。师生能读得入情入境的语文课堂,一定是充满生机、充满灵性、充满情趣的语文课堂。”教学中,教师应做到因文而异,带领学生读出文章的抑扬顿挫,读出作者的喜怒哀乐,展现语文课程的学科魅力。
与此相反,从图4可以看出,萝卜的叶绿素a含量在不同修复时期的污染土壤中均表现出诱导作用,其中在修复的前中期(S1、S2、S3、S4)与对照组之间出现显著诱导,相对于对照处理组S0(0.58±0.00)分别高出了 32.3%、30.0%、11.3%和15.8%,萝卜的叶绿素 a含量最终分别到达(0.76±0.02),(0.75±0.02),(0.64±0.02)和(0.67±0.03) mg·g-1。萝卜的类胡萝卜素的结果和叶绿素 a结果同样表现出极显著的正相关性。这与小麦的叶绿素a和类胡萝卜素结果恰好相反,说明不同的植物种类在石油污染胁迫下叶绿素a和类胡萝卜素的变化表现出差异。大多数植物在污染物的胁迫下会出现光合作用强度减弱、光合色素含量下降的情形。如Pb能抑制菠菜叶绿素中光合电子传递,抑制光合作用中对CO2的固定(吴晓,2008);Cd主要抑制光化学系统中的电子转运,影响光合磷酸化作用,并增加叶肉细胞对气体的阻力,从而使光合作用下降。然而,本研究结果表明石油污染物却对萝卜叶片的光合色素的含量起诱导作用,这可能与萝卜对石油污染物的响应机制有关,具体原因需要进一步探索。
2.4 土壤酶活性实验
石油污染土壤微生物修复过程中生态毒性的变化会直接导致土壤微生物的活性的变化,进而引发土壤酶活性的变化。土壤酶活性作为土壤微生物新陈代谢是否正常的关键性指标,是土壤整体健康状况的综合反映(张晓阳,2013)。其中,过氧化氢酶形成于微生物体呼吸氧化有机物的过程,广泛存在于微生物细胞中,是生物防御体系的关键酶之一。它能直接将对生物体有毒害作用的 H2O2催化分解为无害的H2O与O2,避免强氧化性·OH的形成,进而解除H2O2对微生物的损害(蔺昕等,2005),将其作为土壤生态毒性的指示物,具有理论上的可行性。本文在课题组前期的研究基础上优选过氧化氢酶作为土壤酶的代表(王华金等,2013),考察了 H2O2酶的活性在接种外源石油降解混合菌剂的石油污染土壤修复过程中的变化情况,并将其与石油烃残留量进行耦合进行了相关性分析以及线性拟合,用于估计该微生物修复体系中土壤 H2O2酶活性和石油烃残留量的关系。
不同预处理的土壤在各修复阶段的 H2O2酶活性变化如图5所示。总体来看,不同预处理的土壤中H2O2酶活性高低顺序为:投加菌的污染土壤>净土>未加菌的污染土壤。具体而言,未投加菌剂的污染土壤中 H2O2酶活性始终维持在较低水平(2.39~2.51 mg H2O2·(g干土)-1·h-1),明显低于无污染的土壤(2.60~2.74 mg H2O2·(g干土)-1·h-1),这说明石油污染物对土壤H2O2酶活性产生了抑制作用。而在投加菌剂的污染土壤中,从S1(2.395)到S2(3.003 mg H2O2·(g干土)-1·h-1),H2O2酶活性有一个快速、明显的上升过程,该阶段 H2O2酶活性的增长速率最大,达到25.3%;随后修复阶段的土样S3和S4中酶活性的增长速率急剧下降(仅为2.392%和2.984%),并最终在土样S4中H2O2酶活性在达到最大(3.167mg H2O2·(g干土)-1·h-1);接下来的土样 S5,S6中 H2O2酶活性呈缓慢的下降趋势(-3.258%和-1.222%)。
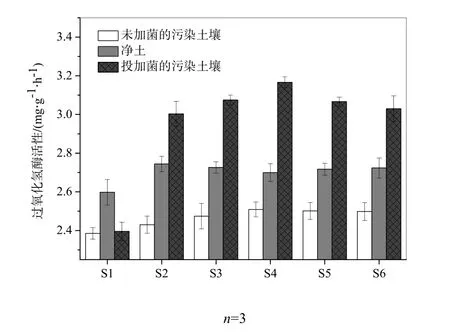
图5 不同预处理的土壤在各修复阶段的H2O2酶活性Fig. 5 Catalase activity activity of the soil samples in different phases of bioremediation
初始阶段,石油烃进入土壤为石油烃降解微生物提供了大量的营养物质,促进了土壤中石油降解微生物的大量繁殖,微生物的呼吸作用增强产生大量 H2O2,微生物分泌 H2O2酶来降低过量的 H2O2对微生物体的毒害作用,这导致了土壤中 H2O2酶活性迅速增强(吴伟林等,2010)。随着修复的进行,土壤中 C∶N∶P的比例逐渐失衡,且石油烃在生物修复过程中产生了某些具有强烈毒性的中间产物,初步抑制了微生物的活性,导致了 H2O2酶活性的增长速率急剧下降(Al-Mutairi et al.,2008;鲁莽等,2009)。从土样S4开始,随着C∶N∶P的比例的进一步失衡,微生物生长所需营养物质消耗殆尽,并且石油烃的强毒性中间代谢产物进一步累积使得 H2O2酶活性开始下降,这表明石油污染物已经开始严重破坏微生物的正常生理活动。此外,可以预见,虽然 H2O2酶能分解微生物的呼吸过程产生的H2O2,但分解能力的局限会导致剩余H2O2在土壤中积累,对微生物产生毒害作用,加剧H2O2酶活性的降低。
进一步对石油污染土壤微生物修复过程中土样酶活性与石油残留量的相关性分析表明,H2O2酶活性与石油残留量呈极显著相关性,相关系数为-0.973(P=0.001);同时以土壤石油烃残留量为自变量(x),土壤酶活性为因变量(y),进行线性拟合分析可得表3。

表3 H2O2酶活性与土壤残油的相关性分析及线型回归方程Table 3 Correlation analysis and linear regression equations between catalase activity and residual oil
H2O2酶活性与土壤残油的线型回归方程如下:

从整个微生物修复过程中,综合3种土壤中过氧化氢酶活性来看,土壤中的土著微生物对解除石油污染土壤的生态毒性作用不大,表现为未投加菌剂的污染土壤中氧化氢酶活性在整个修复过程中始终维持在极低水平且上升幅度极小;投加菌剂的污染土壤中过氧化氢酶活性维持在较高水平且上升幅度大。这也验证了之前的试验一致:本试验中外源添加的复合菌剂对石油污染物的去除起主导作用。同时可以看到,投加菌剂的污染土壤中活性高,只能说明石油烃残留低,并不意味着生态毒性始终维持在低水平,微生物修复前期产生的强毒性中间代谢产物会初步抑制微生物活性并逐步累积导致微生物的正常代谢活动被破坏。前期表现为随石油烃残留量的减少,过氧化氢酶活性上升速率逐渐降低;后期表现为随石油烃残留量的减少,过氧化氢酶活性逐渐减弱。该试验结果也可以间接说明石油污染土壤微生物修复过程中的生态毒性在前期因中间代谢产物的生成而增强,后期部分适应了新的土壤环境的微生物开始降解中间代谢产物导致石油污染土壤生态毒性减弱。
2.5 微生物修复石油污染土壤过程中的生态毒性
目标污染物的浓度是评价石油污染土壤微生物修复效果的重要指标之一,然而土壤生态环境的多样性以及石油污染物组分的复杂性使得通过化学方法将土壤中所有的有毒物质一一检测几乎不可能实现。研究表明,土壤环境本身就是一个复杂的系统,一般的化学方法并不足以科学、全面地评价污染土壤的生态修复效果并指示微生物修复后土壤整体的健康状况。此外,即便石油污染土壤中目标污染物的含量达到环境质量标准,但残留的难降解组分以及微生物生成的某些中间产物仍会使土壤具备较强的生态毒性,并且最终会在生物体上体现出来。所以,化学诊断的局限性决定了用单一化学方法监测和诊断土壤的微生物修复效果已不能准确指示石油污染土壤生态毒性的强弱。
本研究以发光细菌的相对发光强度为主要指标对不同修复时期石油污染土壤生态毒性进行了分析诊断,并以高等植物毒性试验以及土壤酶活性试验结果作为辅助证据来评价了石油污染土壤微生物的修复效果并分析了这 3种指示方法的一致性。通过对比分析可以看出,高等植物光合色素毒性试验、土壤过氧化氢酶和发光细菌生态毒性试验结果之间存在良好的一致性,都表明污染土壤生态毒性随修复时间的延长呈现先增大后减弱的变化趋势。具体而言,发光菌生态毒性试验结果表明,不同修复时期土壤的发光细菌相对发光强度呈现“先减弱后增强”的变化趋势。当发光细菌受到外界影响时,其发光过程就会受到相应的干扰,并且发光细菌的发光强度与毒性作用强度呈线性负相关关系。这说明了土壤中的生态毒性强度也是先增强后减弱。从高等植物光合色素毒性试验结果分析可得,植物光合色素的响应并不是随石油烃的浓度的变化呈现出对应的变化趋势,最高的石油烃浓度并不会对供试植物的光合色素含量产生最强的抑制作用;在石油污染土壤修复过程的前中期,石油污染土壤对小麦叶片光合色素含量的抑制作用最为明显。同时,不同植物(小麦与萝卜)对石油污染土壤的生态毒性响应呈相反趋势。从土壤过氧化氢酶活性试验结果分析可得,投加菌剂的污染土壤中较高的过氧化氢酶活性以及较低的石油烃残留并不意味着石油污染土壤的生态毒性始终维持在低水平,微生物修复前期产生的强毒性中间代谢产物会初步抑制微生物活性并逐步累积导致微生物的正常代谢活动被破坏。随着石油烃残留量的减少,前期表现为过氧化氢酶活性上升速率逐渐降低,后期表现为过氧化氢酶活性逐渐减弱。该试验结果也间接说明了微生物修复土壤的生态毒性在前期因中间代谢产物的生成而增强,后期有减弱趋势。以上结果说明,在石油污染土壤的微生物修复过程中,石油烃目标污染物残留量作为一个化学指标,它的减少并不能说明受污土壤的修复效果好,应结合土壤的生态毒理学试验,综合评价土壤的修复效果和健康状况。
在石油污染土壤中,即使石油目标污染物的含量达到环境标准,土壤的生态毒性仍然很强,而且在生物体上会最终表现出来(Al-Mutairi et al.,2008)。有研究表明尽管微生物修复后的石油烃总量仅为原来的35%,但指示生物的生态毒性评价结果显示生态毒性的最大值出现在修复第一阶段,并且受污土壤在整个修复过程中均有一定的生态毒性效应(Hubálek et al.,2007)。石油污染土壤的生态毒性随着微生物修复过程的进行而变得复杂,生态毒性在微生物修复的前中期表现为增强,可能的主要原因有以下两点:(a)微生物修复的前期易降解、毒性低的短链石油烃含量的减少,难降解物质(如多环芳烃等,毒性明显高于短链石油烃类物质)含量的相对增加;(b)修复过程中微生物的代谢中间产物的产生,导致其毒性要强于原来的污染物。已有研究表明,某些烃尤其是PAHs的氧化中间产物具有比其母本石油烃更强的生态毒性(Al-Mutairi et al.,2008)。因此,在石油污染土壤微生物修复过程中,应对微生物的次生代谢产物以及中间代谢产物予以足够的重视。在石油污染土壤微生物修复后期,部分微生物开始利用少量的多环芳烃等难降解物质作为碳源来维持自身生命活动,土壤的生态毒性呈下降趋势;此外,能够适应土壤新环境的微生物被保留下来,它们可以利用中间代谢产物进行新陈代谢。可以看出,随着石油污染土微生物壤修复时间的延长,受污土壤的生态风险逐渐降低。理论与实践均表明,恢复石油污染土壤的原有的生态功能是一个长期而复杂的生态过程。
3 结论
(1)在发光细菌的生态毒性实验中,土壤的生态毒性呈现先上升后降低的趋势。土样 S1的生态毒性最大,其DCM/DMSO浸提液中发光菌的相对发光度为18.1%,与0.187 mg·L-1HgCl2的毒性相当。明亮发光杆菌的相对发光度能够敏感地指示石油污染土壤的生态毒性。
(2)在植物光合色素毒性试验中,修复前期的土壤对小麦叶片光合色素含量的抑制最为明显,后期抑制效果减弱。小麦与萝卜叶片光合色素含量对石油污染土壤生态毒性的响应存在巨大差异。
(3)土壤过氧化氢酶酶活性与石油烃残留量呈极显著负相关关系(-0.973),土壤过氧化氢酶活性试验与发光菌毒性试验以及植物光合色素毒性试验结果呈现良好的一致性。
(4)石油污染土壤微生物修复过程中,目标石油烃污染物残留量的减少并不意味着土壤生态毒性的降低,石油污染土壤微生物修复过程中土壤生态毒性的变化呈复杂化趋势。石油污染土壤的生态毒性在修复的前中期达到最大,后期逐渐减弱,且在整个微生物修复过程中均存在一定的生态毒性。
AL-MUTAIRI N, BUFARSAN A, AL-RUKAIBI F. 2008. Ecorisk evaluation and treatability potential of soils contaminated with petroleum hydrocarbon-based fuels [J]. Chemosphere, 74(1): 142-148.
BANKS M K, SCHULTZ K E. 2005. Comparison of plants for germination toxicity tests in petroleum-contaminated soils [J]. Water Air and Soil Pollution, 167(1-4): 211-219.
BUNDY J G, PATON G I, CAMPBELL C D. 2004. Combined microbial community level and single species biosensor responses to monitor recovery of oil polluted soil [J]. Soil Biology and Biochemistry, 36(7): 1149-1159.
CARTMILL A D, CARTMILL D L, ALARCON A. 2014. Controlled release fertilizer increased phytoremediation of petroleum-contaminated sandy soil [J]. International Journal of Phytoremediation, 16(3): 285-301.
CHAINEAU C H, YEPREMIAN C, VIDALIE J F et al. 2003. Bioremediation of a crude oil-polluted soil: Biodegradation, leaching and toxicity assessments [J]. Water Air and Soil Pollution, 144(1): 419-440.
HAN M, JI G, NI J. 2009. Washing of field weathered crude oil contaminated soil with an environmentally compatible surfactant, alkyl polyglucoside [J]. Chemosphere, 76(5): 579-586.
HUBÁLEK T, VOSÁHLOVÁ S, MATĚJŮ V et al. 2007. Ecotoxicity monitoring of hydrocarbon-contaminated soil during bioremediation: a case study [J]. Archives of Environmental Contamination and Toxicology, 52(1): 1-7.
KARTHIKEYAN M, HUSSAIN N, GAJALAKSHMI S et al. 2014. Effect of vermicast generated from an allelopathic weed lantana (Lantana camara) on seed germination, plant growth, and yield of cluster bean (Cyamopsis tetragonoloba) [J]. Environmental Science and Pollution Research, 21(21): 12539-12548.
LANGBEHN A, STEINHART H. 1995. Biodegradation studies of hydrocarbons in soils by analyzing metabolites formed [J]. Chemosphere, 30(5): 855-868.
MARGESIN R, ZIMMERBAUER A, SCHINNER F. 1999. Soil lipase activity-a useful indicator of oil biodegradation [J]. Biotechnology Techniques, 13(12): 859-863.
PARSONS T R, STRICKLAND J D. 1963. Discussion of spectrophotometric determination of marine-plant pigments, with revised equations for ascertaining chlorophylls and carotenoids [J]. Journal of Marine Research, 21(3): 155-163.
PŁAZA G, NAŁĘCZ-JAWECKI G, ULFIG K et al. 2005.The application of bioassays as indicators of petroleum-contaminated soil remediation [J]. Chemosphere, 59(2): 289-296.
PORRA R J. 2002. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b [J]. Photosynthesis Research, 73(1-3): 149-156.
RIFFALDI R, LEVI-MINZI R, CARDELLI R et al. 2006. Soil biological activities in monitoring the bioremediation of diesel oil-contaminated soil [J]. Water Air and Soil Pollution, 170(1-4): 3-15.
TANG X, HE L Y, TAO X Q et al. 2010. Construction of an artificial microalgal-bacterial consortium that efficiently degrades crude oil [J]. Journal of Hazardous Materials, 181(1-3): 1158-1162.
VOUILLAMOZ J, MILKE M W. 2001. Effect of compost in phytoremediation of diesel-contaminated soils [J]. Water Science and Technology, 43(2): 291-295.
XIE Y, TAO G, CHEN Q et al. 2014. Effects of Perchlorate Stress on Growth and Physiological Characteristics of Rice (Oryza sativa L.) Seedlings [J]. Water Air and Soil Pollution, 225: (2077-2078).
XU Y, LU M. 2010. Bioremediation of crude oil-contaminated soil: comparison of different biostimulation and bioaugmentation treatments [J]. Journal of Hazardous Materials, 183(1): 395-401.
YILMAZ K, AKINCI I E, AKINCI S. 2009. Effect of lead accumulation on growth and mineral composition of eggplant seedlings (Solanum melongena) [J]. New Zealand Journal of Crop and Horticultural Science, 37(3): 189-199.
何丽媛. 2010. 高效石油降解菌群的构建及其固定化研究[D]. 广州: 华南理工大学.
黄廷林, 徐金兰, 唐智新, 等. 2009. 生物菌剂对石油污染土壤生物修复作用的研究[J]. 环境科学, 30(6): 1838-1843.
焦海华, 刘颖, 金德才, 等. 2013. 牵牛花对石油污染盐碱土壤微生物群落与石油烃降解的影响[J]. 环境科学学报, (12): 3350-3358.
冷凯良, 楚晓珉, 张辉珍, 等. 2001. 微生物对石油烃降解代谢产物的分析方法研究[J]. 海洋水产研究, 22(2): 57-61.
李宝明. 2007. 石油污染土壤微生物修复的研究[D]. 北京: 中国农业科学院.
廖长君. 2015. 玉米CT38对石油污染土壤的修复研究[D]. 广州: 华南理工大学.
林志芬, 于红霞, 许士奋, 等. 2001. 发光菌生物毒性测试方法的改进[J].环境科学, 22(2): 114-117.
蔺昕, 李培军, 孙铁珩, 等. 2005. 石油污染土壤的生物修复与土壤酶活性关系[J]. 生态学杂志, 24(10): 1226-1229.
刘五星, 骆永明, 滕应, 等. 2007. 石油污染土壤的生态风险评价和生物修复Ⅱ.石油污染土壤的理化性质和微生物生态变化研究[J]. 土壤学报, 44(5): 848-853.
卢丽丽. 2008. 石油污染土壤的植物修复研究[D]. 西安: 西安建筑科技大学.
鲁莽, 张忠智, 孙珊珊, 等. 2009. 植物根际强化修复石油污染土壤的研究[J]. 环境科学, 30(12): 3703-3709.
马梅, 童中华, 王子健, 等. 1998. 新型淡水发光菌(Vibrio qinghaiensis sp.—Q67)应用于环境样品毒性测试的初步研究[J]. 环境科学学报, 18(1):88-93.
沈伟航, 朱能武, 商儒, 等. 2015. 石油污染土壤微生物修复过程中植物毒 性 变 化 规 律 [J/OL]. 环 境 科 学 学 报 , http://www.cnki.net/kcms/detail/ 11.1843.X.20150617.1502.001.html.
宋玉芳, 宋雪英, 张薇, 等. 2004. 污染土壤生物修复中存在问题的探讨[J]. 环境科学, 25(2): 129-133.
王华金, 朱能武, 杨崇, 等. 2013. 石油污染土壤生物修复对土壤酶活性的影响[J]. 农业环境科学学报, 32(6): 1178-1184.
吴伟林, 张秀霞, 单宝来, 等. 2010. 不同处置方式对石油污染土壤理化性质和生物学特性的影响[J]. 石油学报(石油加工), 26(5): 831-834.
吴晓. 2008. 铅离子对菠菜光合作用的若干抑制机制[D]. 苏州: 苏州大学.
杨丽芹, 蒋继辉. 2011. 微生物对石油烃类的降解机理[J]. 油气田环境保护, 21(2): 24-26.
张晓阳. 2013. 陕北石油污染对土壤理化性质和酶活性的影响[D]. 杨凌:西北农林科技大学.
赵晴, 张甲耀, 陈兰洲, 等. 2005. 疏水性石油烃降解菌细胞表面疏水性及降解特性[J]. 环境科学, 26(5):132-136.
周礼恺, 张志明. 1980. 土壤酶活性的测定方法[J]. 土壤通报, (5):37-38.
Study on Combined Bioindicators in Ecotoxicity Monitoring of Oil-contaminated Soil during Bioremediation
SHEN Weihang1, ZHU Nengwu1,2*, YIN Fuhua1, WANG Huajin1, DANG Zhi1,2
1. School of Environment and Energy, South China University of Technology, Guangzhou 510006, China 2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006, China
Bacterial luminescence, content of photosynthetic pigments together with soil enzyme activity could be used to comprehensively reflecting the soil health condition. In order to explore the soil ecotoxicity patterns and biological indicator effects, bioremediation of oil-contaminated soil were conducted. Oil degrading bacterial consortium were built with three strains isolated from oil-contaminated soil. Bacterial luminescence, chlorophyll a and carotene contents, and soil catalase activity was employed to evaluate the ecotoxicity of soil sampled in different bioremediation phases. Good consistency can be obtained among phytotoxicity tests, soil enzyme activity and Photobacterium phosphoreum ecotoxicity tests. The results showed that the application of a mixed bacterial consortium was illustrated to effectively remediate oil-contaminated soil due to the high TPH removal efficiency, which reduced the crude oil concentration from 5 000 mg·kg-1soil to 1 781 mg·kg-1in only 40 d. The maximum inhibition of bacterial luminescence for Photobacterium phosphoreum in the dichloromethane/dimethyl sulfoxide extracts was observed at the initial stage of bioremediation and gradually dropped to normal. Compared with the control group, the chlorophyll a content of Triticum acstivnm L. was significantly inhibited in the different phases of bioremediation. In soils S1, the chlorophyll a content decreased by 39.3% to (1.36±0.04) mg·g-1. A significant negative correlation can be found between soil catalase activity and the residue of petroleum hydrocarbon. The correlation coefficient is -0.973. Soil extract on the 8th day of the bioremediation remained constant at a relative luminosity of 18.1%, with toxicity equivalent to that of 0.187 mg·L-1HgCl2. Therefore, bacterial luminescence, phytotoxicity (inhibition of chlorophyll a and carotene contents), and soil catalase activity could potentially be sensitive indicators to evaluate the effectiveness of bioremediation techniques.
oil contaminated soil; bioremediation; Photobacterium phosphoreum; combined-bioindicators
10.16258/j.cnki.1674-5906.2015.09.021
X171.5;X172
A
1674-5906(2015)09-1560-10
沈伟航,朱能武,尹富华,王华金,党志. 微生物修复石油污染土壤的生态毒性指示[J]. 生态环境学报, 2015, 24(9): 1560-1569.
SHEN Weihang, ZHU Nengwu, YIN Fuhua, WANG Huajin, DANG Zhi. Study on Combined Bioindicators in Ecotoxicity Monitoring of Oil-contaminated Soil during Bioremediation [J]. Ecology and Environmental Sciences, 2015, 24(9): 1560-1569.
广东省自然科学基金团队项目(9351064101000001);教育部新世纪优秀人才支持计划项目(NCET-11-0166)
沈伟航(1988年生),男,硕士,主要研究方向为生态毒理与生物指示。Email: shen.wh@mail.scut.edu.cn *通讯作者。朱能武,E-mail: nwzhu@scut.edu.cn
2015-07-08
