干燥方式对菊苣根多酚含量和抗氧化活性的影响
2015-12-07尚红梅杨忠富马培东吴成扬王雪昭
尚红梅,郭 玮,潘 丹,杨忠富,马培东,吴成扬,王雪昭
(1.吉林农业大学动物科学技术学院,吉林 长春 130118;2.吉林省畜牧总站,吉林 长春 130062)
干燥方式对菊苣根多酚含量和抗氧化活性的影响
尚红梅1,郭 玮2,潘 丹1,杨忠富1,马培东1,吴成扬1,王雪昭1
(1.吉林农业大学动物科学技术学院,吉林 长春 130118;2.吉林省畜牧总站,吉林 长春 130062)
研究不同干燥方式对菊苣根总酚含量及抗氧化活性的影响。通过测定阴干、冻干和不同温度热风干燥处理过程中菊苣根多酚氧化酶(polyphenol oxidase,PPO)活性变化、干燥根中总黄酮和总酚含量,以及多酚提取液的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐自由基(2,2’-azino-bis(3-ehtylbenzothiazoline-6-sulfonic acid)diammonium salt radical,ABTS+·)清除能力和总还原力,确定菊苣根最佳干燥方法。结 果表明:经不 同干燥方式干制的菊苣根总酚含量差异很大,可能是干燥过程中剩余PPO活性和酚热敏性2 个因素综合作用的结果。综合考虑总黄酮、总酚含量2 项指标,60 ℃热风干燥最优,冻干次之,阴干最差。菊苣根的抗氧化活性与其中的总黄酮含量相关性较小,而与总酚含量相关性较大,DPPH自由基、ABTS+·清除能力和总还原力均与总酚含量呈显著正相关(R2≥0.85,P<0.05)。为了保留菊苣根干燥样品中较高的多酚含量,建议采用60 ℃热风干燥法干制菊苣根。
菊苣;根;干燥方式;多酚;抗氧化活性
植物多酚(包含黄酮)具有良好的抗氧化活性,能有效清除体内自由基、抑制脂质过氧化以及保护机体生物大分子等[1-2]。菊苣(Cichorium intybus L.)为菊科菊苣属多年生草本植物,其地上部分、根和种子可入药[3-4],具有清热解毒、利尿消肿、保肝降脂、促进消化等功效[5]。菊苣根中含有绿原酸、菊苣酸、黄酮等多酚物质,此类物质在菊苣药效功能中发挥着重要作用[6-7]。
植物类药材在采摘后,除部分鲜用外,在贮藏和运输过程中,常会发生虫蛀、霉变等变质现象而无法满足临床需要,因此采后必须要对药材进行初加工,干燥是避免此类变质现象发生的一种有效的初加工方法[8]。干燥处理能抑制物质的呼吸等生理作用,减少营养物质损失和微生物活动,有利于物质的保藏[2]。在多种干燥方法中,空气干燥法具有简单易行、成本低的优点。然而空气干燥耗时较长,活性成分多酚在药材干燥过程中极易发生变性或失活[9],比如植物体内普遍存在的多酚氧化酶(polyphenol oxidase,PPO)能氧化多酚类物质形成醌类聚合物,减少植物中多酚类物质的含量[10],从而降低药材的抗氧化等生物活性[11]。
本实验通过研究比较阴干、冻干和不同温度下热风干燥对菊苣根中酚类物质含量和抗氧化活性的影响,同时监测各种干燥方式下PPO活性的变化,以期找到一种较有利于减少多酚损失的干燥方式,为菊苣药材的初加工提供依据。
1 材料与方法
1.1 材料与试剂
菊苣生长5 个月时,新鲜根被用作实验材料,2011年10月从吉林农业大学牧草园采收。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、水溶性VE(Trolox) 东京化成工业株式会社;没食子酸、芦丁、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2’-azino-bis(3-ehtylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS) 上海阿拉丁公司;铁氰化钾、三氯乙酸、三氯化铁、亚硝酸钠、碳酸钠、过硫酸钾、硝酸铝等均为分析纯。
1.2 仪器与设备
KQ-100KDE型高功率数控超声波清洗仪 昆山市超声仪器有限公司;FA2004N型分析天平 上海民桥精密科学仪器有限公司;HGBTWTS3型组织捣碎机 美国Waring Commercial公司;3K30型高速台式冷冻离心机德国Sigma公司;752型紫外光分光光度计 上海现科分光仪器有限公司;FD-1B型冷冻干燥机 北京博医康实验仪器有限公司;101-3AB型电热鼓风干燥箱 天津泰斯特仪器有限公司。
1.3 方法
1.3.1 干燥处理
新鲜菊苣根洗净、吸干表面水分,切片,厚度0.5 cm左右,分别进行阴干、冻干和热风干燥处理。其中阴干处理为将根片置于通风良好、干燥、无阳光直射的室内进行干燥,室内相对湿度45%,温度20 ℃;冻干处理在冷冻干燥机内(-43 ℃)进行;热风干燥温度为40、 50、60、70、80、90、100、120 ℃。对于每种干燥方式,干燥过程中定时(最初每隔0.5 h取1 次样,接近干燥时每隔0.1 h取1 次样)取样测定根片含水量,监测干燥情况,同时取样测定PPO活性,研究干燥过程中PPO相对活性降低速率。最后将干燥样品粉碎,过0.45 mm筛,4 ℃条件下保存待测多酚类物质含量和抗氧化活性。每次检测设3 个重复。
1.3.2 含水量测定
采用恒重法,按照GB 5009.3—2010《食品安全国家标准 食品中水分的测定》方法进行测定。
1.3.3 PPO活性测定
PPO的 提取和测定参照文献[12-13]方法,略作修改。取菊苣根样品2 g(根据当时所取样品含水量和原鲜根含水量折算为鲜根质量,即相当于取鲜根样品2 g),加入10 mL磷酸盐缓冲液(0.2 mol/L,pH 7.0,4 ℃),用组织 捣碎机匀浆,于12 000 r/min、4 ℃冷冻离心20 min,提取上清液,即为PPO酶液。取0.5 mL PPO酶液,加入2.5 mL焦性没食子酸溶液(40 mmol/L),对照用磷酸盐缓冲液(0.2 mol/L,pH 7.0)代替PPO酶液。混匀后立即在330 nm波长处测定吸光度,每隔20 s读数1 次,依据曲线最初直线段的斜率计算酶活力。酶活力单位以每克样品每分钟A330nm变化0.001来表示,按下式计算。

式中:ΔA330nm为反应时间内吸光度的变化;D为稀释倍数,即提取的总酶液为反应系统内酶液体积的倍数;mf为样品鲜质量/g;t为反应时间/min。
将新鲜菊苣根PPO活力(974.44±59.01) U/g定为100%,其他条件下菊苣根的酶活性与其相比较计算相对酶活力。
菊苣根干燥过程中PPO活性降低速率反映干燥过程中PPO失活的速率,按式(2)计算。

式中:E1为新鲜菊苣根PPO相对酶活力/%;E2为干燥菊苣根PPO相对酶活力/%;t为菊苣根干燥消耗时间/h。
1.3.4 菊苣根多酚类物质提取及含量测定
参照张利娟等[14]的方法,略作修改。采用超声波辅助法提取,取待测样品1 g,加入25 mL 95%乙醇提取液,20 ℃、100 W超声处理60 min,取滤液即为菊苣根多酚类物质提取液(以下简称提取液),立即放入-40 ℃保存,所有样品提取完后同时分析黄酮及总酚含量。 每个指标的分析均设3 次重复。
1.3.4.1 总酚含量测定
采用Folin-Ciocalteu比色法[7]。标准曲线的制备:精密称取没食子酸0.005 g,用蒸馏水定容至50 mL,制备质量浓度为100 μg/mL的标准溶液。精确量取上述标准液0、0.1、0.2、0.3、0.4、0.5 mL于10 mL容量瓶中,各加水6 mL,摇匀,再加0.5 mL福林试剂,充分摇匀,1 min之后,加入质量浓度为20 g/100 mL的Na2CO3溶液1.5 mL,混匀,用蒸馏水定容至刻度,75 ℃水浴10 min,自然冷却至室温,以相应试剂为空白,在765 nm波长处测定吸光度,建立标准曲线,得线性回归方程为:y=0.162 9x+0.010 4(R2=0.998 8),式中,x为没食子酸溶液质量浓度/(μg/mL),y为A765nm。
吸取提取液0.1 mL,按标准曲线步骤反应后,测定吸光度,结果以菊苣根干基中含有相当于没食子酸的毫克数表示,单位为mg/g。
1.3.4.2 总黄酮含量测定
参照卞杰松[15]和蔡文国[16]等的方法进行,略作修改。标准曲线的制备:精密称取芦丁标准品0.025 g,用75%乙醇溶解并定容至50 mL,制备质量浓度为0.5 mg/mL的标准溶液。精确量取上述标准液0、0.4、0.8、1.2、1.6、2.0 mL于10 mL刻度试管中,加无水乙醇至5 mL,摇匀,加入质量浓度为5 g/100 mL的NaNO2溶液0.3 mL,摇匀放置6 min,再加入质量浓度为10 g/100 mL的Al(NO3)3溶液0.3 mL,摇匀放置6 min,最后加1 mol/L的NaOH溶液4 mL,用无水乙醇补至刻度,摇匀放置10 min后,以无水乙醇为空白,在510 nm波长处测定吸光度,建立标准曲线,得线性回归方程为:y=0.008x+ 0.011 5(R2=0.998 1),式中,x为芦丁溶液质量浓度/(μg/mL),y为A510nm。
吸取提取液1 mL,按标准曲线步骤反应后,测定吸光度,结果以菊苣根干基中含有相当于芦丁的毫克数表示,单位为mg/g。
1.3.5 抗氧化活性测定
1.3.5.1 DPPH自由基清除能力测定
测定方法参照文献[16-17]。标准曲线的制备:取浓度为0、200、400、600、800、1 000 μmol/L的Trolox标准液(用无水乙醇配制浓度为5 000 μmol/L的母液,使用前用蒸馏水稀释)0.1 mL加入10 mL试管中,加入3.9 mL DPPH(0.1 mmol/L,用甲醇溶解,现配现用)反应液。用相同体积的95%的乙醇作空白对照。在暗处反应30 min后测定波长为515 nm的吸光度,得到线性回归方程:y=-0.000 6x+1.229 5(R2=0.998 9),式中:x为Trolox标准液浓度/(μmol/L),y为A515nm。
取0.1 mL提取液加入10 mL试管中,加入3.9 mL DPPH反应液,按标准曲线步骤反应后,测定吸光度。最后按制作的标准曲线将菊苣根DPPH自由基清除能力表示为每克菊苣根(干质量)所具有的清除能力相当于多少微摩尔的Trolox,单位为μmol/g。
1.3.5.2 ABTS+·清除能力测定
测定方法参照文献[1,17-18],略作修改。ABTS+·溶液的配制:将5 mL 7 mmol/L ABTS+·溶液和88 μL的140 mmol/L过硫酸钾混合,在室温、避光条件下反应12 h,得到ABTS储备液,使用时用10 mmol/L pH 7.4的磷酸盐缓冲液稀释成工作液,使其在室温下,734 nm波长处的吸光度为0.70±0.02。
标准曲线的制备:取浓度为0、20、40、60、80、100 μmol/L的Trolox标准液(用无水乙醇配制浓度为5 000 μmol/L的母液,使用前用蒸馏水稀释)0.3 mL加入10 mL试管中,加入ABTS反应溶液3 mL,反应30 min,测定波长为734 nm处的吸光度。按Trolox浓度(x,μmol/L)和吸光度(y,A734nm)绘制成标准曲线:y=-0.004 4x+0.623 5(R2=0.999 0)。
取0.3 mL提取液的稀释液(体积比1∶3)加入10 mL试管中,加入ABTS反应溶液3 mL,按标准曲线步骤反应后,测定吸光度。最后按制作的标准曲线将菊苣根ABTS+·清除能力表示为每克菊苣根(干质量)所具有的清除能力相当于多少微摩尔的Trolox,单位为μmol/g。
1.3.5.3 总还原力测定
测定方法参照文献[1,19],略作修改。标准曲线的制备:取浓度为0、200、400、600、800、1 000 μmol/L的Trolox标准液取(用无水乙醇配制浓度为5 000 μmol/L的母液,使用前用蒸馏水稀释)1 mL加入2.5 mL 磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2.5 mL铁氰化钾溶液(10 g/L),混合物在50 ℃条件下水浴20 min,冷却后加入2.5 mL三氯乙酸溶液(100 g/L),混合物于3 000 r/min离心10 min,取该混合物的上清液2.5 mL,加入2.5 mL去离子水和0.5 mL 氯化铁(1 g/L)溶液,在700 nm波长处测吸光度,以乙醇溶液为空白。按Trolox浓度(x,μmol/L)和吸光度(y,A700nm)绘制成标准曲线:y=0.001 3x+0.041 7(R2=0.999 6)。
取1 mL提取液,按标准曲线步骤反应后,测定吸光度。最后按制作的标准曲线将菊苣根还原力表示为每克菊苣根(干质量)所具有的还原力相当于多少微摩尔的Trolox,单位为μmol/g。
1.4 数据处理
实验数据经Excel 2003初步整理后, 采用SPSS 17.0统计软件进行方差分析,采用Tukey法进行多重比较;用Regression-Curve程序对处理温度效应进行回归分析,Correlate-bivariate程序分析指标间相关性。数据以表示,P<0.05为差异显著。
2 结果与分析
2.1 不同干燥方式条件下菊苣根的总酚含量

表1 不同干燥方式下菊苣根的多酚含量、含水量、干燥时间及PPO活性降低速率Table 1 Moisture and polyphenol contents of chicory root, drying durations and reduction rates of PPO relative activity with different drying methods
由表1可知,60 ℃热风干燥样品中总黄酮含量为(4.05±0.13)mg/g,显著高于(P<0.05)阴干、冻干和其他温度热风干燥样品中的总黄酮含量;70 ℃热风干燥样品中的总酚含量((7.56±0.04)mg/g)最高,但与冻干以及60 ℃和80 ℃热风干燥样品中的总酚含量无显著差异(P>0.05),显著高于(P<0.05)阴干和其他温度热风干燥样品中的总酚含量。除100 ℃和120 ℃热风干燥样品外,冻干和其他温度热风干燥样品中的总酚、总黄酮含量均显著高于(P<0.05)阴干样品。所以对于菊苣根活性成分多酚的保留,综合考虑总黄酮和总酚含量两项指标,60 ℃热风干燥最优,冻干次之,阴干最差。
不同干燥方式样品多酚含量呈现较大差异,可能与干燥过程中PPO的作用及作用时间2 个因素有关,PPO相对活性降低速率可以在一定程度上反映以上2 个因素的综合作用。尚红梅等[13]通过研究发现,菊苣根PPO活性在35 ℃时最大,并随着温度的升高逐渐下降。热风干燥温度范围为40~120 ℃,较高的温度使得PPO活性降低,且随着干燥温度的增加,PPO相对活性降低速率线性升高(R2=0.910,P=0.000),从而使得菊苣根多酚损失较少。阴干(20 ℃)过程中,PPO始终保持一定活性,经测定,干燥48 h时,还保持着(48.06±2.83)%的相对活性,96 h以后,P PO相对活性才降低到(11.46±1.84)%左右,即使到菊苣根完全干燥时,PPO仍然保持(9.41±0.31)%的相对活性;整个阴干过程中,PPO相对活性降低速率只有(0.38±0.01)%/h,说明PPO在阴干条件下较为稳定,失活需要的时间较长,因而菊苣根中的多酚在PPO的作用下损失较多,导致阴干样品总酚、总黄酮含量均较低。冻干(-43 ℃)过程中PPO相对活性降低速率为(3.11±0.02)%/h,显著高于(P<0.05)阴干处理,说明在低温条件下PPO的活性受到一定程度的抑制。
由表1可知,热风干燥过程中,菊苣根总黄酮和总酚的含量并未随着温度的升高而升高,而是呈现先升高后降低的趋势,总酚含量在70 ℃热风干燥处理时最高,总黄酮含量在60 ℃热风干燥处理时最高,均在120 ℃时出现最低值。这可能与酚类物质的热敏性有关,据文献[9,20-21]报道,当温度升高到70 ℃以上时酚类物质会受热降解。可见在本实验条件下,不同干燥方式处理后多酚含量的差异,至少是干燥过程中剩余PPO活性和因温度不同导致酚热敏性差异2 个因素综合作用的结果。
由表1可知,不同干燥方式下干燥样品的含水量在9.40%~12.37%之间,阴干和冻干样品含水量较高,均高于热风干燥样品的含水量。热风干燥样品时,随着干燥温度的升高,干燥样品含水量线性降低(R2=0.849,P=0.000)。对于干燥时间而言,不同干燥方式相互间有显著差异(P<0.05),阴干样品所需干燥时间((240.33±0.09)h)最长,冻干样品次之((28.63±0.09)h),热风干燥样品时,随着干燥温度的升高,干燥样品所需时间线性降低(R2=0.853,P=0.000)。这是由于温度越高,水分运动越剧烈,越有利于水分的散失[2],使得菊苣根含水量越低,所需干燥时间越短。
2.2 不同干燥方式菊苣根的抗氧化活性及相关性分析
最常用的评价活性成分体外抗氧化活性的方法有DPPH自由基清除能力、ABTS+·清除能力和总还原力测定等[14]。其中DPPH能形成稳定的醇溶性自由基,而ABTS+·能形成稳定的水溶性自由基,二者常用来评价抗氧化物质清除自由基的能力。还原力从另一方面反映体系的抗氧化活性,具有还原能力的物质能够还原脂质过氧化过程中产生的中间体,从而表现其抗氧化作用[22]。
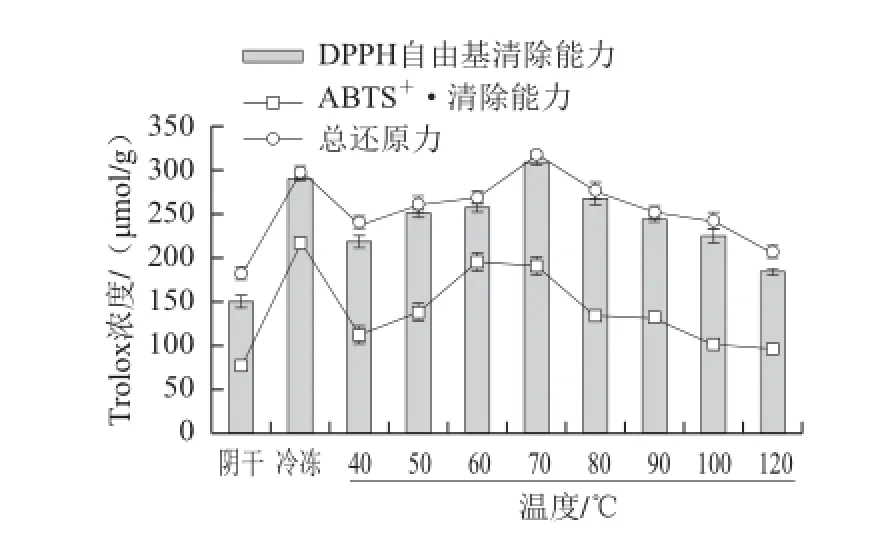
图1 阴干、冻干及不同温度热风干燥对菊苣根抗氧化活性的影响Fig.1 Effects of air-drying, freeze-drying and hot air-drying at different temperatures on the antioxidant activities of chicory root
由图1可知,对于DPPH自由基清除能力和总还原力两项抗氧化指标,70 ℃热风 干燥处理样品的值均最高,分别为(309.38±3.09)μmol/g和(318.41±3.13)μmol/g,冻干样品次之,分别为(289.94±2.00)μmol/g和(297.50±4.55)μmol/g;方差分析表明,70 ℃热风干燥处理样品和冻干样品的以上两项抗氧化指标的差异均不显著(P>0.05),但均显著高于(P<0.05)阴干样品的相应抗氧化活性((150.27±6.55)、(180.50±4.04)μmol/g);对于热风干燥处理,70 ℃热风干燥处理样品的DPPH自由基清除能力和总还原力均显著高于(P<0.05)其他温度热风干燥样品的相应抗氧化活性。对于ABTS+·清除能力,冻干样品最高,为(216.70±2.31)μmol/g,60 ℃热风干燥处理样品次之,为(194.88±8.59)μmol/g,70 ℃热风干燥处理样品居第3位,为(193.52±8.46)μmol/g,三者之间差异不显著(P>0.05),均显著高于(P<0.05)阴干样品的ABTS+·清除能力((77.10±1.33)μmol/g)。所以对于抗氧化活性,综合考虑DPPH自由基清除能力、ABTS+·清除能力和总还原力3 项指标,70 ℃热风干燥和冻干处理较好,阴干处理较差。

表2 菊苣根多酚含量与抗氧化活性的相关分析Table 2 Correlation analysis between polyphenol content and antioxidant activities of chicory root
由图1可知,随着热风干燥温度的升高,菊苣根DPPH自由基、ABTS+·清除能力和总还原力均呈现先升高后降低的趋势,这与总黄酮、总酚含量的变化趋势一致。相关分析发现(表2),黄酮含量与ABTS+·清除能力显著正相关(R2=0.83,P<0.05),与其他各评价指标间均无显著相关性(P>0.05),表明总黄酮含量对总酚及采用DPPH法和总还原力法测定的抗氧化活性均无显著贡献。王毕妮等[23]研究发现,红枣中总黄酮含量与总酚含量 和采用DPPH法评价的抗氧化活性也无显著相关性。在本实验中,总酚含量与DPPH自由基、ABTS+·清除能力和总还原力均呈显著正相关(R2≥0.85,P<0.05),这与张利娟等[14]的报道相符,且3 种抗氧化活性测定方法间呈显著正相关(R2≥0.82,P<0.05)。说明菊苣根中酚类化合物的组成复杂,除黄酮类化合物外,其中存在的其他酚类化合物对菊苣根的抗氧化活性有很大的贡献;DPPH自由基、ABTS+·清除能力和总还原力可以用来评价菊苣根的抗氧化活性。本实验中,虽然菊苣根提取液中总酚含量与DPPH自由基、ABTS+·清除能力和总还原力均呈显著正相关,但基于总酚含量筛选出的热风干燥温度(60 ℃)和基于抗氧化活性筛选出的热风干燥温度(70 ℃)有所差异,可能归因于提取液中其他成分的作用。据报道[24],植物提取物中除多酚外,还有维生素、生物碱、皂苷、多糖、活性肽等成分具有抗氧化作用。
3 结 论
不同干燥条件下,菊苣根多酚含量差异很大,可能是干燥过程中剩余PPO活性和因温度不同导致的酚热敏性差异2 个因素综合作用的结果,综合考虑总黄酮、总酚含量2 项指标,60 ℃热风干燥最优,冻干次之,阴干最差。由相关性分析可知,菊苣根的抗氧化活性与其中的总黄酮含量关系不大,仅ABTS+·清除能力1 项抗氧化指标与总黄酮含量显著正相关,而与总酚含量有很大关系,DPPH自由基、ABTS+·清除能力和总还原力均与总酚含量呈显著正相关(R2≥0.85,P<0.05)。因此,为了保留菊苣根干燥样品中较高的多酚含量,建议采用60 ℃热风干燥法干制菊苣根。
[1] 杨小兰, 袁娅, 郭晓晖, 等. 超高压处理对不同品种猕猴桃浆多酚含量及其抗氧化活性的影响[J]. 食品科学, 2013, 34(1): 73-77.
[2] 郭泽美, 任章成, 陈腾, 等. 干燥方式对葡萄皮多酚及其抗氧化活性的影响[J]. 食品科学, 2013, 34(11): 117-121.
[3] 吐尔逊娜依·迪力夏提, 穆拉丁·库热西, 阿不都拉·阿巴斯. 菊苣茎乙醇提取物抑菌活性研究[J]. 食品科学, 2009, 30(11): 80-82.
[4] 中华人民共和国卫生部药 典委员会. 中华人民共和国药典(第一部)[M]. 北京: 化学工业出版社, 2005: 217.
[5] 王佺珍, 崔健. 牧草菊苣及其利用潜力Ⅱ利用价值和开发潜力[J].草业科学, 2010, 27(2): 150-156.
[6] 华春, 李建玲, 周峰, 等. 菊苣中菊苣酸提取工艺优化[J]. 食品科学, 2011, 32(20): 126-129.
[7] 尚红梅, 陈诚, 刘祥, 等. Folin-Ciocaileu比色法测定菊苣中多酚的含量[J]. 草业科学, 2013, 30(9): 1445-1448.
[8] 张家春, 林绍霞, 罗文敏, 等. 中药材干燥技术现状及发展趋势[J].贵州科学, 2013, 31(2): 89-93.
[9] 涂宗财, 张璆, 王辉, 等. 不同干燥方式对玫瑰茄水提物成分及活性的影响[J]. 食品科学, 2013, 34(21): 47-50.
[10] CHENG X F, ZHANG M, ADHIKARI B. The inactivation kinetics of polyphenol oxidase in mushroom (Agaricus bisporus) during thermal and thermosonic treatments[J]. Ultrasonics Sonochemistry, 2013, 20(2): 674-679.
[11] BENNETT L E, JEGASOTHY H, KONCZAK I, et al. Total polyphenolics and anti-oxidant properties of selected dried fruits and relationships to drying condition s[J]. Journal of Functional Foods, 2011, 3(2): 115-124.
[12] ZHANG Ya nli, TANG Tiexin, HE Hanjun, et al. Infl uence of several postharvest processing methods on polyphenol oxidase activity and cichoric acid content of Echinacea purpurea roots[J]. Industrial Crops and Products, 2011, 34(1): 873-881.
[13] 尚红梅, 韩淑君, 陈诚, 等. 菊苣根多酚氧化酶的酶学特性研究[ J].西北农林科技大学学报: 自然科学版, 2013, 41(11): 179-184; 190.
[14] 张利娟, 师俊玲. 无核白葡萄热风干燥过程中总酚与抗氧化活性的变化[J]. 食品科学, 2013, 34(5): 55-59.
[15] 卞杰松, 冯纪南, 谭巧燕, 等. 马鞭草中总黄酮的超声波辅助提取及其抗氧化活性研究[J]. 宝鸡文理学院学报: 自然科学版, 2013, 33(1): 22-27.
[16] 蔡文国, 吴卫, 代沙, 等. 不同种质鱼腥草总酚、黄酮含量及其抗氧化活性[J]. 食品科学, 2013, 34(7): 42-46.
[17] LI Hua, WANG Xiaoyu, LI Yong, et al. Polyphenolic compounds and antioxidant properties of selected China wines[J]. Food Chemistry, 2009, 112(2): 454-460.
[18] ZHANG Ang, FANG Yulin, WANG Hua, et al. Free-radical scavengi ng properties and reducing power of grape cane extracts from 11 selected grape cultivars widely grown in China[J]. Molecules, 2011, 16(12): 10104-10122.
[19] SOONG Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417.
[20] DANIEL D L, HUERTA B E B, SOSA I A, et al. Effect of fixed bed drying on the retention of phenolic compounds, anthocyanins and antioxidant activity of roselle (Hibiscus sabdariffa L.)[J]. Industrial Crops and Products, 2012, 40: 268-276.
[21] CIOU J Y, LIN H H, CHIANG P Y, et al. The role of polyphenol oxidase and peroxidase in the browning of water caltrop pericarp during heat treatm ent[J]. Food Chemistry, 2011, 127(2): 523-527.
[22] ZHAO Haifeng, CHEN Wenfen, LU Jian, et al. Phenolic profi les and antioxidant activit ies of commercial beers[J]. Food Chemistry, 2010, 119(3): 1150-1158.
[23] 王毕妮, 樊明涛, 程妮, 等. 干制方式对红枣多酚抗氧化活性的影响[J].食品科学, 2011, 32(23): 157-161.
[24] 谭榀新, 叶涛, 刘湘新, 等. 植物提取物抗氧化成分及机理研究进展[J].食品科学, 2010, 31(15): 288-292.
Effects of Drying Methods on Polyphenol Contents and Antioxidant Activities of Chicory Root
SHANG Hongmei1, GUO Wei2, PAN Dan1, YANG Zhongfu1, MA Peidong1, WU Chengyang1, WANG Xuezhao1
(1. College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China; 2. Animal Husbandry Station of Jilin Province, Changchun 130062, China)
The study aimed to investigate the impacts of different drying methods on polyphenol contents and antioxidant activities of chicory root. The changes in polyphenol oxidase (PPO) activity during drying, as well as fl avonoid and tot al polyphenol contents of dried chicory root were measured. The 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical, 2,2’-azinobis (3-ehtylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS+·) radical scavenging capacity and reducing power of polyphenols extract ed from chicory root with different drying methods, including air-drying, freeze-drying and hot airdrying at different temperatures, were also determined so as to obtain the optimum drying method. The results showed that the contents of polyphenol in chicory root processed by different drying methods differed signifi cantly, likely due to a combination of residual PPO activity and heat sensitivity of polyphenol during the drying process. When fl avonoid content and total polyp henol content were taken into acc ount, hot air-drying at 60 ℃ was the best method, followed by freeze-drying and air-drying methods. The antioxidant activity of chicory root was less closely correlated with the content of fl avonoids, but highly correlated with the content of total polyphenols. The DPPH radical, ABTS+· radical scavenging capacity and reducing power all displayed a signifi cantly (R2≥ 0.85, P < 0.05) positive correlation with the total polyphenol content. In order to achieve higher polyphenol content in dried chicory root, hot air-drying at 60 ℃ was a recommended drying method for chicory root.
chicory; root; drying methods; polyphenol; antioxidant activities
S609.2
A
1002-6630(2015)01-0084-05
10.7506/spkx1002-6630-201501016
2014-01-14
吉林省教育厅“十二五”科学技术研究——高校科研春苗人才培育计划项目(201447);
吉林农业大学大学生科技创新基金项目(2013ZR0507;2012ZR0504);
吉林省科技发展计划青年科研基金项目(20100144);国家级大学生创新创业训练计划项目(201210193011)
尚红梅(1981—),女,讲师,硕士,研究方向为饲草资源开发与利用。E-mail:shangmei2000@163.com
